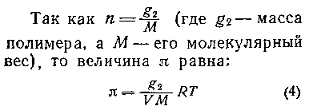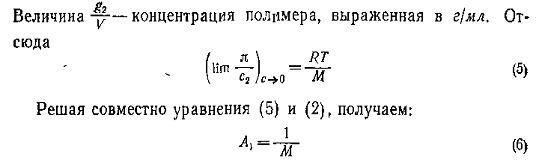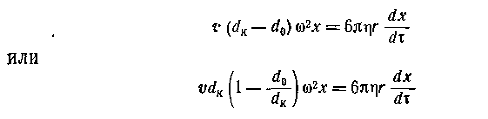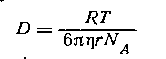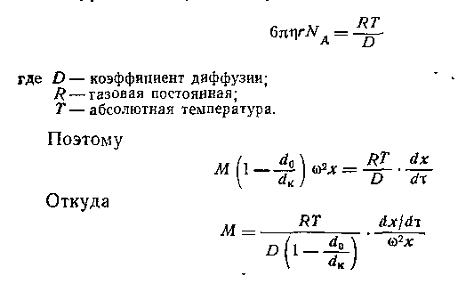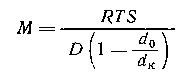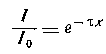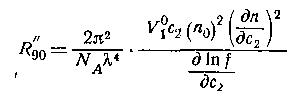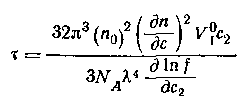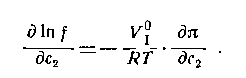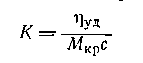Растворение полимеров
является единственным способом их
диспергирования
до молекулярного уровня, благодаря чему
становится возможным
изучение характеристик индивидуальных
макромолекул (размера, формы,
молекулярной массы и т.д.).
Важнейшей особенностью
полимеров являются большие значения
их молекулярных
масс (от нескольких тысяч до нескольких
миллионов) и неидентичность
их молекул, что обусловливает необычные
и ценные свойства полимеров.
В отличие от низкомолекулярных соединений
полимеры представляют
собой смесь макромолекул различной
длины, т.е. они неоднородны
по молекулярной массе. Существование
в образце полимера макромолекул
разной длины обусловлено многими
причинами, и в первую очередь
механизмом реакций их синтеза.
Разделение полимера
на фракции более или менее однородные
по молекулярной
массе называется фракционированием.
Ряд методов
фракционирования
основан на зависимости растворимости
полимера от его молекулярной массы.
Чем больше молекулярная масса, тем хуже
растворимость полимера. Различают два
типа фракционирования:препаративное,
при котором выделяют фракции и изучают
их свойства, и аналитическое, при котором
получают кривую распределения без
выделения отдельных
фракций. Наиболее часто из препаративных
методов используют методы
фракционного осаждения и фракционного
растворения.
Метод фракционного
осаждения
состоит в
последовательном осаждении из
раствора полимера ряда фракций,
молекулярные массы которых монотонно
убывают. Вызвать осаждение фракций
можно различными способами;а)
добавлением осадителя к раствору
полимера; б) испарением растворителя,
если полимер был предварительно
растворён в смеси растворитель -осадитель;
в) изменением температуры раствора,
которое приводит к ухудшению качества
растворителя.
Метод фракционного
растворения
состоит в
последовательном экстрагировании
полимера рядом жидкостей, растворяющая
способность которых
по отношению к данному полимеру
последовательно возрастает. Получаемые
фракции обладают последовательно
возрастающими молекулярными массами.
Путём раздельного изучения этих фракций,
т.е. измерения их средних молекулярных
масс, удаётся построить кривую
распределения помолекулярной
массе всего полимера в целом.
Значение молекулярной
массы полимера является некоторой
средней величиной
по ансамблю макромолекул. Средняя
молекулярная масса складывается
из суммы произведений молекулярных
масс каждого компонента |М1,
М2,
М3
и т.д.) на его долю (а1,
а2,
а3
) в смеси полимергомологов:
Мср=
М1а1+
М2
а2+
М3а3
Различают
среднечисловую Мn
и среднемассовую Мω
молекулярные массы. Физическое
различие между ними сводится к
характеруэксперимента,
с помощью которого они измеряются, т.е.
основан ли этот эксперимент
на определении числа макромолекул
(количества вещества) или на определении
концентрации
полимера г/дм3
.
Среднечисловую
молекулярную
массу определяют делением массы образца
полимера на число молекул:
Мn
=М1N1/∑N1+
М2N2/∑N2+
….+ МiNi/∑Ni
где N1
,N2
,Ni
– число макромолекул с молекулярными
массами соответственно
М1
М2
Мi.
Среднемассовую
молекулярную
массу определяют по формуле
Мn
=М1ω1+
М2ω2+
….+ Мiωi
где ω – массовая доля макромолекул с
молекулярной массой М.
На значения
среднечисловой молекулярной массы
большее влияние оказывает
содержание в полимере низкомолекулярных
фракций, а на значение среднемассовой
молекулярной массы — содержание
высокомолекулярных фракций.
Среднечисловую
молекулярную
массу определяют
по данным измерений,
основанных на подсчёте числа молекул
М, причём вклад каждоймолекулы
одинаков и не зависит от её молекулярной
массы.
Для определения
молекулярной массы полимеров используют
следующие методы.
1. химические методы
основанные на определении функциональных
групп (методконцевых
групп).
2. термодинамические методы основанные
на термодинамических свойвствах
разбавленных растворов полимеров
(измерение осмотического давления,
криоскопия, эбуллиоскопия).
3. молекулярно-кинетические методы
(измерение скорости диффузии),
ультрацентрифугирование, измерение
вязкости растворов полимеров.
4. оптические методы (основанные на
измерении светорассеивания в растворах
полимерах).
Наиболее часто используют метод концевых
групп, осмометрический метод, метод
ультрацентрифугирования, метод
светорассеивания, вискозиметрический
метод.
Метод
концевых групп
применяется для конденсационных линейных
полимеров,которые
содержат реакционно-способные
функциональные концевые группы ОН,
-СООН, NH2
и др и позволяет определить молекулярную
массуполимеров
в пределах от 103
до 105.
Среднечисловую
молекулярную массу находят по уравнению
Mn
=100ZE/e
Где Z- число концевых групп
на макромолекулу,E–
молярная масса концевой группы,e– экспериментально найденное содержание
концевых групп в %.
Определить число
концевых групп можно титриметрическими
или колориметрическими методами.
Среднемассовая
молекулярная
масса
определяется по данным измерений,
основанных на
определении массовой доли молекул с
молекулярной массой М|.
Для определения используют вискозиметрию,
диффузионные
методы, ультрацентрифугирование и метод
светорассеяния.
Наиболее простым методом определения
молекулярной массы является
вискозиметрический метод.
Вискозиметрический
метод основан
на том, что линейные макромолекулы,
находящиеся в растворителе, даже при
относительно низких концентрациях
значительно повышают его вязкость,
причем повышение вязкости раствора
пропорционально увеличению молекулярной
массы. Этот метод применим только к
линейным и мало разветвленным
мапкромолекулам и не подходит для
шарообразных или сильно разветвленных
макромолекул.
Вязкость жидкостей
определяют с помощью прибора, называемоговискозиметром. При
исследовании разбавленных растворов
полимеровопределяют
обычно не абсолютную вязкость, а
относительную,
которая при
условии, когда
плотности разбавленного раствора и
чистого растворителяпрактически
совпадают, равна отношению, вязкости
раствора полимера(η)
квязкости
чистого растворителя
(η0)
ηот=η/η0
=t/t0
где t
и t0
— время истечения соответственно раствора
и растворителя.
Определение
времени истечения раствора и растворителя
производятся при строго определённой
температуре, так как вязкость зависит
от температуры.
Исходя из относительной вязкости
рассчитывают удельную (η
уд)и приведенную вязкость(η
пр).
η уд
=(η – η 0)/
η 0 =
ηот –
1
η пр
= η уд
/с =( ηот
– 1)/с
где с –
концентрация полимера г/100см3
.
Удельная вязкостьпоказывает
относительный прирост вязкостивследствие
введения в растворитель полимера, а
приведенная
вязкость —
это удельная
вязкость, отнесённая к единице концентрации
полимера (с). Приведенная вязкость
линейно зависит отконцентрации
раствора полимера. Экстраполяцией этой
зависимости до
нулевой концентрации определяют
характеристическую
вязкость [η]
полимера:
[η]
= lim
η уд /с
при с→0.
Наиболее часто измерения
характеристической вязкости используются
для определения молекулярной массы
вискозиметрическим способом.
Для большинства полимеров наблюдается
зависимость характеристической вязкости
от молекулярной массы полимера, выражаемая
уравнением Марка-Хаувинка-Куна:
[η] = КМα
где К — постоянная константа, зависящая
от температуры и природы полимера и
растворителя;
α — показатель, характеризующий конформацию
макромолекул в растворе, и зависит от
всех факторов, влияющих на конформацию
цепи.
Величина α в
зависимости от природы растворителя
может меняться от 0,5 для статистического
молекулярного клубка до 2,0 для абсолютно
жёсткой молекулы. Величина К изменяется
в пределах от 10-2
до 10-5
и зависит от выбора системы полимер —
растворитель. Значения К и α берутся из
литературных данных.
Определив значение
характеристической вязкости при
известных величинах
констант К α
и вычисляют молекулярную массуполимера.
Для расчёта
молекулярной массы подставляют значения
[η],
констант Ки α
и логарифмируют уравнение Марка
-Хаувинка — Куна
lg[
η] = lg
К + α
lg
M
Характеристическая
вязкость определяет поведение
изолированныхмакромолекул.
Она представляет собой меру потерь
энергии на трениеизолированных
макромолекул о растворитель при их
поступательномдвижении
с градиентом скорости отличным от нуля.
Характеристическаявязкость
зависит от размеров макромолекул в
растворе, от природырастворителя
и температуры. Поэтому характеристические
вязкости имолекулярные
массы для одного и того же полимера,
измеренные в разныхрастворителях,
отличаются, так как константы α
различны (например, вхорошем
и плохом растворителях).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Молекулярная масса макромолекулы и полимера
Полимер (высокомолекулярное вещество) состоит из множества длиноцепных молекул (макромолекул), образование которых формально можно представить в виде схемы:
nA 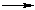
где А – мономер; n – число молекул исходного мономера и число мономерных звеньев в образовавшейся макромолекуле (степень полимеризации).
Молекулярная масса макромолекулы связана со степенью полимеризации соотношением:
М(макромолекулы) = M(звена) • n,
- где n – степень полимеризации,
M – относительная молекулярная масса
(подстрочный индекс r в обозначении относительной молекулярной массы Мr в химии полимеров обычно не используется).
Для полимера, состоящего из множества макромолекул, понятие молекулярная масса и степень полимеризации имеют несколько иной смысл. Дело в том, что когда в ходе реакции образуется полимер, то в каждую макромолекулу входит не строго постоянное число молекул мономера. Это зависит от того, в какой момент прекратится рост полимерной цепи.
Поэтому в одних макромолекулах мономерных звеньев больше, а в других – меньше. То есть, образуются макромолекулы с разной степенью полимеризации и, соответственно, с разной молекулярной массой (так называемые полимергомологи).
Следовательно, молекулярная масса и степень полимеризации полимера являются средними величинами:
Mср(полимера) = M(звена) • nср
Большинство экспериментальных методов определения молекулярной массы полимеров дает среднечисловое значение М. Смысл этого понятия можно пояснить на следующем примере.
- Допустим, N молекул полиэтилена (-CH2-CH2-)n имеют молекулярную массу 28000, а 3N молекул – 140000. Какова молекулярная масса этого полимера?
Находим среднее (числовое) значение:
Среднечисловая степень полимеризации nср в этом случае равна:
Кроме среднечисловой молекулярной массы полимера в ряде случаев используется среднемассовое ее значение, когда усреднение ведется не по числу макромолекул, а по их массе.
Наиболее часто среднечисленную молекулярную массу 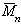
Молекулярная масса определяется как коэффициент, связывающий весовую и частичную концентрации
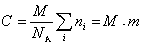
где С – весовая концентрация, г/см3; 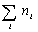
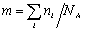
Таким образом, задача сводится к определению мольной концентрации раствора известной весовой концентрации.
Стремление молекул растворителя к самопроизвольному проникновению через мембрану определяется разностью химических потенциалов растворителя в частях системы, разделенных перегородкой, причем 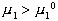
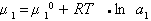
где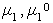
Осмотическое давление раствора
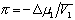
где 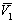
Связь между осмотическим давлением и весовой концентрацией растворов описывается следующими уравнениями:
(уравнение Вант-Гоффа) для растворов низкомолекулярных веществ
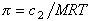
для растворов полимеров
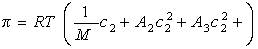
или
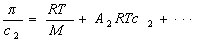
где А2 – второй вириальный коэффициент, характеризующий взаимодействие полимера с растворителем и форму макромолекул в растворе, обычно А3®0.
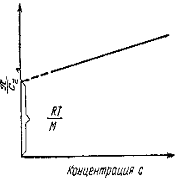
Величина p /c2 носит название приведенного осмотического давления. На рис. 2.50 показан пример зависимости приведенного осмотического давления для растворов полимера в различных растворителях. Чем больше наклон прямых, тем сильнее проявляется взаимодействие между компонентами раствора и тем больше величина
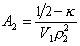
где k- параметр взаимодействия, r2 – плотность полимера в растворе, V1 – мольный объём растворителя.
При k = 0,5 А2 =0 и раствор ведет себя как идеальный. Таким образом, определяя наклон зависимости p /c2 = fc2 , можно охарактеризовать сродство компонентов раствора. Величина молекулярной массы определяется как
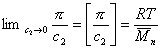
Найденная из измерений осмотического давления молекулярная масса характеризует 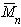
Метод светорассеяния. Среднемассовая молекулярная масса
Явление светорассеяния в растворах полимеров наблюдается в том случае, если размер макромолекул менее l/2 — половины длины волны проходящего света. Существуют различные теории рассеяния света, положенные в основу расчетных уравнений экспериментальных методов определения молекулярной массы. При условии, что размер молекул полимера меньше l/2, для растворов полимеров справедлива теория рассеяния света Эйнштейна.
Если рассеяние света происходит на сферических частицах, то интенсивность рассеяния будет одинаковой во всех направлениях. Обозначим угол, под которым по отношению к падающему лучу определяется интенсивность рассеянного света, Q. Рассеивающая способность характеризуется коэффициентом рассеяния R:
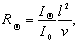
где IQ, I0— интенсивность рассеянного и падающего света; l– расстояние, на котором наблюдается рассеянный свет от рассеивающего объёма; v – рассеивающий объём.
В практике определения интенсивности рассеянного света наиболее часто определяется R90, т.е. рассеяние света под углом 90o, хотя с помощью современных приборов, особенно использующих в качестве источника света лазер, можно определять интенсивность рассеянного света от Q = 4o.
Для расчета молекулярной массы полимеров используется уравнение Дебая:
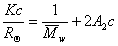
где с – весовая концентрация, г/см3; K – оптическая постоянная, зависящая от коэффициента преломления среды (n0), концентрационного инкремента коэффициента преломления раствора (dn/dc) и длины волны света l,
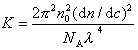
Таким образом для определения молекулярной массы следует измерять угловое рассеяние света, коэффициент преломления среды. Особенно тщательно следует определять (dn/dc), так как эта величина обычно чрезвычайно мала. Следует привлекать приборы, позволяющие определить коэффициент преломления с точностью до 6-го знака.
По аналогии с поглощением света можем записать для интенсивности рассеяния
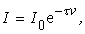
гдеt – мутность 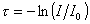
Мутность связана с коэффициентом рассеяния соотношением
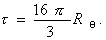
Поэтому, с учетом уравнения (2.5.19), можно проводить расчет молекулярной массы по уравнению
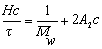
где Н – оптическая постоянная, Н = 16p K/3.
Для расчета молекулярной массы определяется величина
По углу наклона можно определить значение А2 и охарактеризовать взаимодействие компонентов раствора. Изменение температуры, замена растворителя могут вызвать изменение межмолекулярного взаимодействия компонентов раствора и формы макромолекул в растворе.
Молекулы могут приобретать и асимметрическую форму. В этом случае рассеяние света под разными углами к падающему лучу будет неравномерным и найденное значение молекулярной массы содержит погрешность. Поэтому необходимо вводить поправку на внутреннюю интерференцию света, появляющуюся в результате рассеяния света с некоторой разностью фаз от различных участков молекул. Для введения поправок существуют два основных метода: метод Дебая и метод Зимма.
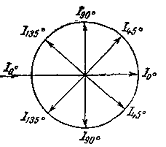
Метод Дебая основан на измерении интенсивности рассеянного света при значении углов рассеяния, равных 135 и 45o, соответственно R45 и R135. Отношение интенсивности равно отношению поправок Р и называется коэффициентом асимметрии
z = R 45 /R135 = P45 / P135 . (2.5.24)
Величина z зависит от концентрации раствора, так как форма макромолекул в растворе может изменяться с увеличением концентрации. Для определения истинного значения z строят зависимость 1/(z-1)=fс и определяют 1/([z]-1) = limс®0 1/(z-1).
Зная z,по существующим таблицам находят величину Р, которую вводят в расчетное уравнение
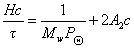
Метод Зимма основан на построении специальной диаграммы, на которой по оси абсцисс откладывается и концентрация, и угол рассеяния света. Линии на диаграмме образуют два семейства параллельных (практически прямых) линий. Более крутые линии представляют собой зависимость рассеяния света от концентрации растворов. Более пологие – зависимость рассеяния света от угла определения. Нижняя линия соответствует рассеянию света при с = 0, крайняя левая — дает совокупность точек при sin Q/2 =0. Обе прямые пересекаются с осью ординат в точке, характеризующей 
Комбинированный метод измерения диффузии и вязкости
Для определения молекулярной массы полимеров можно измерять коэффициент диффузии растворенного вещества. Если представить, что макромолекулы имеют узкое распределение по молекулярной массе и каждая молекула не взаимодействует с другими молекулами полимера, то для молекулы, перемещающейся вдали от стенки сосуда, сила трения со средой может быть описана выражением
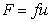
где F- сила трения; u – скорость перемещения молекулы; f =6ph0r- коэффициент трения сферических частиц; h0 – вязкость растворителя; r – радиус макромолекулы в растворе.
Уравнение (2.5.26) справедливо при скорости перемещения макромолекул 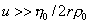
Предполагая применимость уравнения Эйнштейна для диффузии полимерных молекул в растворе, запишем
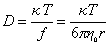
Молекулярная масса сферических макромолекул определяется как масса 1 моля полимера:
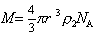
Сочетание (2.5.27) и (2.5.28) дает
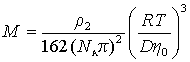
Cущественную ошибку может внести в расчет использование в качестве r2 значения плотности полимера, так как в растворе плотность макромолекул может значительно отличаться от плотности “сухого” полимера. Поэтому следует использовать значение 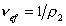
Тогда
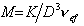
где vef— это тот удельный объём, который занимают макромолекулы в растворе, см3/г, учитывающий взаимодействие макромолекул в растворителе.
Вискозиметрический метод определенияvef и 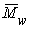
Существуют несколько уравнений, связывающих вязкость растворов полимеров с их концентрацией. Уравнение Симха для сферических частиц связывает удельную вязкость с объёмной концентрацией полимера:
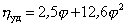
где j – объёмная доля, занимаемая полимером, 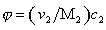
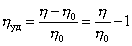
где h0 – вязкость растворителя; h – вязкость раствора; (h/h0) – относительная вязкость.
Поэтому
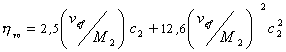
В общем виде
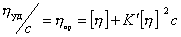
где 
Уравнение (2.5.33) носит название уравнения Хаггинса, K’ – постоянная Хаггинса, характеризующая форму макромолекул в растворе. Для сферических макромолекул K’ = 2, для эллипсоид-
ных K’ = 2¸10; для игольчатых форм K'<2 и может быть даже отрицательной.
Для определения vef строится зависимость hпр от концентрации раствора (рис. 2.51.). Из значения [h] находится величина vef, которая затем подставляется в уравнение (2.5.30).
Расчет молекулярной массы из вискозиметрических данных (рис 2.52.) проводится по эмпирическому уравнению Марка-Хаувинка-Куна 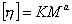
Для этого уравнение приводят к линейному виду
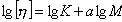
По этой зависимости определяют постоянные а и K. Для многих полимеров эти постоянные приведены в таблицах. Следует помнить, что постоянные приводятся при заданной температуре и для определения молекулярной массы следует использовать тот же растворитель, для которого найдены эти постоянные. Если в процессе синтеза могут образовываться разветвленные молекулы, то степень разветвления также сказывается на точности определения молекулярной массы полимеров этим методом, так как постоянные а и K зависят от формы макромолекул, а последняя изменяется при разветвлении. При калибровке постоянных уравнения Марка-Хаувинка-Куна следует определять характеристическую вязкость не менее чем пяти относительно однородных фракций полимера.
Определения молекулярной массы вискозиметрическим методом удобны и просты. Однако следует всегда помнить о возможных погрешностях на применимость этого метода.
Метод седиментации- один из наиболее точных методов определения молекулярной массы полимеров. Для анализов используется ультрацентрифуга, которую разработал шведский ученый Уве Сведберг в 1926 г. Он же предложил метод расчета молекулярной массы полимеров по скорости осаждения. За эти разработки он был удостоен Нобелевской премии.
Если предположить, что макромолекулы имеют узкое распределение по молекулярной массе (а в идеальном случае – монодисперсны), то сила, действующая на молекулу в центробежном поле,
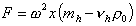
где F– сила, действующая на молекулу полимера; w2x – ускорение центробежного поля, w – угловая скорость вращения; x – расстояние от молекулы до центра вращения; mh – масса одной сольватированной молекулы; vh – объем одной молекулы, r0 — плотность растворителя, vhr0 – поправка на выталкивающую силу.
Масса одной сольватированной молекулы, в соответствии с концепцией сольватированной частицы Онслея, определяется как
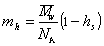
где hs— число сольватации макромолекул (г/г).
Объем одной сольватированной макромолекулы
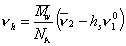
где v2— парциальный удельный объем макромолекул, см3/г; hsv10— поправка на объем связанного растворителя; v10 = 1/r0 – — удельный объем растворителя, см3/г.
С учетом (2.5.36) и (2.5.37) запишем уравнение (2.5.35) в виде
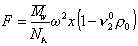
Можно видеть, что величина сольватации hs исключается из расчетного уравнения. Сила трения, уравновешивающая центробежную силу в стационарном режиме,
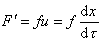
Из условия стационарности F= F’, следовательно,
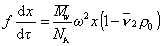
Для перехода от дифференциальной формы уравнения к интегральной Сведберг предложил использовать понятие постоянной седиментации
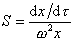
характеризующей скорость осаждения макромолекул под действием единицы центробежного поля. Эта постоянная зависит только от свойств макромолекул.
Коэффициент трения может быть определен из измерения коэффициента диффузии по уравнению Эйнштейна
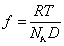
поэтому

Уравнение (2.5.42) носит название уравнения Сведберга. Коэффициент диффузии D и коэффициент седиментации s определяются независимо. Для исключения эффекта взаимодействия макромолекул значение s экстраполируют к бесконечно малой концентрации и в расчетах используют значение s0.
Метод седиментации позволяет наиболее точно определить значение молекулярной массы полимера, так как здесь не надо определять или предполагать форму макромолекул, а величина сольватации исключается из расчетного уравнения. Экспериментально установлено, что
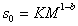
гдеK и b – постоянные, для многих полимеров приведенные в таблицах. Поэтому после калибровки постоянных уравнение (2.5.43) можно использовать для определения молекулярной массы без привлечения диффузионных измерений.
Определение средней молекулярной массы методом
диффузионно-седиментационного равновесия.
По этому методу не проводят осаждения полимера, а ведут процесс только до установления равновесия между седиментацией и диффузией.
Для седиментационного потока
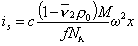
Для диффузионного потока
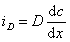
При седиментационно-диффузионном равновесии iD= is, следовательно,
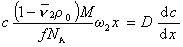
После преобразования с учетом D = kT/f и kNА=R получаем
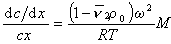
Откуда после интегрирования
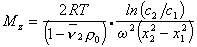
Таким образом достаточно определить значения концентрации раствора в двух точках кюветы чтобы рассчитать значение Mz . Этот метод носит название метода Арчибальда. Можно проводить расчет и по неустановившемуся равновесию, что значительно сокращает время эксперимента, но усложняет расчет.
Кроме определения молекулярной массы метод седиментационного ультрацентрифугирования в сочетании с вискозиметрией позволяет охарактеризовать форму макромолекул в растворе, определяя фактор Шераги — Манделькерна b, который для сферических частиц равен b = 2,12×106.
Расчет проводится по формуле
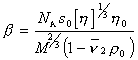
где s0 – коэффициент седиментации, экстраполированный к бесконечному разбавлению; [h] – характеристическая вязкость;h0 – вязкость растворителя.
АННОТАЦИЯ
В статье описан наиболее удобный и простой процесс — вискозиметрический метод экспериментального определения молекулярной массы полимера. При внедрении разработанной методики в лабораторную практику химии высокомолекулярных соединений, усваемость материала студентами составит в среднем 72-89%.
ABSTRACT
The article describes the most convenient and simple process — a viscometric method for the experimental determination of the molecular weight of a polymer. When the developed technique is introduced into laboratory practice of chemistry of high-molecular compounds, the assimilation of students will average 72-89%.
Ключевые слова: молекулярные соединения, молекулярная масса, растворимость, макромолекула, вискозиметр, резина, полистирол.
Keywords: molecular compounds, molecular weight, solubility, macromolecule, viscometer, rubber, polystyrene.
Введение. Одной из главных особенностей, отличающих высокомолекулярные соединения от низкомолекулярных веществ, является то, что они имеют большую молекулярную массу. Молекулярная масса является наиболее важной константой для полимеров и необходимым показателем для полного описания каждого высокомолекулярного соединения.
Изменения, которые происходят в процессе переработки полимеров и их эксплуатации, могут быть обнаружены по молекулярной массе.
Экспериментальная часть. Молекулярная масса определяет температурный предел текучести соединения, его свойства, такие как набухание и растворимость. На её величину большое влияние оказывают механические свойства полимеров, в том числе прочность, деформация и упругость. Определение молекулярная масса, присущая высокомолекулярным соединениям, простые и ясные понятия, связанные с ними, чрезвычайно сложны по сравнению с низкомолекулярными соединениями.
Наиболее удобным и простым способом экспериментального определения молекулярной массы полимеров является вискозиметрический метод. Немецкий ученый Штаудингер установил, что вязкость растворов зависит от размера молекулярной массы высокомолекулярных соединений и формы макромолекулы. При этом все макромолекулы в растворе находятся в строго линейной форме, в виде цилиндра [3]. Это соотношение объясняется следующим уравнением:
В этом случае ηнис-относительная вязкость, K — Константа, характерная для данного полимера, с — молярная концентрация, моль / л.
Величина K отражается на специфической химической структуре макромолекулы и постоянна для одного и того же полимера в данном растворителе. Относительная вязкость — (ηнис) — это отношение расхода раствора к расходу растворителя. Расход определяется на вискозиметре.
В лабораторных условиях мы определили молекулярную массу нескольких полимеров вискозиметрическим методом. Ниже приводится методика определения молекулярной массы полиметилметакрилата, полистирола и натурального каучука.
Определение молекулярной массы полиметилметакрилата
Для определения молекулярной массы полиметилметакрилата были проведены два лабораторных эксперимента.
Первая лабораторная работа
Студентам даётся кратко понятие о растворах высокомолекулярных соединений, уделяя больше внимания взаимосвязи между вязкостью и молекулярной массой. Затем объясняются структура и техническое обслуживание устройства вискозиметра.
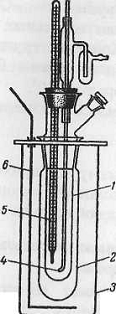
Вискозиметр Оствальда состоит из U-образной стеклянной трубки (показано на рисунке). Одна сторона трубки расширена, а другая снабжена капилляром диаметром 0,6-1,0 мм. В верхней части капилляра прикреплена расширенная сфера объемом 2-3 мл. К нижней части расширенной стеклянной трубки прикреплена малогабаритная трубка, на которой обозначены верхняя и нижняя части сферического удлинителя (А и В). Вискозиметр установливаются в водяном термостате при температуре 200С .
Рисунок. Вискозиметр Оствальда
В расширенную часть заливается 12 мл растворителя, например бензола (эта часть должна быть заполнена растворителем). В капилляре не должно быть пузырьков воздуха. (Вообще, жидкость не следует тянуть ртом, иначе может произойти несчастный случай, так как многие растворители токсичны)
После снятия резиновой насадки мы наблюдаем, что бензол заливается в расширенную часть вискозиметра. Когда жидкость (А) попадает в верхнюю часть метки, используется секундомер и устанавливается время, пока второй объем растворителя (В) не достигнет нижней части метки. Секундомер останавливается, и результат записывается. Процесс повторяется 3-4 раза и получается среднее значение. Например: I результат — 94,5 сек; II результат — 94,6 сек; III результат — 94,7 сек. Среднее время составляет 94,6 сек.
Затем вискозиметр извлекают из термостата с водой, растворитель переливают в другой сосуд, прибор промывают и сушат в сушильном шкафу.
В этой лабораторной работе студенты готовят 1% раствор полиметилметакрилата в бензоле. Для этого берут чистую и сухую пробирку, наполняют ее 0,2 г полиметилметакрилата и заливают 20 мл бензола, закрывают пробкой и оставляют при комнатной температуре на 3,0-3,5 часа.
Вторая лабораторная работа
Студенты определяют расход раствора полиметилметакрилата точно так же, как они определяли расход растворителя на первой лабораторной работе. (Температура в термостате должна быть одинаковой для растворителя и раствора)
Вычисляется относительная вязкость, в уравнение вводится найденное значение и определяется молекулярная масса
Ниже приведены расчеты молекулярной массы полиметилметакрилата, полученные в лабораторных условиях:
Время прохода раствора: 235,8 сек (среднее значение)
/Khudoynazarova.files/image003.png)
/Khudoynazarova.files/image004.png)
Определение молекулярной массы полистирола
Готовят 1% раствор полистирола в бензоле. (0.2 г полистирола добавляют в 20 мл бензола и оставляют на 3 часа). Некоторые студенты таким же образом готовят блочный полистирол (промышленно полученный полистирол), в то время как другие студенты готовят эмульсионные полистирольные (полистирол полученный лаборатории) растворы.
Таблица.
Константы K и α
|
№ |
Полимеры |
Элементарное звено |
Растворитель |
Температура 0С |
К∙10-4 |
α |
|
1 |
Полистирол |
-СН2-СН(С6Н5)- |
Толуол Бензол |
25 25 |
1,28 4,17 |
0,70 0,60 |
|
2 |
Полиакрилонитрил |
-СН2-СН(СN)- |
Диметил-формамид |
20 25 |
1,75 3,95 |
0,66 0,75 |
|
3 |
Поливинилацетат |
-СН2-СН- │ ОСОСН3 |
Ацетон |
50 |
2,82 |
0,67 |
|
4 |
Поливинилспирт |
-СН2-СН(ОН)- |
Вода ДМСО |
25 30 |
5,90 5,95 |
0,67 0,63 |
|
5 |
Поливинилхлорид |
-СН2-СН(Сl)- |
ТГФ |
20 |
0,26 |
0,92 |
|
6 |
Полиизопрен Каучук (естественный) |
-СН2-С=СН-СН2 │ СН3 |
Толуол Бензол |
25 20 |
3,60 14,0 |
0,64 0,50 |
|
7 |
Полиметилмет- акрилат |
-СН2-С(СН3)- │ СООСН3 |
Хлороформ Бензол |
20 20 |
0,94 2,40 |
0,75 0,54 |
|
8 |
Полиметилакрилат |
-СН2-С(СН3)- │ СООСН3 |
Бензол |
30 |
0,45 |
0,78 |
|
9 |
Полиакриламид |
-СН2-СH- │ СОNН2 |
Вода |
25 |
0,631 |
0,80 |
|
10 |
Целлюлоза |
-[С6Н7О2(ОН)3]n |
Реактив Швейцера |
25 |
0,85 |
0,81 |
|
11 |
Полиэтилен |
-СН2-СН2— |
Декалин n-ксилол |
70 80 |
0,39 1,65 |
0,74 0,83 |
Время прохода раствора: 220,5 сек (среднее значение)
/Khudoynazarova.files/image005.png)
Затем каждый студент получает дополнительное задание: некоторые студенты вычисляют молекулярную массу промышленного блочного полистирола, некоторые студенты вычисляют молекулярную массу эмульсионного полистирола, полученного в лаборатории, остальные студенты определяют молекулярную массу эмульсионного полистирола полученного в промышленности. Например:
Промышленно полученный блочный полистирол М = (3,58 -1) * 24980 = 64448,4 у.е.
Лабораторно полученный эмульсионный полистирол М = (2,33 -1) *24980 = 33223,4 у.е.
Промышленно полученный эмульсионный полистирол М = (8,7 — 1) * 24980 =192346 у.е.
Определение молекулярной массы натурального каучука
Готовят 0,2-0,3% раствор каучука в бензоле. Помещают в колбу 40-50 мг каучука, заливают 20 мл бензола и закрывают горлышко пробкой и оставляют на 12 часов.
Перед определением молекулярной массы каучука, из раствора отделяют не растворившийся каучук (фильтруют через ватный тампон) и затем определяют концентрацию раствора. Для этого берут 2 мл раствора и помещают его в фарфоровую чашу, раствор выпаривают, отмеряют остаток и рассчитывают концентрацию 2 мл раствора.
Относительная вязкость каучука определяется при 200С. Зная молярную концентрацию и константу (1,4 * 10-4) (из ниже приведённой таблицы), студенты рассчитывают молекулярную массу натурального каучука.
Время прохода раствора: 118,4 сек (среднее значение)
/Khudoynazarova.files/image007.png)
Предложенная методика была применена в группе 2.1.Хим.-17. В группе было 20 студентов, которые были разделены на 4 группы. Из них в 3 группах были проведены нетрадиционные способы определения молекулярной массы, а в 1 группе традиционный способом, то есть на основе методики, приведенной в источнике [4]. Студентам I группы было поручено определить «Молекулярную массу полиметилметакрилата», студентам II группы определить «Молекулярную массу полистирола», студентам III группы определить «Молекулярную массу натурального каучука», а студентам IV группы определить молекулярную массу полимера традиционным способом.
В ходе эксперимента было отмечено, что студенты I, II и III групп быстро и точно определяли молекулярные массы полимеров. Студенты IV группы, напротив, потратили много времени на проведение эксперимента и испытывали большие трудности в определении молекулярной массы полимера на основе сложного уравнения.
В конце экспериментов, когда от студентов групп был получен отчет, осваение лабораторной темой в I, II и III группах составило в среднем 72-89%, в то время как осваение студентами IV группы составило 60-74%.
Выводы. Разработана методика проведения лабораторных занятий по определению молекулярной массы полимеров с использованием вискозиметрического метода определения вязкости растворов полимеров. Полученные результаты имеют большое практическое значение и используются для определения областей применения полимеров.
Таким образом, предлагаемая лабораторная методика экспериментального расчета молекулярной массы полимера оказывает положительное влияние на повышение знаний, преобретению навыков по применению полученных знаний на практике и формирования квалификации по определению молекулярной массы полимеров.
Список литературы:
- Касьянова А.А., Добрынина Л.Е. Лабораторный практикум по физике и химии высокомолекулярных соединений.– М:Легкая индустрия.-1979-с.97-99
- Практикум по высокомолекулярным соединением. Под ред. проф. В.А. Кабанова – М: «Химия» — 1985. – с.80-113
- Практикум по химии и физике полимеров. Учеб. Н.И. Аввакумова., Л.А. Бударина, С.М. Дивгун и др. – М: «Химия»- 1997. – с.218-220
- Мавлонов Б.А., Мустафоев Х.М., Хайдаров А.А. Лабораторный практикум по высокомолекулярным соединением, учебное пособие. –Бухара, «Муаллиф»-1996. – с.17-19.
- Худойназарова Г.А., Мавлонов Б.А., Хайдаров А.А. Лабораторный практикум по химии высокомолекулярных соединений, учебное пособие. –Бухара, “Бухара” 2020. 272с.
- Худойназарова Г.А., Мавланов Б.А., Азимова Н.И., Олимова Ф. Исследование сополимеризации стирола с гетероциклическими эфирами акриловых кислот и применение полученных знаний в семинарских и самостоятельных занятиях по химии ВМС. Междисциплинарные исследования в науке и образовании. – 2012. -№1 Kg; URL: www.rs.rae.ru/mino/159-1208. Украина, г. Киев.
Методы определения молекулярной массы и молекулярно-массового распределения полимеров
На тему: » Методы определения
молекулярной массы и молекулярно-массового распределения полимеров»
Содержание
1. Введение
2. Виды молекулярных масс
3. Методы определения молекулярных масс полимеров
3.1 Осмометрический метод
3.2 Метод ультрацентрифугирования
3.3 Метод светорассеяния
3.4 Метод вискозиметрии
3.5 Определение ММ по концевым группам
3.5 Криоскопический метод
4. Молекулярно-массовое распределение полимеров
4.1 Ультрацентрифугирование.
4.2 Турбидиметрическое титрование
1.
Введение
Молекулярная масса (ММ) является одной из основных
характеристик полимеров. Значение этой величины, возможность ее надежного
определения и варьирования важны, как для разнообразных технологических
процессов, так и для интерпретации иных фундаментальных характеристик
полимеров.
При этом обычные методы определения молекулярной массы,
применяемые в химии низкомолекулярных соединений, такие, как криоскопия и
эбуллиоскопия, пригодны только для исследования полимеров с молекулярной массой
до 20000. Ниже будут рассмотрены методы определения ММ полимеров.
Молекулярно-массовое распределение (ММР) — фундаментальная
характеристика полимера — наряду с химической и технологической структурой цепи
макромолекулы определяют весь комплекс физико-химических и механических свойств
не только самого полимера, но и получаемого из него материала.
2. Виды
молекулярных масс
В химии полимеров различают среднечисловую
(Mn), среднемассовую (Мw),a также срдневязкостную (Мв)
молекулярные массы. В настоящее время не существует метода, обеспечивающего
определение как Mn, так и Mw во всем интервале
молекулярных масс. В этой связи химики пользуются различными методами, каждый
из которых охватывает определенные границы значений молекулярных масс.
Так как синтетические высокомолекулярные
соединения представляют собой смеси макромолекул с различными молекулярными
массами, т.е. являются полидисперсными, можно определить лишь среднее значение
молекулярной массы. Различные экспериментальные методы позволяют измерить
молекулярные массы разной степени усреднения. Так, среднемассовая молекулярная
масса Mw определяется по данным светорассеяния,
ультрацентрифугирования и измерения вязкости, среднечисловая молекулярная масса
Mw получается по данным
измерения осмотического давления или определения концевых групп. Для
монодисперсных полимеров Mw=Mn, для полидисперсных Mw всегда больше Mn. Отношение
среднемассовой и среднечисловой молекулярной массы дает величину,
характеризующую полидисперсность соответствующего полимера:
U = Mw / Mn
В большинстве случаев это отношение больше
2. При полимеризации некоторых мономеров в присутствии специально подобранных
инициаторов и в особых условиях можно получить полимеры с узким
молекулярно-массовым распределением: U=1,1-1,3. При определении молекулярной массы в
растворе необходимо предварительно убедиться в том, что макромолекулы не
ассоциированы. Отсутствие ассоциатов может быть доказано с помощью
полимераналогичных превращений: если степень полимеризации полимерного образца
до реакции совпадает со степенью полимеризации прореагировавшего полимера, то
ассоциация исключается. Иногда для доказательства отсутствия ассоциации
сравнивают значения молекулярной массы, полученные в разных растворителях: они
должны совпадать.
3. Методы
определения молекулярных масс полимеров
Методы определения молекулярных условно
масс полимеров можно на:
. Абсолютные методы, результаты которых не
зависят от принятой модели макромолекулы (рассеяние света, седиментационное
равновесие).
. Относительные методы, использующие
калибровочные зависимости и полимерные стандарты.
Абсолютные методы дают непосредственно
значение молекулярной массы или степени полимеризации, причем в расчетное
уравнение, наряду с легко определяемыми константами, такими, как плотность,
показатель преломления и т.д., входят только универсальные константы — газовая
постоянная или число Авогадро.
В настоящее время наиболее важными
абсолютными методами определения молекулярной массы являются следующие:
) осмометрический метод (определение
осмотического давления);
) метод ультрацентрифугирования
(определение констант седиментации и диффузии);
) методы светорассеяния (определение
интенсивности тиндлевского рассеяния в зависимости от длины волны падающего
света и угла наблюдения).
Эти методы требуют специального
аппаратурного оформления и экспериментальных навыков, поэтому они доступны
далеко не каждой лаборатории. В связи с этим, по-прежнему широко используют
химические методы, такие как определение концевых групп, криоскопия, несмотря
на некоторые ограничения.
С помощью относительных методов измеряется
какое-либо свойство полимера, которое однозначно зависит от его молекулярной
массы, например степень растворимости в данном растворителе, вязкость раствора.
При этом для оценки молекулярной массы необходимо иметь экспериментальную градировочную
кривую, полученную путем сравнения с данными одного из абсолютных методов.
Одним из наиболее распространенных и
широко применяемых относительных методов является измерение вязкости по
Штаудингеру.
Рассмотрим подробно абсолютные и
относительные методы определения молекулярной массы.
3.1
Осмометрический метод
Зависимость приведенного осмотического
давления от концентрации для разбавленных растворов полимеров выражена
уравнением:
, (1)
Графически она представлена на рис.1
Рис.1 Изменение осмотического давления в зависимости от
концентрации В соответствие с уравнением отрезок ординаты, отсекаемой прямой,
равен приведенному осмотическому давлению при бесконечном
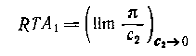
Если предположить, что при бесконечном
разбавлении справедливы законы идеальных растворов, то можно записать:

Следовательно, первый вириальный
коэффициент зависит от молекулярного веса полимера и может быть рассчитан по
величине отрезка ординаты, отсекаемого прямой Таким образом, для определения
молекулярного веса полимера следует изменить осмотическое давление растворов
при нескольких концентрациях и экстраполировать полученную прямую к нулевой
концентрации. Осмометрическим методом можно измерять молекулярные веса от 104
до 106.
Для определения молекулярного веса этим
способом служат специальные приборы — осмометры. Принцип действия осмометров
заключается в том, что растворитель, отделенный от раствора полупроницаемой
мембраной, проницает через нее в раствор до тех пор, пока уровень последнего в
капилляре не перестанет изменятся. Разность уравнений в капилляре осмометра и в
контрольном капилляре является мерой осмотического давления. Обычно пользуются
статическим и динамическим методами.
Статический метод состоит в том, что
измеряется равновесная разность уровней в осмометре. Динамический метод основан
на измерении скорости проникновения растворителя через мембрану в зависимости
от приложенного давления.
Осмометры, предназначенные для инверсии
осмометрического давления статическим методом, очень простые по устройству, и в
этом заключается их преимущество перед осмометрами других типов. Однако все они
имеют общий недостаток: длительность установления равновесия. В процессе
установления равновесия может произойти увеличение концентрации раствора вблизи
мембраны вследствие адсорбции полимера, что не учитывается и приводит к ошибкам
в определении молекулярного веса. Этот недостаток, не является принципиальным и
может быть устранен при правильном изготовлении и хранении мембран.
Статический метод обычно не рекомендуется
для определения молекулярной массы полимеров, которые могут структурироваться.
Основным достоинством динамического метода
является быстрота измерений.
Надежность осмометрических измерений
определяется правильным выбором мембран, проницаемых для растворителя и
непроницаемых для растворенного вещества. Во-первых, мембрана не должна сильно
набухать в растворителе, во-вторых, она должна быть достаточно тонкопористой
для того, чтобы свободно пропускать молекула растворителя.
В настоящее время для изготовления мембран
используется целлофан и соответствующим методом обработанные пленки из
денитрованного нитрата целлюлозы.
молекулярная масса полимер
Для определения молекулярного веса
осмометрическим методом, полимер должен быть тщательно очищен от примесей.
Этого обычно достигают его переосаждением. Для очищенного 1% -ого раствора
получают путем разбавления растворы с концентрацией 0,5, 0,25 и 0,075%.
Для вычисления молекулярного веса полимера полученные
вещества осмотического давления полимеров делят на соответствующие значения
концентраций и найденные таким образом величины приведенного осмотического
давления наносят на зависимости от с2. Прямую
=f (c2) экстраполируют к
нулевой концентрации (до пересечения с осью ординат) и полученное значение представляют для
вычисления ММ в уравнение (5).
Чтобы выразить осмотическое давление в
атмосферах, величину π, выраженную в
сантиметрах столбах раствора, следует умножить на плотность растворителя,
разделить на плотность ртути и на 76. Поскольку концентрация выражена в г/ 100
мл, числитель необходимо умножить на 10, чтобы получить концентрацию раствора
отнесенную к литру. Тогда,
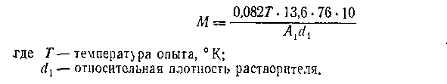
Метод определения ММ с помощью
осмотического давления является одним из наиболее точных. Однако из-за
трудоемкости он не может быть применен на практике для быстрого определения ММ.
3.2 Метод
ультрацентрифугирования
Известно, что по скорости оседания частиц
можно определить их размеры. Оседающая частица находится под влиянием двух сил:
гравитационного поля и сопротивления среды, т.е. силы внутреннего трения. Если
оседающая частица имеет шарообразную форму, сила внутреннего сгорания, согласно
закону Стокса, равна 6πηru. Если обе силы равны
друг другу, частица оседает с постоянной скоростью: (8)
Из уравнений следует, что для определения
радиуса оседающей частицы необходимо измерить скорость ее оседания, т.е. путь S, проходимый частицей за
промежуток времени.
Однако очень небольшие частицы оседают с
малыми скоростями. В 1912 году А.В. Думанский предложил использовать
центробежное поле для ускорения процесса осаждения, а в 1923 г. Светбергом была
сконструирована ультрацентрифуга, представляющая собой аппарат, в котором
создается ускорение, превышающее ускорение ускорение гравитационного поля в
сотни раз. Оседание молекул в центробежном поле происходит в направлении,
перпендикулярном оси вращения. Молекула, имеющая объем v, под действием
центробежной силы постепенно оседает. В процессе оседания расстояние ее от оси вращения
(x) все время изменяется.
Движущая центробежная сила равна произведению массы частицы на ускорение
центробежного поля w2x, где w — угловая скорость вращения. Сила сопротивления выражается
законом Стокса для шарообразных частиц:
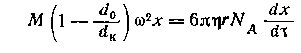

Отношение называется постоянной
седиментации и обозначается S.
Таким образом, Согласно этому уравнению,
для вычисления молекулярного веса полимера необходимо знать коэффициент
диффузии и постоянную седиментации. Постоянная седиментации определяется при
помощи ультрацентрифуги. Для этой цели через кювету с раствором полимера,
помещенную в ультрацентрифугу, пропускают пучок света, который падает на
фотопластинку, находящуюся за кюветой. При вращении кюветы, по мере осаждения
вещества граница раздела между раствором и растворителем постепенно
перемещается, и свет поглощается по высоте кюветы в различной степени. На
фотопластинке получаются полосы разной степени почернения. Фотометрируя снимки,
сделанные через определенные промежутки времени, можно определить скорости
седиментации. Разделив найденную величину на квадрат угловой скорости вращения
ультрацентрифуги w2 и величину x, получим постоянную седиментации S.
Для монодисперсного полимера, граница
раздела выражена достаточно резко, так как все молекулы оседают с одинаковой
скоростью. Поэтому на фотопластинке получаются четко различимые полосы разной
степени почернения. В полимолекулярной системе, каждая фракция оседает со своей
собственной скоростью, поэтому граница очень размыта и определение постоянной
седиментации затруднено. Размывание границы при седиментации, само по себе
очень важное явление, так как позволяет определить распределение полимера по
молекулярным весам.
Метод ультрацентрифуги с успехом
применяется для определения ММ и полимолекулярности полимеров, и является
единственным методом, позволяющим непосредственно получить кривые распределения
по молекулярным весам.
Однако этот метод очень сложен по
конструктивному оформлению и требует выполнения ряда условий: свойства раствора
должны оставаться постоянными иногда в течение нескольких суток, а растворитель
и полимер должны обладать разными плотностями, растворитель должен иметь низкую
вязкость, а полимер — растворятся при комнатной температуре. Все это
ограничивает возможность его применения.
3.3 Метод
светорассеяния
Как известно, среды бывают прозрачными и
мутными. Мутность среды объясняется рассеянием света. Если интенсивность
падающего света I0, а при прохождении света через среду толщиной x
интенсивность пучка вследствие рассеяния
уменьшается до значения I (поглощение света средой исключается), то мутность среды τ определяется уравнением: (11)
Следовательно, мутность характеризует долю
первичного света, рассеянного во всех направлениях при прохождение его через
какую-либо толщиной 1см.
Рассеивающая прозрачность вещества
характеризуется коэффициентом рассеяния R, определяется
соотношением: (12)
Первоначально предполагали что среда
рассеивает свет вследствие того, что в ней содержатся частицы определенного
размера (коллоидные частицы). Среды, лишенные таких частиц, называются оптически
пустыми (их не существует). Любая чистая жидкость (даже газы),
способна рассеивать свет. Светорассеивание обусловлено флюктуациями плотностей
и концентраций (если это раствор), т.е. отклонение плотности и концентраций от
равномерного значения. Образующие рои, или ассоциаты, служат центрами рассеяния
света.
Свет рассеивается от частицы или ассоциата
под разными углами, которые называются углами рассеивания света (рис.2).
Рис.2 Угол светорассеяния света под углом θ
Диаграмма рассеяния света во всех
направлениях, называется индикатрисой рассеяния.
Если рассеивающие частицы очень малы по
сравнению с длиной волной падающего света и изотропны, а падающий свет является
естественным, то индикатриса светорассеяния имеет вид, представленный на рис.3.
Рис.3. Индикатриса светорассеяния для
малых частиц.
Для малых по сравнению с длиной волны
падающего света частиц мутность связна с коэффициентом рассеяния света
уравнением: (13)
На основание представлений Смолуховского о
флюктуации плотностей и концентраций Эйнштейн создал теорию рассеяния света
жидкостями и растворами. Согласно этой теории, в растворе всегда возникают
флюктуации концентраций, вследствие чего наблюдается светорассеяние.
Интенсивность рассеянного света I«, вызванное флюктуациями концентраций, днеполяризованного
луча, выражается уравнением: (14)
Подставив в уравнение (14) значение R, из уравнения (12), для
избыточного рассеяния под углом 900 получим: (15)
Значение R90« можно заменить на
коэффициент мутности τ из уравнения (13) и
получим: (17)
В 1944 г. Теория Эйнштейна была применима
Дебаем к разбавленным растворам полимеров. При очень больших разбавлениях
образование ассоциатов мало вероятно, поэтому предполагается, что рассеивающими
центрами являются молекулярные клубки, которые представляют собой свернутые
гибкие макромолекулы.
Если размер не превышает 400 Ả, т.е. составляет 0,05λ-0,1λ, теория Эйнштейна
применима полностью и можно воспользоваться уравнением 17. Выразив
летучесть через осмотическое давление. (18)
И подставим значение π рядом с вириальными коэффициентами
(19)
Получим выражение для определения мутности
раствора полимера:
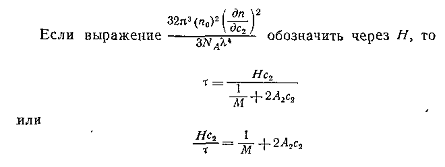
Опыт показывает, что уравнение (20) можно
применит только для определения молекулярного веса сравнительно
низкомолекулярных полимеров. При больших значениях ММ размер клубка значительно
больше 0,05λ-0,1λ и наблюдается угловая асимметрия рассеяния. Поэтому общая
интенсивность рассеяния уменьшается и молекулярный вес полимера, рассчитанный
по уравнению (20), меньше истинного молекулярного веса.
3.4 Метод
вискозиметрии
С помощью относительных методов измеряется
какое-либо свойство полимера, которое однозначно зависит от его молекулярной
массы, например степень растворимости в данном растворителе, вязкость раствора.
При этом для оценки молекулярной массы необходимо иметь экспериментальную
градуировочную кривую, полученную путем сравнения с данными одного из
абсолютных методов. Одним из наиболее распространенных и широко применяемых
относительных методов является измерение вязкости по Штаудингеру.
Именно Штаудингер, впервые обратил
внимание на связь вязкости разбавленных растворов и молекулярной массы
полимеров и установил эмпирическую зависимость: (21)
Для определения ММ по уравнению (21),
необходимо определить удельную вязкость заданной концентрации с и
коэффициент К. В своей работе Штаудингер применял растворы концентрации
~00,25/100 мл; постоянная К, вычислялась по значению молекулярного веса
низкомолекулярных членов полимергомологического ряда, определенного
криоскопическим методом.
Очевидно, что правильность такого
определения коэффициента К основана на предположении о независимости его от
молекулярного веса в пределах полимергомологического ряда.
Однако уравнение (21), которым
пользовались для определения ММ, оказалось неточным.
Во — первых, коэффициент К не
является постоянной величиной, а зависит от ММ полимера.
Во-вторых, уравнение Штаудигера
неправильно отражает концентрационную зависимость удельной вязкости. Поэтому,
правильнее связывать с ММ полимера не удельную вязкость, а величину вязкости,
независящую от концентраций раствора, т.е. характеристическую вязкость. Поэтому
широкое распространение получило эмпирическое уравнение: (21)
Характеристическую вязкость определяют по величине
относительной вязкости разбавленных растворов полимеров. Затем рассчитывают
удельные и приведенные вязкости строят график зависимости . Экстраполяцией
полученной прямой к нулевой концентрации находят значение [η]. Определение К и а находят следующим образом. Сначала получают
несколько фракций одного и того же полимера и осмометрическим методом или
светорассеяние определяют ММ (М`, М«, М«`). Затем для этих фракций находят
соответствующее значение [η] `, [η] «, [η] «`.
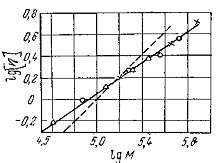
Логарифмируя уравнение (21), получаем:
(22)
Следовательно, зависимость , выражается прямой
линией, тангенс угла наклона к прямой а (рис.4). Эта прямая отсекает на оси
ординат отрезок, численно равный lg K. Таким образом, величины К и а в
настоящее время определены для многих систем полимер — растворитель. Необходимо
помнить что для определения вязкости следует применить тот же растворитель, для
которого найдены значения постоянных К и а.
Рис.4. Зависимость для раствора
полибутадиенового каучука в бензоле.
Метод определения молекулярного веса путем
измерения вязкости растворов очень удобен благодаря надежности применяемого
оборудования. Этот метод может быть использован в любой заводской и цеховой
лаборатории, однако получаемые абсолютные значения ММ полимера не всегда
оказываются точны. Это объясняется тем, что вязкость разбавленного раствора
определяется размером молекул, а размер молекул и ММ — это не одно и тоже. При
одном и том же молекулярном весе молекула может быть и линейной и
разветвленной, т.е. она может иметь неодинаковый размер и форму, что по-разному
отражается на значении характеристической вязкости. Если постоянные К и а были
определены для полимера менее разветвленного, а затем они используются при
исследовании более разветвленного полимера того же химического состава, или
наоборот, то ММ полученная по уравнению (21), могут быть неверными. Поэтому
вискозиметрический метод может быть рекомендован для определения не абсолютного
значения ММ, а ее изменение в различных процессах.
3.5
Определение ММ по концевым группам
Метод анализа концевых групп в линейных
полимерах позволяет определить молекулярную массу соответствующего полимера. Он
применяется в основном для анализа линейных полимеров, полученных
поликонденсацией. Метод основан на определении концевых функциональных групп
(ОН-, — СООН, — NH2 и др.), меченых фрагментов инициаторов или отдельных атомов в макромолекулах
(хлор, сера, бром и др.). Концевые группы определяют известными химическими и
физическими методами. Обычно химические методы позволяют определять Mn порядка 1∙104.
Наиболее распространенным методом определения
ММ по концевым группам является ИК и ЯМР.
3.5
Криоскопический метод
Криоскопический метод основан на различии
между температурами замерзания раствора полимера и чистого растворителя.
Изменение температуры замерзания для разбавленных растворов:
где Кс — криоскопическая
константа для данного растворителя, характеризующая снижение температуры
замерзания или плавления, вызванное 1 молем растворенного полимера; n — число молей полимера.
где Ts и Ms — температура замерзания
и молекулярная масса растворителя;
ρs и Ηns — плотность и теплота плавления растворителя.
Зависимость ∆ Ts/C от С представляет собой
прямую, отсекающую на оси координат отрезок, равный Kc / Mn, тангенс угла которой
характеризует второй вириальный коэффициент.
Так криоскопический метод (рис.5)
определения Мп применяется для полимеров с молекулярной
массой от 103 до 5∙104.
Рис.5. Прибор для определения молекулярной
массы полимеров криоскопическим методом: 1 — криоскопическая ячейка с
боковым отводом; 2 — пробирка; 3 — стакан; 4,6 — мешалки;
5 — термометр Бекмана.
4.
Молекулярно-массовое распределение полимеров
Молекулярно-массовое распределение —
фундаментальная характеристика полимера — наряду с химической и топологической
структурой цепи макромолекулы, определяет весь комплекс физико-химических и
механических свойств не только самого полимера, но и получаемого на его основе
материала. Это в равной мере относится к линейным полимерам и сополимерам,
сетчатым полимерам, а также композиционным материалам, в которых полимерное
связующее может находиться в сшитом и несшитом состоянии.
Отношение U = Mw / Mn может служить мерой
полидисперсности полимера. Нередко требуется более полная характеристика
полидисперсности, чем указанное выше отношение. Одному и тому же Mw / Mn могут соответствовать
различные типы молекулярно-массового распределения (ММР). На практике кривые
ММР обычно получают экспериментально путем фракционирования полимеров
различными методами, т.е. путем разделения образцов на фракции с разными
молекулярными массами.
Различают два типа фракционирования:
препаративное, при котором выделяют фракции и изучают их свойства, и
аналитическое, при котором получают кривую распределения без выделения
отдельных фракций.
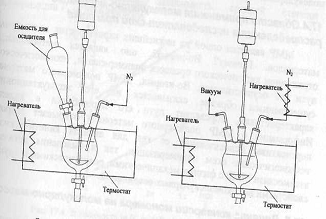
Так, к препаративным методам относятся
методы фракционного осаждения (рис.6) и фракционного растворения. Наиболее
часто используют первый метод.
добавлением осадителя к раствору полимера
(рис.6 а);
испарением растворителя, если полимер был
предварительно растворен в смеси растворитель-осадитель (рис.6, б);
изменением температуры раствора.
К аналитическим методам фракционирования
относятся:
ультрацентрифугирование;
турбидиметрическое титрование;
гельпроникающая хроматография и др.
4.1
Ультрацентрифугирование.
Если полимер полидисперсен, то центробежная сила,
зависящая от массы молекул, заставляет большие молекулы двигаться соответственно с большей
скоростью. Поэтому при перемещении фронта, отделяющего раствор от растворителя, происходит размывание границы. Определяя
величину концентрации раствора в зависимости от расстояния до центра вращения в различные
моменты времени, получаем кривую, характеризующую интегральное распределение
полимерного образца по молекулярной массе.
Дифференцирование этой зависимости позволяет выявить дифференциальную форму
распределения полимера по молекулярной массе.
В тех случаях, когда полимер
имеет бимодальное распределение, на интегральной кривой появляется перелом, а
на дифференциальной — два максимума. Появление таких зависимостей обычно
свидетельствует о течении реакции образования полимера параллельно по двум механизмам с различной скоростью.
4.2
Турбидиметрическое титрование
Турбидиметрическое титрование состоит в
измерении мутности раствора полимера при постоянном добавлении к нему
осадителя. Этот метод быстрый, но он дает лишь качественную картину ММР. По
мере добавления осадителя мутность возрастает до тех пор, пока не выделится
весь полимер. Результаты турбидиметрического титрования образца исследуемого
полимера представляют в виде кривой зависимости оптической плотности среды от
объемной доли добавленного осадителя.
Эту зависимость предварительно устанавливают для каждой системы
полимер-растворитель-осадитель титрованием растворов 5-6 узких фракций
исследуемого полимера с известными MB, причем каждую фракцию титруют при 5-6
концентрациях.
Пользуясь которой, по кривой турбидиметрического титрования
исследуемого образца полимера можно сделать заключение о его ММР.
По кривой турбидиметрического титрования даже при отсутствии
калибровочных данных можно оценить степень полидисперсности титруемого
полимера.
По результатам турбидиметрического титрования можно
установить пределы растворимости полимера и оценить пригодность данной пары
растворитель — осадитель для фракционирования обычными методами.
Большим преимуществом метода турбидиметрического титрования
является возможность определения весовых долей и MМ фракций без их
выделения из раствора.
Рис.6. Сосуды для препаративного
фракционирования: а — фракционирование по методу добавления осадителя; б — фракционирование
по методу испарения растворителя.
Вывод В данной работе мы рассмотрели методы определения
молекулярной массы и молекулярно-массового распределения полимеров, необходимые
для изучения свойств полимеров для кинетических, физико-химических
исследований. В связи с тем, что обычно применяемые в химии низкомолекулярных
соединений методы определения молекулярной массы не применимы для полимеров.



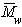
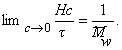
/Khudoynazarova.files/image001.png)
/Khudoynazarova.files/image002.jpg)
/Khudoynazarova.files/image006.png)
/Khudoynazarova.files/image008.png)