Молярная масса некоторых газов значения (Таблица)
Молярная масса газа (или вещества) — это отношение массы газа к количеству молей этого газа, то есть масса одного моля газа (вещества).
В системе СИ молярная масса выражается в кг/моль (или г/моль), обозначают обычно буквой M.
|
Название газа и его химическая формула |
Молярная масса, г/моль |
|
Азот (N2) |
28,016 |
|
Аммиак (NH3) |
17,031 |
|
Аргон (Ar) |
39,944 |
|
Ацетилен (C2H2) |
26,04 |
|
Ацетон (C3H6O) |
58,08 |
|
Н-бутан (C4H10) |
58,12 |
|
Изо-бутан ( C4HJ0) |
58,12 |
|
Н-бутиловый спирт ( C4HJ0O) |
74,12 |
|
Вода (H2O) |
18,016 |
|
Водород (H2) |
2,0156 |
|
Воздух (сухой) |
28,96 |
|
Н-гексан (C6HJ4) |
86,17 |
|
Гелий (He) |
4,003 |
|
Н-гептан (C7HJ6) |
100,19 |
|
Двуокись углерода (CO2) |
44,01 |
|
Н-декан ( C10H22) |
142,30 |
|
Дифенил ( C12H10) |
154,08 |
|
Дифениловый эфир ( CJ2H10O) |
168,8 |
|
Дихлорметан ( CH2Cl2) |
84,94 |
|
Диэтиловый эфир (C4H10O) |
74,12 |
|
Закись азота (N2O) |
44,016 |
|
Йодистый водород (HJ) |
127,93 |
|
Кислород (O2) |
32,00 |
|
Криптон (Kr) |
83,7 |
|
Ксенон (Xe) |
131,3 |
|
Метан (CH4) |
16,04 |
|
Метиламин (CH5N) |
31,06 |
|
Метиловый спирт (CH4O) |
32,04 |
|
Неон (Ne) |
20,183 |
|
Нитрозилхлорид (NOCl) |
65,465 |
|
Озон (O3) |
48,00 |
|
Окись азота (NO) |
30,008 |
|
Окись углерода (CO) |
28,01 |
|
Н-октан ( C8H18) |
114,22 |
|
Н-пентан ( C5H12) |
72,14 |
|
Изо-пентан ( C5H12) |
72,14 |
|
Пропан ( C3H8) |
44,09 |
|
Пропилен ( C3H6) |
42,08 |
|
Селеновая кислота (H2Se) |
80,968 |
|
Сернистый газ (SO2) |
64,06 |
|
Сернистый ангидрид (SO3) |
80,06 |
|
Сероводород (H2S) |
34,08 |
|
Фосфористый водород (PH3) |
34,04 |
|
Фреон 11 (CF3CI) |
137,40 |
|
Фреон-12 (CF2CI2) |
120,92 |
|
Фреон-13 (CFCI3) |
114,47 |
|
Фтор (F2) |
38,00 |
|
Фтористый кремний (SiF4) |
104,06 |
|
Фтористый метил (CH3F) |
34,03 |
|
Хлор (Cl2) |
70,914 |
|
Хлористый водород (HCl) |
36,465 |
|
Хлористый метил (CH3Cl) |
50,49 |
|
Хлороформ (CHCl3) |
119,39 |
|
Циан (C2N2) |
52,04 |
|
Цианистая кислота (HCN) |
27,026 |
|
Этан (C2H6) |
30,07 |
|
Этиламин (C2H7N) |
45,08 |
|
Этилен (C2H4) |
28,05 |
|
Этиловый спирт (C2H6O) |
46,07 |
|
Хлористый этил (C2H5Cl) |
64,52 |
В газовой промышленности за
стандарт приняты условия Т=293,15 0К и Р=0,1013 МПа, в этом случае 1
гмоль и 1 кгмоль будут занимать объемы соответственно 24,04 дм3/моль
и 24,04 м3/кмоль.
Для природного газа,
являющегося смесью углеводородных и неуглеводородных компонентов, вводится
понятие кажущаяся молярная масса Мк, значение которой определяется
по формуле
Мк=åМi∙ni кг/кмоль (2.1.1)
где Мi – молярная масса i-го компонента, кг/кмоль; ni — молярная масса i-го компонента в смеси; к – число
компонентов в смеси.
Если ni дано в мольных процентах, формула
имеет вид:
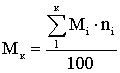
Иногда используют единицы
измерения г/моль. Часто слово “кажущаяся” опускается и для природного газа это
значение называют молярная (а иногда молекулярная) масса газа.
Плотность вещества – масса
единицы объема. Плотность газа определяется, как отношение молярной массы к
объему моля газа, т.е.
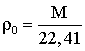
При стандартных условиях – ρст
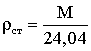
где ρ0 и ρст
– плотность газа при соответствующих условиях.
2.2. Пересчет состава газа и
конденсата.
Пересчет состава газа и
конденсата осуществляется следующим образом.
Дан состав газа (конденсата)
в мольных долях – ∑Мi=1, где ni – мольная масса i-го компонента в смеси, к – число
компонентов в смеси. При известной молярной массе Мi – каждого компонента определить
состав в массовых долях, т.е. найти mi и ∑mi=1,
mi – массовая доля i-го компонента. Решение приводится в таблице
2.2.
Таблица 2.2 – Пересчет мольного
состава смеси углеводородов в массовый.
|
Компоненты |
Мольные |
Молярная |
Масса |
Массовая |
|
1 |
n1 |
М1 |
n1∙ М1 |
|
|
2 |
n2 |
М2 |
n2∙М2 |
|
|
3 |
n3 |
М3 |
n3∙ М3 |
|
|
i |
ni |
Мi |
ni∙ Мi |
|
|
Итого |
1,00 |
– |
|
|
Пересчет массового состава в
мольный приведен в таблице 2.3.
Таблица 2.3
|
Компоненты |
Мольные |
Молярная |
Масса |
Массовая |
|
1 |
m1 |
М1 |
m1/ М1 |
|
|
2 |
m2 |
М2 |
m2/М2 |
|
|
3 |
m3 |
М3 |
m3/ М3 |
|
|
i |
mi |
Мi |
mi /Мi |
|
|
Итого |
1,00 |
– |
|
|
Используя расчеты легко найти
молярную массу смеси (кажущуюся молярную массу) – Мк по формуле (2.1.1)
или по следующему выражению:
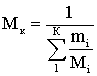
Содержание жидких
углеводородов определяется по формулам:
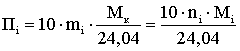
г/м3 (2.2.2)
где Пi – потенциальное содержание i-го компонента в смеси газа, г/м3
при 0,1013 МПа и 293 К.
Объем паров, получаемый после
испарения жидкого углеводорода – Vi в м3, равен:
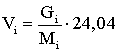
м3 (2.2.3)
где Gi – масса жидкого углеводорода при
0,1013 МПа и 293 К.
2.3. Критические параметры.
Псевдокритические параметры. Приведенные параметры. Закон соответственных состояний.
Рассмотрим диаграмму
давление-температура Р-Т для однокомпонентного вещества, приведенную на рисунке
2.3.1.
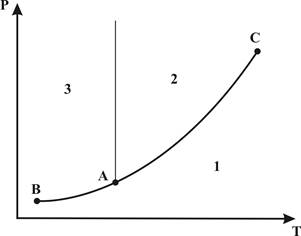
Рисунок 2.3.1 – Фазовая диаграмма “давление-температура”
чистого вещества.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание — внизу страницы.
Как определить молярную массу газа
Что такое молярная масса? Это масса одного моля вещества, то есть такого его количества, в котором содержится столько же атомов, сколько в 12 граммах углерода. Молярную массу сложного вещества вычисляют, складывая молярные массы входящих в него элементов. Например, NaCl — хорошо знакомая всем нам поваренная соль. Какова ее молярная масса? Заглянув в Таблицу Менделеева, получите ответ: 23 + 35,5 = 58,5. Часто ставится задача определить молярную массу газа. Как это можно сделать?

Инструкция
Зная формулу газа, его молярную массу можно вычислить путем элементарного подсчета. Возьмите углекислый газ. Его формула – СО2. Значит его молярная масса такова: 12 + 32 (молярная масса кислорода с учетом индекса «2») = 44.
Ну а если вам надо вычислить молярную массу неизвестного нам газа, находящегося в каком-то замкнутом объеме, например, герметично закрытом баллоне? Тут нам на помощь придет универсальное уравнение Менделеева–Клапейрона, описывающее состояние «идеального газа». Разумеется, ни один газ не удовлетворяет условиям «идеального», но при давлении и температуре, несущественно отличающихся от нормальных, это уравнение очень удобно для расчетов. А полученная при вычислениях погрешность весьма незначительна и ею смело можно пренебречь.
Универсальное уравнение имеет такой вид: PV = MRT/m, гдеР – давление газа в Паскалях;
V – его объем в кубических метрах;
M – фактическая масса газа;
m – его молярная масса;
R – универсальная газовая постоянная;
Т – температура газа в градусах Кельвина.
Вы увидите, что молярная масса вычисляется по формуле MRT/PV. Например, надо найти молярную массу газа, если известно, что 3 килограмма этого газа находятся в герметичной емкости объемом 1,7 кубических метра при давлении 100000 Па и температуре 27 градусов по Цельсию.
Подставьте известные значения в эту формулу, разумеется, не забыв сначала преобразовать в одну систему величин. Иначе выйдет полная несуразица. 3,0*8,31*300/170000=0,04399 кг/моль.
Ну а поскольку молярная масса вещества измеряется в граммах на моль, умножьте полученный результат на 1000 и получите ответ: молярная масса газа, находящегося при таких условиях, равна 43,99 грамма/моль или с учетом округления — 44 грамма/моль. То есть это тот же самый углекислый газ.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
-
ГДЗ
-
10 класс
-
Физика
-
Рымкевич 10-11
-
496
Подробное решение задание 496 по физике задачник для учащихся 10 класса, авторов А.П. Рымкевич 2016
показать содержание
← предыдущее
Следующее →
496. Найти массу природного горючего газа объёмом 64 м3, считая, что объём указан при нормальных условиях. Молярную массу природного горючего газа считать равной молярной массе метана (СН4).
Решебник №1 / задание / 496
← предыдущее
Следующее →
Подпишись на нашу группу
×
© 2023 «Resheba.me»
Хостинг для сайта от 113,5 руб/мес.
[email protected]

