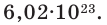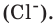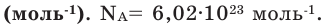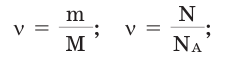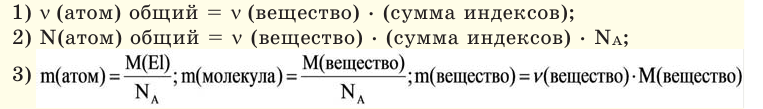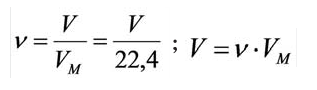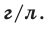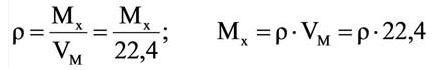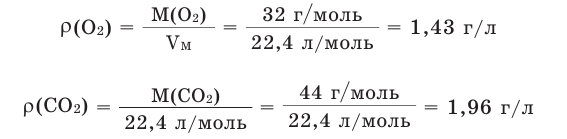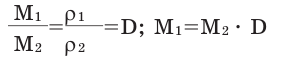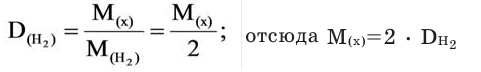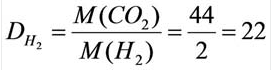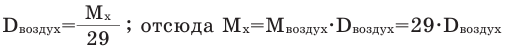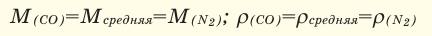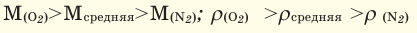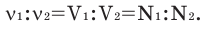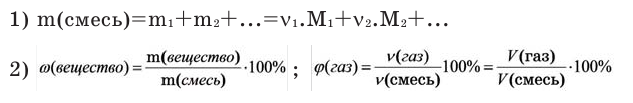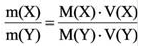Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
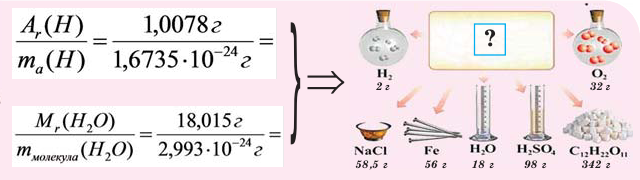
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 

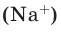

Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Здесь 
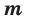
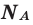
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из сравнений, молярная масса веществ по своей единице отличается от относительной молекулярной массы. То есть молярная масса — измеряемая величина.
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
Закон Авогадро и молярный объём газов
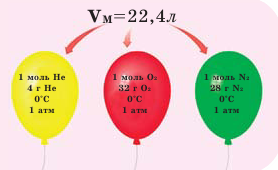
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 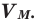
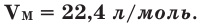
Здесь 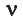
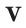
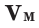
На основе закона Авогадро и молярного объёма газов можно вычислить плотность газов при нормальных условиях и относительную плотность одного газа по отношению к другому газу. Плотность обозначается буквой 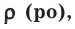
измерения —
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 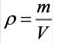
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
Относительную плотность газов в большинстве случаев вычисляют по самому легкому газу — водороду и воздуху:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 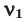
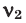
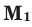
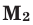

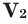
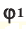
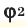
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 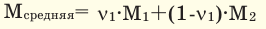
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
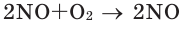
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
Как найти молярную массу смеси газов
Молярная масса – это масса одного моля любого вещества, то есть такого его количества, в котором содержится 6,022*10^23 элементарных частиц. Численно молярная масса совпадает с молекулярной, выраженной в атомных единицах массы (а.е.м.), но размерность у нее другая – грамм/моль.

Инструкция
Если бы вам надо было вычислить молярную массу любого газа, вы бы взяли величину атомной массы азота и умножили ее на индекс 2. В итоге получили бы 28 грамм/моль. Но как вычислить молярную массу смеси газов? Эта задача решается элементарно. Надо лишь знать, какие именно газы и в какой пропорции входят в состав смеси.
Рассмотрите конкретный пример. Предположим, у вас есть газовая смесь, которая состоит из 5% (массовых) водорода, 15% азота, 40% углекислого газа, 35% кислорода и 5% хлора. Какова ее молярная масса? Воспользуйтесь формулой для смеси, состоящей из х компонентов: Мсм = M1N1 + M2N2 + M3N3 +…+ MxNx, где M – молярная масса компонента, а N – его массовая доля (процентная концентрация).
Молярные массы газов вы узнаете, вспомнив величины атомных весов элементов (тут вам понадобится Таблица Менделеева). Их массовые доли известны по условиям задачи. Подставив величины в формулу и произведя вычисления, получите: 2*0,05 + 28*0,15 + 44*0,40 + 32*0,35 + 71*0,05 = 36,56 грамм/моль. Вот такова молярная масса указанной смеси.
Можно ли решить задачу другим способом? Да, конечно. Предположим, у вас точно такая же смесь, заключенная в герметичный сосуд объемом V при комнатной температуре. Как можно лабораторным путем вычислить ее молярную массу? Для этого вам понадобится сначала взвесить этот сосуд на точных весах. Обозначьте его массу как М.
Потом с помощью подсоединенного манометра измерьте давление P внутри сосуда. Затем с помощью шланга, подсоединенного к вакуум-насосу, откачайте немного смеси. Легко можно понять, что давление внутри сосуда уменьшится. Перекрыв вентиль, подождите примерно полчаса для того, чтобы смесь внутри сосуда снова приняла температуру окружающего воздуха. Проверив это с помощью термометра, измерьте давление смеси манометром. Обозначьте его P1. Взвесьте сосуд, обозначьте новую массу как M1.
Ну а дальше вспомните универсальное уравнение Менделеева-Клапейрона. Согласно ему, в обоих случаях:- PV = MRT/m;- P1V = M1RT/m.Немного видоизменив это уравнение, вы получите:- m = MRT/PV;- m = M1RT/P1V.
Отсюда следует, что m = (M – M1)RT/ (P – P1)V. А m – та самая молярная масса смеси газов, которую вам надо узнать. Подставив в формулу известные величины, вы получите ответ.
Источники:
- молекулярная масса смеси
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Download Article
Download Article
Atoms are too small to allow meaningful measurement of chemical substances. To work with meaningful amounts of substances, scientists group them into units called moles. A mole is defined as the number of carbon atoms in 12 grams of the isotope carbon-12,[1]
which is roughly 6.022 x 1023 atoms. This number is called Avogadro’s number or Avogadro’s constant.[2]
This constant is used as the number of atoms given by one mole for any substance, and the mass of 1 mole of a substance is its molar mass.
-
1
Understand molar mass. Molar mass is the mass (in grams) of one mole of a substance.[3]
Using the atomic mass of an element and multiplying it by the conversion factor grams per mole (g/mol), you can calculate the molar mass of that element. -
2
Find the relative atomic mass of the element. An element’s relative atomic mass is the average mass, in atomic units, of a sample of all its isotopes.[4]
This information can be found on the periodic table of elements. Locate the element and find the number underneath the symbol for the element. It will not be a whole number, but will have decimals.- For example, for hydrogen, the relative atomic mass is 1.007; for carbon, it is 12.0107; for oxygen, it is 15.9994; and for chlorine, it is 35.453.
Advertisement
-
3
Multiply the relative atomic mass by the molar mass constant. This is defined as 0.001 kilogram per mole, or 1 gram per mole. This converts atomic units to grams per mole, making the molar mass of hydrogen 1.007 grams per mole, of carbon 12.0107 grams per mole, of oxygen 15.9994 grams per mole, and of chlorine 35.453 grams per mole.[5]
- Some elements are only found in molecules of 2 atoms or more. This means that if you want to find the molar mass of elements that are composed of 2 atoms, such as hydrogen, oxygen, and chlorine, then you’ll have to find their relative atomic masses. Multiply them by the molar mass constant, and then multiply the result by 2.
- For H2: 1.007 x 2 = 2.014 grams per mole; for O2: 15.9994 x 2 = 31.9988 grams per mole; and for Cl2: 35.453 x 2 = 70.096 grams per mole.
- One mnemonic device for remembering diatomic elements (molecules of 2 atoms) is: Have No Fear Of Ice Cold Beverages (Hydrogen, Nitrogen, Fluorine, Oxygen, Iodine, Chlorine, Bromine).[6]
Advertisement
-
1
Find the chemical formula for the compound. This is the number of atoms in each element that makes up the compound. (This information is given in any chemistry reference book.) For example, the formula for hydrogen chloride (hydrochloric acid) is HCl; for glucose, it is C6H12O6. Using this formula, you can identify the number of atoms of each element that makes up the compound.[7]
- For HCl, there is one atom of hydrogen and one atom of chlorine.
- For C6H12O6, there are 6 carbon atoms, 12 hydrogen atoms, and 6 oxygen atoms.
-
2
Find the relative atomic mass of each element in the compound. Using the periodic table, locate the relative atomic mass for each element. It is the number located beneath the symbol for the element.[8]
As we did in the first method of calculating the molar mass of an element, we will also multiply these masses by 1 gram/mole.- The relative atomic masses of the elements in hydrochloric acid are: hydrogen, 1.007 g/mol and chlorine, 35.453 g/mol.
- The relative atomic masses of the elements in glucose are: carbon, 12.0107 g/mol; hydrogen, 1.007 g/mol; and oxygen, 15.9994 g/mol.
-
3
Calculate the molar mass of each element in the compound. Multiply the element’s atomic mass by the number of atoms of that element in the compound. This will give you the relative amount that each element contributes to the compound.[9]
- For hydrogen chloride, HCl, the molar mass of each element is 1.007 grams per mole for hydrogen and 35.453 grams per mole for chlorine.
- For glucose, C6H12O6, the molar mass of each element is: carbon, 12.0107 x 6 = 72.0642 g/mol; hydrogen, 1.007 x 12 = 12.084 g/mol; and oxygen, 15.9994 x 6 = 95.9964 g/mol.
-
4
Add the molar masses of each element in the compound. This determines the molar mass for the entire compound. Take the products you obtained in the previous step and add them all together to calculate the molar mass of the compound.[10]
- For hydrogen chloride, the molar mass is 1.007 + 35.453 = 36.460 g/mol. 36.46 grams is the mass of one mole of hydrogen chloride.
- For glucose, the molar mass is 72.0642 + 12.084 + 95.9964 = 180.1446 g/mol. 180.14 grams is the mass of one mole of glucose.
Advertisement
Calculator, Practice Problems, and Answers
Add New Question
-
Question
What is the molar mass of Helium?
Bess Ruff is a Geography PhD student at Florida State University. She received her MA in Environmental Science and Management from the University of California, Santa Barbara in 2016. She has conducted survey work for marine spatial planning projects in the Caribbean and provided research support as a graduate fellow for the Sustainable Fisheries Group.
Environmental Scientist
Expert Answer
-
Question
What is the molecular mass of oxygen and hydrogen as a mixture?
Oxygen with Hydrogen gives you WATER (H2O). The relative atomic mass for Oxygen is 16, while Hydrogen is 1 since Hydrogen (H2) have two molecules you multiply by 2 1*2=2. Oxygen (O) being 16*1=16. Add up your answers to get 18, and the molecular mass of Oxygen and Hydrogen which is water gives you 18.
-
Question
How do you calculate the molar mass of water?
Water’s chemical formula is H2O, this means it is composed of 2 Hydrogen atoms and 1 Oxygen atom. To find the molar mass, find the atomic mass of all the components of a chemical. You can either memorize it, or find all of the atomic masses located on the periodic table of elements. In this case, hydrogen has an atomic mass of 1, and oxygen has an atomic mass of 16. The equation is therefore: 1(2) + 16(1) = 18. Therefore, the molar mass of water, is 18.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
While most relative atomic masses are known to a precision of 1 part in 10 thousand (4 decimal places), in most laboratory work, molar masses are normally quoted to 2 decimal places and fewer for particularly large masses. Thus, in the laboratory, the molar mass for hydrogen chloride would be given as 36.46 grams per mole and that of glucose as 180.14 grams per mole.
Advertisement
Things You’ll Need
- Chemistry reference book or periodic table of the elements
- Calculator
References
About This Article
Article SummaryX
When you’re measuring extremely tiny amounts of a substance, it can be helpful to use molar mass. According to the International System of Units, a mole is the amount of any substance that contains the same number of elementary entities—typically atoms or molecules—as there are atoms in 12 grams of the isotope carbon-12. Molar mass is the mass in grams of 1 mole of any given substance. To find an element’s molar mass, start by checking the periodic table for the relative atomic mass of the element. This is usually located under the symbol and name of the element. For instance, the relative atomic mass of zirconium (Zr) is 91.22. Next, multiply the atomic mass by the molar mass constant, which is equal to 1 gram per mole. For most elements, this means that the relative atomic mass is equal to the molar mass. For instance, zirconium has a molar mass of 91.22 x 1 g/mol, or 91.22 g/mol. However, some elements, such as hydrogen, nitrogen, and oxygen, only occur naturally in molecules of 2 or more atoms. In these cases, you’ll need to multiply the relative atomic mass of the element by the number of atoms in the molecule, then multiply the result by the molar mass constant. For example, the molar mass of H2 is 1.007 x 2 x 1 g/mol, or 2.014 g/mol. Finding the molar mass of a compound is a little more complicated. First, you’ll need to find the chemical formula for the compound. For example, if you’re calculating the molar mass of water, you’d start with the formula H2O. Then, calculate the molar mass of each element in the compound. Don’t forget to take into account the number of atoms of each element when you make your calculation. In this case, the molar mass of the two hydrogen atoms is 2.014 g/mol, while the single oxygen atom is 15.999 g/mol. Add them together to get the total molar mass of 18.013 g/mol. To see specific examples for how to calculate molar mass, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 1,270,013 times.
Reader Success Stories
-
Sesame Makgasane
Aug 2, 2016
«The steps helped me understand really quickly. I am writing an examination tomorrow, and this really helped me.»
Did this article help you?
2.1. Основные понятия и формулы
Количество
вещества
—
число структурных элементов (молекул,
атомов, ионов и т. п.), содержащихся в
теле или системе. Количество вещества
выражается в молях. Моль равен количеству
вещества системы, содержащей столько
же структурных элементов, сколько
содержится атомов в
0,012
кг изотопа углерода 12C.
Количество вещества тела (системы)
,
где
N
—
число структурных элементов (молекул,
атомов, ионов и т.п.), составляющих тело
(систему). Постоянная Авогадро NА=6,021023
моль-1.
Молярная масса вещества ,
где
m—масса
однородного тела (системы);
—количество
вещества (число молей) этого тела
(системы). Выражается в единицах г/моль
(или кг/моль).
Единица
массы, равная 1/12 массы атома углерода
12C,
называется атомной единицей массы
(а.е.м.). Массы атомов или молекул выраженные
в атомных единицах массы называют
соответственно относительной атомной
или относительной молекулярной массой
вещества. Относительная молекулярная
масса вещества состоит из относительных
атомных масс химических элементов,
составляющих молекулу вещества.
Относительные атомные массы химических
элементов приводятся в таблице Д. И.
Менделеева (см. также таблицу 8 приложения
данного пособия).
Молярная
масса вещества численно равна относительной
атомной или молекулярной массе данного
вещества, если размерность а.е.м. заменить
на размерность г/моль.
Количество вещества смеси n газов
или
,
где
νi,
Ni,
mi,
i
—
соответственно количество вещества,
число молекул, масса и молярная масса
i-го
компонента смеси (i=1,2,…,n).
Уравнение
Менделеева
—
Клапейрона (уравнение состояния
идеального газа)
,
где
т
—
масса газа,
—
молярная масса газа, R
—
универсальная газовая постоянная, ν
—
количество вещества, Т
—
термодинамическая температура.
Опытные
газовые законы, являющиеся частными
случаями уравнения Менделеева
—
Клапейрона для изопроцессов:
а)
закон Бойля—Мариотта
(изотермический процесс: T=const,
m=const)
или
для двух состояний газа, обозначенных
цифрами 1 и 2,
,
б)
закон Гей-Люссака (изобарический процесс:
р=const,
m=const)
или
для двух состояний
,
в)
закон Шарля (изохорический процесс:
V=const,
m=const)
или
для двух состояний
,
г)
объединенный газовый закон (m=const)
или
для двух состояний
.
Под
нормальными условиями понимают давление
po=1
атм (1,013105
Па), температуру 0оС
(T=273
K).
Закон
Дальтона, определяющий давление смеси
n
газов.
,
где
pi
—
парциальные давления компонентов смеси
(i=1,2,…,n).
Парциальным
давлением называется давление газа,
которое производил бы этот газ, если бы
только он один находился в сосуде,
занятом смесью.
Молярная масса смеси n газов
.
Массовая
доля i-го
компонента смеси газа (в долях единицы
или процентах)
,
где
т
—
масса смеси.
Концентрация молекул
,
где
N
—
число молекул, содержащихся в данной
системе;
—
плотность вещества в системе;
V
—
объем системы. Формула справедлива не
только для газов, но и для любого
агрегатного состояния вещества.
Уравнение
Ван-дер-Ваальса для реального газа
,
где
a
и b
—
коэффициенты Ван-дер-Ваальса
Для
идеального газа уравнение Ван-дер-Ваальса
переходит в уравнение Менделеева
—
Клапейрона.
Основное уравнение
молекулярно — кинетической теории газов
,
где
п
—
средняя кинетическая энергия
поступательного движения молекулы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #