| Сульфат железа (III) | |
|---|---|
 |
|
| Систематическое наименование |
сульфат железа (III) |
| Традиционные названия | сернокислое железо (III), тетрасульфид (VI) железа (III) |
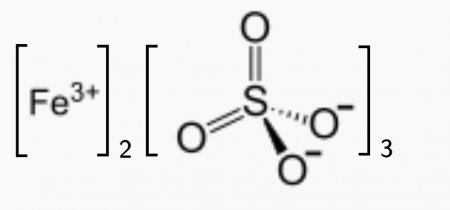
| Хим. формула | Fe2(SO4)3 |
| Рац. формула | Fe2O12S3 |
| Состояние | безводный — светло-жёлтый порошок |
| Молярная масса |
(безв.) 399.88 г/моль (пентагидрат) 489.96 г/моль |
| Плотность |
(безв.) 3.097 г/см³ (пентагидрат) 1.898 (нонагидрат) 2.1 г/см³ |
| Температура | |
| • плавления |
(безв.) 480 °C (с разл.) (нонагидрат) 175 °C |
| • разложения | 600 |
| Мол. теплоёмк. | 271,75 Дж/(моль·К) |
| Энтальпия | |
| • образования | −2580 кДж/моль |
| Растворимость | |
| • в воде | (безв.) растворим(нонагидрат) 440 г/100 мл |
| • в этаноле | (нонагидрат) растворим |
| Рег. номер CAS |
10028-22-5 15244-10-7 (для всех гидратов с формулой Fe2(SO4)3·nH2O (где n=1, 3, 4, 6, 7, 9, 10, 12) |
| PubChem | 24826 |
| Рег. номер EINECS | 233-072-9 |
| SMILES |
[O-]S(=O)(=O)[O-].[O-]S(=O)(=O)[O-].[O-]S(=O)(=O)[O-].[Fe+3].[Fe+3] |
| InChI |
1S/2Fe.3H2O4S/c;;3*1-5(2,3)4/h;;3*(H2,1,2,3,4)/q2*+3;;;/p-6 RUTXIHLAWFEWGM-UHFFFAOYSA-H |
| RTECS | NO8505000 |
| ChEBI | 53438 |
| ChemSpider | 23211 и 21493902 |
| ЛД50 | (крысы, орально) 500 мг/кг |
| Пиктограммы ECB |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфат железа (III) (лат. Ferrum sulfuricum oxydatum) — неорганическое химическое соединение, соль, химическая формула—Fe2(SO4)3.
Содержание
- 1 Физические свойства
- 2 Нахождение в природе
- 2.1 Марс
- 3 Получение
- 4 Химические свойства
- 5 Использование
Физические свойства
Безводный сульфат железа (III) — светло-жёлтые парамагнитные очень гигроскопичные кристаллы моноклинной сингонии, пространственная группа P21/m, параметры элементарной ячейки a = 0,8296 нм, b = 0,8515 нм, c = 1,160 нм, β = 90,5°, Z = 4. Есть данные, что безводный сульфат железа образовывает орторомбическую и гексагональную модификации. Растворим в воде, трудно растворим в этаноле.
Из воды кристаллизуется в виде кристаллогидратов Fe2(SO4)3·n H2O, где n = 12, 10, 9, 7, 6, 4, 3, 1. Наиболее изученный кристаллогидрат — нонагидрат сульфата железа (III) Fe2(SO4)3·9H2O — жёлтые гексагональные кристаллы, параметры элементарной ячейки a = 1,085 нм, c = 1,703 нм, Z = 4. Хорошо растворяется в воде (440 г на 100 г воды). В водных растворах сульфат железа(III) из-за гидролиза приобретает красно-коричневый цвет.
При нагревании нонагидрат превращается при 98 °C в тетрагидрат, при 125 °C — в моногидрат и при 175 °C — в безводный Fe2(SO4)3, который выше 600 °C разлагается на Fe2O3 и SO3.
Нахождение в природе
Минералогическая форма сульфата железа (III) — микасаит (англ. mikasaite), смешанный сульфат железа-алюминия. Его химическая формула — (Fe3+, Al3+)2(SO4)3. Этот минерал содержит безводную форму сульфата железа, поэтому встречается в природе очень редко. Гидратированные формы встречаются чаще, например:
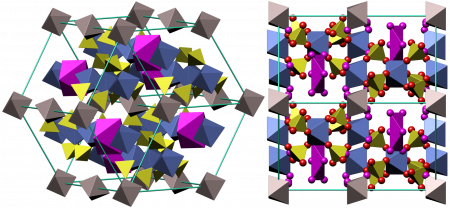
- Кокимбит (англ. coquimbite) — Fe2(SO4)3·9H2O — нонагидрат — наиболее распространённая в природе форма.
Кристаллическая структура кокимбита
- Паракокимбит (англ. paracoquimbite) — другой нонагидрат — редкая форма.
- Корнелит (англ. kornelite) — гептагидрат — и куэнстедтит (англ. quenstedtite) — декагидрат — тоже встречаются редко.
- Лаусенит (англ. lausenite) — гекса- или пентагидрат (самостоятельность этого минерала под вопросом).
Все перечисленные выше природные гидраты железа на поверхности Земли нестабильны. Но их запасы постоянно пополняются благодаря окислению других минералов (в основном пирита и марказита).
Марс
Сульфат железа и ярозит были обнаружены двумя марсоходами: «Спирит» и «Оппортьюнити». Эти вещества являются признаком сильных окислительных условий на поверхности Марса. В мае 2009 года «Спирит» застрял, когда ехал по мягкому грунту планеты и наехал на залежи сульфата железа, скрытые под слоем обычного грунта. Вследствие того, что сульфат железа имеет очень низкую плотность, марсоход застрял настолько глубоко, что часть его корпуса коснулась поверхности планеты.
Получение
В промышленности сульфат железа (III) получают прокаливанием пирита или марказита с NaCl на воздухе:
- 2FeS2 + 2NaCl +
2 ⟶ Fe2(SO4)3 + Na2SO4 + Cl2
или растворяют оксид железа (III) в серной кислоте:
- Fe2O3 + 3H2SO4 ⟶ Fe2(SO4)3 + 3H2O
В лабораторной практике сульфат железа (III) можно получить из гидроокиси железа (III):
- 2Fe(OH)3 + 3H2SO4 ⟶ Fe2(SO4)3 + 6H2O
Препарат той же чистоты можно получить окислением сульфата железа (II) азотной кислотой:
- 2FeSO4 + H2SO4 + 2 HNO3 ⟶ Fe2(SO4)3 + 2NO2 + 2H2O
также окисление можно провести кислородом или оксидом серы:
- 12FeSO4 + 3O2 ⟶ 4Fe2(SO4)3 + 2Fe2O3
- 2FeSO4 + 2SO3 ⟶ Fe2(SO4)3 + SO2
Концентрированные серная и азотная кислоты окисляют сульфид железа до сульфата железа (III):
- 2FeS + H2SO4 + 18HNO3 ⟶ Fe2(SO4)3 + 18NO2↑ + 10H2O
Дисульфид железа можно окислить концентрированной серной кислотой:
- 2FeS2 + 14H2SO4 ⟶ Fe2(SO4)3 + 15SO2↑ + 14H2O
Сульфат-аммоний железа (II) (соль Мора) также можно окислить дихроматом калия. Вследствие данной реакции выделятся сразу четыре сульфата — железа (III), хрома (III), аммония и калия, и вода:
- 6Fe(NH4)2(SO4)2 + 7H2SO4 + K2Cr2O7 ⟶ Fe2(SO4)3 + Cr2(SO4)3 + 6(NH4)2SO4 + K2SO4 + 7H2O
Сульфат железа (III) можно получить как один из продуктов термического разложения сульфата железа (II):
- 6FeSO4 →T Fe2(SO4)3 + 2Fe2O3 + 3SO2
Ферраты с разбавленной серной кислотой восстанавливаются до сульфата железа (III):
- 4K2FeO4 + 10H2SO4 → 2Fe2(SO4)3 + 3O2↑ + 4K2SO4 + 10H2O
При нагревании пентагидрата до температуры 70—175 °C получается безводный сульфат железа (III):
- Fe2(SO4)3 ⋅ 5H2O →70−175oC Fe2(SO4)3 + 5H2O
Сульфат железа (II) можно окислить триоксидом ксенона:
- XeO3 + 3H2SO4 + 6FeSO4 ⟶ 3Fe2(SO4)3 + Xe↑ + 3H2O
Химические свойства
Сульфат железа (III) в водных растворах подвергается сильному гидролизу по катиону, при этом раствор окрашивается в красновато-коричневый цвет:
- Fe[(H2O)6]3+ + H2O ⇄ Fe[(H2O)5(OH)]2+ + H3O+ ; pK = 2,17
- Fe[(H2O)5(OH)]2+ + H2O ⇄ Fe[(H2O)4(OH)2]+ + H3O+ ; pK = 3,26
- [2Fe(H2O)6]3+ + 2H2O ⇄ [Fe2(H2O)8(OH)2]4+ + 2H3O+ ; pK = 2,91
Горячая вода или пар разлагают сульфат железа (III):
- Fe2(SO4)3 + 2H2O →100oC 2FeSO4(OH)↓ + H2SO4
Безводный сульфат железа (III) при нагревании разлагается:
- Fe2(SO4)3 →500−700oC Fe2O3 + 3SO3
- 2Fe2(SO4)3 →900−1000oC 2Fe2O3 + 6SO2 + 3O2
Растворы щелочей разлагают сульфат железа (III), продукты реакции зависят от концентрации щёлочи:
- Fe2(SO4)3 + 2NaOH ⟶ 2FeSO4(OH)↓ + Na2SO4
- Fe2(SO4)3 + 6NaOH ⟶ 2FeO(OH)↓ + 3Na2SO4 + 2H2O
Если с щёлочью взаимодействует эквимолярный раствор сульфатов железа (III) и железа (II), то в результате получится сложный оксид железа:
- Fe2(SO4)3 + FeSO4 + 8NaOH ⟶ Fe3O4↓ + 4Na2SO4 + 4H2O
Активные металлы (такие как магний, цинк, кадмий, железо) восстанавливают сульфат железа (III):
- Fe2(SO4)3 + Fe ⟶ 3FeSO4
Некоторые сульфиды металлов (например, меди, кальция, олова, свинца, ртути) в водном растворе восстанавливают сульфат железа (III):
- CuS + Fe2(SO4)3 ⟶ 2FeSO4 + CuSO4 + S
С растворимыми солями ортофосфорной кислоты образует нерастворимый фосфат железа (III) (гетерозит):
- Fe2(SO4)3 + 2NaH2PO4 ⟶ Na2SO4 + 2H2SO4 + 2FePO4↓
Использование
- Как реактив при гидрометаллургической переработке медных руд.
- Как коагулянт при очистке сточных вод, коммунальных и промышленных стоков.
- Как протрава при окраске тканей.
- При дублении кожи.
- Для декапирования нержавеющих аустенитных сталей, сплавов золота с алюминием.
- Как флотационный регулятор для уменьшения плавучести руд.
- В медицине используется в качестве вяжущего и кровоостанавливающего средства.
- В химической промышленности как окислитель и катализатор.
Random converter
сульфат железа (III): состав и молярная масса
Химическая формула
Молярная масса Fe2(SO4)3, сульфат железа (III) 399.8778 г/моль
55,845·2+(32,065+15,9994·4)·3
Массовые доли элементов в соединении
| Элемент | Символ | Атомная масса | Число атомов | Массовая доля |
|---|---|---|---|---|
| Ferrum | Fe | 55.845 | 2 | 27.932% |
| Sulfur | S | 32.065 | 3 | 24.057% |
| Oxygenium | O | 15.9994 | 12 | 48.013% |
Использование калькулятора молярной массы
- Химические формулы нужно вводить с учетом регистра
- Индексы вводятся как обычные числа
- Точка на средней линии (знак умножения), применяемая, например, в формулах кристаллогидратов, заменяется обычной точкой.
- Пример: вместо CuSO₄·5H₂O в конвертере для удобства ввода используется написание CuSO4.5H2O.
Калькулятор молярной массы
Моль
Молярная масса
Молярная масса элементов и соединений
Молекулярная масса
Расчет молярной массы
Моль
Все вещества состоят из атомов и молекул. В химии важно точно измерять массу веществ, вступающих в реакцию и получающихся в результате нее. По определению моль является единицей количества вещества в СИ. Один моль содержит точно 6,02214076×10²³ элементарных частиц. Это значение численно равно константе Авогадро NA, если выражено в единицах моль⁻¹ и называется числом Авогадро. Количество вещества (символ n) системы является мерой количества структурных элементов. Структурным элементом может быть атом, молекула, ион, электрон или любая частица или группа частиц.
Постоянная Авогадро NA = 6.02214076×10²³ моль⁻¹. Число Авогадро — 6.02214076×10²³.
Другими словами моль — это количество вещества, равное по массе сумме атомных масс атомов и молекул вещества, умноженное на число Авогадро. Единица количества вещества моль является одной из семи основных единиц системы СИ и обозначается моль. Поскольку название единицы и ее условное обозначение совпадают, следует отметить, что условное обозначение не склоняется, в отличие от названия единицы, которую можно склонять по обычным правилам русского языка. Один моль чистого углерода-12 равен точно 12 г.
Молярная масса
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях. Говоря иначе, это масса одного моля вещества. В системе СИ единицей молярной массы является килограмм/моль (кг/моль). Однако химики привыкли пользоваться более удобной единицей г/моль.
молярная масса = г/моль
Горение — высокотемпературная экзотермическая окислительно-восстановительная реакция.
Молярная масса элементов и соединений
Соединения — вещества, состоящие из различных атомов, которые химически связаны друг с другом. Например, приведенные ниже вещества, которые можно найти на кухне у любой хозяйки, являются химическими соединениями:
- соль (хлорид натрия) NaCl
- сахар (сахароза) C₁₂H₂₂O₁₁
- уксус (раствор уксусной кислоты) CH₃COOH
Молярная масса химических элементов в граммах на моль численно совпадает с массой атомов элемента, выраженных в атомных единицах массы (или дальтонах). Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении. Например, молярная масса воды (H₂O) приблизительно равна 1 × 2 + 16 = 18 г/моль.
Молекулярная масса
Молекулярная масса (старое название — молекулярный вес) — это масса молекулы, рассчитанная как сумма масс каждого атома, входящего в состав молекулы, умноженных на количество атомов в этой молекуле. Молекулярная масса представляет собой безразмерную физическую величину, численно равную молярной массе. То есть, молекулярная масса отличается от молярной массы размерностью. Несмотря на то, что молекулярная масса является безразмерной величиной, она все же имеет величину, называемую атомной единицей массы (а.е.м.) или дальтоном (Да), и приблизительно равную массе одного протона или нейтрона. Атомная единица массы также численно равна 1 г/моль.
Расчет молярной массы
Молярную массу рассчитывают так:
- определяют атомные массы элементов по таблице Менделеева;
- определяют количество атомов каждого элемента в формуле соединения;
- определяют молярную массу, складывая атомные массы входящих в соединение элементов, умноженные на их количество.
Например, рассчитаем молярную массу уксусной кислоты
CH₃COOH
Она состоит из:
- двух атомов углерода
- четырех атомов водорода
- двух атомов кислорода
Расчет:
- углерод C = 2 × 12,0107 г/моль = 24,0214 г/моль
- водород H = 4 × 1,00794 г/моль = 4,03176 г/моль
- кислород O = 2 × 15,9994 г/моль = 31,9988 г/моль
- молярная масса = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Наш калькулятор выполняет именно такой расчет. Можно ввести в него формулу уксусной кислоты и проверить что получится.
Вы затрудняетесь в переводе единицы измерения с одного языка на другой? Коллеги готовы вам помочь. Опубликуйте вопрос в TCTerms и в течение нескольких минут вы получите ответ.
Другие конвертеры
Конвертеры единиц измерения, используемых при измерении скорости передачи данных, в типографике и обработке изображений, для измерения объема лесоматериалов, а также десятичные приставки и калькулятор молярной массы химических соединений
Вычисление молярной массы
Молярная масса — физическое свойство вещества, определяемое как отношение массы этого вещества к количеству вещества в молях, то есть, это масса одного моля вещества.
Молярная масса соединений равна сумме молярных масс элементов, из которых состоит соединение, с учетом количества атомов в соединении.
Использование конвертера «Вычисление молярной массы»
На этих страницах размещены конвертеры единиц измерения, позволяющие быстро и точно перевести значения из одних единиц в другие, а также из одной системы единиц в другую. Конвертеры пригодятся инженерам, переводчикам и всем, кто работает с разными единицами измерения.
Пользуйтесь конвертером для преобразования нескольких сотен единиц в 76 категориях или несколько тысяч пар единиц, включая метрические, британские и американские единицы. Вы сможете перевести единицы измерения длины, площади, объема, ускорения, силы, массы, потока, плотности, удельного объема, мощности, давления, напряжения, температуры, времени, момента, скорости, вязкости, электромагнитные и другие.
Примечание. В связи с ограниченной точностью преобразования возможны ошибки округления. В этом конвертере целые числа считаются точными до 15 знаков, а максимальное количество цифр после десятичной запятой или точки равно 10.
Для представления очень больших и очень малых чисел в этом калькуляторе используется компьютерная экспоненциальная запись, являющаяся альтернативной формой нормализованной экспоненциальной (научной) записи, в которой числа записываются в форме a · 10x. Например: 1 103 000 = 1,103 · 106 = 1,103E+6. Здесь E (сокращение от exponent) — означает «· 10^», то есть «…умножить на десять в степени…». Компьютерная экспоненциальная запись широко используется в научных, математических и инженерных расчетах.
Мы работаем над обеспечением точности конвертеров и калькуляторов TranslatorsCafe.com, однако мы не можем гарантировать, что они не содержат ошибок и неточностей. Вся информация предоставляется «как есть», без каких-либо гарантий. Условия.
Если вы заметили неточность в расчётах или ошибку в тексте, или вам необходим другой конвертер для перевода из одной единицы измерения в другую, которого нет на нашем сайте — напишите нам!
Канал Конвертера единиц TranslatorsCafe.com на YouTube
- Формула: Fe2O12S3 или Fe2(SO4)3
- Относительная молекулярная масса Fe2O12S3: 399.8778
- Молярная масса Fe2O12S3: 399.8778 г/моль (0.39988 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Fe (железо) | 2 | 55.845 | 111.69 |
| O (кислород) | 12 | 15.9994 | 191.9928 |
| S (сера) | 3 | 32.065 | 96.195 |
| 399.8778 |
Расчёт молярной и относительной молекулярной массы Fe2O12S3
- Mr[Fe2O12S3] = Ar[Fe] * 2 + Ar[O] * 12 + Ar[S] * 3 = 55.845 * 2 + 15.9994 * 12 + 32.065 * 3 = 399.8778
- Молярная масса (в кг/моль) = Mr[Fe2O12S3] : 1000 = 399.8778 : 1000 = 0.39988 кг/моль
Расчёт массовых долей элементов в Fe2O12S3
- Массовая доля железа (Fe) = 111.69 : 399.8778 * 100 = 27.931 %
- Массовая доля кислорода (O) = 191.9928 : 399.8778 * 100 = 48.013 %
- Массовая доля серы (S) = 96.195 : 399.8778 * 100 = 24.056 %
Калькулятор массы
Вычисление молярной массы
To calculate molar mass of a chemical compound enter its formula and click ‘Compute’. В химической формуле, вы можете использовать:
- Любой химический элемент. Capitalize the first letter in chemical symbol and use lower case for the remaining letters: Ca, Fe, Mg, Mn, S, O, H, C, N, Na, K, Cl, Al.
- Функциональные группы:D, Ph, Me, Et, Bu, AcAc, For, Ts, Tos, Bz, TMS, tBu, Bzl, Bn, Dmg
- круглые () и квадратные [] скобки.
- Общие составные имена.
Примеры расчета молярной массы:
NaCl,
Ca(OH)2,
K4[Fe(CN)6],
CuSO4*5H2O,
water,
nitric acid,
potassium permanganate,
ethanol,
fructose.
Molar mass calculator also displays common compound name, Hill formula, elemental composition, mass percent composition, atomic percent compositions and allows to convert from weight to number of moles and vice versa.
Вычисление молекулярной массы (молекулярная масса)
Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.
Примеры молекулярные вычисления веса:
C[14]O[16]2,
S[34]O[16]2.
Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная масса
- Молекулярная масса ( молекулярной массой ) это масса одной молекулы вещества, выражающаяся в атомных единицах массы (и). (1 и равна 1/12 массы одного атома углерода-12)
- Молярная масса ( молекулярной массой ) является масса одного моля вещества и выражается в г / моль.
Массы атомов и изотопов с NIST статью .
См. также: молекулярные массы аминокислот
Molar mass of FeSO4 = 151.9076 g/mol
Convert grams Ferrous Sulfate to moles
or
moles Ferrous Sulfate to grams
Molecular weight calculation:
55.845 + 32.065 + 15.9994*4
Percent composition by element
Element: Iron
Symbol: Fe
Atomic Mass: 55.845
# of Atoms: 1
Mass Percent: 36.762%
Element: Oxygen
Symbol: O
Atomic Mass: 15.9994
# of Atoms: 4
Mass Percent: 42.129%
Element: Sulfur
Symbol: S
Atomic Mass: 32.065
# of Atoms: 1
Mass Percent: 21.108%
Similar chemical formulas
Note that all formulas are case-sensitive.
Did you mean to find the molecular weight of one of these similar formulas?
FeSO4
FEsO4
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.

 2 ⟶ Fe2(SO4)3 + Na2SO4 + Cl2
2 ⟶ Fe2(SO4)3 + Na2SO4 + Cl2