Как найти молярную массу кислорода
Молярная масса является важнейшей характеристикой любого вещества, в том числе кислорода. Зная молярную массу, можно производить расчет химических реакций, физических процессов и т.д. Найти эту величину можно, используя таблицу Менделеева или уравнение состояния идеального газа.

Вам понадобится
- — периодическая таблица химических элементов;
- — весы;
- — манометр;
- — термометр.
Инструкция
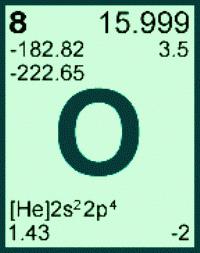
Если точно известно, что исследуемый газ — кислород, определите соответствующий элемент в периодической таблице химических элементов (таблице Менделеева). Найдите элемент кислород, обозначенный латинской буквой O, который находится под номером 8.
Его атомная масса составляет 15,9994. Поскольку эта масса указывается с учетом наличия изотопов, то возьмите самым распространенный атом кислорода, относительная атомная масса которого составит 16.
Учитывайте тот факт, что молекула кислорода двухатомна, поэтому относительная молекулярная масса газа кислород будет равна 32. Она численно равна молярной массе кислорода. То есть, молярная масса кислорода будет равна 32 г/моль. Чтобы перевести эту величину в килограммы на моль, поделите ее на 1000, получите 0,032 кг/моль.
Если точно неизвестно, что рассматриваемый газ кислород, определите его молярную массу при помощи уравнения состояния идеального газа. В тех случаях, когда нет сверхвысоких, сверхнизких температур и высокого давления, когда агрегатное состояние вещества может измениться, кислород можно считать идеальным газом. Откачайте воздух из герметичного баллона, оснащенного манометром, объем которого известен. Взвесьте его на весах.
Наполните его газом, и взвесьте снова. Разность масс пустого и заполненного газом баллона будет равна массе самого газа. Выразите ее в граммах. При помощи манометра определите давление газа в баллоне в Паскалях. Его температура будет равна температуре окружающего воздуха. Измерьте ее термометром и переведите в Кельвины, прибавив к значению в градусах Цельсия число 273.
Рассчитайте молярную массу газа, умножив его массу m на температуру T, и универсальную газовую постоянную R (8,31). Полученное число последовательно поделите на значения давления P и объема V (M=m•8,31•T/(P•V)). Результат должен получиться близким к 32 г/моль.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Атомы элементов и молекулы веществ обладают ничтожно малой массой. Для изучения количественных отношений, характерных для химических реакций, используется несколько физических величин. Одна из них — молярная масса, которую можно рассчитать для атомов, ионов и молекул. Один из важнейших элементов на Земле — кислород, с его участием протекают многие реакции и процессы. Для выполнения расчетов по формулам соединений, уравнениям реакций используется молярная масса кислорода, которая численно равна относительной массе его атома или молекулы.
Кислород
Общие сведения о кислороде (химическом элементе):
- латинское название — Oxygenium;
- химический символ — O;
- находится в верхней части 16-й группы (ранее — группы VI A) периодической таблицы;
- расположен во втором периоде сразу после азота, перед фтором;
- относится к семейству халькогенов;
- номер элемента в периодической таблице и заряд ядер его атомов — 8.
Кислород как один из компонентов атмосферы долгое время не могли выделить в чистом виде. Газ называли «животворящим», «эликсиром жизни». Честь открытия кислорода делят между собой ученые с мировым именем: К. Шееле, Дж. Пристли, А. Лавуазье. Термин «оксиген» предложил А. Лавуазье, исходя из важной роли вещества, его атомов в процессах образования оксидов и кислот.
Как находят молярную массу элемента или вещества?
При выполнении химических расчетов нужно знать массы участвующих в реакциях атомов и молекул веществ. Но они слишком малы, что затрудняет использование таких единиц измерения, как граммы и килограммы. Выход был найден: предложены другие величины, облегчающие расчеты. Например, в химии используются относительные значения атомных и молекулярных масс. Относительная масса атома (Ar) как физическая величина была введена в 1961 году. Ее значение равно 1/12 массы атома углерода (изотопа 12C).
Для выполнения расчетов по формулам и уравнениям с применением этой и других величин нужно помнить несколько правил:
- Масса атома указана в периодической системе рядом с химическим знаком. Молярная масса имеет такое же численное значение, но с единицами измерения г/моль.
- Массу одного моля вещества определяют по формуле соединения, для чего находят сумму молярных масс всех частиц в молекуле.
- Если в химической формуле есть индекс, указывающий на количество структурных единиц, то необходимо умножить молярную массу на этот коэффициент.
Атомная и молекулярная масса кислорода
Масса атома кислорода получена с учетом количества и распространения трех его природных изотопов: Ar (О) = 15,999 (в а. е. м.). В расчетах это значение обычно округляют, получается 16. Для каждого элемента его атомная масса — постоянная величина. По известной массе атомов элемента с порядковым номером 8 может быть найдена молярная масса элемента кислорода. М(О) = 16. Еще одна безразмерная физическая величина — молекулярная масса кислорода — относится к простому веществу. Вычисляют массу молекулы кислорода, умножив массу атома на стехиометрический коэффициент в формуле: Mr(O2) = Ar (О) . 2 = 16 . 2 = 32. На практике нет необходимости выяснять, какая молярная масса кислорода, ведь ее значение численно равно массе молекулы вещества, но с единицей измерения г/моль. Для конкретного соединения его молекулярная масса является постоянной величиной, широко используется при расчетах количества и массы вещества.
Количество вещества
В химии для удобства расчетов используется одна из важнейших физических величин — количество вещества. Относится она не к массе, а к числу структурных единиц. За единицу измерения количества вещества в Международной системе (СИ) принят 1 моль. Зная, что 1 моль включает столько же частиц, сколько их содержится в 12 г углеродного изотопа 12С, можно рассчитать число атомов, молекул, ионов, электронов, содержащихся в навеске любого вещества. Еще одна постоянная величина получила название в честь великого итальянского ученого Авогадро (обозначается NА), Она характеризует число структурных частиц, которые содержит вещество, если его количество — 1 моль. Численное значение постоянной Авогадро — 6,02 . 1023 1/моль. Именно такое количество атомов (молекул, ионов) обладает молярной массой. Обозначение этой физической величины — М, единица измерения — 1 г/моль, формула для расчета — М = m/n (m — масса (г), n — количество вещества (моль)).
Чему равна молярная масса кислорода
На практике нет необходимости пользоваться формулой М = m/n для вычисления молярной массы кислорода. При решении задач чаще требуется определить, чему равна масса, или найти количество вещества. В первом случае используют для расчетов формулу m = n . M, во втором — n = m/M. Численное значение молярной массы элемента совпадает с массой атома, а для вещества — молекулы. Например, массу 16 г имеет 1 моль элемента кислорода. М (О2) — молярная масса молекулы кислорода, которая равна 32 г/моль.
Молярная масса эквивалента кислорода
Эквивалентной называют величину, равную массе 1 моля атомов любого одновалентного элемента. В общем случае можно определить эквивалентную массу, поделив молярную массу атомов химического элемента на его валентность, найденную по формуле конкретного соединения. В большинстве своих соединений кислород, как химический элемент-халькоген, двухвалентен. Молярная масса кислорода может быть найдена по таблице Менделеева, ее округленное значение — 16. Эквивалентная масса в 2 раза меньше — 8. В химии применяется закон эквивалентов, который гласит, что вещества вступают в реакцию между собой в количествах, равных их эквивалентам. При выполнении расчетов можно использовать молярную массу эквивалента кислорода, чтобы определить массу эквивалента вещества, для которого она неизвестна.
Кислород — один из важнейших элементов в земной коре, на него приходится 46,6 % массы. Простое соединение с тем же названием — второе по распространенности в атмосфере Земли. Содержание молекулярного кислорода в воздухе — 20,947 % по объему. При участии атомов элемента и молекул вещества протекают многие реакции и процессы в технике, промышленности, живой и неживой природе. Важно учесть количественные отношения в этих процессах, что значительно облегчает использование физических величин, в том числе молярной массы кислорода.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
← Молярная и молекулярная масса
- Относительная молекулярная масса O: 15.9994
- Молярная масса O: 15.9994 г/моль (0.016 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| O (кислород) | 1 | 15.9994 | 15.9994 |
| 15.9994 |
Расчёт молярной и относительной молекулярной массы O
- Mr[O] = Ar[O] = 15.9994 = 15.9994
- Молярная масса (в кг/моль) = Mr[O] : 1000 = 15.9994 : 1000 = 0.016 кг/моль
Электронная конфигурация атома кислорода
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
C2H3 [27.04522]
Ce2Mo3O12 [760.0448]
Калькулятор молекулярной массы

|
Если под данным вопросом подразумевается вычисление массы одной молекулы кислорода, то надо выполнить следующие действия. Найти молярную массу М из таблицы Менделеева. Молярная масса вещества — это масса одного моля вещества, выраженная в граммах, для молекулы кислорода (О2) это значение равно 32 грамм/моль. Чтобы найти массу молекулы, надо молярную массу разделить на число Авогадро N (число молекул в моле вещества). Число Авогадро равно примерно 6.022*10 в 23 степени. Итак, М делим на N и получаем величину массы молекулы кислорода — 5.3*10 в минус 23 степени грамм. Знаете ответ? |