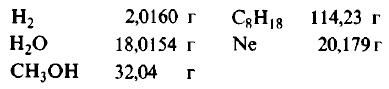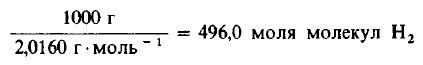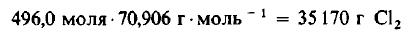Загрузить PDF
Загрузить PDF
Атомы слишком малы, чтобы измерять ими массу химических веществ. Для работы с реальными количествами материи ученые ввели понятие моля. В один моль вещества входит столько же атомов, сколько содержится в 12 граммах изотопа углерод-12, что составляет примерно 6,022 x 1023 атомов. Эта постоянная величина получила название числа Авогадро.[1]
Данная константа применима для описания количества атомов или молекул любых веществ, причем масса одного моля вещества называется его молярной массой.
-
1
Ознакомьтесь с понятием молярной массы. Молярной массой какого-либо вещества называют массу (в граммах) одного моля этого вещества.[2]
Молярную массу химического элемента можно вычислить, умножив атомную массу этого элемента на коэффициент пересчета, измеряемый в граммах на моль (г/моль). -
2
Определите относительную атомную массу элемента. Относительной атомной массой какого-либо элемента называется средняя масса всех его изотопов, выраженная в атомных единицах массы (а.е.м.).[3]
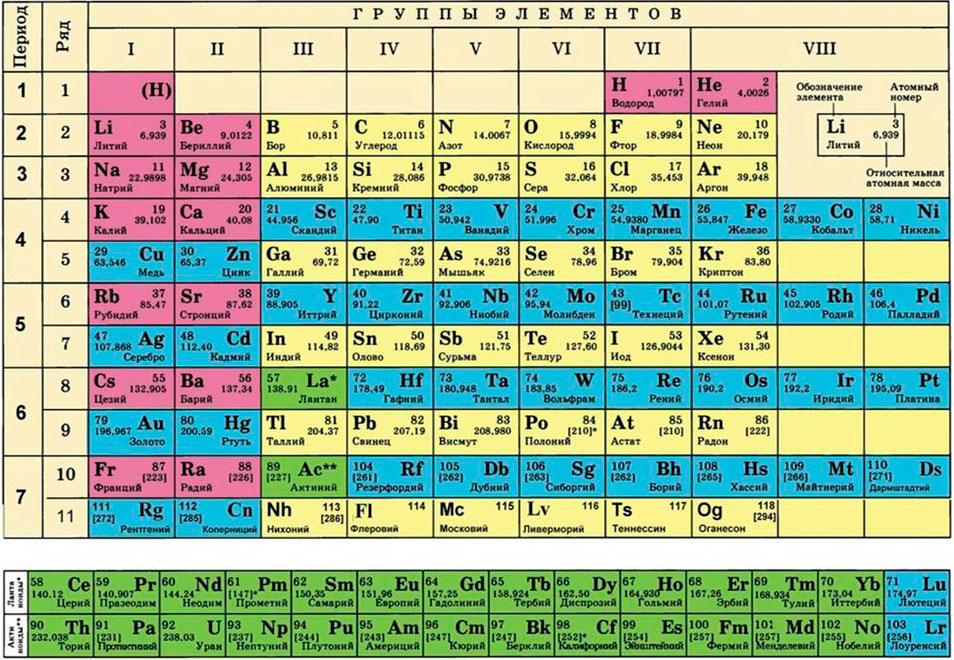
Ее можно узнать из периодической таблицы Менделеева. Найдите в таблице необходимый элемент и обратите внимание на число, приведенное под символом этого элемента. Это нецелое число, имеющее знаки после десятичной запятой.- К примеру, относительная атомная масса водорода составляет 1,007, у углерода она равна 12,0107, у кислорода − 15,9994, у хлора − 35,453.
-
3
Умножьте относительную атомную массу на коэффициент пересчета, равный 0,001 килограмма, или 1 грамм на моль. Тем самым, переведя атомные единицы массы в граммы на моль, вы определите молярную массу элемента. Для водорода у вас получится 1,007 грамма на моль, для углерода − 12,0107 грамма на моль, для кислорода − 15,9994 грамма на моль, и для хлора − 35,453 грамма на моль.
- Некоторые элементы состоят из молекул, каждая из которых образована из двух или более атомов. Для того, чтобы определить молярную массу элемента, молекулы которого состоят из двух атомов (например, водорода, кислорода или хлора), следует найти его относительную атомную массу, умножить ее на коэффициент пересчета в граммы и дополнительно умножить на 2 (число атомов в одной молекуле).
- В случае H2 находим: 1,007 x 2 = 2,014 грамма на моль; для O2 получаем: 15,9994 x 2 = 31,9988 грамма на моль; для Cl2: 35,453 x 2 = 70,096 грамма на моль.
Реклама
-
1
Определите химическую формулу вещества. В этой формуле содержится информация о количестве атомов всех элементов, входящих в состав молекулы данного вещества. Химическую формулу интересующего вас вещества можно найти в справочнике по химии. Например, хлористоводородная (соляная) кислота имеет формулу HCl, а для глюкозы формула записывается как C6H12O6. По химической формуле вещества вы сможете определить число атомов каждого элемента, входящего в его состав.
- В случае HCl молекула состоит из одного атома водорода и одного атома хлора.
- Молекула глюкозы C6H12O6 состоит из 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода.
-
2
Найдите относительные атомные массы всех элементов, входящих в состав данного вещества. Пользуясь периодической таблицей Менделеева, определите относительную атомную массу каждого элемента. Эта масса указана под символом соответствующего элемента. Как и в первом методе, необходимо умножить эти относительные атомные массы на 1 грамм/моль.
- Относительные атомные массы входящих в соляную кислоту водорода и хлора составляют 1,007 г/моль и 35,453 г/моль соответственно.
- Относительные атомные массы элементов, входящих в состав глюкозы, равны 12,0107 г/моль (углерод), 1,007 г/моль (водород) и 15,9994 г/моль (кислород).
-
3
Вычислите молярную массу каждого элемента, входящего в состав химического соединения. Умножьте атомную массу элемента на количество атомов этого элемента, содержащихся в одной молекуле вещества. Таким образом вы найдете относительное количество каждого элемента, входящего в состав рассматриваемого соединения.[4]
- Молярные массы элементов, входящих в состав соляной кислоты HCl, составляют 1,007 грамма на моль (водород) и 35,453 грамма на моль (хлор).
- Для элементов, входящих в состав глюкозы C6H12O6, получаем следующие молярные массы: 12,0107 x 6 = 72,0642 г/моль (углерод); 1,007 x 12 = 12,084 г/моль (водород); 15,9994 x 6 = 95,9964 г/моль (кислород).
-
4
Сложите молярные массы всех элементов, входящих в состав химического соединения. Таким образом вы определите молярную массу данного соединения. Возьмите найденные ранее молярные массы элементов и сложите их. В результате у вас получится молярная масса интересующего вас вещества.
- Для соляной кислоты находим: 1,007 + 35,453 = 36,460 г/моль. Таким образом, масса одного моля соляной кислоты составляет 36,46 грамма.
- Молярная масса глюкозы составляет 72,0642 + 12,084 + 95,9964 = 180,1446 г/моль, то есть в одном моле глюкозы содержится приблизительно 180,14 грамма.
Реклама
Советы
- Для большинства химических элементов относительные атомные массы известны с точностью до 4 знаков после запятой. В расчетах обычно учитывается только 2 знака после запятой. Поэтому, например, в лаборатории молярную массу водорода записали бы как 36,46 г/моль, а глюкозы − как 180,14 г/моль.
Реклама
Что вам понадобится
- Справочник по химии или периодическая таблица Менделеева
- Калькулятор
Похожие статьи
Об этой статье
Эту страницу просматривали 109 048 раз.
Была ли эта статья полезной?
В уроке 5 «Моль и молярная масса» из курса «Химия для чайников» рассмотрим моль как единицу измерения количества вещества; дадим определение числу Авогадро, а также научимся определять молярную массу и решать задачи на количество вещества. Базой для данного урока послужат основы химии, изложенные в прошлых уроках, так что если вы изучаете химию с нуля, то рекомендую их просмотреть хотя бы мельком.
Единица измерения количества вещества
До этого урока мы обсуждали лишь индивидуальные молекулы и атомы, а их массы мы выражали в атомных единицах массы. В реальной жизни с индивидуальными молекулами работать невозможно, потому что они ничтожно малы. Для этого химики взвешивают вещества ни в а.е.м., а в граммах.
Чтобы перейти от молекулярной шкалы измерения масс в лабораторную шкалу, используют единицу измерения количества вещества под названием моль. 1 моль содержит 6,022·1023 частиц (атомов или молекул) и является безразмерной величиной. Число 6,022·1023 носит название Число Авогадро, которое определяется как число частиц, содержащихся в 12 г атомов углерода 12C. Важно понимать, что 1 моль любого вещества содержит всегда одно и то же число частиц (6,022·1023).
Как уже было сказано, термин «моль» применяется не только к молекулам, но также и к атомам. Например, если вы говорите о моле гелия (He), то это означает, что вы имеет количество равное 6,022·1023 атомов. Точно так же, 1 моль воды (H2O) подразумевает количество равное 6,022·1023 молекул. Однако чаще всего моль применяют именно к молекулам.
Молярная масса вещества
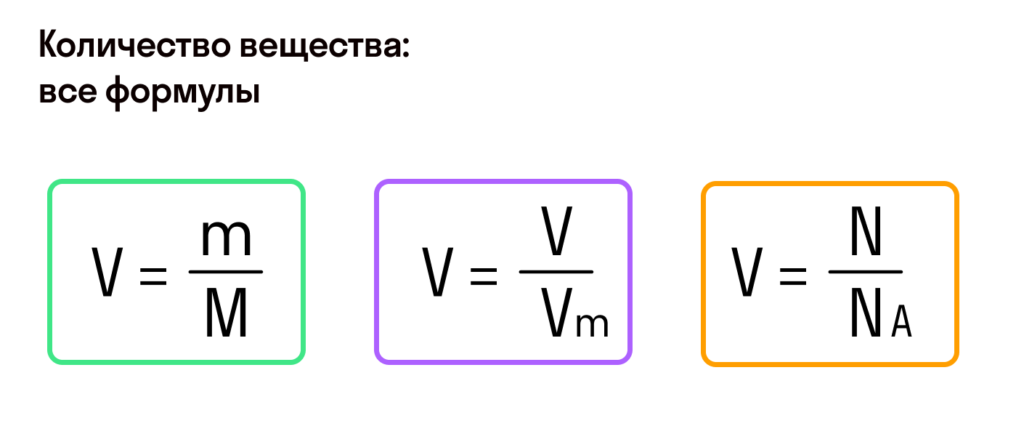
Молярная масса – это масса 1 моля вещества, выраженная в граммах. Молярную массу одного моля любого химического элемента без труда находят из таблицы Менделеева, так как молярная масса численно равна атомной массе, но размерности у них разные (молярная масса имеет размерность г/моль). Запишите и запомните формулы для вычисления молярной массы, количества вещества и числа молекул:
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =NA·n
где m — масса вещества, n — количество вещества (число молей), М — молярная масса, N — число молекул, NA — число Авогадро. Благодаря молярной массе вещества химики могут вести подсчет атомов и молекул в лаборатории просто путем их взвешивания. Этим и удобно использование понятия моль.
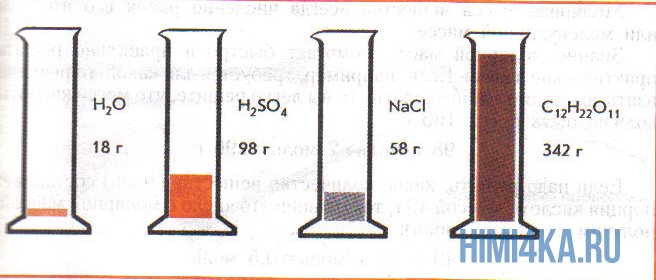
На рисунке изображены четыре колбы с различными веществами, но в каждой из них всего 1 моль вещества. Можете перепроверить, используя формулы выше.
Задачи на количество вещества
Пример 1. Сколько граммов Н2, Н2O, СН3ОН, октана (С8Н18) и газа неона (Ne) содержится в 1 моле?
Решение: Молекулярные массы (в атомных единицах массы) перечисленных веществ приведены в таблице Менделеева. 1 моль каждого из названных веществ имеет следующую массу:
Поскольку массы, указанные в решении примера 1, дают правильные относительные массы взвешиваемых молекул, указанная масса каждого из перечисленных веществ содержит одинаковое число молекул. Этим и удобно использование понятия моля. Нет даже необходимости знать, чему равно численное значение моля, хотя мы уже знаем, что оно составляет 6,022·1023; эта величина называется числом Авогадро и обозначается символом NA. Переход от индивидуальных молекул к молям означает увеличение шкалы измерения в 6,022·1023 раз. Число Авогадро представляет собой также множитель перевода атомных единиц массы в граммы: 1 г = 6,022·1023 а.е.м. Если мы понимаем под молекулярной массой массу моля вещества, то ее следует измерять в граммах на моль; если же мы действительно имеем в виду массу одной молекулы, то она численно совпадает
с молекулярной массой вещества, но выражается в атомных единицах массы на одну молекулу. Оба способа выражения молекулярной массы правильны.
Пример 2. Сколько молей составляют и сколько молекул содержат 8 г газообразного кислорода O2?
Решение: Выписываем из таблицы Менделеева атомную массу атома кислорода (O), которая равна 15,99 а.е.м, округляем до 16. Так как у нас молекула кислорода, состоящая из двух атомов O, то ее атомная масса равна 16×2=32 а.е.м. Хорошо, а теперь переводим ее в молярную массу: 32 а.е.м = 32 г/моль. Это означает, что 1 моль (6,022·1023 молекул) O2 имеет массу 32 грамма. Ну и в заключении по формулам выше находим количество вещества (моль) и число молекул, содержащихся в 8 граммах O2:
- n = m / M = 8г / 32г/моль = 0,25 моль
- N = NA × n = 6,022·1023 × 0,25 = 1,505·1023 молекул
Пример 3. 1 молекула Н2 реагирует с 1 молекулой Сl2, в результате чего образуются 2 молекулы газообразного хлористого водорода НСl. Какую массу газообразного хлора необходимо использовать, чтобы он полностью прореагировал с 1 килограммом (кг) газообразного водорода?
Решение: Молекулярные массы H2 и Cl2 равны 2,0160 и 70,906 г/моль соответственно. Следовательно, в 1000 г H2 содержится
Даже не выясняя, сколько молекул содержится в одном моле вещества, мы можем быть уверены, что 496 моля Cl2 содержат такое же число молекул, как и 496,0 моля, или 1000 г, H2. Сколько же граммов Cl2 содержится в 496 молях этого вещества? Поскольку молекулярная масса Cl2 равна 70,906 г/моль, то
Пример 4. Сколько молекул H2 и Cl2 принимает участие в реакции, описанной в примере 3?
Решение: В 496 молях любого вещества должно содержаться 496 моля × 6,022·1023 молекул/моль, что равно 2,99·1026 молекул.
Чтобы наглядно показать, сколь велико число Авогадро, приведем такой пример: 1 моль кокосовых орехов каждый диаметром 14 сантиметров (см) мог бы заполнить такой объем, какой занимает наша планета Земля. Использование молей в химических расчетах рассматривается в следующей главе, но представление об этом пришлось ввести уже здесь, поскольку нам необходимо знать, как осуществляется переход от молекулярной шкалы измерения масс к лабораторной шкале.
Надеюсь урок 5 «Моль и молярная масса» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Download Article
Download Article
Atoms are too small to allow meaningful measurement of chemical substances. To work with meaningful amounts of substances, scientists group them into units called moles. A mole is defined as the number of carbon atoms in 12 grams of the isotope carbon-12,[1]
which is roughly 6.022 x 1023 atoms. This number is called Avogadro’s number or Avogadro’s constant.[2]
This constant is used as the number of atoms given by one mole for any substance, and the mass of 1 mole of a substance is its molar mass.
-
1
Understand molar mass. Molar mass is the mass (in grams) of one mole of a substance.[3]
Using the atomic mass of an element and multiplying it by the conversion factor grams per mole (g/mol), you can calculate the molar mass of that element. -
2
Find the relative atomic mass of the element. An element’s relative atomic mass is the average mass, in atomic units, of a sample of all its isotopes.[4]
This information can be found on the periodic table of elements. Locate the element and find the number underneath the symbol for the element. It will not be a whole number, but will have decimals.- For example, for hydrogen, the relative atomic mass is 1.007; for carbon, it is 12.0107; for oxygen, it is 15.9994; and for chlorine, it is 35.453.
Advertisement
-
3
Multiply the relative atomic mass by the molar mass constant. This is defined as 0.001 kilogram per mole, or 1 gram per mole. This converts atomic units to grams per mole, making the molar mass of hydrogen 1.007 grams per mole, of carbon 12.0107 grams per mole, of oxygen 15.9994 grams per mole, and of chlorine 35.453 grams per mole.[5]
- Some elements are only found in molecules of 2 atoms or more. This means that if you want to find the molar mass of elements that are composed of 2 atoms, such as hydrogen, oxygen, and chlorine, then you’ll have to find their relative atomic masses. Multiply them by the molar mass constant, and then multiply the result by 2.
- For H2: 1.007 x 2 = 2.014 grams per mole; for O2: 15.9994 x 2 = 31.9988 grams per mole; and for Cl2: 35.453 x 2 = 70.096 grams per mole.
- One mnemonic device for remembering diatomic elements (molecules of 2 atoms) is: Have No Fear Of Ice Cold Beverages (Hydrogen, Nitrogen, Fluorine, Oxygen, Iodine, Chlorine, Bromine).[6]
Advertisement
-
1
Find the chemical formula for the compound. This is the number of atoms in each element that makes up the compound. (This information is given in any chemistry reference book.) For example, the formula for hydrogen chloride (hydrochloric acid) is HCl; for glucose, it is C6H12O6. Using this formula, you can identify the number of atoms of each element that makes up the compound.[7]
- For HCl, there is one atom of hydrogen and one atom of chlorine.
- For C6H12O6, there are 6 carbon atoms, 12 hydrogen atoms, and 6 oxygen atoms.
-
2
Find the relative atomic mass of each element in the compound. Using the periodic table, locate the relative atomic mass for each element. It is the number located beneath the symbol for the element.[8]
As we did in the first method of calculating the molar mass of an element, we will also multiply these masses by 1 gram/mole.- The relative atomic masses of the elements in hydrochloric acid are: hydrogen, 1.007 g/mol and chlorine, 35.453 g/mol.
- The relative atomic masses of the elements in glucose are: carbon, 12.0107 g/mol; hydrogen, 1.007 g/mol; and oxygen, 15.9994 g/mol.
-
3
Calculate the molar mass of each element in the compound. Multiply the element’s atomic mass by the number of atoms of that element in the compound. This will give you the relative amount that each element contributes to the compound.[9]
- For hydrogen chloride, HCl, the molar mass of each element is 1.007 grams per mole for hydrogen and 35.453 grams per mole for chlorine.
- For glucose, C6H12O6, the molar mass of each element is: carbon, 12.0107 x 6 = 72.0642 g/mol; hydrogen, 1.007 x 12 = 12.084 g/mol; and oxygen, 15.9994 x 6 = 95.9964 g/mol.
-
4
Add the molar masses of each element in the compound. This determines the molar mass for the entire compound. Take the products you obtained in the previous step and add them all together to calculate the molar mass of the compound.[10]
- For hydrogen chloride, the molar mass is 1.007 + 35.453 = 36.460 g/mol. 36.46 grams is the mass of one mole of hydrogen chloride.
- For glucose, the molar mass is 72.0642 + 12.084 + 95.9964 = 180.1446 g/mol. 180.14 grams is the mass of one mole of glucose.
Advertisement
Calculator, Practice Problems, and Answers
Add New Question
-
Question
What is the molar mass of Helium?
Bess Ruff is a Geography PhD student at Florida State University. She received her MA in Environmental Science and Management from the University of California, Santa Barbara in 2016. She has conducted survey work for marine spatial planning projects in the Caribbean and provided research support as a graduate fellow for the Sustainable Fisheries Group.
Environmental Scientist
Expert Answer
-
Question
What is the molecular mass of oxygen and hydrogen as a mixture?
Oxygen with Hydrogen gives you WATER (H2O). The relative atomic mass for Oxygen is 16, while Hydrogen is 1 since Hydrogen (H2) have two molecules you multiply by 2 1*2=2. Oxygen (O) being 16*1=16. Add up your answers to get 18, and the molecular mass of Oxygen and Hydrogen which is water gives you 18.
-
Question
How do you calculate the molar mass of water?
Water’s chemical formula is H2O, this means it is composed of 2 Hydrogen atoms and 1 Oxygen atom. To find the molar mass, find the atomic mass of all the components of a chemical. You can either memorize it, or find all of the atomic masses located on the periodic table of elements. In this case, hydrogen has an atomic mass of 1, and oxygen has an atomic mass of 16. The equation is therefore: 1(2) + 16(1) = 18. Therefore, the molar mass of water, is 18.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
While most relative atomic masses are known to a precision of 1 part in 10 thousand (4 decimal places), in most laboratory work, molar masses are normally quoted to 2 decimal places and fewer for particularly large masses. Thus, in the laboratory, the molar mass for hydrogen chloride would be given as 36.46 grams per mole and that of glucose as 180.14 grams per mole.
Advertisement
Things You’ll Need
- Chemistry reference book or periodic table of the elements
- Calculator
References
About This Article
Article SummaryX
When you’re measuring extremely tiny amounts of a substance, it can be helpful to use molar mass. According to the International System of Units, a mole is the amount of any substance that contains the same number of elementary entities—typically atoms or molecules—as there are atoms in 12 grams of the isotope carbon-12. Molar mass is the mass in grams of 1 mole of any given substance. To find an element’s molar mass, start by checking the periodic table for the relative atomic mass of the element. This is usually located under the symbol and name of the element. For instance, the relative atomic mass of zirconium (Zr) is 91.22. Next, multiply the atomic mass by the molar mass constant, which is equal to 1 gram per mole. For most elements, this means that the relative atomic mass is equal to the molar mass. For instance, zirconium has a molar mass of 91.22 x 1 g/mol, or 91.22 g/mol. However, some elements, such as hydrogen, nitrogen, and oxygen, only occur naturally in molecules of 2 or more atoms. In these cases, you’ll need to multiply the relative atomic mass of the element by the number of atoms in the molecule, then multiply the result by the molar mass constant. For example, the molar mass of H2 is 1.007 x 2 x 1 g/mol, or 2.014 g/mol. Finding the molar mass of a compound is a little more complicated. First, you’ll need to find the chemical formula for the compound. For example, if you’re calculating the molar mass of water, you’d start with the formula H2O. Then, calculate the molar mass of each element in the compound. Don’t forget to take into account the number of atoms of each element when you make your calculation. In this case, the molar mass of the two hydrogen atoms is 2.014 g/mol, while the single oxygen atom is 15.999 g/mol. Add them together to get the total molar mass of 18.013 g/mol. To see specific examples for how to calculate molar mass, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 1,271,191 times.
Reader Success Stories
-
Sesame Makgasane
Aug 2, 2016
«The steps helped me understand really quickly. I am writing an examination tomorrow, and this really helped me.»
Did this article help you?
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Молярной массой называют массу одного моля вещества. Эту физическую величину обозначают буквой (M) и выражают в г/моль*.
Если в формуле простого вещества у знака химического элемента подразумевается индекс «(1)», молярная масса численно совпадает с относительной атомной массой химического элемента, образующего данное простое вещество.
Если в формуле простого вещества у знака элемента находится индекс, обозначающий количество вещества атомов в одном моле, для того чтобы рассчитать молярную массу, следует этот индекс умножить на молярную массу химического элемента.
Для того чтобы рассчитать молярную массу соединения (сложного вещества), следует индекс, обозначающий количество вещества атомов каждого элемента в одном моле, умножить на молярную массу этого элемента и полученные данные сложить.
Таким образом, молярная масса соединения с общей формулой (AaBbCc) рассчитывается так:
.
Обрати внимание!
* По СИ молярную массу следует выражать в кг/моль. Однако численное выражение этой физической величины в таком случае менее удобно для проведения расчётов, нежели когда молярная масса выражена в г/моль.
Пример:
молярная масса воды (М()
H2O
()) (=) (0,018) кг/моль, или (М()
H2O
()) (=) (18) г/моль.