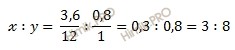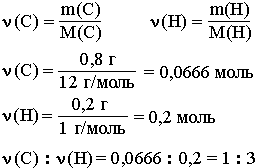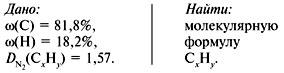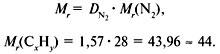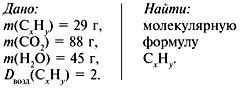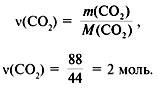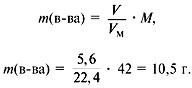В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
определим молекулярную формулу углеводорода, в котором содержится (85,71)
%
углерода и (14,29)
%
водорода. Известно, что относительная плотность этого углеводорода по воздуху составляет (0,966).
Первый вариант решения
1. В веществе содержатся только атомы углерода и водорода, значит, его формулу можно записать так —
CxHy
. Индексы в формуле показывают отношение количеств атомов:
x:y=n(C):n(H).
По массовым долям определяем, что в (100) г углеводорода содержится (85,71) г углерода и (14,29) г водорода.
Найдём количества этих элементов:
x=m(C)Ar(C)=85,71 г12 г/моль=7,1425 моль;
y=m(H)Ar(H)=14,29г1г/моль=14,29моль;
x:y=7,1425:14,29=7,14257,1425:14,297,1425=1:2.
Значит, простейшая формула углеводорода —
CH2
.
2. Определим относительную молекулярную массу вещества и сравним её с массой
CH2
:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
Mr(CxHy)Mr(CH2)=2814=2.
Следовательно, молекулярная формула вещества
(CH2)2=C2H4.
Второй вариант решения
1. Определим относительную молекулярную массу углеводорода:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
2. Найдём число атомов углерода и водорода в молекуле:
x=Mr(C)⋅w(C)Ar(C)⋅100%=28⋅85,71%12⋅100%=2;
y=Mr(CxHy)⋅w(H)Ar(H)⋅100%=28⋅14,29%1⋅100%=4.
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
и т.д.
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3.
x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6.
Искомое вещество — C3H6 — пропен.
Дана относительная плотность по аргону.
Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: Cnh3n
Обсуждение: «Относительная плотность по… задачи»
(Правила комментирования)
distant-lessons.ru
Как найти массу через плотность: учащемуся на заметку
#1
Плотность вещества ρ – физическая величина численно равная отношению массы вещества m к объему V, который занимает это вещество. Для однородного вещества плотность определяется формулой ρ =m/V. Плотность разных веществ может существенно отличаться. Например, плотность золота 19,32 г/см3, а плотность дерева бальза, из которого инки изготавливали каноэ, всего около 0,14 г/см3.
#2
Для решения задач по физике из курса средней школы нужно знать, как найти массу через плотность. Чтобы определить массу вещества mс известной плотностью ρ необходимо воспользоваться соотношением m =ρ·V, где V — объем. Плотность веществ ρ можно узнать из справочных таблиц. Объем веществ V, имеющих форму куба, трапеции, конуса, пирамиды, сферы и т. д. вычисляется с помощью геометрических формул.
#3
Приведенной выше формулой можно воспользоваться, чтобы решить задачу, как найти массу зная объем вещества. Если известен объем V, который занимает вещество, то по справочной таблице определяют плотность ρ данного вещества и по формуле m =ρ·Vопределяют массу.Например, масса куба из золота с ребром 2 см равна: 19,320 г/см3·23 см3=19,320·8=154,56 г. Масса такого же по размеру куба из древесины дерева бальза равна: 0,14 г/см3·23 см3=0,14·8=1,12 г.
#4
Зная плотность, легко решить вопрос, как найти массу воды. Плотность воды при нормальном атмосферном давлении (101325 Па) имеет наибольшее значение ρ = 999,973 кг/м3 при температуре 3,98°С, а при температуре 20°С — 998,203 кг/м3. Для расчетов плотность воды принимается равной 1000 кг/м3. Массу воды также определяют по формуле m =ρ·V, следовательно, mводы = ρводы·V = 103· V.
#5
Вопрос как перевести объем в массу решается легко. Это обратная задача для задачи нахождения массы через объем.Для определения массы m вещества, который занимает известный объем V, необходимо плотность вещества ρ (т.е. массу единичного объема) умножить на объем:m =ρ·VНапример, алюминиевый шар объемом 50 см3 имеет массу: 50 см3 · 2,6989 г/см3 = 134,945 г.
#6
Моль – количество вещества, которое содержит столько же молекул или атомов, сколько атомов в 0,012 кг углерода, т.е. число Авогадро NA = 6,022×1023 моль-1. Как рассчитать молярную массу? При нормальных условиях (давление Р = 105 Па, температура Т = 273 К) 1 моль вещества занимает объем Vмол = 22,4×10-3 м3. Следовательно, молярную массу вещества можно рассчитать по формуле: М = ρ× Vмол, где ρ— плотность вещества.Молярная масса вещества M— это масса одного моля.Молярная масса вещества — это отношение массы вещества m к его количеству n: M = m/n грамм/моль
uznay-kak.ru
Формула массы через объем и плотность
Формула для вычисления массы через объем и плотность
Это количество можно определять по-разному. Если речь идет о числе частиц, то говорят о плотности частиц. Эту величину обозначают буквой n. В СИ она измеряется в м-3. Если имеется ввиду масса вещества, то вводят плотность массы. Её обозначают через . В Си измеряется в кг/м3. Между и n существует связь. Так, если тело состоит из частиц одного сорта, то
= m×n,
где m – масса одной частицы.
Плотность массы можно вычислить по формуле:
= m / V.
Данное выражение можно преобразовать так, чтобы получилась формула массы через объем и плотность:
m = ×V.
Таблица 1. Плотности некоторых веществ.
|
Вещество |
Плотность, кг/м3 |
Вещество |
Плотность, кг/м3 |
|
Вещества атомного ядра |
1017 |
Вода |
1,00×103 |
|
Сжатые газы в центре самых плотных звезд |
108 |
Жидкий водород |
0,07×103 |
|
Золото |
1,93×104 |
Воздух у поверхности Земли |
1,2 |
|
Ртуть |
1,36×104 |
Воздух на высоте 20 км |
9×10-2 |
|
Сжатое железо в ядре Земли |
1,2×104 |
Наивысший искусственный вакуум |
10-13 |
|
Сталь |
(7,6 – 7,8)×103 |
Газы межзвездного пространства |
10-20 |
|
Алмаз |
3,53×103 |
Газы межгалактического пространства |
10-26 |
|
Алюминий |
2,7 ×103 |
||
|
Человеческое тело |
1,07 ×103 |
Независимо от степени сжатия плотности жидких и твердых тел лежат в весьма узком интервале значений (табл. 1). Плотности же газов варьируются в весьма широких пределах. Причина заключается в том, что как в твердых телах, так и в жидкостях частицы вплотную примыкают друг к другу. В этих средах расстояние между соседними частицами составляет величину порядка 1 А и сравнимо с размерами атомов и молекул. По этой причине твердые и жидкие тела обладают очень малой сжимаемостью, чем обусловлено малое различие в их плотности. В газах положение иное. Среднее расстояние между частицами значительно превышает их размеры. Например, для воздуха у поверхности Земли оно составляет 10
2 А. Вследствие этого газы обладают большой сжимаемостью, а их плотность может изменяться в очень широких пределах.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
ru.solverbook.com
Ответы@Mail.Ru: как найти массу вещества
Как найти массу вещества
Массу вещества требуется найти во многих задачах. Это можно сделать с помощью специальных формул. Обычно в условии задачи присутствует реакция, с помощью которой находятся некоторые величины.
Инструкция
1. При данном в условии задачи объеме и плотности вычисляйте массу следующим образом: m = V*p, где m – масса, V – объем, p – плотность.
2. В других случаях рассчитывайте массу так: m = n*M, где m – масса, n – количество вещества, M – молярная масса. Молярную массу не трудно подсчитать, для этого нужно сложить все атомные массы простых веществ, входящих в состав сложного (атомные массы указаны в таблице Д. И. Менделеева по обозначение элемента) .
3. Выражайте значение массы из формулы массовой доли вещества: w = m(x)*100%/m, где w – массовая доля вещества, m(x) – масса вещества, m – масса раствора, в котором растворено данное вещество. Чтобы найти массу вещества необходимо: m(x) = w*m/100%.
4. Из формулы выхода продукта вычисляйте нужную вам массу: выход продукта = mp(x)*100%/m(x), где mp(x) – масса продукта x, полученного в реальном процессе, m(x) – рассчитанная масса вещества x. Выводите: mp(x ) = выход продукта* m(x)/100% или m(x) = mp(x)*100%/ выход продукта. При данном в условии задачи выходе продукта эта формула будет необходима. Если выход продукта не дан, то следует считать, что он равен 100%.
5. Если в условии присутствует уравнение реакции, то решайте задачу по нему. Для этого сначала составьте уравнение реакции, затем вычислите из него количества вещества полученного или затраченного для данной реакции и уже это количество вещества подставьте в нужные формулы. Например, Na2SO4 + BaCl2 = BaSO4 + 2NaCl. Известно, что масса BaCl2 равна 10,4 г, нужно найти массу NaCl. Рассчитайте количество вещества хлорида бария: n = m/M. M (BaCl2) = 208 г/моль. n(BaCl2) = 10,4/208 = 0,05 моль. Из уравнения реакции следует, что из 1 моля BaCl2 образовалось 2 моль NaCl. Вычислите какое количество вещества образуется из 0,05 моль BaCl2. n(NaCl) = 0,05*2/1 = 0,1 моль. В задаче же требовалось найти массу хлорида натрия, найдите, предварительно рассчитав молярную массу хлорида натрия. M(NaCl) = 23+35,5 = 58,5 г/моль. m(NaCl) = 0,1*58,5 = 5,85 г. Задача решена.
а потом массу делишь на молярную
touch.otvet.mail.ru
Вычисление молекулярной и молярной массы вещества
Вычисление молекулярной и молярной массы вещества
— Как вычислить молекулярную и молярную массы вещества?
— Моль, молярная масса
Как вычислить молекулярную и молярную массы вещества?
Для этого нужно сложить массы всех атомов в этой молекуле.
Пример 1. В молекуле воды Н2О 2 атома водорода и 1 атом кислорода. Атомная масса водорода = 1, а кислорода = 16. Поэтому молекулярная масса воды равна 1 + 1 + 16 = 18 атомных единиц массы, а молярная масса воды =18 г/моль.
Пример 2. В молекуле серной кислоты Н2SO4 2 атома водорода, 1 атом серы и 4 атома кислорода. Поэтому молекулярная масса этого вещества составит 1 2 + 32 + 4 16 = 98 а.е.м, а молярная масса — 98 г/моль.
Пример 3. В молекуле сульфата алюминия Al2(SO4)3 2 атома алюминия, 3 атома серы и 12 атомов кислорода. Молекулярная масса этого вещества равна 27 · 2 + 32 · 3 + 16 · 12 = 342 а.е.м., а молярная масса — 342г/моль.
Моль, молярная масса
Молярная масса — это отношение массы вещества к количеству вещества, т.е. М(х) = m(x)/n(x), (1)
где М(х) — молярная масса вещества Х, m(x) – масса вещества Х, n(x) — количество вещества Х.
Единица СИ молярной массы — кг/моль,однако обычно используется единица г/моль. Единица массы — г, кг.
Единица СИ количества вещества — моль.
Моль — это такое количество вещества, в котором содержится 6,02·1023 молекул этого вещества.
Любая задача по химии решается через количество вещества. Необходимо помнить основные формулы:
n(x) =m(x)/ М(х)
n(x) = V(x)/Vm
n(x) = N/NA,
или общую формулу: n(x) =m(x)/М(х) = V(x)/Vm = N/NA, (2)
где V(x) – объем вещества Х(л), Vm — молярный объем газа при н.у. (22,4 л/моль), N — число частиц, NA — постоянная Авогадро (6,02·1023).
Пример 1. Определите массу иодида натрия NaI количеством вещества 0,6 моль.
|
Дано: n(NaI)= 0,6 моль. |
Решение Молярная масса иодида натрия составляет: M(NaI)= M(Na) + M(I) = 23 + 127 = 150 г / моль Определяем массу NaI: m(NaI) = n(NaI)·M(NaI) = 0,6 · 150 = 90 г. |
|
Найти: m(NaI) — ? |
Пример 2. Определите количество вещества атомного бора,содержащегося в тетраборате натрия Na2B4O7 массой 40,4 г.
|
Дано: m(Na2B4O7) = 40,4 г. |
Решение Молярная масса тетрабората натрия составляет 202 г/моль. Определяем количество вещества Na2B4O7: n(Na2B4O7) = m(Na2B4O7)/М(Na2B4O7) = 40,4/202 = 0,2 моль. Вспомним, что 1 моль молекулы тетрабората натрия содержит 2 моль атомов натрия, 4 моль атомов бора и 7 моль атомов кислорода (см. формулу тетрабората натрия). Тогда количество вещества атомного бора равно: n(B)= 4 · n(Na2B4O7) = 4 · 0,2 = 0,8 моль. |
|
Найти: n(B) = ? |
examchemistry.com
формула чтобы найти число молей через массу и молярную массу. Пожалуйста дайте формулу завтро экзамен!!!
Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов) , равное постоянной Авогадро
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль вещества содержит 6,02 • 1023 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν (ню) . Например, в образце вещества содержится 12,04 • 1023 молекул. Следовательно, количество вещества в этом образце составляет:
В общем виде:
где N – число частиц данного вещества;
NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро) .
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана Ch5 определяется следующим образом:
Мr(Ch5) = Ar(C) + 4 Ar(H) = 12+4 =16
M(Ch5)=16 г/моль, т. е. 16 г Ch5 содержат 6,02 • 1023 молекул.
Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Соответственно, зная массу и молярную массу вещества, можно рассчитать число его молей:
или найти массу вещества по числу молей и молярной массе:
m = ν • M
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т. е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример
Вычислить массы метана Ch5 и этана С2H6, взятых в количестве ν = 2 моль каждого.
Решение
Молярная масса метана M(Ch5) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда:
m(Ch5) = 2 моль • 16 г/моль = 32 г;
m(С2Н6) = 2 моль • 30 г/моль = 60 г.
Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т. к. частицы вещества (атомы и молекулы) не одинаковы по массе.
n(Ch5) = n(С2Н6), но m(Ch5) < m(С2Н6)
Вычисление ν используется практически в каждой расчетной задаче.
масса измеряется в граммах, количество вещества в молях, молярная масса в граммах делённых на моль. Ясно что чтобы получить молярную массу надо массу разделить на количество, соответственно количество — это масса делить на молярную массу
1. Количество вещества ν определяется по формуле:
ν = n/NA
ν = NA/N
ν = N/NA
ν = NA/n
затрудняюсь ответить
touch.otvet.mail.ru
Определите истинную формулу углеводорода, при сжигании 4,4 грамм которого получили 13,2 грамм диоксида углерода (CO2) и 7,2 грамм воды (H2O). Относительная плотность по водороду (H2) 22.
Решение задачи
Предлагаю, искомую формулу углеводорода обозначить CхHуOz?, наличие кислорода под вопросом, так как в условии задачи не указано какой углеводород (кислород содержащий или нет).
Рассчитаем молярные массы интересующих нас веществ: диоксид углерода (CO2), воды (H2O):
M (CO2) = 12 + 2 ⋅ 16 = 44 (г/моль);
M (H2O) = 2 ⋅ 1 + 16 = 18 (г/моль).
Найдем массу углерода (Cх) в составе углеводорода (CхHуOz?). Составим пропорцию:
в 44 г диоксид углерода (CO2) содержится 12 г углерода (C)
в 13,2 г диоксид углерода (CO2) содержится Cх г
Откуда:
Найдем массу водорода (Hу) в составе углеводорода (CхHуOz?). Составим пропорцию:
в 18 г воды (H2O) содержится 2 г водорода (H)
в 7,2 г воды (H2O) содержится Hу г
Откуда:
Рассчитаем массу углеводорода (CхHуOz?):
m (CхHуOz?)= 3,6 + 0,8 = 4,4 (г), что соответствует условию задачи.
Следовательно, искомую формула углеводорода CхHу.
Исходя из отношения масс, найдем атомное отношение элементов. Для этого будем использовать формулу устанавливающую связь между химическим количеством вещества и массой:
Учитывая, что молярные массы углерода (C) и водорода (H) соответственно равны 12 г/моль и 1 г/моль, получаем:
Число атомов углерода (C) и водорода (H) относятся 3 : 8, следовательно простейшая формула углеводорода – C3H8.
Молярная масса (C3H8) равна:
M (C3H8) = 3 ⋅ 12 + 8 = 44 (г/моль).
Найдем относительную молярную массу углеводорода (C3H8), зная, что относительная плотность по водороду (H2) равна 22, по формуле:
Учитывая, что молярная масса водорода (H2) равна 2 г/моль, получаем:
M (CxHy) = 22 ∙ 2 = 44 (г/моль).
Найдем сколько раз молярная масса углеводорода (CxHy) ”вмещает” молярную массу (C3H8):
M (CxHy)/ M (CH) = 44/44 = 1.
Следовательно, молекулярная формула углеводорода C3H8 (пропан).
Ответ:
молекулярная формула углеводорода C3H8.
Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
-
Образовательные:
-
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
-
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
-
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
-
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
-
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
-
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
-
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению :
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.
2. Найти массовую долю водорода:
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:
(C) =
(CO2) = 2 моль.
5. Найти количество вещества воды:
(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
(H) = 2
(H2O),
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
(C) :
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
(H2O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) :
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
-
Общая формула алканов CnH2n+2, общая формула монохлоралканов CnH2n+1Cl
-
Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(CnH2n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
-
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
-
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
-
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
-
Уравнения реакций:
CnH2n + Н Сl = CnH2n+1Cl
CnH2n + Н Br = CnH2n+1Br
-
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(CnH2n+1Cl) = n(CnH2n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
-
Находим количество вещества алкена:
n(CnH2n) = 1,012/22,4 = 0,045 моль
-
По уравнению реакции
CnH2n +Сl2 = CnH2nCl2
n(CnH2nCl2)= n(CnH2n) =0,045 моль
-
М(CnH2nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
|
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода. |
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
|
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. |
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
|
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. |
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
|
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. |
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
|
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода |
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.