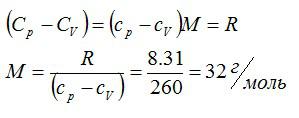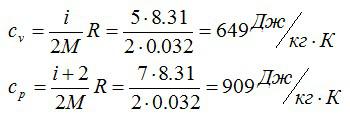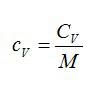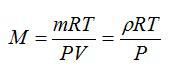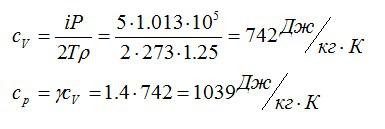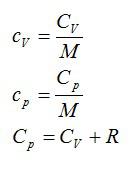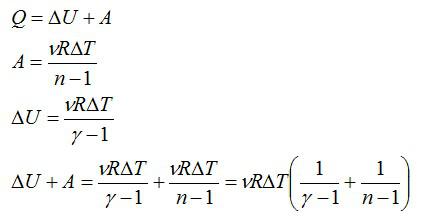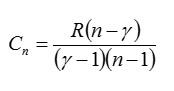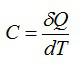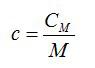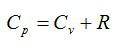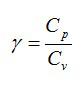Решение задач дело полезное, но не всегда интересное. Чтобы вы справлялись с решением задач по теме «Теплоемкость идеального газа» быстрее, приведем здесь несколько примеров и вопросов с объяснениями.
Подписывайтесь на наш телеграм-канал, чтобы получать полезную и интересную рассылку.
Задачи по теме «Теплоемкость идеального газа» с решениями
Повторение и практика – залог успеха в любом деле. И решение задач не исключение. Поэтому не забываем держать под рукой памятку по задачам и полезные формулы
Задача №1. Определить удельную теплоемкость идеального газа
Условие
Определить молярную массу M двухатомного газа и его удельные теплоемкости, если известно, что разность cр — cv удельных теплоемкостей этого газа равна 260 Дж/(кг*К)
Решение
По определению:
Значит, газ из задачи – кислород. Если кто не понял, как это определяется, учитесь пользоваться таблицей Менделеева.
Считаем удельные теплоемкости:
Ответ: 32 г/моль; 649 Дж/кг*К; 909 Дж/кг*К.
Задача №2. Удельная теплоемкость
Условие
Плотность некоторого газа при нормальных условиях ρ = 1,25 кг/м3. Отношение удельных теплоемкостей γ = 1,4. Определить удельные теплоемкости cv и сp этого газа.
Решение
Исходя из отношения удельных теплоемкостей, можно сделать вывод, что газ – двухатомный, i=5. При постоянном объеме удельная теплоемкость равна:
Молярную массу можно найти из уравнения Клапейрона-Менделеева:
Отсюда:
Ответ: 742 Дж/кг*К; 1039 Дж/кг*К.
Задача №3. Молярная теплоемкость
Условие
Вычислить молярные теплоемкости газа, зная, что его молярная масса М = 4∙10 3 кг/моль и отношение удельных теплоемкостей ср/сv = 1,67.
Решение
Удельные теплоемкости равны:
Можно найти:
Ответ: 12,4 Дж/моль*К; 20,71 Дж/моль*К
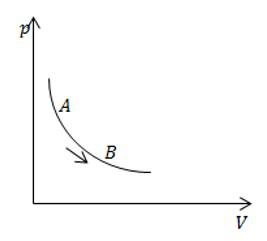
Задача №4. Теплоемкость при изопроцессах
Условие
На рисунке изображен изотермический процесс с газом постоянной массы. Сравните теплоемкость в процессе АВ с теплоемкостью этой же массы газа в изохорном процессе.
Решение
Теплоемкость при изохорном процессе является постоянной величиной. При изотермическом процесса она равна бесконечности. Значит, теплоемкость в процессе АВ больше.
Ответ: Теплоемкость в процессе АВ больше.
Задача №5. Теплоемкость при политропическом процессе
Условие
Найдите молярную теплоемкость идеального газа при политропическом процессе pVn = const, если показатель адиабаты газа равен γ. При каких значениях показателя политропы n теплоемкость газа будет отрицательной?
Решение
Запишем первое начало термодинамики, выражения для работы и изменения внутренней энергии в политропическом процессе соответственно:
Если количество вещества и изменение температуры принять равными единице, это выражение будет равно молярной теплоемкости (по определению теплоемкости):
Ответ: см. выражение выше.
Вопросы по теме «Теплоемкость идеального газа»
Вопрос 1. Что такое теплоемкость идеального газа?
Ответ. Когда газу сообщается определенное количество теплоты, меняется его температура.
Отношение количества теплоты, сообщенного газу, к изменению его температуры, называется теплоемкостью идеального газа.
Вопрос 2. Что такое молярная и удельная теплоемкость идеального газа?
Ответ. Молярная и удельная теплоемкости активно используются в термодинамике. Молярная теплоемкость – это теплоемкость одного моля вещества.
Удельная теплоемкость – теплоемкость единичной массы вещества.
Вопрос 3. Как определяется теплоемкость газа при изопроцессах?
Ответ.
При изотермическом процессе T=const. Теплоемкость равна плюс/минус бесконечности.
При адиабатном процессе нет теплообмена с окружающей средой, теплоемкость равна нулю.
При изохорном процессе газ не совершает работы, а теплоемкость равна:
Здесь i – количество степеней свободы молекул газа. Для одноатомных газов i=3, для двухатомных i=5.
При изобарном процессе теплоемкость определяется соотношением Мейера:
Вопрос 4. Как еще связаны теплоемкости при постоянном давлении и постоянном объеме?
Ответ. Отношение теплоемкостей при постоянном давлении и постоянном объеме обозначается греческой буквой «гамма» и называется показателем адиабаты.
Вопрос 5. Как называются процессы, в которых теплоемкость газа остается неизменной?
Ответ. Такие процессы называются политропными. Адиабатный процесс – частный случай политропного процесса.
Теплоемкость реального газа не равна теплоемкости идеального газа и может сильно отличаться.
Нужна помощь в решении задач и выполнении других заданий? Специальный студенческий сервис готов оказать ее!
8
1й курс. 2й семестр. Лекция
12
Лекция
12.
Теплоёмкость
газа при изопроцессах. Адиабатический
процесс, уравнение Пуассона. Политропический
процесс. Теплоёмкость и работа в
политропических процессах. Газ
Ван-дер-Ваальса. Внутренняя энергия
газа Ван-дер-Ваальса.
Теплоёмкостью тела
называется коэффициент пропорциональности
между изменением его температуры и
количеством подведённой теплоты:
(Дж/К).
Удельной теплоёмкостью
вещества называется теплоёмкость
единицы массы этого вещества:
(Дж/Ккг).
Мольной (молярной)
теплоёмкостью
называется теплоёмкость одного
моля вещества:
(Дж/мольК).
Из размерности теплоёмкости можно
понять, о какой из них идет речь.
Итак, чтобы изменить температуру тела
от начальной ТН до конечной
ТК, ему надо сообщить количество
теплоты
Q
= m CУД
(TК — ТН),
где m – масса вещества,
СУД – удельная
теплоёмкость (Дж/кгК),
TК — ТН
– разность конечной и начальной
температур. Аналогичные формулы и для
обычной и молярной теплоёмкостей:
Q
= CМ
(TК — ТН),
— количество молей вещества, СМ
– молярная теплоёмкость вещества
Замечание: Поскольку в
выражение для количества теплоты входит
разность температур, то температуру
можно брать и в градусах Цельсия, и в
градусах Кельвина. Из формулы видно,
что если температура тела увеличивается,
то количество теплоты считается
положительным, а если уменьшается, то
отрицательным. Поэтому в дальнейшем
будем считать, что теплота, полученная
телом – положительная, а отданная,
наоборот, отрицательная.
Теплоёмкость тела не является постоянной
величиной, а зависит от различных
факторов, в том числе и от условий
протекания термодинамических процессов,
в которых это тело участвует.
Рассмотрим процессы,
в которых один из параметров системы
остаётся постоянным. Такие
процессы принято называть изопроцессами.
1
)
Изохорический (изохорный)
процесс –
процесс изменения состояния газа, при
котором объём газа остаётся постоянным:
V=const.
Для изохорического
процесса:
.
Так как объём газа постоянный, то работа
газа равна нулю: А = 0, следовательно
всё подводимое тепло идет на изменение
внутренней энергии: Q =
U.
Для внутренней энергии идеального газа
получаем:
.
Если обозначим молярную теплоёмкость
газа для изохорического процесса как
CV, то
тогда
Q =
CV
T.
Поэтому первое начало термодинамики
примет вид:
.
Отсюда для изохорной
молярной теплоёмкости
.
Следствие:
.
Ниже в таблице приведены величины
молярных теплоёмкостей при постоянном
объёме (изохорные молярные
теплоёмкости) для различных
газов.
|
Одноатомный |
Двухатомный |
Многоатомный |
|
|
CV |
|
|
|
2
)
Изобарический (изобарный)
процесс —
процесс изменения состояния газа, при
котором давление газа остаётся постоянным:
р = const.
Для изобарного процесса:
.
В этом случае работа газа равна: A
= p (VК
– VН). Первое начало
термодинамики для этого процесса:
.
Из уравнения Менделеева-Клапейрона:
.
Поэтому
.
Если обозначить через CP
— молярную теплоёмкость газа для
изобарического процесса, то
.
Отсюда для молярной
изобарной теплоёмкости:
— это равенство называется соотношением
Майера.
Следовательно,
.
Ниже в таблице приведены величины
молярных теплоёмкостей при постоянном
давлении (изобарные
молярные теплоёмкости) для
различных газов.
|
Одноатомный |
Двухатомный |
Многоатомный |
|
|
CP |
|
|
|
3
)
Изотермический процесс
– процесс изменения состояния газа,
при котором температура газа остаётся
постоянной: T=const.
Для изотермического процесса:
.
Так как температура газа постоянная,
то изменение внутренней энергии равно
нулю:
,
и всё подводимое к газу тепло расходуется
на совершение газом работы: Q
= A .
Работа газа в изотермическом процессе
равна:

Теплоёмкость газа в этом процессе не
определена (говорят, что теплоёмкость
изотермического процесса бесконечно
большая).
4) Адиабатический
(адиабатный) процесс.
Это процесс, происходящий без теплообмена
с окружающей средой: Q=0.
Теплоёмкость адиабатического
процесса равна нулю. Первое начало
термодинамики для адиабатического
процесса: 0 = U
+ A или U
= A — газ совершает
положительную работу за счёт уменьшения
внутренней энергии.
Для малых изменений параметров:
,
,
или
,
откуда
.
Тогда
,
,
.
Разделим последнее уравнение на pV
и тогда с учётом соотношения Майера
()
получим:
,
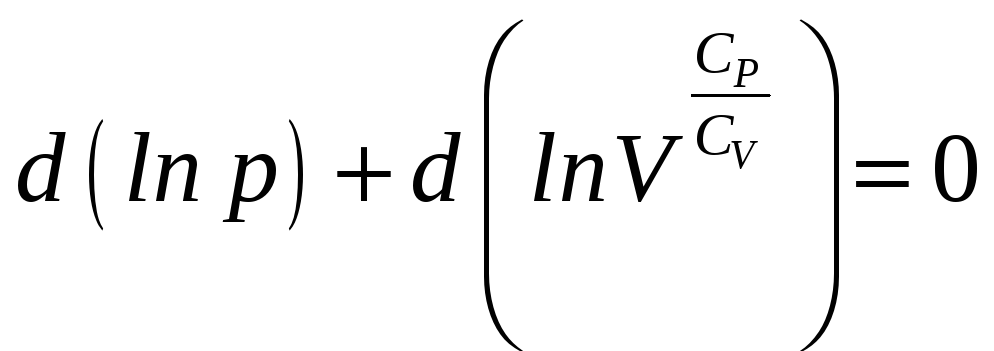

откуда следует уравнение
для адиабатического процесса:
(Уравнение Пуассона).
Коэффициент
называется показателем
адиабаты (или коэффициентом Пуассона).
Для идеального газа
.
|
Одноатомный |
Двухатомный |
Многоатомный |
|
|
|
|
|
|
Следствия
1.Уравнения адиабатического
процесса:
,
с учётом зависимости
получаем это уравнение в координатах
(T,V):
,
а с учётом зависимости
— уравнение в координатах (T,
p):
.
Показатель адиабаты всегда больше
единицы:
.
2. Работа газа при
адиабатическом процессе равна убыли
внутренней энергии:
.
С другой стороны, т.к.
,
то, например,
,
откуда
,
и для работы газа в адиабатическом
процессе получаем выражение:

3. В координатах (p,V)
график адиабаты идёт круче, чем график
изотермы.
Действительно, для изотермического
процесса:
,
— тангенс угла наклона касательной. Для
адиабатического процесса:
,
— тангенс угла наклона касательной. Т.к.
,
то в
точке пересечения графиков адиабата
убывает быстрее, чем изотерма.
Замечания.
1. Скорость звуковых колебаний в газе
определяется соотношением:
.
Звуковые колебания в воздухе можно
считать адиабатическим процессом, для
которого
,
откуда
.
Следовательно,
.
Тогда
и поэтому
.
Для идеального газа из уравнения
Менделеева-Клапейрона:
,
,
.
Для воздуха при нормальных условиях
можно приближённо считать: 1,4.
При Т=300К скорость звука в воздухе v347
м/с.
2. Теплоёмкость, вообще говоря, не является
постоянной величиной, а зависит, например,
от температуры. Для водорода Н2
при Т50К
,
а в диапазоне Т300…400К
,
а при высокой температуре
.
Это говорит о вкладе колебательных
степеней свободы в теплоёмкость
для реального газа.
Политропический процесс
Политропический процесс
– термодинамический процесс, протекающий
при постоянной теплоёмкости:
С=const.
Выведем уравнение для политропического
процесса (аналогично выводу уравнения
Пуассона):
,
,
,
,
.
Показатель политропического процесса
.
Уравнение политропического процесса:
.
Работа при политропическом процессе:6

Частные случаи
политропического процесса.
1) Пусть
.
Тогда n.
Уравнение политропического процесса
можно записать в виде:
,
тогда
— т.е. это изохорический
процесс.
2) Пусть
,
тогда n = 0 и
— изобарический процесс.
3) Пусть С = 0, тогда
и
— адиабатический процесс.
4) Пусть C = ,
тогда n = 1,
— изотермический процесс.
Приближение
Ван-дер-Ваальса
(газ
Ван-дер-Ваальса)
В реальном газе молекулы взаимодействуют
между собой на расстоянии. Это, в
частности, приводит к уменьшению давления
газа. В качестве примера рассмотрим
небольшой сосуд, полностью заполненный
водой при температуре Т= 300 К. Давление
в воде мало отличается от атмосферного.
Предположим, что молекулы воды перестали
взаимодействовать друг с другом, т.е.
вода превратилась в идеальный газ. Так
как плотность газа в сосуде будет равна
плотности воды
= 1000 кг/м3, то давление газа в
сосуде будет равно:
Па, т.е. в 1385 раз больше атмосферного.
Конечно, у реальных газов отличие не
будет таким большим, как у жидкости.
Как показывает основное уравнение МКТ
давление идеального газа пропорционально
кинетической энергии молекул. В реальном
газе молекулы взаимодействуют между
собой. Из-за притяжения между молекулами
кинетическая энергия будет уменьшаться
с увеличением расстояния между молекулами.
Поэтому давление будет уменьшаться
тоже. Для учёта уменьшения давления для
реального газа можно ввести поправку
к давлению идеального газа:
,
откуда
,
где V – объём газа,
— количество моль вещества, a
— некоторый коэффициент.
Идеальный газ состоит из материальных
точек, не имеющих размеров. Поэтому
объём молекул в идеальном газе можно
не учитывать. Объём реального газа,
однако, будет больше на величину
суммарного объёма молекул:
,
откуда
,
b — некоторый
коэффициент.
Рассмотрим уравнение Менделеева-Клапейрона:
и подставим в него указанные величины:

Это уравнение в 1873 г. предложил
Ван-дер-Ваальс для описания
неидеального газа.
Константы a, b
определяются для каждого газа
экспериментально. Газ, для которого
справедливо уравнение Ван-дер-Ваальса,
называется газом Ван-дер-Ваальса.
Перепишем уравнение Ван-дер-Ваальса в
следующем виде:
.
Это кубическое уравнение при Т =
const для заданного давления
p может иметь три
корня – три значения объёма V.
Температура, при которой уравнение
имеет три одинаковых корня, называется
критической. Для определения
критических параметров запишем уравнение
в виде:
.
Затем, раскрывая скобки, получаем:
,
откуда следует система трёх уравнений:
,
,
.
Делим последнее уравнение на второе:
или
.
Из второго уравнения следует:
.
Из первого уравнения:
.
В таблице приведены примерные значения
констант и критических параметров:
|
Газ |
a, |
b, м3/моль |
pкр, |
Vкр, |
Tкр, |
|
He |
0,00346 |
0,0000237 |
2,28105 |
7,1110-5 |
5,20 |
|
Ne |
0,02135 |
0,00001709 |
2,71106 |
5,1310-5 |
44,54 |
|
H2 |
0,02476 |
0,00002661 |
1,30106 |
7,9810-5 |
33,18 |
|
Ar |
0,1363 |
0,00003219 |
4,87106 |
9,6610-5 |
150,97 |
|
N2 |
0,1408 |
0,00003913 |
3,41106 |
1,1710-4 |
128,30 |
|
O2 |
0,1378 |
0,00003183 |
5,04106 |
9,5510-5 |
154,36 |
|
H2O |
0,5536 |
0,00003049 |
2,21107 |
9,1510-5 |
647,39 |
В
ведём
безразмерные переменные:
,
,
.
Подставим в уравнение Ван-дер-Ваальса:
,
,
.
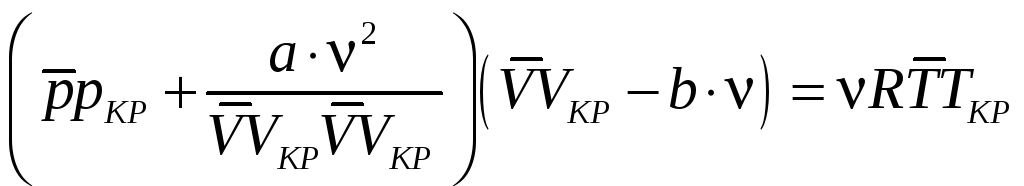

,
и получим уравнение для безразмерных
величин:
.
Полученное уравнение не зависит от
параметров a, b.
Поэтому оно справедливо для всех
газов, которые описываются уравнением
Ван-дер-Ваальса. Его называют приведённым
уравнением Ван-дер-Ваальса.
Из уравнения следует, что любые два
безразмерных параметра также однозначно
определяют третий независимо от свойств
газа даже для газов, не являющихся
идеальными. Такие состояния называются
соответственными. Приведённое
уравнение Ван-дер-Ваальса описывает
закон соответственных состояний.
Нулевая производная
описывается линией
.
Из графика видно, что при Т>ТKP
изотермы газа Ван-дер-Ваальса монотонно
убывают с ростом объёма. При меньших
температурах изотерма имеет участок
возрастания давления с увеличением
объёма газа, чего в реальных газах не
наблюдается.
Отметим ещё одну особенность газа
Ван-дер-Ваальса. Из приведённого уравнения
выражаем давление:
.
Простая арифметика показывает, что
возможны такие положительные
значения параметров
и
при которых давление отрицательно.
Например, при
и любой температуре
:
.
Следовательно, уравнение Ван-дер-Ваальса
применимо не во всем диапазоне изменения
параметров. Опыт показывает, что
уравнение достаточно точно описывает
поведение некоторых реальных газов
вблизи их критической точки. При этом
также качественно точно описываются
фазовые переходы жидкость-газ.
Внутренняя
энергия газа Ван-дер-Ваальса.
Внутренняя энергия неидеального газа
– это сумма кинетической энергии
движения молекул и потенциальной энергии
их взаимодействия:
.
Кинетическая энергия зависит от
температуры. Потенциальная энергия
взаимодействия отрицательная. При
увеличении объёма газа расстояние между
молекулами увеличивается, поэтому
абсолютное значение потенциальной
энергии убывает и в пределе бесконечного
объёма обращается в ноль. Поэтому в этом
случае
.
Для любой адиабатически изолированной
системы изменение внутренней энергии
.
Для идеального газа:
.
Для газа Ван-дер-Ваальса:
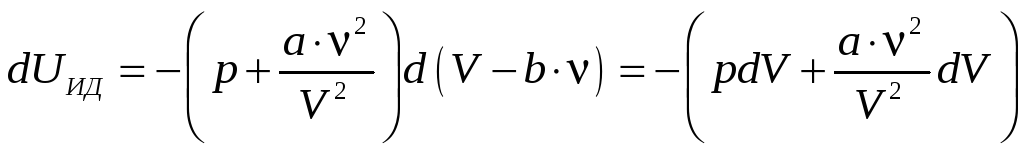
.
Откуда, после интегрирования, получаем:
.
Внутренняя энергия газа Ван-дер-Ваальса
зависит от объёма. Если газ расширяется
при постоянной внутренней энергии
U=const,
то температура газа уменьшается. Это,
в частности происходит в случае, когда
теплоизолированный газ расширяется
без совершения работы против внешних
сил, т.е. при адиабатном расширении в
пустоту. (Этот процесс расширения
необратим). Явление понижения температуры
неидеального газа при адиабатном
расширении в пустоту называется эффектом
Джоуля-Томсона. Оно наблюдается из-за
того, что газ не является идеальным.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
10.02.201533.29 Mб26метрология2.pdf
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Перевод термодинамической системы (например, порции идеального газа) из состояния `1` в состояние `2` можно осуществить разными способами. На рис. 12 показаны графики двух возможных процессов (`1-«а»-2` и `1-«в»-2`), позволяющих осуществить такой перевод. Изменение внутренней энергии системы в том и в другом случае одинаково (оно определяется положениями точек `1` и `2` на -диаграмме), а работа, совершённая системой над окружающими телами, различна (площадь фигур под графиками процессов `1-«а»-2` и `1-«в»-2` разная, площадь под графиком процесса `1-«в»-2` больше).
Следовательно, и количество теплоты, затраченное на перевод системы из состояния `1` в `2` ( $$ Q=Delta U+{A}^{text{‘}}$$ ), будет разным.
Теплоёмкостью $$ C$$ термодинамической системы (тела) называют отношение бесконечно малого количества теплоты $$ Delta Q$$, переданного системе, к изменению $$ Delta T$$ его температуры, вызванного этим количеством теплоты.
$$ C={displaystyle frac{Delta Q}{Delta T}}$$ — теплоёмкость тела (системы).
Единицей измерения этой величины будет $$ left[Cright]={displaystyle frac{1mathrm{Дж}}{mathrm{К}}}$$.
Численное значение теплоёмкости тела показывает, какое количество теплоты потребуется для изменения температуры всего тела на `1` градус по шкале Цельсия (Кельвина).
При расчётах чаще пользуются удельной теплоёмкостью (теплоёмкостью `1` кг вещества).
называют отношение теплоёмкости тела (системы) к массе этого тела (системы):
| $$ {c}_{mathrm{уд}}={displaystyle frac{C}{m}}={displaystyle frac{Delta Q}{m· Delta T}}$$ — удельная теплоёмкость тела (системы). | (1) |
Единицей измерения этой величины будет $$ left[cright]={displaystyle frac{1mathrm{Дж}}{mathrm{кг}·mathrm{К}}}$$.
называют отношение теплоёмкости тела (системы) к количеству вещества в этом теле (системе):
| $$ {c}_{mathrm{мол}}={displaystyle frac{C}{nu }}={displaystyle frac{Delta Q}{ Delta T·nu }}$$ — молярная теплоёмкость тела (системы). | (2) |
Единицей измерения этой величины будет $$ left[{c}_{mathrm{мол}}right]={displaystyle frac{1mathrm{Дж}}{mathrm{моль}·mathrm{К}}}$$.
Получим соотношение между удельной и молярной теплоёмкостями:
| $$ {c}_{mathrm{мол}}={displaystyle frac{Q}{ Delta T·frac{m}{M}}}={displaystyle frac{Q·M}{ Delta T·m}}={c}_{mathrm{уд}}·M$$ — соотношение между молярной и удельной теплоёмкостями | (3) |
Теперь найдём молярную теплоёмкость идеального газа при изобарном и при изохорном процессах.
При изобарном процессе присутствуют и $$ Delta U$$, и $$ {A}^{text{‘}}$$, следовательно:
$$ {c}_{p}={displaystyle frac{Q}{nu · Delta T}}={displaystyle frac{Delta U+Atext{‘}}{nu · Delta T}}={displaystyle frac{Delta U}{nu Delta T}}+{displaystyle frac{Atext{‘}}{nu Delta T}}={displaystyle frac{frac{i}{2}nu R Delta T}{nu Delta T}}+{displaystyle frac{nu R Delta T}{nu Delta T}}={displaystyle frac{iR}{2}}+R=R{displaystyle frac{i+2}{2}}$$,
$${c}_{p}=R{displaystyle frac{i+2}{2}}$$ — молярная теплоёмкость газа при изобарном процессе.
При изохорном процессе работа не совершается, $$ {A}^{text{‘}}=0$$, следовательно:
$$ {c}_{V}={displaystyle frac{Q}{nu Delta T}}={displaystyle frac{Delta U+{A}^{text{‘}}}{nu Delta T}}={displaystyle frac{Delta U}{nu Delta T}}={displaystyle frac{frac{i}{2}nu R Delta T}{nu Delta T}}={displaystyle frac{iR}{2}}$$
$$ {c}_{V}=R{displaystyle frac{i}{2}}$$ — молярная теплоёмкость газа при изохорном процессе.
Соотношение между $$ {c}_{V}$$ и $$ {c}_{р}$$ можно записать в двух формах:
1) $$ {c}_{p}={c}_{V}+R$$ — закон Майера, и
2) $$ gamma ={displaystyle frac{{c}_{p}}{{c}_{V}}}$$ — коэффициент Пуассона.
Т. к. мы уже знаем, чему равно число степеней свободы у разных молекул, то можем вычислить и значения $$ {с}_{р}$$ и $$ gamma $$:
|
формула |
Одноатомные `(i = 3)` |
Двухатомные `(i = 5)` |
|||
| `c_p` |
`R((i+2)/2)` |
`5/2 R` |
`20,775 «Дж»/(«моль»*»К»)` | `7/2 R` | `29,085 «Дж»/(«моль»*»К»)` |
|
`gamma` |
`(i+2)/i` |
`5/3` |
`1,66667` |
`7/5` |
`1,4` |
Воздух представляет собой смесь газов, преимущественно двухатомных азота и кислорода, потому для него эксперименты дают значение $$ gamma approx mathrm{1,4}$$.
Для твёрдых тел теплоёмкости $$ {с}_{р}$$ и $$ {c}_{V}$$ будут почти одинаковыми. Это можно показать следующим образом. По определению $$ C={displaystyle frac{Delta Q}{ Delta T}}$$, но $$ Delta Q= Delta U+pDelta V$$, тогда
$$ {C}_{p}={displaystyle frac{Delta U+pDelta V}{ Delta T}}={displaystyle frac{Delta U}{ Delta T}}+{displaystyle frac{pDelta V}{ Delta T}}={C}_{V}+{displaystyle frac{pDelta V}{ Delta T}}$$.
При нагревании твёрдых или жидких тел изменение объёма составляет около $$ {10}^{-6}$$ первоначального объёма, поэтому вторым слагаемым можно пренебречь по сравнению с первым, что и позволяет говорить о равенстве $$ {c}_{p}={c}_{V}$$.
Для газов $$ frac{ Delta V}{V}$$ на два порядка больше, чем для твёрдых или жидких тел, потому пренебрегать вторым слагаемым нельзя, более того, оно будет составлять заметную долю теплоёмкости $$ {c}_{p}$$.
2018-04-16
Имеется идеальный газ, молярная теплоемкость которого при постоянном объеме равна $C_{V}$. Найти молярную теплоемкость этого газа как функцию его объема $V$, если газ совершает процесс по закону:
а) $T = T_{0}e^{ alpha V}$; б) $p = p_{0}e^{ alpha V}$,
где $T_{0}, p_{0}$ и $alpha$ — постоянные.
Решение:
(a) По первому закону термодинамики
$dQ = dU + dA = nu C_{V}dT + pdV$
Молярная теплоемкость по определению
$C = frac{dQ}{ nu dT } = frac{C_{V} dT + pdV }{ nu dT} = frac{ nu C_{V}dT + frac{ nu RT }{V} dT }{ nu dT} = C_{V} + frac{RT}{V} frac{dV}{dT}$,
Дано $T = T_{0}e^{ alpha V}$
После дифференцирования получаем $dT = alpha T_{0}e^{ alpha V} dV$
Итак, $frac{dV}{dT} = frac{1}{ alpha T_{0}e^{ alpha V} }$,
Следовательно $C = C_{V} + frac{RT}{V } frac{1}{ alpha T_{0}e^{ alpha V} } = C_{V} + frac{RT_{0}e^{ alpha V} }{ alpha VT_{0} e^{ alpha nu} } = C_{V} + frac{R}{ alpha V}$
(б) Из условия $p = p_{0}e^{ alpha V} dV$
$p = frac{RT}{V} = p_{0}e^{ alpha V}$
или, $T = frac{p_{0} }{R} e^{ alpha V} V$
Итак, $C = C_{V} + frac{RT}{V} frac{dV}{dT} = C_{V} + p_{0}e^{ alpha V} frac{R}{p_{0}e^{ alpha V}(1 + alpha V) } = C_{V} + frac{R}{1 + alpha V}$