Определить объем аммиака (NH3) (в л), занимаемый при нормальных условиях 3,4 грамм аммиака (NH3).
Решение задачи
Учитывая, что аммиак (NH3) – бесцветный газ с резким запахом, вычислим объем аммиака (NH3), по формуле перерасчета, устанавливающей связь между объемом и массой газа:
Откуда:
Рассчитаем молярную массу аммиака (NH3):
M (NH3) = 14 + 3 ∙ 1 = 71 (г/моль).
Получаем, что объем аммиака равен:
V (NH3) = 3,4 ∙ 22,4 / 17 = 4,48 (л).
Ответ:
oбъем аммиака 4,48 литра.
Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
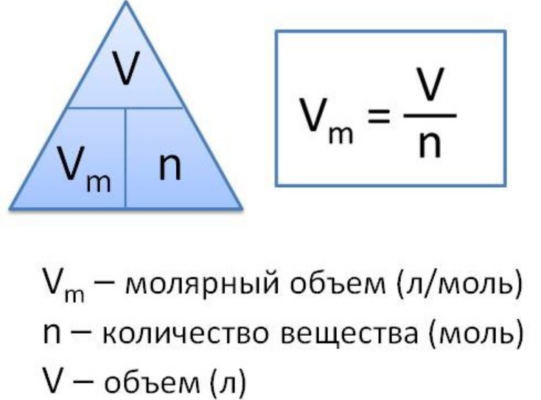
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
А какая ваша оценка?
NH3-аммиак
m=n*M, где m- масса, n- количество вещества, M- молярная масса (см. таблицу Менделеева)
V=n*Vm, где V- объём, n- количество вещества, Vm- молярный объём (всегда равен 22,4 л/моль)
m=0,5 моль*(14+1*3) г/моль=8,5г
V=0,5 моль* 22,4 л/моль=11,2л
Ответ: 8,5г, 11,2л
Объем газа в молях это отношение объёма вещества к его количеству, численно равен объёму одного моля вещества.
Значение «молярный объём» иногда применяют к простым веществам, а также химическим соединениям и смесям. В общем случае он зависит от температуры, давления и агрегатного состояния вещества.
Формула расчета объема газа в газах Vm = RT/P где где R — универсальная газовая постоянная, T — термодинамическая температура, P — давление.
Объем, занимаемый молем азота N2
Одной из самых важных закономерностей, наблюдаемых в поведении газов, является постоянство объема, занимаемого молем газа.
Изучение этого вопроса с сопоставления размеров газообразных частиц со средним расстоянием между ними при нормальных условиях температуры и давления.
Молекулярная формула азота — N2; молекула азота двухатомна. Следовательно, 1 моль N2 содержит 2 моля атомов азота. 1 моль N2 весит 28,0 г.
При достаточно низкой температуре (ниже —210° С) азот представляет собой твердое вещество с плотностью 1,03 г/см3. Объем, занимаемый 1 молем твердого вещества, называется молярным объемом:
VN2, тв = (28,0 г/моль)/(1,03г/см3) = 27,2 см3/моль
Если нагреть твердое вещество до —210 ° С, то оно расплавится и образуется жидкий азот. Плотность этой жидкости равна 0,81 г/см3. Таким образом, объем 1 моля жидкого азота определяется следующим образом:
VN2, ж = (28,0 г/моль)/(0,81г/см3)= 34,6 см3/моль
Если повышать температуру и дальше, то жидкость испаряется и образуется газ, заполняющий сосуд.
От чего зависит плотность газа
Плотность газа зависит от объема сосуда и температуры. Для удобства сравнения предположим, что 1 моль газообразного азота заполняет сосуд такого объема, что в нем создается давление 1 атм, если сосуд помещен в баню со льдом при 0° С.
В этом случае плотность газа составляет лишь 0,00125 г/см3. Это означает, что молярный объем газообразного азота при 0° С и 1 атм будет равен
VN2. г = (28,0 г/моль)/(0,00125 г/см3) = 22,4 • 103см3/моль = 22.4 л/моль
Объем этого газа почти в 1000 раз больше объема того же количества твердого вещества. Опыты с другими газами приводят к тем же результатам.
Если принять, что размер отдельных молекул твердого вещества и газа одинаков, то в газообразном состоянии молекулы должны быть удалены друг от друга.
Свободное пространство между молекулами газа примерно в 1000 раз превышает объем, занимаемый молекулами твердого вещества.
Сопоставление молярных объемов газов
Объем 22,4 л, вычисленный выше, нам уже встречался. В табл. 1 указано, что произведение давления и объема 32,0 г кислорода при 0° С равно 22,4. (Заметим, что 32,0 г — вес 1 моля O2). Мы можем использовать выражение
PV = 22,4((л•атм)/(моль)) (при 0°С)
для определения объема 1 моля О2 при давлении 1 атм:
1 атм • V = 22,4((л•атм)/(моль))
V = 22,4((л•атм)/(моль))
V = 22,4 л/моль
Получм тот же объем, что и для 1 моля азота при 0° С и давлении 1 атм. Такой же объем занимают 17,0 г аммиака при 0°С и давлении 1 атм.
Аммиак имеет молекулярную формулу NH3; следовательно, его молекулярный вес равен (14,0 + 3•1,0) = 17,0 г. Таким образом, 1 моль аммиака (17,0 г) тоже занимает объем 22,4 л при 0° С и давлении 1 атм.
Опыты с многими другими газами приводят к аналогичному выводу:
1 моль газа занимает объем 22,4 л при 0°С и давлении 1 атм (1)
Что произойдет с газом, если температура изменится? Ответ дают экспериментальные данные. В табл.1 приведены результаты измерений для газообразного аммиака при 25° С (т. е. при комнатной температуре).
Хотя эти данные содержат некоторую экспериментальную ошибку, вновь обнаруживается закономерность PV = const.
Давление и объем 17,0 г газообразного аммиака NH3 при 25°С
Таблица1
| Давление Р, атм | Объем V, л | PV |
| 0,200 | 123 | 24,6 |
| 0,400 | 60.0 | 24,0 |
| 0,600 | 43,0 | 25,8 |
| 0,800 | 29,3 | 23,4 |
| 1,00 | 25,7 | 25,7 |
| 1,50 | 15,9 | 23,9 |
| 2,00 | 12,1 | 24,2 |
| Среднее 24,5 ± 0,7 |
Однако на этот раз произведение объема и давления для 1 моля аммиака равно 24,5±0,7. Мы можем сравнить эту величину с результатом, полученным ранее:
Для 1 моля аммиака при 0°С PV = 22,4 л • атм (2)
Для 1 моля аммиака при 25° С PV = 24,5 л•атм (3)
Зависимость молярного объема от температуры
Уравнение (3) показывает, что молярный объем аммиака при 25° С и давлении 1 атм равен 24,5 л, а при 0° С — 22,4 л. Следовательно, молярный объем аммиака зависит от температуры.
Это не является неожиданным: любой газ, если его нагревать при постоянном давлении, расширяется.
Поэтому когда мы сравниваем молярные объемы различных газов, они должны быть измерены при одинаковой температуре (и по той же причине при одинаковом давлении).
Опыты с газами
Рассмотрим следующий опыт. Колбу емкостью 1 л, из которой откачан воздух, взвешивают. Затем колбу заполняют газом при 25° С и давлении 1 атм и снова взвешивают. Разность двух весов дает вес 1 л газа.
По этим данным мы можем вычислить объем 1 моля этого газа. В табл. 2 приведены результаты расчета. Мы видим, что все газы имеют приблизительно одинаковый молярный объем при 25° С и 1 атм.
Любой газ — О2, N2, СО или СО2, занимающий объем 24,5 ± 0,2 л, содержит 6,02•10м молекул (при 25° С и 1 атм). Объем 22,4±0,1 л N2, СО или какого-либо другого газа содержит 6,02 • 10м молекул при 0° С и 1 атм.
Закон Авогадро
Если сравнивать различные газы при одинаковых температуре и давлении, то легко показать, что они имеют одинаковый молярный объем.
Это наблюдается не только при 0° С и 1 атм, но, что еще более важно, и при других температурах и давлениях.
Таблица 2
Объем 1 моля газа при температуре 0°С и давлении 1 атм
|
Газ |
Вес пустой колбы W1, г | Вес колбы с газом W2, г | Вес 1 л газа W2,—W1,. г |
Молекулярный вес MW. г |
Объем MW/(W2 — W2)A |
| Кислород О2 | 157,35 | 158,66 | 1,31 | 32,0 | 24,5 |
| Азот N2 | 157,35 | 158,50 | 1,15 | 28,0 | 24,3 |
| Окись углерода СО | 157,35 | 158,50 | 1,15 | 28,0 | 24,4 |
| Двуокись углерода CO2 | 157,35 | 159,16 | 1.81 | 44,0 | 24,3 |
Когда реагируют два газа, например аммиак NH3 и хлористый водород НСl, то 1 л аммиака реагирует с 1 л хлористого водорода, если объемы обоих газов измерены при одинаковых температуре и давлении Это простое отношение объемов (1 : 1) наблюдается не только при 0°С и 1 атм, но, что еще более важно, и при других температурах и давлениях.
Эти и другие подобные результаты привели к тому, что Авогадро выдвинул свою знаменитую гипотезу. По этой гипотезе, равные объемы газов содержат одинаковое число молекул (при одинаковых температуре и давлении).
Следовательно, молекулярный вес газа можно определить сравнением веса известного объема газа с весом такого же объема другого газа с известным молекулярным весом. Какими будут величины Р и t, не имеет значения, поскольку они одинаковы для обоих газов.
Гипотеза Авогадро
Гипотезу Авогадро часто называют законом Авогадро, так как она нашла очень широкое применение. Это одна из наиболее важных закономерностей в химии.
Она важна не потому, что дает точные результаты, а вследствие применимости ко всем газам независимо от размера их молекул. Молекулы различных газов имеют различные размеры и несколько отличаются по силе притяжения друг к другу.
В связи с этим в данном объеме различных газов содержится неодинаковое число молекул. Такие отклонения невелики (обычно меньше 1 %) и не снижают значения гипотезы Авогадро как метода определения молекулярного веса газа.
Интересно отметить, что эта важнейшая закономерность, теперь часто называемая законом, в течение полувека с момента выдвижения не была признана.
Авогадро предложил свою гипотезу в 1811 г., но только в 1858 г. на Международном конгрессе химиков в Карлсруэ (Германия) она получила всеобщее признание.
В настоящее время мы можем привести множество примеров, доказывающих справедливость этой гипотезы, так как в нашем распоряжении имеются многочисленные количественные данные об отношениях весов и объемов газов.
Наоборот, в начале XIX в. не были известны точные атомные веса и не были окончательно разработаны.
Практическое занятие по теме объем газа в молях
Сколько молекул азота содержится в 1 л газа при 0° С и давлении 1 атм?
а) Вычислите объем (в миллилитрах), занимаемый одной молекулой азота в твердой фазе.
б) Зная, что 1 мл = 1,00 см3, определите размер (в сантиметрах) кубика объемом, рассчитанным в пункте (а). Используйте одну значащую цифру, Выразите ответ в ангстремах (1 Å = 10-8 см).
Дано:
m (NH₃) = 450 г.
Найти:
V (NH₃) — ?
Решение:
1. Найдём количество вещества аммиака. По формуле:
‣ n = m ÷ M; где: n — количество вещества (моль), m — масса (г), M — молярная масса (г/моль).
n (NH₃) = 450 г ÷ 17 г/моль ≈ 26,47 (моль).
2. Найдём объём аммиака. По формуле:
‣ V = n · Vm; где: V — объём (л), n — количество вещества (моль), Vm — молярный объём газов при н.у., постоянная величина, равная 22,4 (л/моль).
V (NH₃) = 26,47 моль · 22,4 л/моль = 593 (л).
Ответ: 593 л.