Данный онлайн калькулятор рассчитывает молярный объем идеального газа в зависимости от условий (разных значений температуры и давления). Формулы и перечисление некоторых часто используемых значений для описания физических условий можно найти под калькулятором.
Молярный объем газа
Точность вычисления
Знаков после запятой: 3
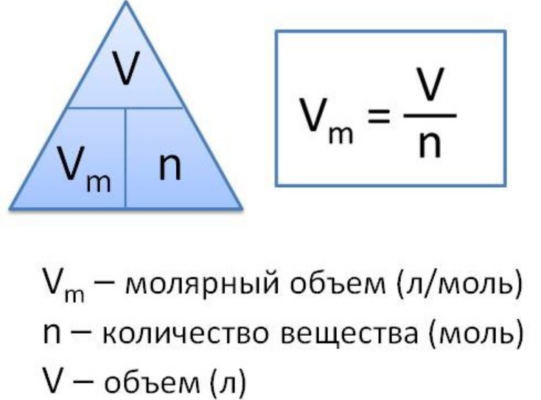
Калькулятор использует уравнение молярного объема идеального газа:
Уравнение идеального газа является достаточно близкой аппроксимацией для многих реальных газов. Для заданных температуры и давления, молярный объем для всех идеальных газов один и тот же, и известен с точностью совпадающей с точностью универсальной газовой постоянной: R = 0.082 057 338(47) Л атм K−1 моль−1, то есть относительная стандартная неопределенность молярного объема равна 5.7×10−7, в соответствии с рекомендацией CODATA от 20141
Так как молярный объем одинаков для всех газов, он может быть вычислен независимо от газа по температуре и давлению (физическим условиям). Например, для стандартных условий по версии НИСТ (стандартной температуре 273.15 K и стандартному давлению 101.325 kPa), молярный объем идеального газа равен 22.413962×10-3 м3 моль-1 со стандартной неопределенностью 0.000013 x 10-3 м3 моль-12
Собственно, слова стандартные условия или нормальные условия (что не одно и тоже) для давления и температуры — это отсылка к «справочным», известным значениям температуры и давления, применяющимся для вычисления значений других физических величин, зависящих от давления и температуры.
Для удобства значения молярного объема для некоторых общеупотребимых физических условий приведены в таблице ниже.
| Физические условия | Температура | Давление | Молярный объем, литры |
|---|---|---|---|
| Стандартные условия (НИСТ) | 0C (273.15K) | 101.325кПа (1атм) | 22.414 |
| Стандартные условия (ИЮПАК) | 0C (273.15K) | 100.000кПа (1бар) | 22.711 |
| Нормальные условия (некоторые ГОСТы, НИСТ) | 20C (293.15K) | 101.325кПа (1атм) | 24.055 |
Разные отрасли и организации, могут использовать свои значения температуры и давления для расчетов. Используя калькулятор, мы можете ввести нужные вам значения температуры и давления и получить молярный объем газа.
Обратите внимание, что для больших значений (сотни атмосфер и тысячи градусов) поведение реальных газов отличается от поведения идеальных газов (собственно, поэтому они и не «идеальные») и использовать уравнение, приведенное выше, нельзя.
Здравствуйте! У меня возник вопрос. В анализируемой литературе молярный объём газа указывается как 22,41383 л. Оно и понятно, что это было доказано давным давно великими учёными. Но вот загвоздка в том, что этот объём получается, как Вы знаете, только при нормальных условиях (0 С, 760 мм. рт.ст.). Соответственно при изменении температуры он будет другим. А вот каким именно, практически нигде нету. Я интересовался у некоторых учёных по этому поводу, они говорили мне, чтоб я искал истину в законе Менделеева-Клапейрона, Гея-Люссака и т.д. Но так как я не специалист в химмии и физике, то так толком и не смог разобраться в этом вопросе.
Вот в связи с этим у меня к Вам вопрос: «Не могли бы Вы помочь в определении молярного объёма газов при изменением температуры при неизменном давлении?»
В частности мне необходимо рассчитать как измениться этот объём при температурах -35, -25, -15, -10, -5, +5, +10, +15, +20, +25 градусов Цельсия для газов окись углерода (CO), гексан (С6H14) и двуокись азота (NO2). Или хотя бы показать подход, для решения этой задачи.
Надеюсь что откликнуться люди компитентные в этом вопросе, которым не составит труда мне помочь. Заранее спасибо!
С Уважением Евгений.
Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 502.
А какая ваша оценка?
Молярный объём
Vm
— это отношение объёма данной порции вещества к его количеству.
Численно молярный объём равен объёму (1) моль вещества.
Обрати внимание!
Молярный объём любого газа при нормальных условиях (давлении (101,3) кПа и температуре (0) °С) равен (22,4) дм³/моль.
Вычисление объёма газа по его количеству
Преобразуем формулу молярного объёма — выразим из неё
V
:
— объём газа равен произведению его количества на молярный объём.
Пример:
вычисли объём (н. у.) метана количеством (1,5) моль.
дм³.
Вычисление количества газа по его объёму
Выразим из формулы молярного объёма
n
:
— количество газа можно вычислить, если его объём разделить на молярный объём.
Пример:
вычисли количество водорода, соответствующее при н. у. его объёму (11,2) дм³.
моль.
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Идеальный газ − математическая модель газа, в которой предполагается, что потенциальной энергией молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Модель широко применяется для решения задач термодинамики газов и задач аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точной модели, например модели газа Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Необходимо найти молярный объем данного газа V при заданных значениях давления Pитемпературы T.
Состояние реального газа может быть описано уравнением Ван-дер-Ваальса:
где:
R – универсальная газовая постоянная,
T – температура газа,
Pc – критическое давление,
Tc – критическая температура,
V – молярный объем газа.
Величины критических параметров Pcи Tc отдельных газов приведены в следующей таблице:
|
Газ |
метан |
этан |
пропан |
i-бутан |
|
190,55 |
305,43 |
369,82 |
425,16 |
|
|
4,695 |
4,976 |
4,333 |
3,719 |
|
|
Газ |
i—пентан |
n—гексан |
n—пентан |
n—бутан |
|
460,39 |
507,35 |
469,65 |
408,13 |
|
|
3,448 |
3,072 |
3,435 |
3,871 |
Таблица 1. Величины критических параметров Pcи Tc отдельных газов
Решим задачу методом касательных (Ньютона) и найдем молярный объем газа Vдля метана.
|
Газ |
Метан |
|
Т, К |
305 |
|
Р, МПа |
2,200 |
|
190,55 |
|
|
4,695 |
Таблица 2. Параметры метана
Запишем исходное уравнение в виде:
Заменим на и представим последнее равенство в виде функции:
С помощью пакета Mathcad построим график функции и отделим корень (см. рис. 1).
Рис.1 – Графическое отделение корней
Следовательно, искомый корень находится на интервале [1075;1110].
Убедимся, что данный интервал является интервалом изоляции искомого корня, т.е. для него выполняется два условия:
1. На концах интервала функция принимает значения разных знаков.
2. Первая производная сохраняет свой знак на интервале (см. рис.2).
Рис.2 – Графическое отделение корней
Найдем корень уравнения с помощью встроенной функции root.
Рис.3 – Нахождение корня уравнения
Подтвердим найденный корень методом касательных (Ньютона) до точности и определим число разделений, записав алгоритм в программе PascalABC.
Рис.4 – Нахождение корня в программе Pascal
|
ε |
Корень ξ , f(ξ) |
Количество разбиений |
|
0,000000000001 |
1105.09013991945 -4.54747350886464∙10-13 |
13 |
Таблица 3 – Найденный корень и значение функции
Исследуем зависимость точности нахождения корня ξ от числа разбиений.
|
№ |
ε |
Корень ξ , f(ξ) |
Количество разбиений |
|
1 |
0,001 |
1105.09013303187 -1.39789399327128∙10—5 |
6 |
|
2 |
0,000001 |
1105.09013987773 -8.468441592413∙10—8 |
8 |
|
3 |
0,0000001 |
1105.0901399162 -6.5915628510993∙10—9 |
9 |
|
4 |
0,000000001 |
1105.09013991943 -4.00177668780088∙10—11 |
11 |
Таблица 4 – Зависимость числа разбиений от точности нахождения корня
Таким образом, решение, найденное при помощи пакета Mathcad, совпадает с решением алгоритма записанного в программе PascalABC.
Действительно при подставлении заданных параметров и найденного объема Vуравнение Ван-дер-Ваальса обращается в верное тождество.
При заданных значениях давления P = 2,2 МПа и температуры T = 305 К молярный объем данного газа V = 1105 л/моль.
Список литературы
1. Любитов Ю. Н., Идеальный газ, Физическая энциклопедия, Гл. ред. А. М. Прохоров. – М.: Советская энциклопедия, 1990. – Т. 2. – С. 98. – 704 с.
2. Любитов Ю. Н., Ван-дер-Ваальса уравнение, Физическая энциклопедия, Гл. ред. А. М. Прохоров. – М.: Советская энциклопедия, 1988. – Т. 1. – С. 240. – 704 с.
3. Бахвалов Н. С., Жидков Н. П., Кобельков Г. Г., Численные методы. – 8-е изд. – М.: Лаборатория Базовых Знаний, 2000.
4. Акулич И. Л., Математическое программирование в примерах и задачах: Учеб. пособие для студентов эконом. спец. вузов. – М.: Высшая школа, 1986. – 319 с.