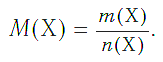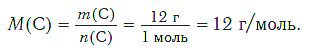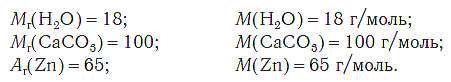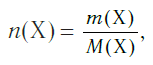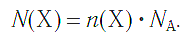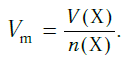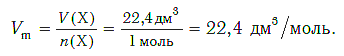Молярный объем

4.2
Средняя оценка: 4.2
Всего получено оценок: 261.
4.2
Средняя оценка: 4.2
Всего получено оценок: 261.
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
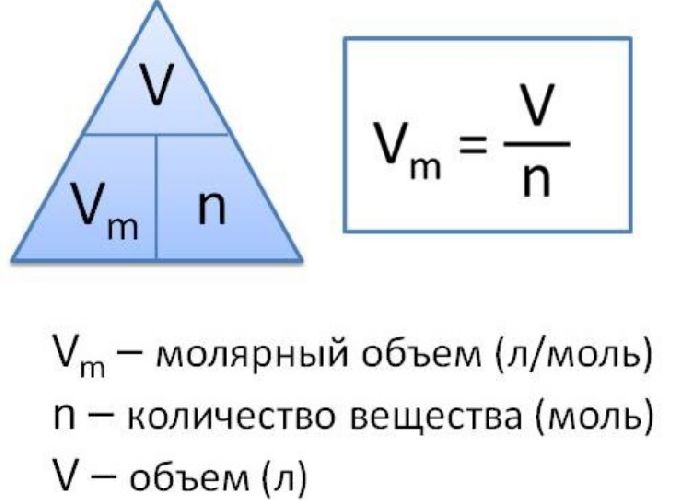
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
Vm=M/p,
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
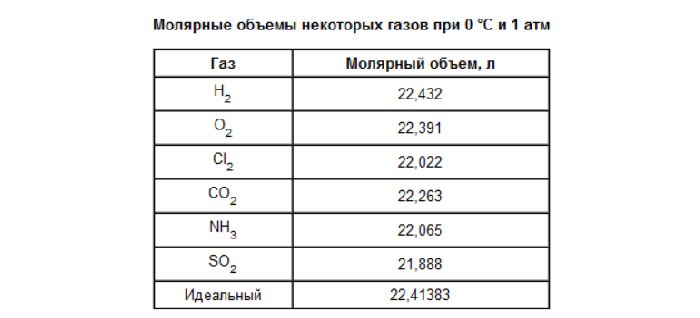
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
P*V=n*R*T,
где R – универсальная газовая постоянная, R=8.314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого.
Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Александр Котков
10/10
-
Артак Саркисян
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 261.
А какая ваша оценка?
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
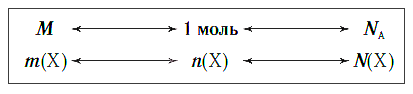
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Таблица молярных объёмов химических элементов.
Молярный объём – отношение объёма вещества к его количеству при определенной температуре и давлении.
Молярный объём имеет обозначение Vm.
Молярный объём численно равен объёму одного моля вещества.
Молярный объём в Международной системе единиц (СИ) измеряется в кубических метрах на моль, русское обозначение: м3/моль; международное: m3/mol.
Термин «молярный объём» может быть применён к простым веществам, химическим соединениям и смесям.
Молярный объём зависит от температуры, давления и агрегатного состояния вещества.
Молярный объём вещества вычисляется по формуле:
Vm = V/n = M/ρ,
где
V – объем вещества,
n – количество вещества,
M – молярная масса,
ρ – плотность вещества.
Таблица молярных объёмов химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Молярный объём, см3/моль |
| 1 | Водород | H | 11,21 |
| 2 | Гелий | He | 22,42354 |
| 3 | Литий | Li | 12,97383 |
| 4 | Бериллий | Be | 4,8767 |
| 5 | Бор | B | 4,3947 |
| 6 | Углерод | C | 5,314469 – графит,
3,42 – алмаз |
| 7 | Азот | N | 11,196 |
| 8 | Кислород | O | 11,196 |
| 9 | Фтор | F | 11,202 |
| 10 | Неон | Ne | 22,42 |
| 11 | Натрий | Na | 23,74976 |
| 12 | Магний | Mg | 13,984 |
| 13 | Алюминий | Al | 9,993 |
| 14 | Кремний | Si | 12,05386 |
| 15 | Фосфор | P | 16,99054 |
| 16 | Сера | S | 16,35969 |
| 17 | Хлор | Cl | 11,0308 |
| 18 | Аргон | Ar | 22,392 |
| 19 | Калий | K | 45,675584 |
| 20 | Кальций | Ca | 25,85677 |
| 21 | Скандий | Sc | 15,060606 |
| 22 | Титан | Ti | 10,62059 |
| 23 | Ванадий | V | 8,3373977 |
| 24 | Хром | Cr | 7,282 |
| 25 | Марганец | Mn | 7,35449 |
| 26 | Железо | Fe | 7,0923 |
| 27 | Кобальт | Co | 6,6217 |
| 28 | Никель | Ni | 6,58884 |
| 29 | Медь | Cu | 7,12399 |
| 30 | Цинк | Zn | 9,16092 |
Таблица молярных объёмов химических элементов (2 часть):
| 31 | Галлий | Ga | 11,80945 |
| 32 | Германий | Ge | 13,6464 |
| 33 | Мышьяк | As | 13,082 |
| 34 | Селен | Se | 16,3851 |
| 35 | Бром | Br | 25,610256 |
| 36 | Криптон | Kr | 22,34613 |
| 37 | Рубидий | Rb | 55,78838 |
| 38 | Стронций | Sr | 33,315589 |
| 39 | Иттрий | Y | 19,88 |
| 40 | Цирконий | Zr | 14,01075 |
| 41 | Ниобий | Nb | 10,84 |
| 42 | Молибден | Mo | 9,33 |
| 43 | Технеций | Tc | 8,5217 |
| 44 | Рутений | Ru | 8,17057 |
| 45 | Родий | Rh | 8,2655 |
| 46 | Палладий | Pd | 8,851 |
| 47 | Серебро | Ag | 10,282955 |
| 48 | Кадмий | Cd | 12,995 |
| 49 | Индий | In | 15,7 |
| 50 | Олово | Sn | 16,239398 |
| 51 | Сурьма | Sb | 18,181275 |
| 52 | Теллур | Te | 20,4487 |
| 53 | Йод | I | 25,689 |
| 54 | Ксенон | Xe | 22,253 |
| 55 | Цезий | Cs | 70,732 |
| 56 | Барий | Ba | 39,1245 |
| 57 | Лантан | La | 22,6 |
| 58 | Церий | Ce | 20,9472 |
| 59 | Празеодим | Pr | 21,221 |
| 60 | Неодим | Nd | 20,5763 |
Таблица молярных объёмов химических элементов (3 часть):
| 61 | Прометий | Pm | 19,961 |
| 62 | Самарий | Sm | 20,4487964 |
| 63 | Европий | Eu | 28,978642 |
| 64 | Гадолиний | Gd | 19,9 |
| 65 | Тербий | Tb | 19,3363 |
| 66 | Диспрозий | Dy | 19,0 |
| 67 | Гольмий | Ho | 18,7527 |
| 68 | Эрбий | Er | 18,449 |
| 69 | Тулий | Tm | 18,124 |
| 70 | Иттербий | Yb | 26,33789 |
| 71 | Лютеций | Lu | 17,77939 |
| 72 | Гафний | Hf | 13,41 |
| 73 | Тантал | Ta | 10,86774 |
| 74 | Вольфрам | W | 9,55 |
| 75 | Рений | Re | 8,858563 |
| 76 | Осмий | Os | 8,42 |
| 77 | Иридий | Ir | 8,52 |
| 78 | Платина | Pt | 9,249786 |
| 79 | Золото | Au | 10,2 |
| 80 | Ртуть | Hg | 14,821 |
| 81 | Таллий | Tl | 17,247535 |
| 82 | Свинец | Pb | 18,2716 |
| 83 | Висмут | Bi | 21,3681 |
| 84 | Полоний | Po | 22,727272 |
| 85 | Астат | At | 32,94 − предположительно |
| 86 | Радон | Rn | 22,816 |
| 87 | Франций | Fr | нет данных |
| 88 | Радий | Ra | 45,2 |
| 89 | Актиний | Ac | 22,5422 |
| 90 | Торий | Th | 19,791717 |
Таблица молярных объёмов химических элементов (4 часть):
| 91 | Протактиний | Pa | 15,03 |
| 92 | Уран | U | 12,4949559 |
| 93 | Нептуний | Np | 11,5892 |
| 94 | Плутоний | Pu | 12,313 |
| 95 | Америций | Am | 17,77615 |
| 96 | Кюрий | Cm | 18,28275 |
| 97 | Берклий | Bk | 16,71 |
| 98 | Калифорний | Cf | 16,62 |
| 99 | Эйнштейний | Es | нет данных |
| 100 | Фермий | Fm | нет данных |
| 101 | Менделевий | Md | нет данных |
| 102 | Нобелий | No | нет данных |
| 103 | Лоуренсий | Lr | нет данных |
| 104 | Резерфордий (Курчатовий) | Rf | нет данных |
| 105 | Дубний (Нильсборий) | Db | нет данных |
| 106 | Сиборгий | Sg | нет данных |
| 107 | Борий | Bh | нет данных |
| 108 | Хассий | Hs | нет данных |
| 109 | Мейтнерий | Mt | нет данных |
| 110 | Дармштадтий | Ds | нет данных |
Источник: https://www.schoolmykids.com
Коэффициент востребованности
3 870
Моля́рный объём Vm — объём одного моля вещества (простого вещества, химического соединения или смеси) при данной температуре и давлении; величина, получающаяся от деления молярной массы M вещества на его плотность ρ: таким образом, Vm = M/ρ. Молярный объём характеризует плотность упаковки молекул в данном веществе. Для простых веществ иногда используется термин атомный объём[1].
В Международной системе единиц (СИ) единицей измерения молярного объёма является кубический метр на моль (русское обозначение: м3/моль; международное: m3/mol).
Содержание
- 1 Молярный объём смеси
- 2 Стандартный молярный объём
- 3 Молярный объём кристаллов
- 4 Значения молярного объёма химических элементов
- 5 См. также
- 6 Примечания
Молярный объём смеси
Молярный объём смеси веществ, имеющей плотность ρc и содержащей N компонентов с массовыми долями xi и молярными массами Mi, равен
Стандартный молярный объём
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (T = 273,15 K, P = 101 325 Па) имеет один и тот же объём Vm = RT/P= 22,413962(13) л/моль[2], называемый молярным объёмом идеального газа (здесь T — абсолютная температура, P — давление, R — универсальная газовая постоянная).
Молярный объём кристаллов
Объём Vя элементарной ячейки кристалла можно вычислить из параметров кристаллической структуры, которые определяются с помощью рентгеноструктурного анализа. Объём ячейки связан с молярным объёмом следующим образом:
- Vm = VяNA/Z,
где Z — количество формульных единиц в элементарной ячейке.
Значения молярного объёма химических элементов
Ниже приведены значения молярного (атомного) объёма простых веществ в см3/моль (10−6 м3/моль, 10−3 л/моль) при нормальных условиях либо (для элементов, газообразных при н.у.) при температуре конденсации и нормальном давлении.
| Группа | I A (1) | II A (2) | III B (3) | IV B (4) | V B (5) | VI B (6) | VII B (7) | VIII B (8) | VIII B (9) | VIII B (10) | I B (11) | II B (12) | III A (13) | IV A (14) | V A (15) | VI A (16) | VII A (17) | VIII A (18) |
| Период | ||||||||||||||||||
| 1 | H 14,0 |
He 31,8 |
||||||||||||||||
| 2 | Li 13,1 |
Be 5 |
B 4,6 |
C 5,3 |
N 17,3 |
O 14 |
F 17,1 |
Ne 16,8 |
||||||||||
| 3 | Na 23,7 |
Mg 14 |
Al 10 |
Si 12,1 |
P 17 |
S 15,5 |
Cl 18,7 |
Ar 24,2 |
||||||||||
| 4 | K 45,3 |
Ca 29,9 |
Sc 15 |
Ti 10,6 |
V 8,35 |
Cr 7,23 |
Mn 7,39 |
Fe 7,1 |
Co 6,7 |
Ni 6,6 |
Cu 7,1 |
Zn 9,2 |
Ga 11,8 |
Ge 13,6 |
As 13,1 |
Se 16,5 |
Br 23,5 |
Kr 32,2 |
| 5 | Rb 55,9 |
Sr 33,7 |
Y 19,8 |
Zr 14,1 |
Nb 10,8 |
Mo 9,4 |
Tc 8,5 |
Ru 8,3 |
Rh 8,3 |
Pd 8,9 |
Ag 10,3 |
Cd 13,1 |
In 15,7 |
Sn 16,3 |
Sb 18,4 |
Te 20,5 |
I 25,7 |
Xe 42,9 |
| 6 | Cs 70 |
Ba 39 |
* | Hf 13,6 |
Ta 10,9 |
W 9,53 |
Re 8,85 |
Os 8,43 |
Ir 8,54 |
Pt 9,1 |
Au 10,2 |
Hg 14,8 |
Tl 17,2 |
Pb 18,3 |
Bi 21,3 |
Po 22,7 |
At н/д |
Rn н/д |
| 7 | Fr н/д |
Ra 45 |
** | Rf н/д |
Db н/д |
Sg н/д |
Bh н/д |
Hs н/д |
Mt н/д |
Ds н/д |
Rg н/д |
Cn н/д |
Uut н/д |
Fl н/д |
Uup н/д |
Lv н/д |
Ts н/д |
Og н/д |
| Лантаноиды | * | La 22,5 |
Ce 21 |
Pr 20,8 |
Nd 20,6 |
Pm 19,96 |
Sm 19,9 |
Eu 28,9 |
Gd 19,9 |
Tb 19,2 |
Dy 19 |
Ho 18,7 |
Er 18,4 |
Tm 18,1 |
Yb 24,8 |
Lu 17,8 |
||
| Актиноиды | ** | Ac 22,54 |
Th 19,8 |
Pa 15 |
U 12,5 |
Np 21,1 |
Pu 12,12 |
Am 20,8 |
Cm 18,28 |
Bk н/д |
Cf н/д |
Es н/д |
Fm н/д |
Md н/д |
No н/д |
Lr н/д |
||
См. также
- Число Авогадро
- Удельный объём
- Молярная масса
- Молярная теплоёмкость
Примечания
- ↑ Следует отметить, что для молекулярных кристаллов простых веществ молярный объём, определяемый через 1 моль молекул, не равен атомному объёму, поскольку количество атомов не равно количеству молекул. В этих случаях необходимо уточнять, относится ли указанная величина к молекулярному или к атомному молярному объёму. Так, атомный молярный объём иода (кристаллы, состоящие из двухатомных молекул I2) вдвое меньше молекулярного молярного объёма.
- ↑ CODATA Value: molar volume of ideal gas (273.15 K, 101.325 kPa)