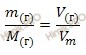Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
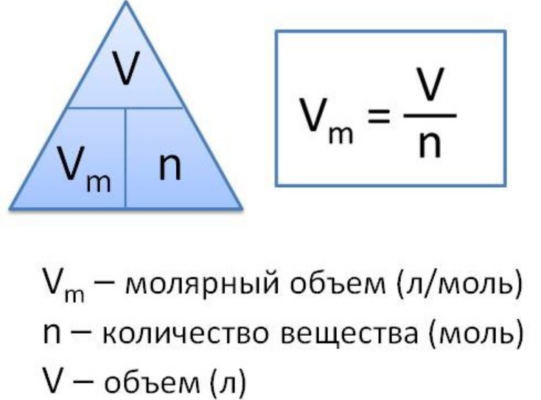
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
А какая ваша оценка?
Известно, что масса углекислого газа (CO2) 35 грамм. Определите объём углекислого газа (CO2).
Решение задачи
Так как, углекислый газ (CO2) – газообразное вещество, то для нахождения объема углекислого газа (CO2) массой 35 г будем использовать формулу перерасчета, которая устанавливает связь между массой и объемом газа:
Откуда выразим объем произвольной массы газа:
Учитывая, что молярная масса углекислого газа (CO2) равна:
M (CO2) = 12 + 2 ∙ 16 = 44 (г/моль)
Рассчитаем объем углекислого газа (CO2):
Ответ:
объем углекислого газа равен 17,82 литра.
Рассчитать объем углекислого газа.
Рассчитать объем углекислого газа при нормальных условиях, если известна его масса, можно по формуле: V = m · Vm / M = ν · Vm. Рассчитать объем углекислого газа, если известна его масса, температура и давление, можно по формуле: V = m · R · T / (p · M) = ν · R · T / p.
Химическая формула углекислого газа CO₂.
Расчет объема воздуха (газа)
Теория расчета объема газа
Пример: Рассчитайте объем для 1 кг углекислого газа
Рассчитать объем газа: азота, водорода, гелия, кислорода, углекислого газа, хлора
Рассчитать объем углекислого газа при нормальных условиях:
Рассчитать объем углекислого газа:
Теория:
Рассчитать объем углекислого газа при нормальных условиях, если известна его масса, можно по формуле:
V = m · Vm / M = ν · Vm,
где
V – объем газа, л,
ν – количество вещества, моль,
Vm – молярный объем газа, л/моль, Vm = 22,4 л/моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(СО₂) = 12 + 2·16 = 44 г/моль,
Нормальные условия: 0 оС (или 273,15 К), 101,325 кПа или 1 атм.
Рассчитать объем углекислого газа, если известна его масса, температура и давление, можно по формуле:
V = m · R · T / (p · M) = ν · R · T / p,
где
V – объем газа, л,
ν – количество вещества, моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(СО₂) = 12 + 2·16 = 44 г/моль,
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура, К.
P – давление, кПа.
Пример: Рассчитайте объем для 1 кг углекислого газа:
Рассчитайте объем для 1 кг углекислого газа при нормальных условиях.
V = m · Vm / M = 1 000 грамм · 22,4 л/моль / 44 г/моль = 509,090 литров.
Рассчитайте объем для 1 кг углекислого газа при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 1 000 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 44 г/моль) = 1 909,385 литров или 1,909385 м3.
Рассчитать объем газа: азота, водорода, гелия, кислорода, углекислого газа, хлора
Коэффициент востребованности
1 583
Молярный объем и молярная масса газов. Закон Авогадро
Закон Авогадро.
Любой газ количеством вещества 1 моль при нормальных условиях занимает объем приблизительно 22,4 л.
Нормальными условиями (н.у.) принято считать температуру 0˚ при давлении 760 мм рт.ст.
Пояснение:
Если возьмем 1 моль нескольких газов, то они будут иметь одинаковый объем.
К примеру, определим объем газов H2, O2 и CO2.
Объем вычисляется по формуле
m
V = ——
ρ
где m – масса, ρ («ро») – плотность.
С помощью таблицы Менделеева определяем массу наших газов:
H2 = 2 г
O2 = 32 г
CO2 = 44 г
Теперь по таблице плотностей находим плотность газов:
ρ(H2) = 0,089 г/л
ρ(O2) = 1,429 г/л
ρ(CO2) = 1,96 г/л
Осталось произвести вычисления:
2 г
V(H2) = ————— ≈ 22,4 л
0,089 г/л
32 г
V(O2) = ————— ≈ 22,4 л
1,429 г/л
44 г
V(CO2) = ————— ≈ 22,4 л
1,96 г/л
Как видим, объем одного моля разных газов имеет одинаковую величину, равную ≈ 22,4 л.
Молярный объем газа.
Молярный объем газа – это отношение объема газа к количеству вещества:
V
Vm = —
ν
где Vm – молярный объем, V – объем, ν («ню») – количество вещества.
Следовательно:
22,4 л
Vm = ——— = 22,4 л/моль
1 моль
Пример: Вычислим объем (н.у) водорода, который можно получить при взаимодействии 12 г магния с избытком соляной кислоты.
Итак:
Дано: m(Mg) = 12 г
Найти: V(H2)
Решение:
1) Сначала найдем количество вещества магния. Для этого применим формулу соотношения количества вещества, его массы и молярной массы:
m
v = ——
M
где v («ню») – количество вещества, m – масса, M – молярная масса вещества.
Выясним по Периодической таблице молярную массу магния (24 г/моль) и воспользуемся приведенной формулой:
m(Mg) 12 г
v(Mg) = ———— = ———— = 0,5 моль
M(Mg) 24 г/моль
Мы выяснили, что 12 г магния составляют 0,5 моль.
2) Пишем уравнение реакции
0,5 моль x моль
Mg + 2HCl = MgCl2 + H2↑
1 моль 1 моль
На основании этого уравнения находим соотношение количества вещества Mg2 и H2 и находим количество вещества водорода. Для этого составляем пропорцию и решаем ее:
0,5 моль x моль
———— = ————
1 моль 1 моль
Определяем значение x:
0,5 моль · 1 моль
x = ———————— = 0,5 моль.
1 моль
3) Осталось найти объем водорода:
V(H2) = Vm · ν = 22,4 л/моль · 0,5 моль = 11,2 л.
Ответ: V(H2) = 11,2 л.
Молярная масса газа.
Молярная масса газа равна произведению молярного объема на плотность:
M = Vm · ρ
Другая формула молярной массы (если известна относительная плотность газа и молярная масса другого газа, с которым сравнивается молярная масса исследуемого газа):
M1 = D · M2
где M1 – исследуемый газ, M2 – сравниваемый газ, D – относительная плотность (см.раздел «Относительная плотность газов»).
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Данный онлайн калькулятор рассчитывает молярный объем идеального газа в зависимости от условий (разных значений температуры и давления). Формулы и перечисление некоторых часто используемых значений для описания физических условий можно найти под калькулятором.
Молярный объем газа
Точность вычисления
Знаков после запятой: 3
Калькулятор использует уравнение молярного объема идеального газа:
Уравнение идеального газа является достаточно близкой аппроксимацией для многих реальных газов. Для заданных температуры и давления, молярный объем для всех идеальных газов один и тот же, и известен с точностью совпадающей с точностью универсальной газовой постоянной: R = 0.082 057 338(47) Л атм K−1 моль−1, то есть относительная стандартная неопределенность молярного объема равна 5.7×10−7, в соответствии с рекомендацией CODATA от 20141
Так как молярный объем одинаков для всех газов, он может быть вычислен независимо от газа по температуре и давлению (физическим условиям). Например, для стандартных условий по версии НИСТ (стандартной температуре 273.15 K и стандартному давлению 101.325 kPa), молярный объем идеального газа равен 22.413962×10-3 м3 моль-1 со стандартной неопределенностью 0.000013 x 10-3 м3 моль-12
Собственно, слова стандартные условия или нормальные условия (что не одно и тоже) для давления и температуры — это отсылка к «справочным», известным значениям температуры и давления, применяющимся для вычисления значений других физических величин, зависящих от давления и температуры.
Для удобства значения молярного объема для некоторых общеупотребимых физических условий приведены в таблице ниже.
| Физические условия | Температура | Давление | Молярный объем, литры |
|---|---|---|---|
| Стандартные условия (НИСТ) | 0C (273.15K) | 101.325кПа (1атм) | 22.414 |
| Стандартные условия (ИЮПАК) | 0C (273.15K) | 100.000кПа (1бар) | 22.711 |
| Нормальные условия (некоторые ГОСТы, НИСТ) | 20C (293.15K) | 101.325кПа (1атм) | 24.055 |
Разные отрасли и организации, могут использовать свои значения температуры и давления для расчетов. Используя калькулятор, мы можете ввести нужные вам значения температуры и давления и получить молярный объем газа.
Обратите внимание, что для больших значений (сотни атмосфер и тысячи градусов) поведение реальных газов отличается от поведения идеальных газов (собственно, поэтому они и не «идеальные») и использовать уравнение, приведенное выше, нельзя.