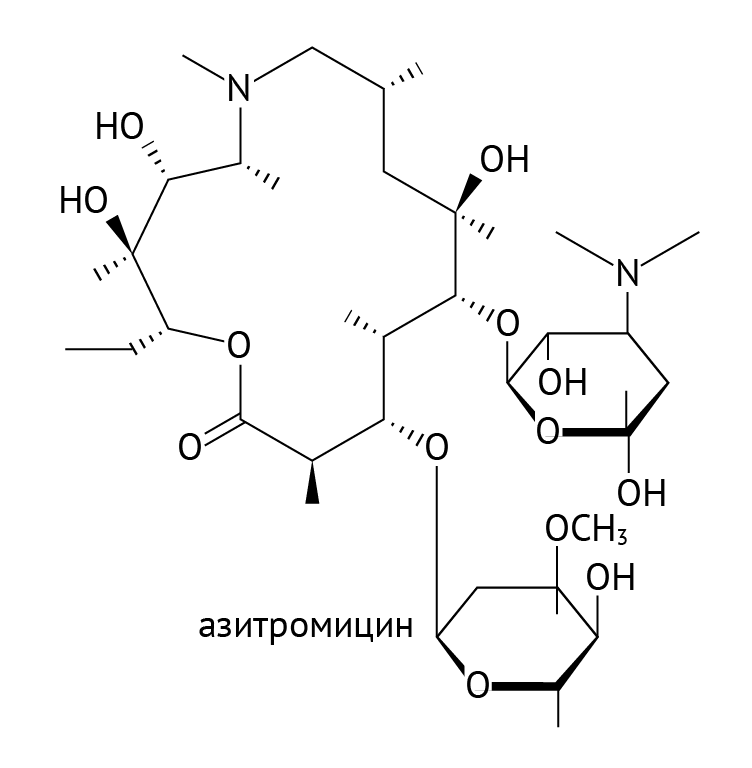
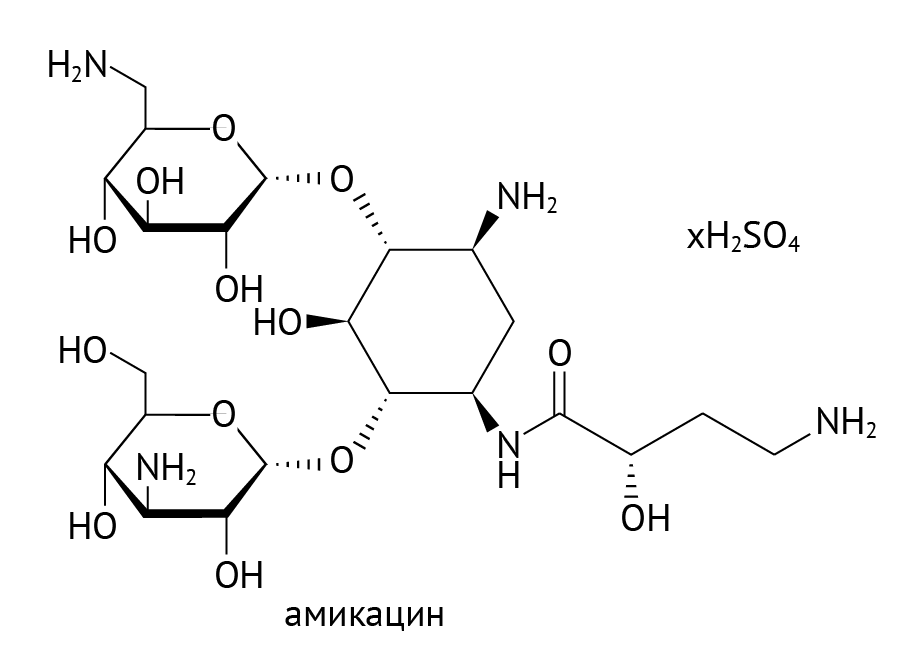
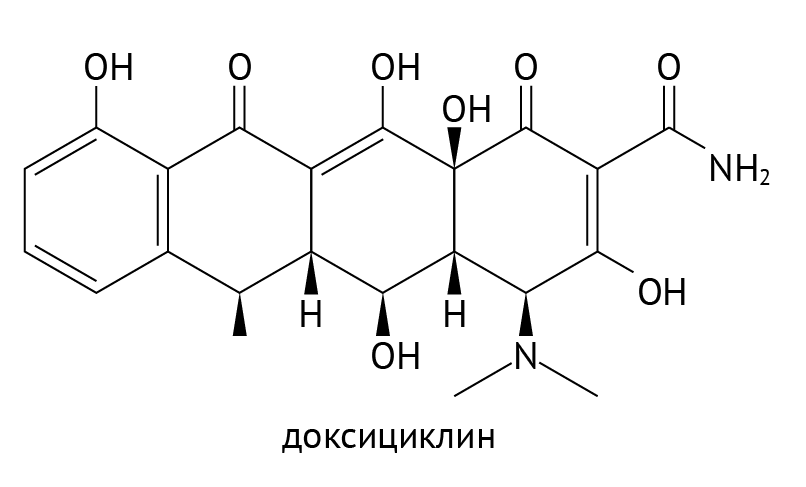
Как транскрибировать ДНК в мРНК
Автор:
Louise Ward
Дата создания:
11 Февраль 2021
Дата обновления:
24 Май 2023
Содержание
- Что такое гены
- Как транскрибировать ДНК в мРНК
Генетическим материалом большинства организмов является ДНК, в которой хранится информация, необходимая для развития, функционирования и воспроизводства организма. ДНК представляет собой длинный фрагмент нуклеотидов, где в нуклеотидной последовательности могут быть идентифицированы как кодирующие, так и некодирующие области. Области кодирования содержат информацию для производства функциональных белков в организмах. Процесс производства полипептидной цепи белка внутри клетки известен как синтез белка. Транскрипция ДНК в мРНК и трансляция мРНК в аминокислотную последовательность белка являются последовательными этапами синтеза белка.
Ключевые области покрыты
1. Что такое гены
— определение, особенности, роль
2. Как транскрибировать ДНК в мРНК
— Процесс транскрипции
Ключевые слова: ДНК, гены, мРНК, синтез белка, транскрипция, трансляция.
Что такое гены
Гены представляют собой фрагменты ДНК, которые содержат кодирующие белок области в геноме конкретного организма. Белок-кодирующая область и регуляторная область являются двумя сегментами гена. Кодирующая белок область эукариотических генов содержит интроны и экзоны. Регуляторная последовательность гена содержит нуклеотидные последовательности, такие как промотор, энхансер и сайленсер, которые отвечают за регуляцию экспрессии гена. Гены включены в хромосомы, как показано на Рисунок 1.
Рисунок 1: Джин
Полный набор генов определенного вида наследуется организмом во время размножения. Альтернативные формы гена известны как аллели. Различные аллели дают фенотипические изменения организмам в определенной популяции.
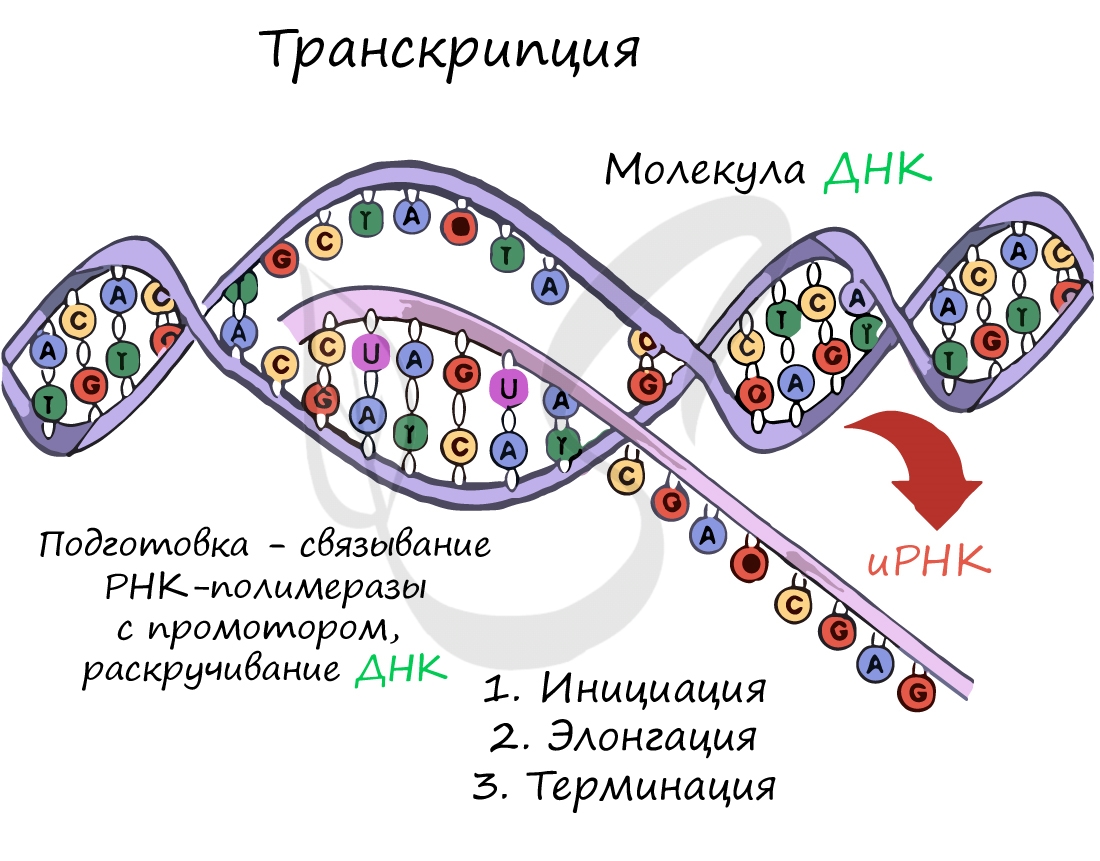
Как транскрибировать ДНК в мРНК
Синтез белка — это процесс производства полипептидной цепи функционального белка на основе информации, хранящейся в гене. Двумя этапами синтеза белка являются транскрипция и трансляция. Транскрипция является первым этапом синтеза белка; здесь молекула мРНК производится на основе информации, закодированной в соответствующем гене.
РНК-полимераза — это фермент, участвующий в транскрипции. Транскрипция инициируется связыванием РНК-полимеразы с промотором гена. Это связывание облегчается транскрипционными факторами как у прокариот, так и у эукариот. Шесть транскрипционных факторов, связанных с РНК-полимеразой у эукариот, представляют собой TFIIA, TFIIB, TFIID, TFIIE, TFIIF и TFIIH. Связывание РНК-полимеразы с двойной спиралью ДНК образует пузырь транскрипции, РНК-полимераза считывает антисмысловую цепь ДНК в направлении от 3 до 5. Транскрипционный пузырь состоит приблизительно из 14 оснований намотанного двухцепочечного промотора. Затем к антисмысловой цепи добавляются нуклеотиды комплементарной РНК с сайта инициации транскрипции с 5′-3′-направления. Добавление нуклеотидов останавливается в месте терминации транскрипции. К концу 3′-конца фермент также добавляет хвост полиаденилата. Процесс транскрипции показан на фигура 2.
Рисунок 2: Транскрипция
Первичный транскрипт, синтезируемый РНК-полимеразой, известен как пре-мРНК. Пре-мРНК эукариот состоит из интронов, которые должны отщепляться во время сплайсинга РНК в посттрансляционных модификациях. Альтернативный сплайсинг эукариотической пре-мРНК продуцирует несколько белков из одного гена. Как правило, эукариотические гены организованы в генные кластеры, известные как оперонов, Гены в определенном опероне отвечают за определенную функцию в клетке, такую как метаболизм. Эти опероны транскрибируются одновременно и продуцируют несколько белков из одной молекулы мРНК.
Заключение
Синтез белка — это процесс производства белков на основе информации, закодированной в гене. Транскрипция является первым этапом синтеза белка. Во время транскрипции белок-кодирующая область гена транскрибируется в молекулу мРНК, которая в конечном итоге подвергается трансляции для синтеза полипептидной цепи.
Ссылка:
1. Вентерс, Б. Дж. И Б. Ф. Пью. «Как транскрибируются гены эукариот».Критические обзоры в области биохимии и молекулярной биологии.Национальная медицинская библиотека США, июнь 2009 г.,
И транскрипция, и трансляция относятся к матричным биосинтезам. Матричным биосинтезом называется синтез
биополимеров (нуклеиновых кислот, белков) на матрице — нуклеиновой кислоте ДНК или РНК. Процессы матричного биосинтеза относятся к пластическому обмену: клетка расходует энергию АТФ.
Матричный синтез можно представить как создание копии исходной информации на несколько другом или новом
«генетическом языке». Скоро вы все поймете — мы научимся достраивать по одной цепи ДНК другую, переводить РНК в ДНК
и наоборот, синтезировать белок с иРНК на рибосоме. В данной статье вас ждут подробные примеры решения задач, генетический словарик пригодится — перерисуйте его себе 

Возьмем 3 абстрактных нуклеотида ДНК (триплет) — АТЦ. На иРНК этим нуклеотидам будут соответствовать — УАГ (кодон иРНК).
тРНК, комплементарная иРНК, будет иметь запись — АУЦ (антикодон тРНК). Три нуклеотида в зависимости от своего расположения
будут называться по-разному: триплет, кодон и антикодон. Обратите на это особое внимание.
Репликация ДНК — удвоение, дупликация (лат. replicatio — возобновление, лат. duplicatio — удвоение)
Процесс синтеза дочерней молекулы ДНК по матрице родительской ДНК. Нуклеотиды достраивает фермент ДНК-полимераза по
принципу комплементарности. Переводя действия данного фермента на наш язык, он следует следующему правилу: А (аденин) переводит в Т (тимин), Г (гуанин) — в Ц (цитозин).
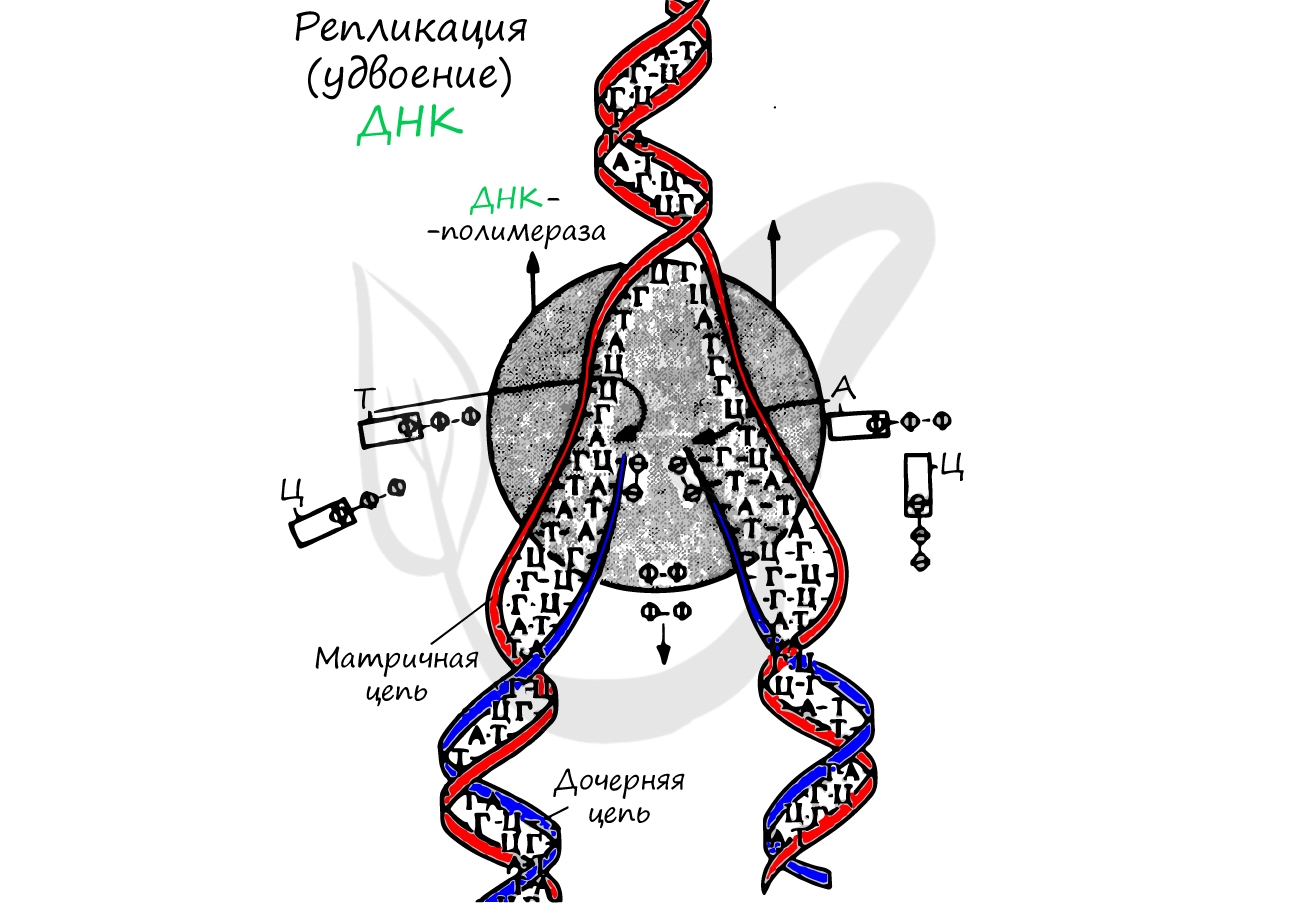
Удвоение ДНК происходит в синтетическом периоде интерфазы. При этом общее число хромосом не меняется, однако каждая из них
содержит к началу деления две молекулы ДНК: это необходимо для равномерного распределения генетического материала между
дочерними клетками.
Транскрипция (лат. transcriptio — переписывание)
Транскрипция представляет собой синтез информационной РНК (иРНК) по матрице ДНК. Несомненно, транскрипция происходит
в соответствии с принципом комплементарности азотистых оснований: А — У, Т — А, Г — Ц, Ц — Г (загляните в «генетический словарик»
выше).
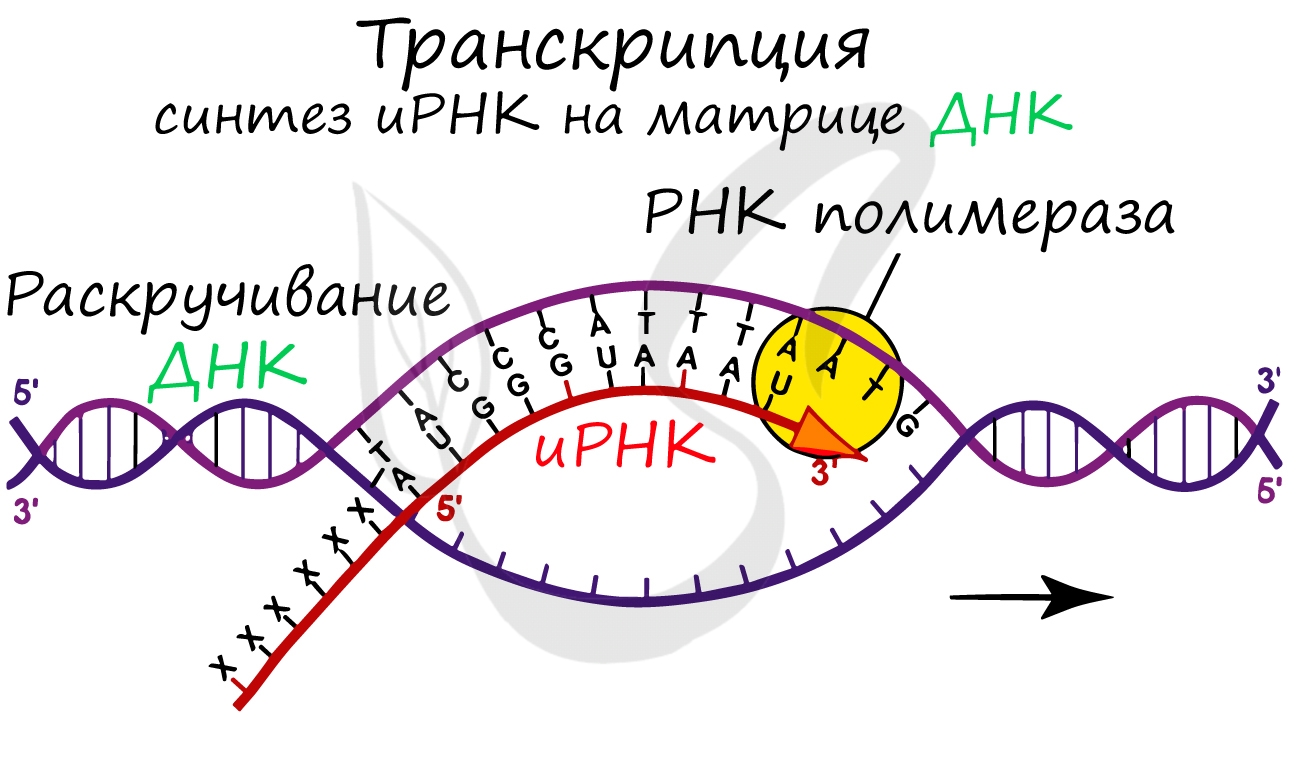
До начала непосредственно транскрипции происходит подготовительный этап: фермент РНК-полимераза узнает особый участок молекулы ДНК — промотор и связывается с ним. После связывания с промотором происходит раскручивание молекулы ДНК, состоящей из двух
цепей: транскрибируемой и смысловой. В процессе транскрипции принимает участие только транскрибируемая цепь ДНК.
Транскрипция осуществляется в несколько этапов:
- Инициация (лат. injicere — вызывать)
- Элонгация (лат. elongare — удлинять)
- Терминация (лат. terminalis — заключительный)
Образуется несколько начальных кодонов иРНК.
Нити ДНК последовательно расплетаются, освобождая место для передвигающейся РНК-полимеразы. Молекула иРНК
быстро растет.
Достигая особого участка цепи ДНК — терминатора, РНК-полимераза получает сигнал к прекращению синтеза иРНК. Транскрипция завершается. Синтезированная иРНК направляется из ядра в цитоплазму.
Трансляция (от лат. translatio — перенос, перемещение)
Куда же отправляется новосинтезированная иРНК в процессе транскрипции? На следующую ступень — в процесс трансляции.
Он заключается в синтезе белка на рибосоме по матрице иРНК. Последовательность кодонов иРНК переводится в последовательность
аминокислот.
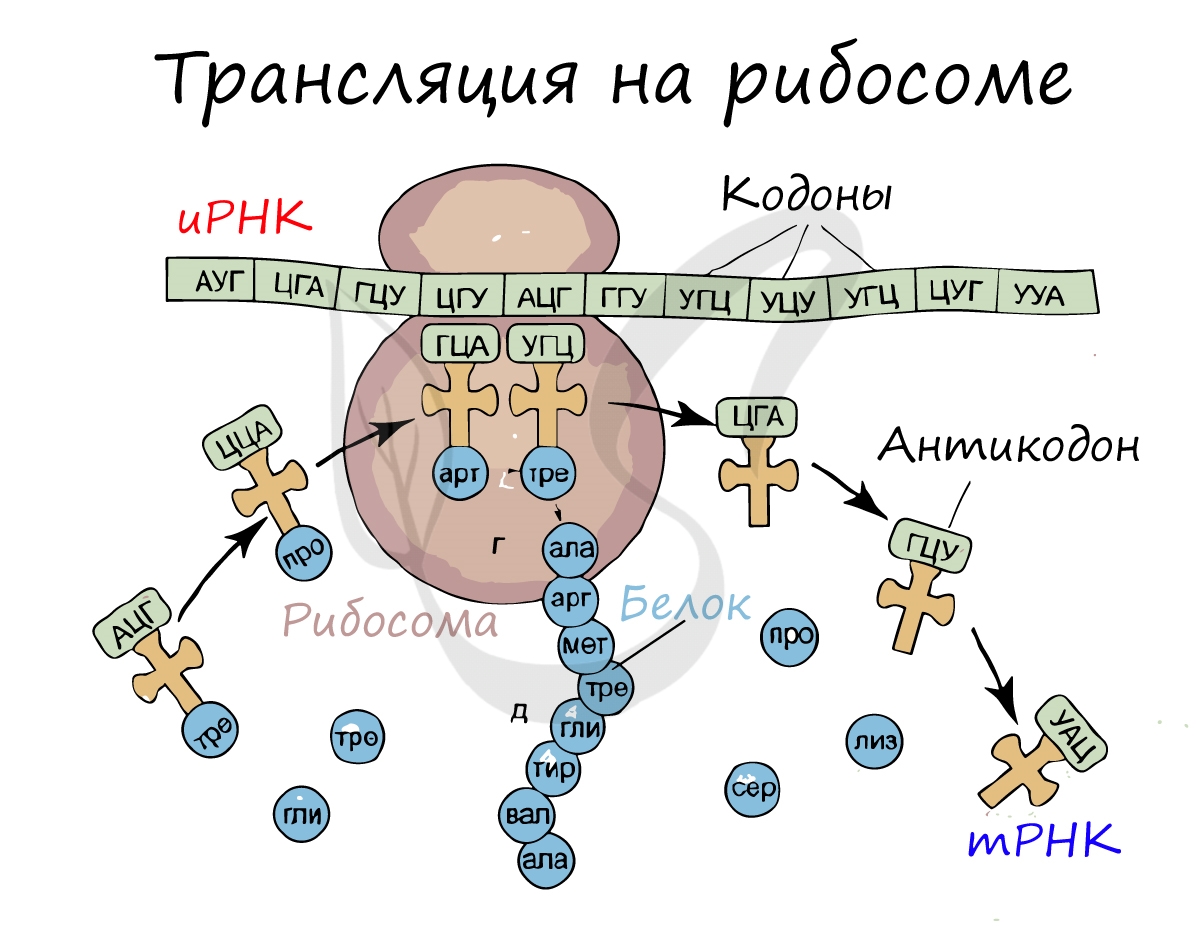
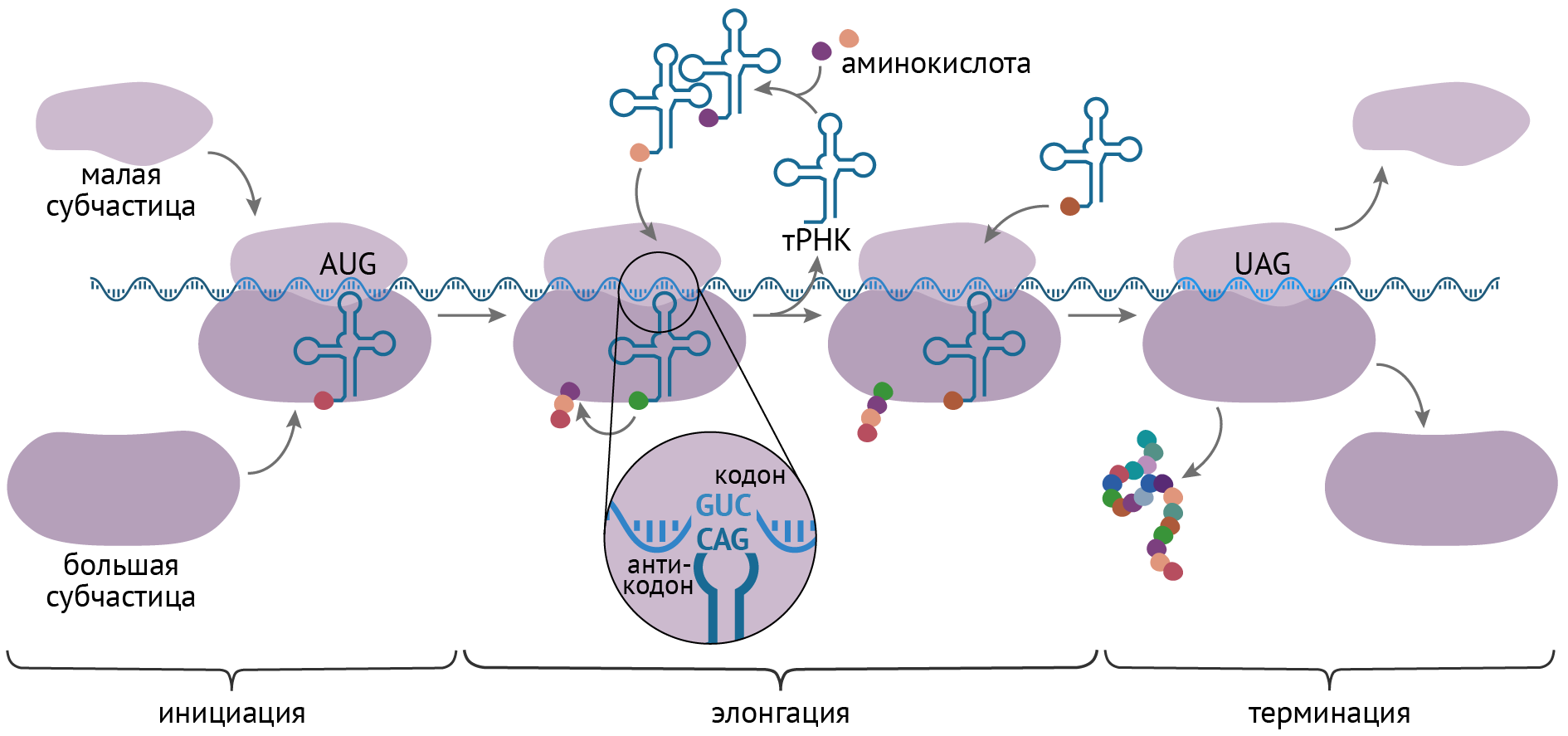
Перед процессом трансляции происходит подготовительный этап, на котором аминокислоты присоединяются к соответствующим молекулам тРНК. Трансляцию можно разделить на несколько стадий:
- Инициация
- Элонгация
- Терминация
Информационная РНК (иРНК, синоним — мРНК (матричная РНК)) присоединяется к рибосоме, состоящей из двух субъединиц.
Замечу, что вне процесса трансляции субъединицы рибосом находятся в разобранном состоянии.
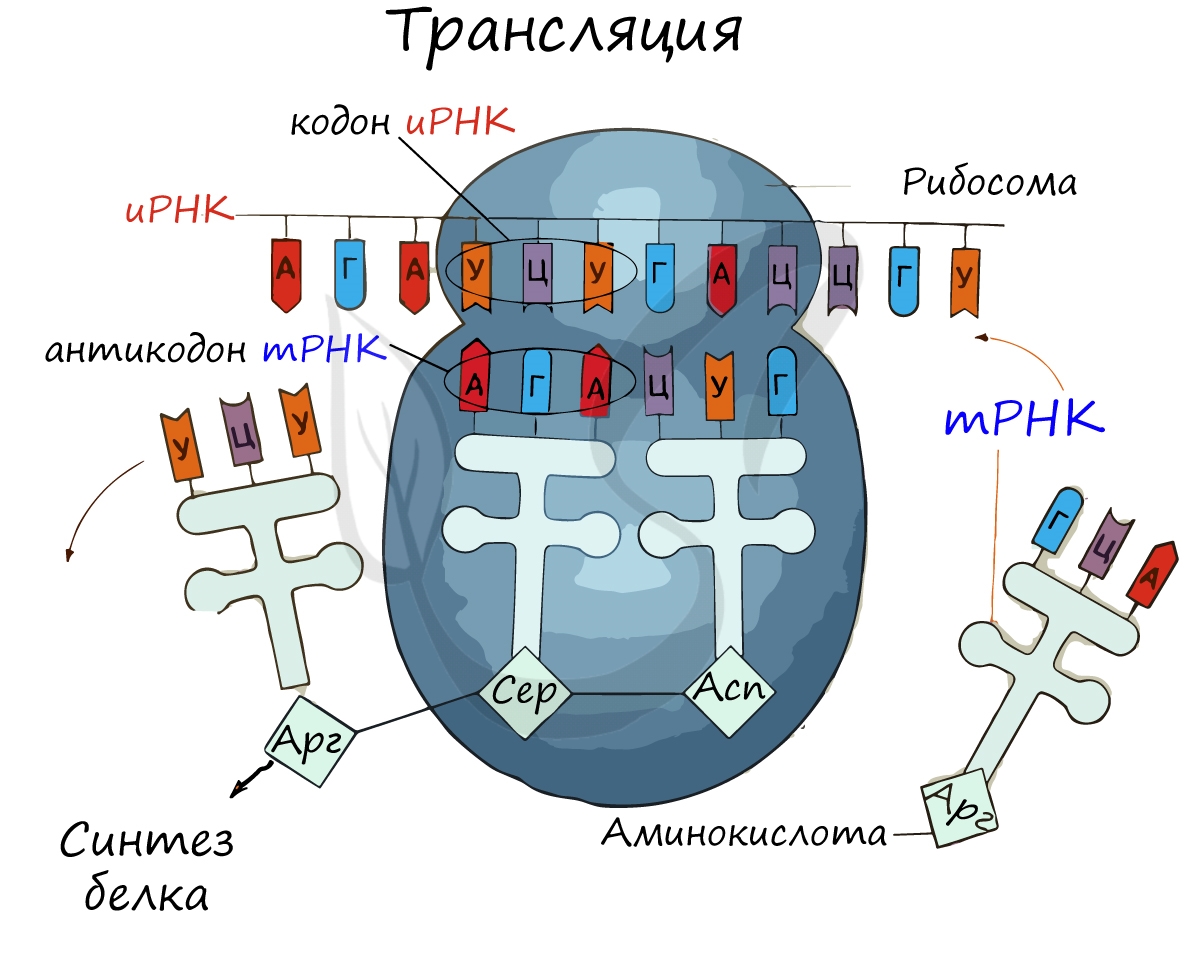
Первый кодон иРНК, старт-кодон, АУГ оказывается в центре рибосомы, после чего тРНК приносит аминокислоту,
соответствующую кодону АУГ — метионин.
Рибосома делает шаг, и иРНК продвигается на один кодон: такое в фазу элонгации происходит десятки тысяч раз.
Молекулы тРНК приносят новые аминокислоты, соответствующие кодонам иРНК. Аминокислоты соединяются друг с другом: между ними образуются пептидные связи, молекула белка растет.
Доставка нужных аминокислот осуществляется благодаря точному соответствию 3 нуклеотидов (кодона) иРНК 3 нуклеотидам (антикодону) тРНК. Язык перевода между иРНК и тРНК выглядит как: А (аденин) — У (урацил), Г (гуанин) — Ц (цитозин).
В основе этого также лежит принцип комплементарности.
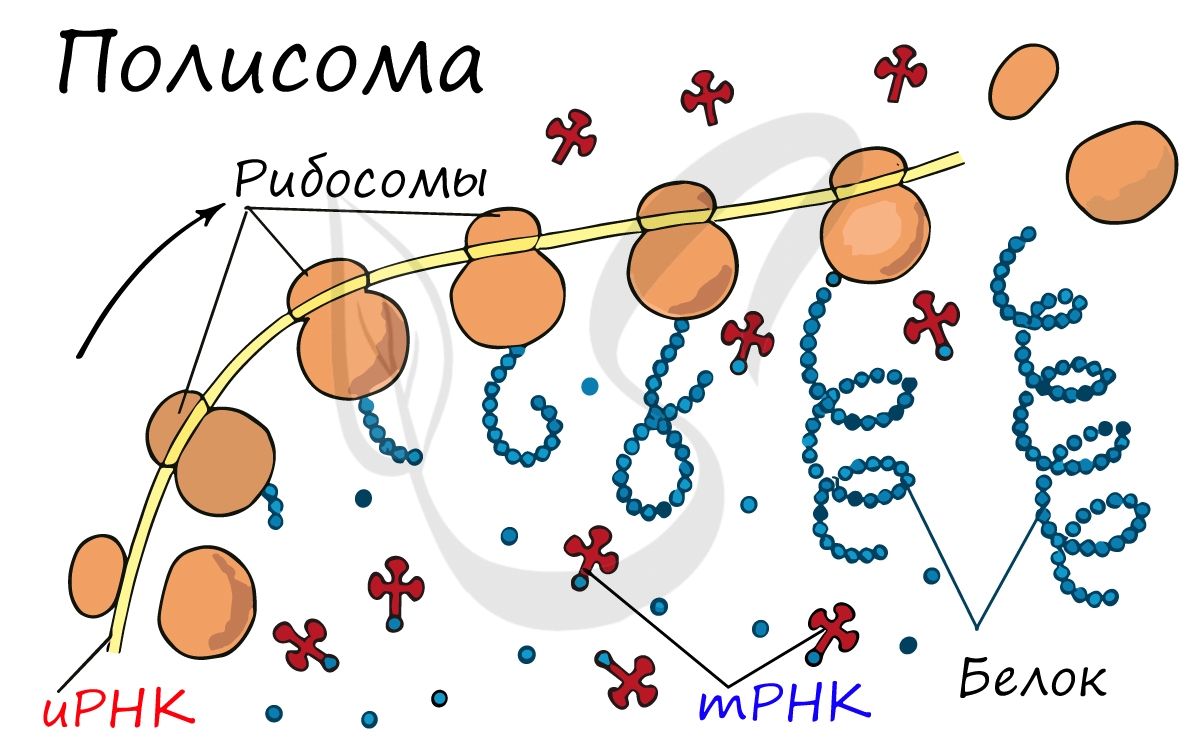
Движение рибосомы вдоль молекулы иРНК называется транслокация. Нередко в клетке множество рибосом садятся на одну молекулу
иРНК одновременно — образующаяся при этом структура называется полирибосома (полисома). В результате происходит одновременный синтез множества одинаковых белков.
Синтез белка — полипептидной цепи из аминокислот — в определенный момент завершатся. Сигналом к этому служит попадание
в центр рибосомы одного из так называемых стоп-кодонов: УАГ, УГА, УАА. Они относятся к нонсенс-кодонам (бессмысленным), которые не кодируют ни одну аминокислоту. Их функция — завершить синтез белка.
Существует специальная таблица для перевода кодонов иРНК в аминокислоты. Пользоваться ей очень просто, если вы запомните, что
кодон состоит из 3 нуклеотидов. Первый нуклеотид берется из левого вертикального столбика, второй — из верхнего горизонтального,
третий — из правого вертикального столбика. На пересечении всех линий, идущих от них, и находится нужная вам аминокислота 
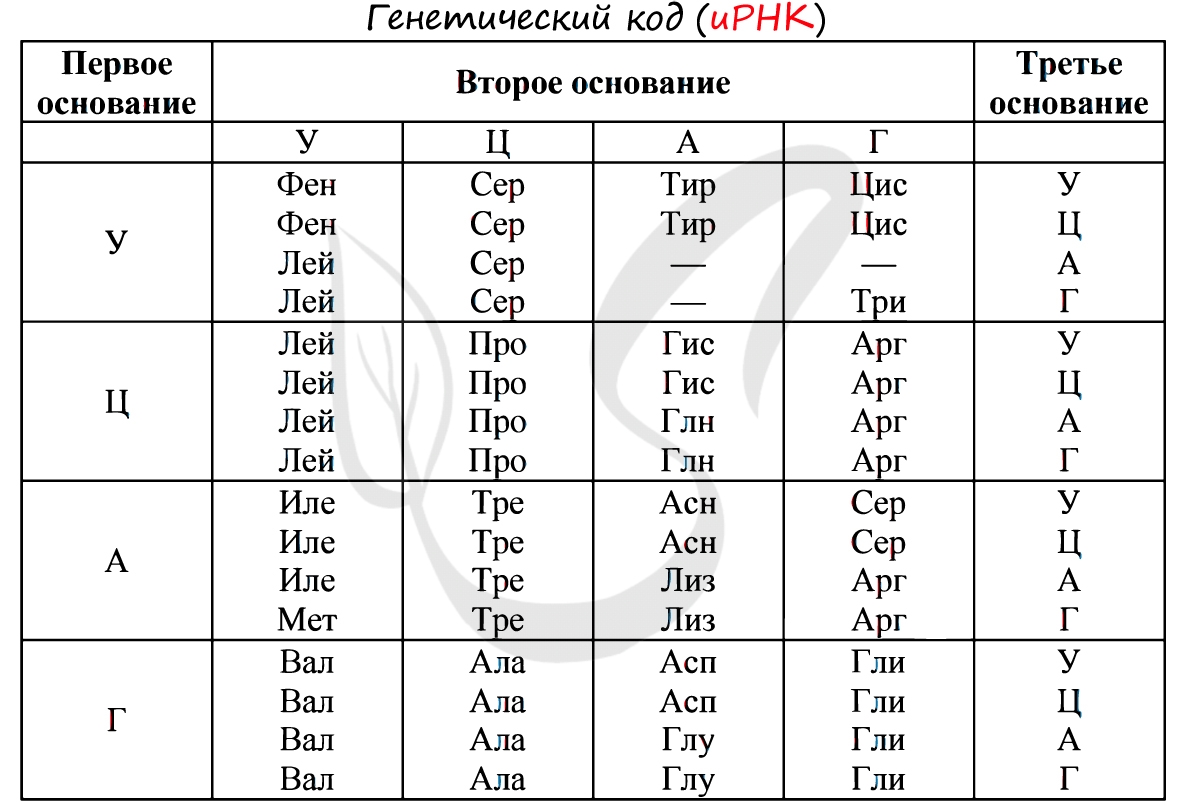
Давайте потренируемся: кодону ЦАЦ соответствует аминокислота Гис, кодону ЦАА — Глн. Попробуйте самостоятельно найти
аминокислоты, которые кодируют кодоны ГЦУ, ААА, УАА.
Кодону ГЦУ соответствует аминокислота — Ала, ААА — Лиз. Напротив кодона УАА в таблице вы должны были обнаружить прочерк:
это один из трех нонсенс-кодонов, завершающих синтез белка.
Примеры решения задачи №1
Без практики теория мертва, так что скорее решим задачи! В первых двух задачах будем пользоваться таблицей генетического кода (по иРНК),
приведенной вверху.
«Фрагмент цепи ДНК имеет следующую последовательность нуклеотидов: ЦГА-ТГГ-ТЦЦ-ГАЦ. Определите последовательность нуклеотидов
во второй цепочке ДНК, последовательность нуклеотидов на иРНК, антикодоны
соответствующих тРНК и аминокислотную последовательность соответствующего фрагмента молекулы белка, используя таблицу генетического кода»

Объяснение:
По принципу комплементарности мы нашли вторую цепочку ДНК: ГЦТ-АЦЦ-АГГ-ЦТГ. Мы использовали следующие правила при нахождении второй нити
ДНК: А-Т, Т-А, Г-Ц, Ц-Г.
Вернемся к первой цепочке, и именно от нее пойдем к иРНК: ГЦУ-АЦЦ-АГГ-ЦУГ. Мы использовали следующие правила при переводе ДНК в иРНК:
А-У, Т-А, Г-Ц, Ц-Г.
Зная последовательность нуклеотидов иРНК, легко найдем тРНК: ЦГА, УГГ, УЦЦ, ГАЦ. Мы использовали следующие правила перевода иРНК в тРНК:
А-У, У-А, Г-Ц, Ц-Г. Обратите внимание, что антикодоны тРНК мы разделяем запятыми, в отличие кодонов иРНК. Это связано с тем, что
тРНК представляют собой отдельные молекулы (в виде клеверного листа), а не линейную структуру (как ДНК, иРНК).
Пример решения задачи №2
«Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой синтезируется участок центральной петли тРНК, имеет
следующую последовательность нуклеотидов: ТАГ-ЦАА-АЦГ-ГЦТ-АЦЦ. Установите нуклеотидную последовательность участка тРНК, который синтезируется
на данном фрагменте, и аминокислоту, которую будет переносить эта тРНК в процессе биосинтеза белка, если третий триплет соответствует антикодону
тРНК»

Обратите свое пристальное внимание на слова «Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой
синтезируется участок центральной петли тРНК «. Эта фраза кардинально меняет ход решения задачи: мы получаем право напрямую и сразу
синтезировать с ДНК фрагмент тРНК — другой подход здесь будет считаться ошибкой.
Итак, синтезируем напрямую с ДНК фрагмент молекулы тРНК: АУЦ-ГУУ-УГЦ-ЦГА-УГГ. Это не отдельные молекулы тРНК (как было
в предыдущей задаче), поэтому не следует разделять их запятой — мы записываем их линейно через тире.
Третий триплет ДНК — АЦГ соответствует антикодону тРНК — УГЦ. Однако мы пользуемся таблицей генетического кода по иРНК,
так что переведем антикодон тРНК — УГЦ в кодон иРНК — АЦГ. Теперь очевидно, что аминокислота кодируемая АЦГ — Тре.
Пример решения задачи №3
Длина фрагмента молекулы ДНК составляет 150 нуклеотидов. Найдите число триплетов ДНК, кодонов иРНК, антикодонов тРНК и
аминокислот, соответствующих данному фрагменту. Известно, что аденин составляет 20% в данном фрагменте (двухцепочечной
молекуле ДНК), найдите содержание в процентах остальных нуклеотидов.

Один триплет ДНК состоит из 3 нуклеотидов, следовательно, 150 нуклеотидов составляют 50 триплетов ДНК (150 / 3). Каждый триплет ДНК
соответствует одному кодону иРНК, который в свою очередь соответствует одному антикодону тРНК — так что их тоже по 50.
По правилу Чаргаффа: количество аденина = количеству тимина, цитозина = гуанина. Аденина 20%, значит и тимина также 20%.
100% — (20%+20%) = 60% — столько приходится на оставшиеся цитозин и гуанин. Поскольку их процент содержания равен, то
на каждый приходится по 30%.
Теперь мы украсили теорию практикой. Что может быть лучше при изучении новой темы? 
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
ДНК и гены
ДНК ПРОКАРИОТ И ЭУКАРИОТ
 |
|
Справа крупнейшая спираль ДНК человека, выстроенная из людей на пляже в Варне (Болгария), вошедшая в книгу рекордов Гиннесса 23 апреля 2016 года
Дезоксирибонуклеиновая кислота. Общие сведения

- Дезоксирибонуклеиновая кислота
- Строение нуклеиновых кислот
- Репликация
- Строение РНК
- Транскрипция
- Трансляция
- Генетический код
- Геном: гены и хромосомы
- Прокариоты
- Эукариоты
- Строение генов
- Строение генов прокариот
- Строение генов эукариот
- Сравнение строения генов
- Мутации и мутагенез
- Генные мутации
- Хромосомные мутации
- Геномные мутации
- Видео по теме ДНК
- Дополнительный материал
ДНК (дезоксирибонуклеиновая кислота) – своеобразный чертеж жизни, сложный код, в котором заключены данные о наследственной информации. Эта сложная макромолекула способна хранить и передавать наследственную генетическую информацию из поколения в поколение. ДНК определяет такие свойства любого живого организма как наследственность и изменчивость. Закодированная в ней информация задает всю программу развития любого живого организма. Генетически заложенные факторы предопределяют весь ход жизни как человека, так и любого др. организхма. Искусственное или естественное воздействие внешней среды способны лишь в незначительной степени повлиять на общую выраженность отдельных генетических признаков или сказаться на развитии запрограммированных процессов.
Дезоксирибонуклеи́новая кислота (ДНК) — макромолекула (одна из трёх основных, две другие — РНК и белки), обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. ДНК содержит информацию о структуре различных видов РНК и белков.
В клетках эукариот (животных, растений и грибов) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами.
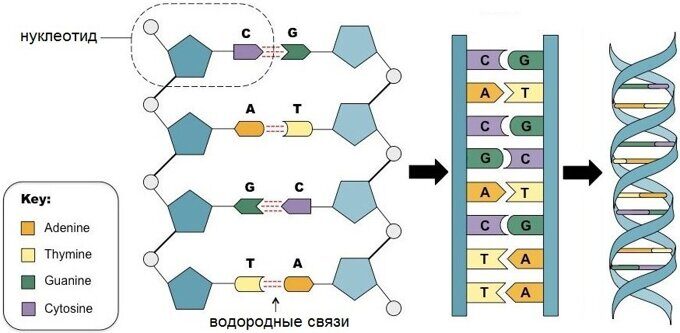
С химической точки зрения ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков — нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы (С) и фосфатной (Ф) группы (фосфодиэфирные связи).
Рис. 2. Нуклертид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы
В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула закручена по винтовой линии.
В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин). Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином (А-Т), гуанин — только с цитозином (Г-Ц). Именно эти пары и составляют «перекладины» винтовой «лестницы» ДНК (см.: рис. 2, 3 и 4).
Рис. 2. Азотистые основания
Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции, и принимают участие в биосинтезе белков (процессе трансляции). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции.

Рис. 3. Репликация ДНК
Расположение базовых комбинаций химических соединений ДНК и количественные соотношения между этими комбинациями обеспечивают кодирование наследственной информации.
Образование новой ДНК (репликация)
- Процесс репликации: раскручивание двойной спирали ДНК — синтез комплементарных цепей ДНК-полимеразой — образование двух молекул ДНК из одной.
- Двойная спираль «расстегивается» на две ветви, когда ферменты разрушают связь между базовыми парами химических соединений.
- Каждая ветвь является элементом новой ДНК. Новые базовые пары соединяются в той же последовательности, что и в родительской ветви.
По завершении дупликации образуются две самостоятельные спирали, созданные из химических соединений родительской ДНК и имеющие с ней одинаковый генетический код. Таким путем ДНК способна перерывать информацию от клетки к клетке.
Более подробная информация:
СТРОЕНИЕ НУКЛЕИНОВЫХ КИСЛОТ

Рис. 4 . Азотистые основания: аденин, гуанин, цитозин, тимин
Дезоксирибонуклеиновая кислота (ДНК) относится к нуклеиновым кислотам. Нуклеиновые кислоты – это класс нерегулярных биополимеров, мономерами которых являются нуклеотиды.
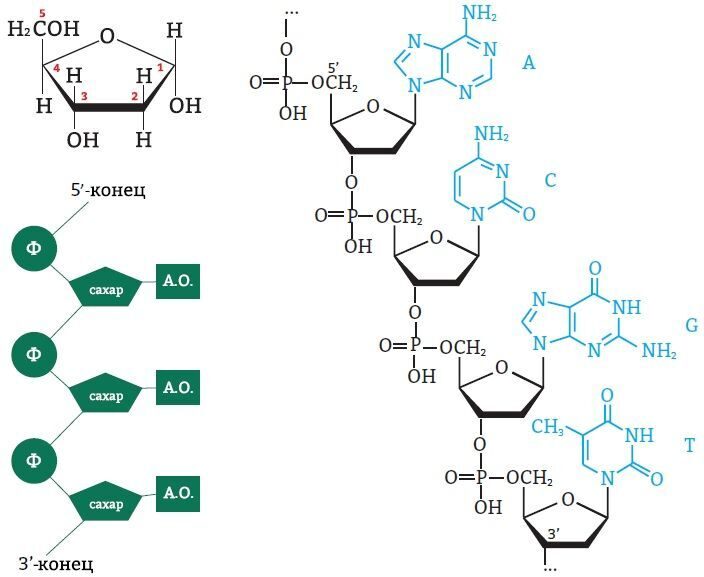
НУКЛЕОТИДЫ состоят из азотистого основания, соединенного с пятиуглеродным углеводом (пентозой) – дезоксирибозой (в случае ДНК) или рибозой (в случае РНК), который соединяется с остатком фосфорной кислоты (H2PO3–).
Азотистые основания бывают двух типов: пиримидиновые основания – урацил (только в РНК), цитозин и тимин, пуриновые основания – аденин и гуанин.
Рис. 5. Структура нуклеотидов (слева), расположение нуклеотида в ДНК (снизу) и типы азотистых оснований (справа): пиримидиновые и пуриновые
Атомы углерода в молекуле пентозы нумеруются числами от 1 до 5. Фосфат соединяется с третьим и пятым атомами углерода. Так нуклеинотиды соединяются в цепь нуклеиновой кислоты. Таким образом, мы можем выделить 3’ и 5’-концы цепи ДНК:
Рис. 6. Выделение 3’ и 5’-концов цепи ДНК
Две цепи ДНК образуют двойную спираль. Эти цепи в спирали сориентированы в противоположных направлениях. В разных цепях ДНК азотистые основания соединены между собой с помощью водородных связей. Аденин всегда соединяется с тимином, а цитозин – с гуанином. Это называется правилом комплементарности (см. принцип комплементарности).
Правило комплементарности:
Например, если нам дана цепь ДНК, имеющая последовательность
3’– ATGTCCTAGCTGCTCG – 5’,
то вторая ей цепь будет комплементарна и направлена в противоположном направлении – от 5’-конца к 3’-концу:
5’– TACAGGATCGACGAGC– 3’.

Рис. 7. Направленность цепей молекулы ДНК и соединение азотистых оснований с помощью водородных связей
РЕПЛИКАЦИЯ ДНК
Репликация ДНК – это процесс удвоения молекулы ДНК путем матричного синтеза. В большинстве случаев естественной репликации ДНК праймером для синтеза ДНК является короткий фрагмент РНК (создаваемый заново). Такой рибонуклеотидный праймер создается ферментом праймазой (ДНК-праймаза у прокариот, ДНК-полимераза у эукариот), и впоследствии заменяется дезоксирибонуклеотидами полимеразой, выполняющей в норме функции репарации (исправления химических повреждений и разрывов в молекле ДНК).
Репликация происходит по полуконсервативному механизму. Это значит, что двойная спираль ДНК расплетается и на каждой из ее цепей по принципу комплементарности достраивается новая цепь. Дочерняя молекула ДНК, таким образом, содержит в себе одну цепь от материнской молекулы и одну вновь синтезированную. Репликация происходит в направлении от 3’ к 5’ концу материнской цепи.

Рис. 8. Репликация (удвоение) молекулы ДНК
ДНК-синтез – это не такой сложный процесс, как может показаться на первый взгляд. Если подумать, то для начала нужно разобраться, что же такое синтез. Это процесс объединения чего-либо в одно целое. Образование новой молекулы ДНК проходит в несколько этапов:
1) ДНК-топоизомераза, располагаясь перед вилкой репликации, разрезает ДНК для того, чтобы облегчить ее расплетание и раскручивание.
2) ДНК-хеликаза вслед за топоизомеразой влияет на процесс «расплетения» спирали ДНК.
3) ДНК-связывающие белки осуществляют связывание нитей ДНК, а также проводят их стабилизацию, не допуская их прилипания друг к другу.
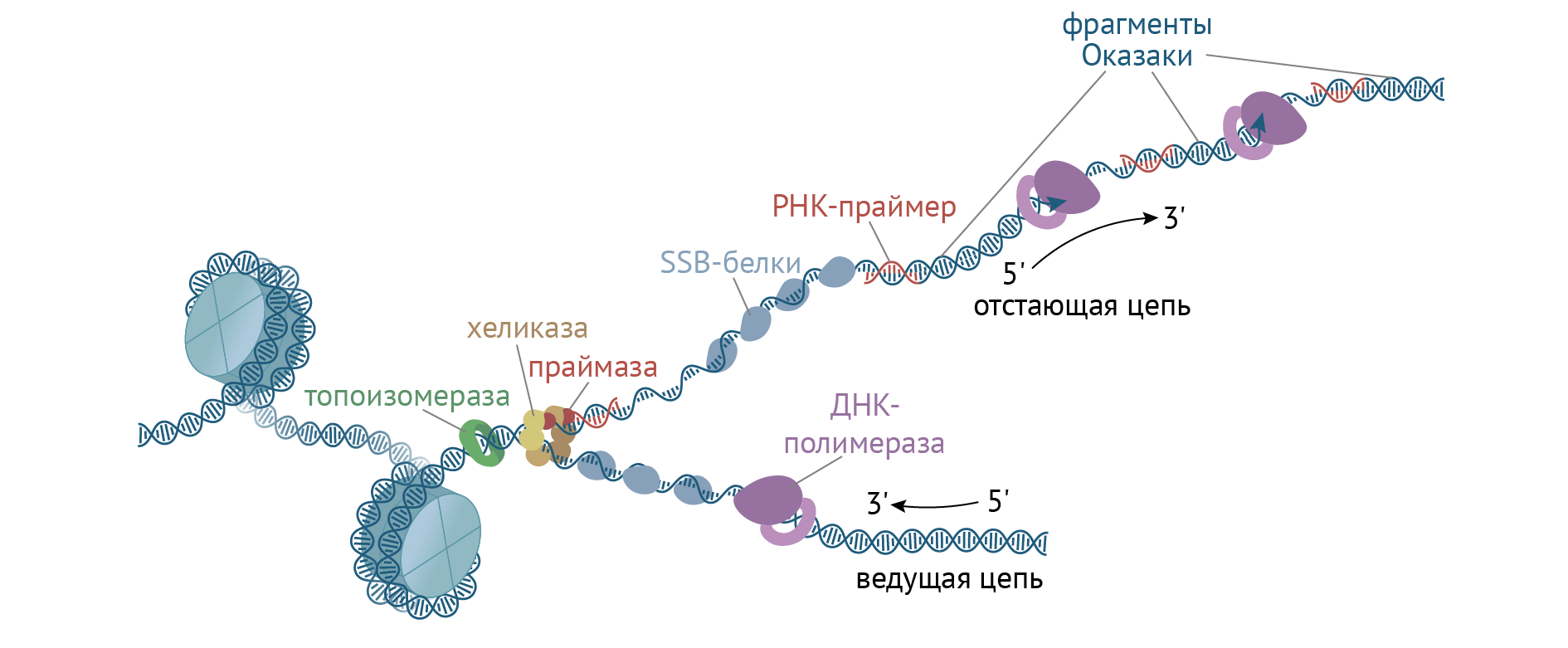
4) ДНК-полимераза δ (дельта), согласовано со скоростью движения репликативной вилки, осуществляет синтез ведущей цепи дочерней ДНК в направлении 5’→3′ на матрице материнской нити ДНК по направлению от ее 3′-конца к 5′-концу (скорость до 100 пар нуклеотидов в секунду). Этим события на данной материнской нити ДНК ограничиваются.
Рис. 9. Схематическое изображение процесса репликации ДНК: (1) Отстающая цепь (запаздывающая нить), (2) Ведущая цепь (лидирующая нить), (3) ДНК-полимераза α (Polα), (4) ДНК-лигаза, (5) РНК-праймер, (6) Праймаза, (7) Фрагмент Оказаки, (8) ДНК-полимераза δ (Polδ), (9) Хеликаза, (10) Однонитевые ДНК-связывающие белки, (11) Топоизомераза.
Далее описан синтез отстающей цепи дочерней ДНК (см. Схему репликативной вилки и функции ферментов репликации)
Нагляднее о репликации ДНК см. видео →
5) Непосредственно сразу после расплетания и стабилизации другой нити материнской молекулы к ней присоединяется ДНК-полимераза α (альфа) и в направлении 5’→3′ синтезирует праймер (РНК-затравку) – последовательность РНК на матрице ДНК длиной от 10 до 200 нуклеотидов. После этого фермент удаляется с нити ДНК.
Вместо ДНК-полимеразы α к 3′-концу праймера присоединяется ДНК-полимераза ε.
6) ДНК-полимераза ε (эпсилон) как бы продолжает удлинять праймер, но в качестве субстрата встраивает дезоксирибонуклеотиды (в количестве 150-200 нуклеотидов). В результате образуется цельная нить из двух частей – РНК (т.е. праймер) и ДНК. ДНК-полимераза ε работает до тех пор, пока не встретит праймер предыдущего фрагмента Оказаки (синтезированный чуть ранее). После этого данный фермент удаляется с цепи.
7) ДНК-полимераза β (бета) встает вместо ДНК-полимеразы ε, движется в том же направлении (5’→3′) и удаляет рибонуклеотиды праймера, одновременно встраивая дезоксирибонуклеотиды на их место. Фермент работает до полного удаления праймера, т.е. пока на его пути не встанет дезоксирибонуклеотид (еще более ранее синтезированный ДНК-полимеразой ε). Связать результат свой работы и впереди стоящую ДНК фермент не в состоянии, поэтому он сходит с цепи.
В результате на матрице материнской нити «лежит» фрагмент дочерней ДНК. Он называется фрагмент Оказаки.

СТРОЕНИЕ РНК
Рибонуклеиновая кислота (РНК) — одна из трёх основных макромолекул (две другие — ДНК и белки), которые содержатся в клетках всех живых организмов.
Так же, как ДНК, РНК состоит из длинной цепи, в которой каждое звено называется нуклеотидом. Каждый нуклеотид состоит из азотистого основания, сахара рибозы и фосфатной группы. Однако в отличие от ДНК, РНК обычно имеет не две цепи, а одну. Пентоза в РНК представлена рибозой, а не дезоксирибозой (у рибозы присутствует дополнительная гидроксильная группа на втором атоме углевода). Наконец, ДНК отличается от РНК по составу азотистых оснований: вместо тимина (Т) в РНК представлен урацил (U), который также комплементарен аденину.
Последовательность нуклеотидов позволяет РНК кодировать генетическую информацию. Все клеточные организмы используют РНК (мРНК) для программирования синтеза белков.
Клеточные РНК образуются в ходе процесса, называемого транскрипцией, то есть синтеза РНК на матрице ДНК, осуществляемого специальными ферментами — РНК-полимеразами.
Затем матричные РНК (мРНК) принимают участие в процессе, называемом трансляцией, т.е. синтеза белка на матрице мРНК при участии рибосом. Другие РНК после транскрипции подвергаются химическим модификациям, и после образования вторичной и третичной структур выполняют функции, зависящие от типа РНК.

Рис. 10. Отличие ДНК от РНК по азотистому основанию: вместо тимина (Т) в РНК представлен урацил (U), который также комплементарен аденину.
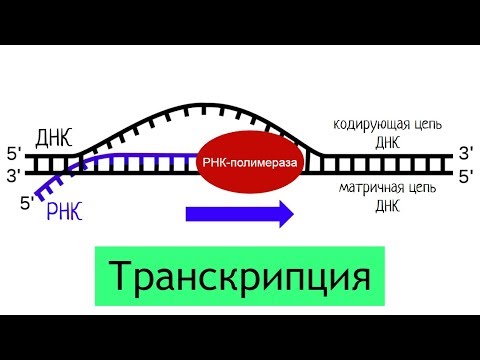
ТРАНСКРИПЦИЯ
Транскрипция – это процесс синтеза РНК на матрице ДНК. ДНК раскручивается на одном из участков. На одной из цепей содержится информация, которую необходимо скопировать на молекулу РНК – эта цепь называется кодирующей. Вторая цепь ДНК, комплементарная кодирующей, называется матричной. В процессе транскрипции на матричной цепи в направлении 3’ – 5’ (по цепи ДНК) синтезируется комплементарная ей цепь РНК. Таким образом, создается РНК-копия кодирующей цепи.

Рис. 11. Схематическое изображение транскрипции
Например, если нам дана последовательность кодирующей цепи
3’– ATGTCCTAGCTGCTCG – 5’,
то, по правилу комплементарности, матричная цепь будет нести последовательность
5’– TACAGGATCGACGAGC– 3’,
а синтезируемая с нее РНК – последовательность
3’– AUGUCCUAGCUGCUCG – 5’.
ТРАНСЛЯЦИЯ
Рассмотрим механизм синтеза белка на матрице РНК, а также генетический код и его свойства. Также для наглядности по ниже приведенной ссылке рекомендуем посмотреть небольшое видео о процессах транскрипции и трансляции, происходящих в живой клетке:
|
|
В представленном видоролике (кнопка-ссылка слева) показан процесс образования белка из аминокислот. Наглядно (в анимированном варианте) продемонстрированы процессы транскрипции и трансляции. Биосинтез белка на рибосоме также кратко описан в разделе Аминокислоты белков. Более подробное видео о геноме, ДНК и ее структуре, а также процессах кодировки представленно ниже на данной странице: Видео по теме ДНК |

Рис. 12. Процесс синтеза белка: ДНК кодирует РНК, РНК кодирует белок
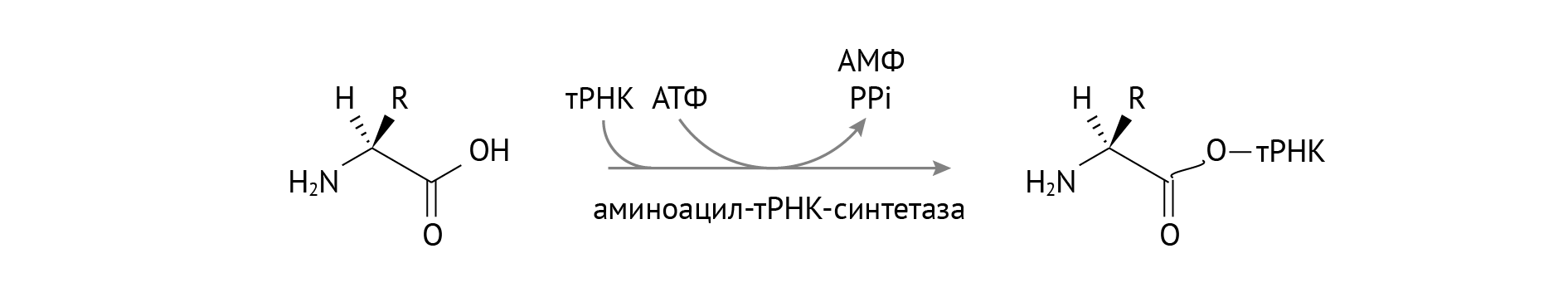
Трансляция — это процесс, посредством которого генетическая информация преобразуется в белки, рабочие лошадки клетки. Небольшие молекулы, называемые переносными РНК («тРНК»), играют решающую роль в трансляции; они являются молекулами-адаптерами, которые соответствуют кодонам (строительным блокам генетической информации) с аминокислотами (строительными блоками белков). Организмы несут множество типов тРНК, каждая из которых кодируется одним или несколькими генами («набор генов тРНК»).
Вообще говоря, функция набора генов тРНК — переводить 61 тип кодонов в 20 различных типов аминокислот — сохраняется в разных организмах. Тем не менее, состав набора генов тРНК может значительно варьировать между организмами.
ГЕНЕТИЧЕСКИЙ КОД
Генетический код — способ кодирования аминокислотной последовательности белков с помощью последовательности нуклеотидов. Каждая аминокислота кодируется последовательностью из трех нуклеотидов — кодоном или триплетом.
Генетический код, общий для большинства про- и эукариот. В таблице приведены все 64 кодона и указаны соответствующие аминокислоты. Порядок оснований — от 5′ к 3′ концу мРНК.
Таблица 1. Стандартный генетический код
|
1-е ние |
2-е основание |
3-е ние |
|||||||
|
U |
C |
A |
G |
||||||
|
U |
UUU |
Фенилаланин (Phe/F) |
UCU |
Серин (Ser/S) |
UAU |
Тирозин (Tyr/Y) |
UGU |
Цистеин (Cys/C) |
U |
|
UUC |
UCC |
UAC |
UGC |
C |
|||||
|
UUA |
Лейцин (Leu/L) |
UCA |
UAA |
Стоп-кодон** |
UGA |
Стоп-кодон** |
A |
||
|
UUG |
UCG |
UAG |
Стоп-кодон** |
UGG |
Триптофан (Trp/W) |
G |
|||
|
C |
CUU |
CCU |
Пролин (Pro/P) |
CAU |
Гистидин (His/H) |
CGU |
Аргинин (Arg/R) |
U |
|
|
CUC |
CCC |
CAC |
CGC |
C |
|||||
|
CUA |
CCA |
CAA |
Глутамин (Gln/Q) |
CGA |
A |
||||
|
CUG |
CCG |
CAG |
CGG |
G |
|||||
|
A |
AUU |
Изолейцин (Ile/I) |
ACU |
Треонин (Thr/T) |
AAU |
Аспарагин (Asn/N) |
AGU |
Серин (Ser/S) |
U |
|
AUC |
ACC |
AAC |
AGC |
C |
|||||
|
AUA |
ACA |
AAA |
Лизин (Lys/K) |
AGA |
Аргинин (Arg/R) |
A |
|||
|
AUG |
Метионин* (Met/M) |
ACG |
AAG |
AGG |
G |
||||
|
G |
GUU |
Валин (Val/V) |
GCU |
Аланин (Ala/A) |
GAU |
Аспарагиновая кислота (Asp/D) |
GGU |
Глицин (Gly/G) |
U |
|
GUC |
GCC |
GAC |
GGC |
C |
|||||
|
GUA |
GCA |
GAA |
Глутаминовая кислота (Glu/E) |
GGA |
A |
||||
|
GUG |
GCG |
GAG |
GGG |
G |
Среди триплетов есть 4 специальных последовательности, выполняющих функции «знаков препинания»:
- *Триплет AUG, также кодирующий метионин, называется старт-кодоном. С этого кодона начинается синтез молекулы белка. Таким образом, во время синтеза белка, первой аминокислотой в последовательности всегда будет метионин.
- **Триплеты UAA, UAG и UGA называются стоп-кодонами и не кодируют ни одной аминокислоты. На этих последовательностях синтез белка прекращается.
Свойства генетического кода
1. Триплетность. Каждая аминокислота кодируется последовательностью из трех нуклеотидов – триплетом или кодоном.

2. Непрерывность. Между триплетами нет никаких дополнительных нуклеотидов, информация считывается непрерывно.

3. Неперекрываемость. Один нуклеотид не может входить одновременно в два триплета.

4. Однозначность. Один кодон может кодировать только одну аминокислоту.

5. Вырожденность. Одна аминокислота может кодироваться несколькими разными кодонами.

6. Универсальность. Генетический код одинаков для всех живых организмов.
Пример. Нам дана последовательность кодирующей цепи:
3’– CCGATTGCACGTCGATCGTATA– 5’.
Матричная цепь будет иметь последовательность:
5’– GGCTAACGTGCAGCTAGCATAT– 3’.
Теперь «синтезируем» с этой цепи информационную РНК:
3’– CCGAUUGCACGUCGAUCGUAUA– 5’.
Синтез белка идет в направлении 5’ → 3’, следовательно, нам нужно перевернуть последовательность, чтобы «прочитать» генетический код:
5’– AUAUGCUAGCUGCACGUUAGCC– 3’.
Теперь найдем старт-кодон AUG:
5’– AUAUGCUAGCUGCACGUUAGCC– 3’.
Разделим последовательность на триплеты:
Найдем стоп-кодон и согласно таблице генетического кода запишем последовательность аминокислот:

Центральная догма молекулярной биологии звучит следующим образом: информация с ДНК передается на РНК (транскрипция), с РНК – на белок (трансляция). ДНК также может удваиваться путем репликации, и также возможен процесс обратной транскрипции, когда по матрице РНК синтезируется ДНК, но такой процесс в основном характерен для вирусов.

Рис. 13. Центральная догма молекулярной биологии
ГЕНОМ: ГЕНЫ и ХРОМОСОМЫ
(общие понятия)
Геном — совокупность всех генов организма; его полный хромосомный набор.
Термин «геном» был предложен Г. Винклером в 1920 г. для описания совокупности генов, заключенных в гаплоидном наборе хромосом организмов одного биологического вида. Первоначальный смысл этого термина указывал на то, что понятие генома в отличие от генотипа является генетической характеристикой вида в целом, а не отдельной особи. С развитием молекулярной генетики значение данного термина изменилось. Известно, что ДНК, которая является носителем генетической информации у большинства организмов и, следовательно, составляет основу генома, включает в себя не только гены в современном смысле этого слова. Большая часть ДНК эукариотических клеток представлена некодирующими («избыточными») последовательностями нуклеотидов, которые не заключают в себе информации о белках и нуклеиновых кислотах. Таким образом, основную часть генома любого организма составляет вся ДНК его гаплоидного набора хромосом.
Гены — это участки молекул ДНК, кодирующие полипептиды и молекулы РНК
За последнее столетие наше представление о генах существенно изменилось. Ранее геном называли участок хромосомы, кодирующий или определяющий один признак или фенотипическое (видимое) свойство, например цвет глаз.
|
|
|
Рис. 14. Соответствие между кодирующими участками ДНК, мРНК и аминокислотной последовательностью полипептидной цепи. |
В 1940 г. Джордж Бидл и Эдвард Тейтем предложили молекулярное определение гена. Ученые обрабатывали споры гриба Neurospora crassa рентгеновским излучением и другими агентами, вызывающими изменения в последовательности ДНК (мутации), и обнаружили мутантные штаммы гриба, утратившие некоторые специфические ферменты, что в некоторых случаях приводило к нарушению целого метаболического пути. Бидл и Тейтем пришли к выводу, что ген — это участок генетического материала, который определяет или кодирует один фермент. Так появилась гипотеза «один ген — один фермент». Позднее эта концепция была расширена до определения «один ген — один полипептид», поскольку многие гены кодируют белки, не являющиеся ферментами, а полипептид может оказаться субъединицей сложного белкового комплекса.
На рис. 14 показана схема того, как триплеты нуклеотидов в ДНК определяют полипептид — аминокислотную последовательность белка при посредничестве мРНК. Одна из цепей ДНК играет роль матрицы для синтеза мРНК, нуклеотидные триплеты (кодоны) которой комплементарны триплетам ДНК. У некоторых бактерий и многих эукариот кодирующие последовательности прерываются некодирующими участками(так называемыми интронами).
Современное биохимическое определение гена еще более конкретно. Генами называются все участки ДНК, кодирующие первичную последовательность конечных продуктов, к которым относятся полипептиды или РНК, обладающие структурной или каталитической функцией.
Наряду с генами ДНК содержит и другие последовательности, выполняющие исключительно регуляторную функцию. Регуляторные последовательности могут обозначать начало или конец генов, влиять на транскрипцию или указывать место инициации репликации или рекомбинации. Некоторые гены могут экспрессироваться разными путями, при этом один и тот же участок ДНК служит матрицей для образования разных продуктов.
Мы можем приблизительно рассчитать минимальный размер гена, кодирующего средний белок. Каждая аминокислота в полипептидной цепи кодируется последовательностью из трех нуклеотидов; последовательности этих триплетов (кодонов) соответствуют цепочке аминокислот в полипептиде, который кодируется данным геном. Полипептидная цепь из 350 аминокислотных остатков (цепь средней длины) соответствует последовательности из 1050 п.н. (пар нуклеотидов). Однако многие гены эукариот и некоторые гены прокариот прерываются сегментами ДНК, не несущими информации о белке, и поэтому оказываются значительно длиннее, чем показывает простой расчет.
Сколько генов в одной хромосоме?

ДНК прокариот устроена более просто: их клетки не имеют ядра, поэтому ДНК находится непосредственно в цитоплазме в форме нуклеоида.

Прокариоты (Бактерии).

Большинство плазмид состоит всего из нескольких тысяч пар нуклеотидов, некоторые содержат более 10000 п. н. Они несут генетическую информацию и реплицируются с образованием дочерних плазмид, которые попадают в дочерние клетки в процессе деления родительской клетки. Плазмиды обнаружены не только в бактериях, но также в дрожжах и других грибах. Во многих случаях плазмиды не дают никаких преимуществ клеткам-хозяевам, и их единственная задача — независимое воспроизведение. Однако некоторые плазмиды несут полезные для хозяина гены. Например, содержащиеся в плазмидах гены могут придавать клеткам бактерий устойчивость к антибактериальным агентам. Плазмиды, несущие ген β-лактамазы, обеспечивают устойчивость к β-лактамным антибиотикам, таким как пенициллин и амоксициллин. Плазмиды могут переходить от клеток, устойчивых к антибиотикам, к другим клеткам того же или другого вида бактерий, в результате чего эти клетки также становятся резистентными. Интенсивное применение антибиотиков является мощным селективным фактором, способствующим распространению плазмид, кодирующих устойчивость к антибиотикам (а также транспозонов, которые кодируют аналогичные гены) среди болезнетворных бактерий, и приводит к появлению бактериальных штаммов с устойчивостью к нескольким антибиотикам. Врачи начинают понимать опасность широкого использования антибиотиков и назначают их только в случае острой необходимости. По аналогичным причинам ограничивается широкое использование антибиотиков для лечения сельскохозяйственных животных.
См. также: Равин Н.В., Шестаков С.В. Геном прокариот // Вавиловский журнал генетики и селекции, 2013. Т. 17. № 4/2. С. 972–984.
Эукариоты.
Таблица 2. ДНК, гены и хромосомы некоторых организмов
|
Общая ДНК, п.н. |
Число хромосом* |
Примерное число генов |
|
|
Escherichia coli (бактерия) |
4 639 675 |
1 |
4 435 |
|
Saccharomyces cerevisiae (дрожжи) |
12 080 000 |
16** |
5 860 |
|
Caenorhabditis elegans (нематода) |
90 269 800 |
12*** |
23 000 |
|
Arabidopsis thaliana (растение) |
119 186 200 |
10 |
33 000 |
|
Drosophila melanogaster (плодовая мушка) |
120 367 260 |
18 |
20 000 |
|
Oryza sativa (рис) |
480 000 000 |
24 |
57 000 |
|
Mus musculus (мышь) |
2 634 266 500 |
40 |
27 000 |
|
Homo sapiens (человек) |
3 070 128 600 |
46 |
29 000 |
Примечание. Информация постоянно обновляется; для получения более свежей информации обратитесь к сайтам, посвященным отдельным геномным проектам
*Для всех эукариот, кроме дрожжей, приводится диплоидный набор хромосом. Диплоидный набор хромосом (от греч. diploos- двойной и eidos- вид) – двойной набор хромосом (2n), каждая из которых имеет себе гомологичную.
**Гаплоидный набор. Дикие штаммы дрожжей обычно имеют восемь (октаплоидный) или больше наборов таких хромосом.
***Для самок с двумя Х хромосомами. У самцов есть Х хромосома, но нет Y, т. е. всего 11 хромосом.
В клетке дрожжей, одних из самых маленьких эукариот, в 2,6 раза больше ДНК, чем в клетке E. coli (табл. 2). Клетки плодовой мушки Drosophila, классического объекта генетических исследований, содержат в 35 раз больше ДНК, а клетки человека — примерно в 700 раз больше ДНК, чем клетки E. coli. Многие растения и амфибии содержат еще больше ДНК. Генетический материал клеток эукариот организован в виде хромосом. Диплоидный набор хромосом (2n) зависит от вида организма (табл. 2).
Например, в соматической клетке человека 46 хромосом (рис. 17). Каждая хромосома эукариотической клетки, как показано на рис. 17, а, содержит одну очень крупную двухспиральную молекулу ДНК. Двадцать четыре хромосомы человека (22 парные хромосомы и две половые хромосомы X и Y) различаются по длине более чем в 25 раз. Каждая хромосома эукариот содержит определенный набор генов.

Рис. 17. Хромосомы эукариот. а — пара связанных и конденсированных сестринских хроматид из хромосомы человека. В такой форме эукариотические хромосомы пребывают после репликации и в метафазе в процессе митоза. б — полный набор хромосом из лейкоцита одного из авторов книги. В каждой нормальной соматической клетке человека содержится 46 хромосом.
Размер и функция ДНК как матрицы для хранения и передачи наследственного материала объясняют наличие особых структурных элементов в организации этой молекулы. У высших организмов ДНК распределена между хромосомами.
Совокупность ДНК (хромосом) организма называется геномом. Хромосомы находятся в клеточном ядре и формируют структуру, называемую хроматином. Хроматин представляет собой комплекс ДНК и основных белков (гистонов) в соотношении 1:1. Длину ДНК обычно измеряют числом пар комплементарных нуклеотидов (п.н.). Например, 3-я хромосома человека представляет собой молекулу ДНК размером 160 млн п.н.. Выделенная линеаризованная ДНК размером 3*106 п.н. имеет длину примерно 1 мм, следовательно, линеаризованная молекула 3-й хромосомы человека была бы 5 мм в длину, а ДНК всех 23 хромосом (~3*109 п.н., MR = 1,8*1012) гаплоидной клетки – яйцеклетки или сперматозоида – в линеаризованном виде составляла бы 1 м. За исключением половых клеток, все клетки организма человека (их около 1013) содержат двойной набор хромосом. При клеточном делении все 46 молекул ДНК реплицируются и снова организуются в 46 хромосом.
Если соединить между собой молекулы ДНК человеческого генома (22 хромосомы и хромосомы X и Y или Х и Х), получится последовательность длиной около одного метра. Прим.: У всех млекопитающих и других организмов с гетерогаметным мужским полом, у самок две X-хромосомы (XX), а у самцов — одна X-хромосома и одна Y-хромосома (XY).
Большинство клеток человека диплоидны, поэтому общая длина ДНК таких клеток около 2м. У взрослого человека примерно 1014 клеток, таким образом, общая длина всех молекул ДНК составляет 2・1011 км. Для сравнения, окружность Земли — 4・104 км, а расстояние от Земли до Солнца — 1,5・108 км. Вот как удивительно компактно упакована ДНК в наших клетках!
В клетках эукариот есть и другие органеллы, содержащие ДНК, — это митохондрии и хлоропласты. Выдвигалось множество гипотез относительно происхождения ДНК митохондрий и хлоропластов. Общепризнанная сегодня точка зрения заключается в том, что они представляют собой рудименты хромосом древних бактерий, которые проникли в цитоплазму хозяйских клеток и стали предшественниками этих органелл. Митохондриальная ДНК кодирует митохондриальные тРНК и рРНК, а также несколько митохондриальных белков. Более 95% митохондриальных белков кодируется ядерной ДНК.
СТРОЕНИЕ ГЕНОВ
Рассмотрим строение гена у прокариот и эукариот, их сходства и различия. Несмотря на то, что ген — это участок ДНК, кодирующий всего один белок или РНК, кроме непосредственно кодирующей части, он также включает в себя регуляторные и иные структурные элементы, имеющие разное строение у прокариот и эукариот.
Кодирующая последовательность – основная структурно-функциональная единица гена, именно в ней находятся триплеты нуклеотидов, кодирующие аминокислотную последовательность. Она начинается со старт-кодона и заканчивается стоп-кодоном.
До и после кодирующей последовательности находятся нетранслируемые 5’- и 3’-последовательности. Они выполняют регуляторные и вспомогательные функции, например, обеспечивают посадку рибосомы на и-РНК.
Нетранслируемые и кодирующая последовательности составлют единицу транскрипции – транскрибируемый участок ДНК, то есть участок ДНК, с которого происходит синтез и-РНК.
Терминатор – нетранскрибируемый участок ДНК в конце гена, на котором останавливается синтез РНК.
В начале гена находится регуляторная область, включающая в себя промотор и оператор.
Промотор – последовательность, с которой связывается полимераза в процессе инициации транскрипции. Оператор – это область, с которой могут связываться специальные белки – репрессоры, которые могут уменьшать активность синтеза РНК с этого гена – иначе говоря, уменьшать его экспрессию.
Строение генов у прокариот
Общий план строения генов у прокариот и эукариот не отличается – и те, и другие содержат регуляторную область с промотором и оператором, единицу транскрипции с кодирующей и нетранслируемыми последовательностями и терминатор. Однако организация генов у прокариот и эукариот отличается.

Рис. 18. Схема строения гена у прокариот (бактерий) — изображение увеличивается
В начале и в конце оперона есть единые регуляторные области для нескольких структурных генов. С транскрибируемого участка оперона считывается одна молекула и-РНК, которая содержит несколько кодирующих последовательностей, в каждой из которых есть свой старт- и стоп-кодон. С каждого из таких участков синтезируется один белок. Таким образом, с одной молекулы и-РНК синтезируется несколько молекул белка.
Для прокариот характерно объединение нескольких генов в единую функциональную единицу – оперон. Работу оперона могут регулировать другие гены, которые могут быть заметно удалены от самого оперона – регуляторы. Белок, транслируемый с этого гена называется репрессор. Он связывается с оператором оперона, регулируя экспрессию сразу всех генов, в нем содержащихся.
Для прокариот также характерно явление сопряжения транскрипции и трансляции.

Рис. 19 Явление сопряжения транскрипции и трансляции у прокариот — изображение увеличивается
Такое сопряжение не встречается у эукариот из-за наличия у них ядерной оболочки, отделяющей цитоплазму, где происходит трансляция, от генетического материала, на котором происходит транскрипция. У прокариот во время синтеза РНК на матрице ДНК с синтезируемой молекулой РНК может сразу связываться рибосома. Таким образом, трансляция начинается еще до завершения транскрипции. Более того, с одной молекулой РНК может одновременно связываться несколько рибосом, синтезируя сразу несколько молекул одного белка.
Строение генов у эукариот
Гены и хромосомы эукариот очень сложно организованы
У бактерий многих видов всего одна хромосома, и почти во всех случаях в каждой хромосоме присутствует по одной копии каждого гена. Лишь немногие гены, например гены рРНК, содержатся в нескольких копиях. Гены и регуляторные последовательности составляют практически весь геном прокариот. Более того, почти каждый ген строго соответствует аминокислотной последовательности (или последовательности РНК), которую он кодирует (рис. 14).
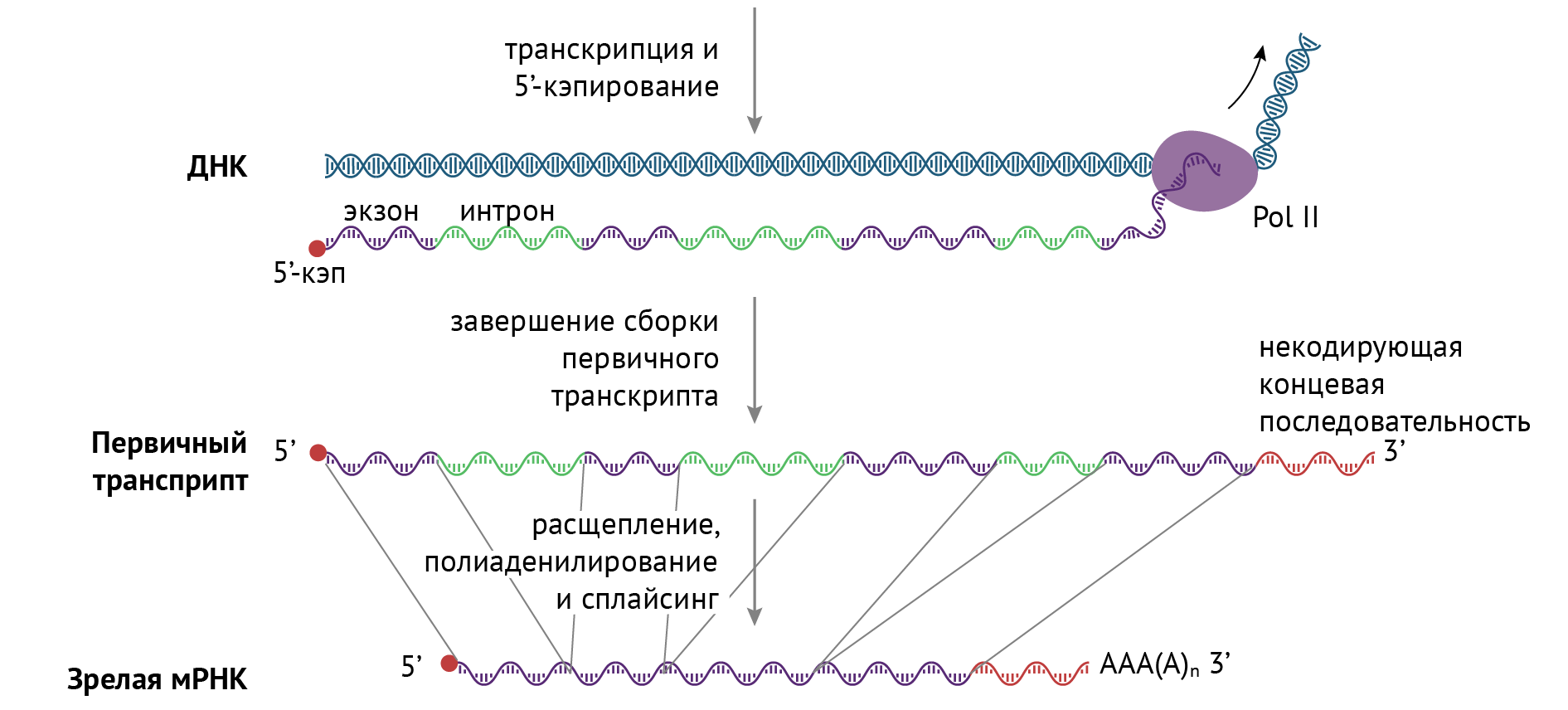
Структурная и функциональная организация генов эукариот гораздо сложнее. Исследование хромосом эукариот, а позднее секвенирование полных последовательностей геномов эукариот принесло много сюрпризов. Многие, если не большинство, генов эукариот обладают интересной особенностью: их нуклеотидные последовательности содержат один или несколько участков ДНК, в которых не кодируется аминокислотная последовательность полипептидного продукта. Такие нетранслируемые вставки нарушают прямое соответствие между нуклеотидной последовательностью гена и аминокислотной последовательностью кодируемого полипептида. Эти нетранслируемые сегменты в составе генов называют интронами, или встроенными последовательностями, а кодирующие сегменты — экзонами. У прокариот лишь немногие гены содержат интроны.
Итак, у эукариот практически не встречается объединение генов в опероны, и кодирующая последовательность гена эукариот чаще всего разделена на транслируемые участки – экзоны, и нетранслируемые участки – интроны.
В большинстве случаев функция интронов не установлена. В целом, лишь около 1,5% ДНК человека являются ≪кодирующими≫, т. е. несут информацию о белках или РНК. Однако с учетом крупных интронов получается, что ДНК человека на 30% состоит из генов. Поскольку гены составляют относительно небольшую долю в геноме человека, значительная часть ДНК остается неучтенной.
Рис. 16. Схема строение гена у эукариот — изображение увеличивается
С каждого гена сначала синтезируется незрелая, или пре-РНК, которая содержит в себе как интроны, так и экзоны.
После этого проходит процесс сплайсинга, в результате которого интронные участки вырезаются, и образуется зрелая иРНК, с которой может быть синтезирован белок.
Рис. 20. Процесс альтернативного сплайсинга — изображение увеличивается
Такая организация генов позволяет, например, осуществить процесс альтернативного сплайсинга, когда с одного гена могут быть синтезированы разные формы белка, за счет того, что в процессе сплайсинга экзоны могут сшиваться в разных последовательностях.
Сравнение строения генов прокариот и эукариот
Рис. 21. Отличия в строении генов прокариот и эукариот — изображение увеличивается
МУТАЦИИ И МУТАГЕНЕЗ
Мутацией называется стойкое изменение генотипа, то есть изменение нуклеотидной последовательности.
Процесс, который приводит к возникновению мутаций называется мутагенезом, а организм, все клетки которого несут одну и ту же мутацию — мутантом.
Мутационная теория была впервые сформулирована Гуго де Фризом в 1903 году. Современный ее вариант включает в себя следующие положения:
1. Мутации возникают внезапно, скачкообразно.
2. Мутации передаются из поколения в поколение.
3. Мутации могут быть полезными, вредными или нейтральными, доминантными или рецессивными.
4. Вероятность обнаружения мутаций зависит от числа исследованных особей.
5. Сходные мутации могут возникать повторно.
6. Мутации не направленны.
Мутации могут возникать под действием различных факторов. Различают мутации, возникшие под действием мутагенных воздействий: физических (например, ультрафиолета или радиации), химических (например, колхицина или активных форм кислорода) и биологических (например, вирусов). Также мутации могут быть вызваны ошибками репликации.
В зависимости от условий появления мутации подразделяют на спонтанные — то есть мутации, возникшие в нормальных условиях, и индуцированые — то есть мутации, которые возникли при особых условиях.
Мутации могут возникать не только в ядерной ДНК, но и, например, в ДНК митохондрий или пластид. Соответственно, мы можем выделять ядерные и цитоплазматические мутации.
В результате возникновения мутаций часто могут появляться новые аллели. Если мутантный аллель подавляет действие нормального, мутация называется доминантной. Если нормальный аллель подавляет мутантный, такая мутация называется рецессивной. Большинство мутаций, приводящих к возникновению новых аллелей являются рецессивными.
По эффекту выделяют мутации адаптивные, приводящие к повышению приспособленности организма к среде, нейтральные, не влияющие на выживаемость, вредные, понижающие приспособленность организмов к условиям среды и летальные, приводящие к смерти организма на ранних стадиях развития.
По последствиям выделяются мутации, приводящие к потери функции белка, мутации, приводящие к возникновению у белка новой функции, а также мутации, которые изменяют дозу гена, и, соответственно, дозу белка синтезируемого с него.
Мутация может возникнуть к любой клетке организма. Если мутация возникает в половой клетке, она называется герминативной (герминальной, или генеративной). Такие мутации не проявляются у того организма, у которого они появились, но приводят к появлению мутантов в потомстве и передаются по наследству, поэтому они важны для генетики и эволюции. Если мутация возникает в любой другой клетке, она называется соматической. Такая мутация может в той или иной степени проявляться у того организма, у которого она возникла, например, приводить к образованию раковых опухолей. Однако такая мутация не передается по наследству и не влияет на потомков.
Мутации могут затрагивать разные по размеру участки генома. Выделяют генные, хромосомные и геномные мутации.
Генные мутации
Мутации, которые возникают в масштабе меньшем, чем один ген, называются генными, или точечными (точковыми). Такие мутации приводят к изменению одного и нескольких нуклеотидов в последовательности. Среди генных мутаций выделяют замены, приводящие к замене одного нуклеотида на другой, делеции, приводящие к выпадению одного из нуклеотидов, инсерции, приводящие к добавлению лишнего нуклеотида в последовательность.

Рис. 23. Генные (точечные) мутации
По механизму воздействия на белок, генные мутации делят на: синонимичные, которые (в результате вырожденности генетического кода) не приводят к изменению аминокислотного состава белкового продукта, миссенс-мутации, которые приводят к замене одной аминокислоты на другую и могут влиять на структуру синтезируемого белка, хотя часто они оказываются незначительными, нонсенс-мутации, приводящие к замене кодирующего кодона на стоп-кодон, мутации, приводящие к нарушению сплайсинга:

Рис. 24. Схемы мутаций
Также по механизму воздействия на белок выделяют мутации, приводящие к сдвигу рамки считывания, например, инсерции и делеции. Такие мутации, как и нонсенс-мутации, хоть и возникают в одной точке гена, часто воздействуют на всю структуру белка, что может привести к полному изменению его структуры.
Рис. 25. Схема мутации, приводящей к сдвигу рамки считывания
Хромосомные мутации
Рис. 26. Хромосомные абберации
Хромосомными мутациями называются мутации, которые затрагивают отдельные гены в рамках одной хромосомы. Различают делеции, когда теряется один или несколько генов, дупликации, когда удваивается тот или иной ген или несколько генов, инверсии, когда участок хромосомы поворачивается на 180 градусов, транслокации, когда гены переходят с одной хромосомы на другую.

Рис. 27. Схемы хромосомных мутаций: делеции, дупликации, инверсии
|
|
|
|
Рис. 28. Транслокация |
Рис. 29. Хромосома до и после дупликации |
Геномные мутации
Наконец, геномные мутации затрагивают весь геном целиком, то есть меняется количество хромосом. Выделяют полиплоидии — увеличение плоидности клетки, и анеуплоидии, то есть изменение количества хромосом, например, трисомии (наличие у одной из хромосом дополнительного гомолога) и моносомии (отсутствие у хромосомы гомолога).
Видео по теме ДНК
РЕПЛИКАЦИЯ ДНК, КОДИРОВАНИЕ РНК, СИНТЕЗ БЕЛКА
(Если видео не отображается оно доступно по ссылке→)
См. дополнительно:
- Нуклеиновые кислоты (PDF)
- Общие сведения о секвенировании биополимеров
- Метагеномика и микробиом
- Бактериальный иммунитет и система CRISPR/Cas
- Трансляция белка на рисбосоме (общие сведения)
- Раскрыт секрет спиральной структуры ДНК (новое о ДНК)
- Антимутагенные свойства пробиотиков (в свете защиты ДНК)
- МикроРНК, микробиом кишечника и иммунитет
- Эпигенетика, короткоцепочечные жирные кислоты и врожденная иммунная память
- Замедление старения: роль питательных веществ и микробиоты в модуляции эпигенома (о метилировании ДНК)
Литература в помощь:
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
- ПРОБИОТИКИ
- ПРОБИОТИКИ И ПРЕБИОТИКИ
- СИНБИОТИКИ
- ДОМАШНИЕ ЗАКВАСКИ
- КОНЦЕНТРАТ БИФИДОБАКТЕРИЙ ЖИДКИЙ
- ПРОПИОНИКС
- ЙОДПРОПИОНИКС
- СЕЛЕНПРОПИОНИКС
- ГЕМОПРОПИОВИТ
- БИФИКАРДИО
- ПРОБИОТИКИ С ПНЖК
- МИКРОЭЛЕМЕНТНЫЙ СОСТАВ
- БИФИДОБАКТЕРИИ
- ПРОПИОНОВОКИСЛЫЕ БАКТЕРИИ
- МИКРОБИОМ ЧЕЛОВЕКА
- МИКРОФЛОРА ЖКТ
- ДИСБИОЗ КИШЕЧНИКА
- МИКРОБИОМ и ВЗК
- МИКРОБИОМ И РАК
- МИКРОБИОМ, СЕРДЦЕ И СОСУДЫ
- МИКРОБИОМ И ПЕЧЕНЬ
- МИКРОБИОМ И ПОЧКИ
- МИКРОБИОМ И ЛЕГКИЕ
- МИКРОБИОМ И ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
- МИКРОБИОМ И ЩИТОВИДНАЯ ЖЕЛЕЗА
- МИКРОБИОМ И КОЖНЫЕ БОЛЕЗНИ
- МИКРОБИОМ И КОСТИ
- МИКРОБИОМ И ОЖИРЕНИЕ
- МИКРОБИОМ И САХАРНЫЙ ДИАБЕТ
- МИКРОБИОМ И ФУНКЦИИ МОЗГА
- АНТИОКСИДАНТНЫЕ СВОЙСТВА
- АНТИОКСИДАНТНЫЕ ФЕРМЕНТЫ
- АНТИМУТАГЕННАЯ АКТИВНОСТЬ
- МИКРОБИОМ и ИММУНИТЕТ
- МИКРОБИОМ И АУТОИММУННЫЕ БОЛЕЗНИ
- ПРОБИОТИКИ и ГРУДНЫЕ ДЕТИ
- ПРОБИОТИКИ, БЕРЕМЕННОСТЬ, РОДЫ
- ВИТАМИННЫЙ СИНТЕЗ
- АМИНОКИСЛОТНЫЙ СИНТЕЗ
- АНТИМИКРОБНЫЕ СВОЙСТВА
- КОРОТКОЦЕПОЧЕЧНЫЕ ЖИРНЫЕ КИСЛОТЫ
- СИНТЕЗ БАКТЕРИОЦИНОВ
- АЛИМЕНТАРНЫЕ ЗАБОЛЕВАНИЯ
- МИКРОБИОМ И ПРЕЦИЗИОННОЕ ПИТАНИЕ
- ФУНКЦИОНАЛЬНОЕ ПИТАНИЕ
- ПРОБИОТИКИ ДЛЯ СПОРТСМЕНОВ
- ПРОИЗВОДСТВО ПРОБИОТИКОВ
- ЗАКВАСКИ ДЛЯ ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
- НОВОСТИ

В основе жизнедеятельности клетки лежит процесс интерпретации данных с дезоксирибонуклеиновой кислоты (ДНК). Но прежде чем показать, как все это происходит, я напомню базовые моменты.
(перейти к главе 1)
▶ Материал по теме: Подкаст о биохимии (и зачем она врачу)
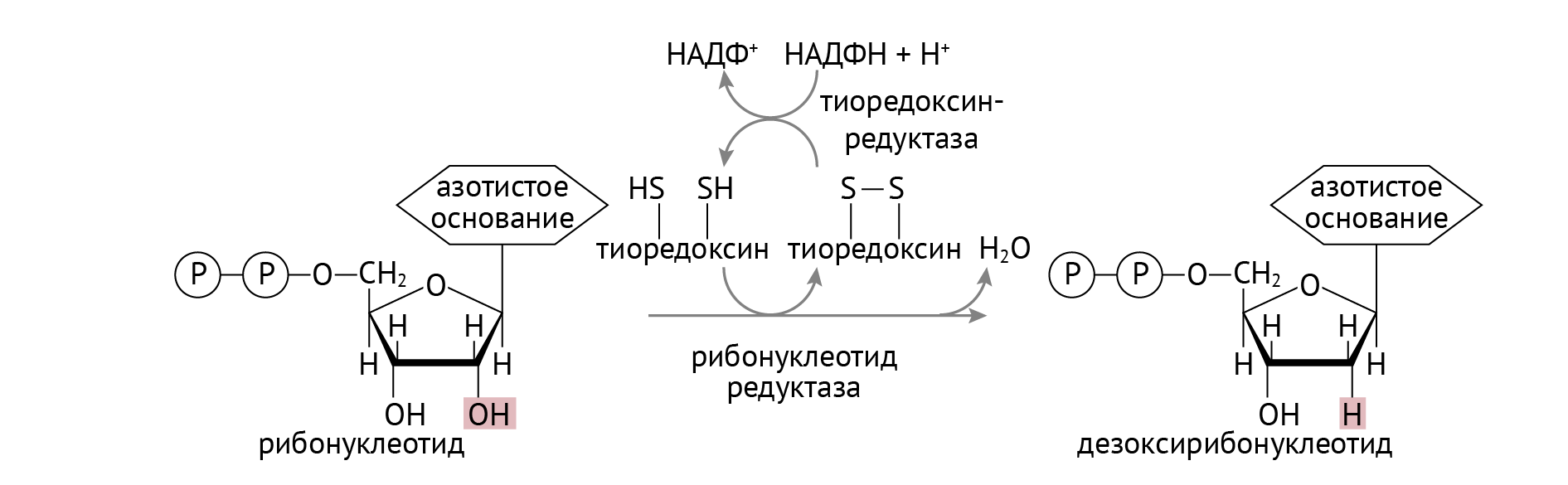
ДНК — это полимер, состоящий из дезоксирибонуклеотидов — нуклеотидов, у которых «отобрали» ОН-группу при втором атоме рибозы. Получается это в ходе следующей реакции (рис. 1):
Рисунок 1 | Образование дезоксирибонуклеотидов
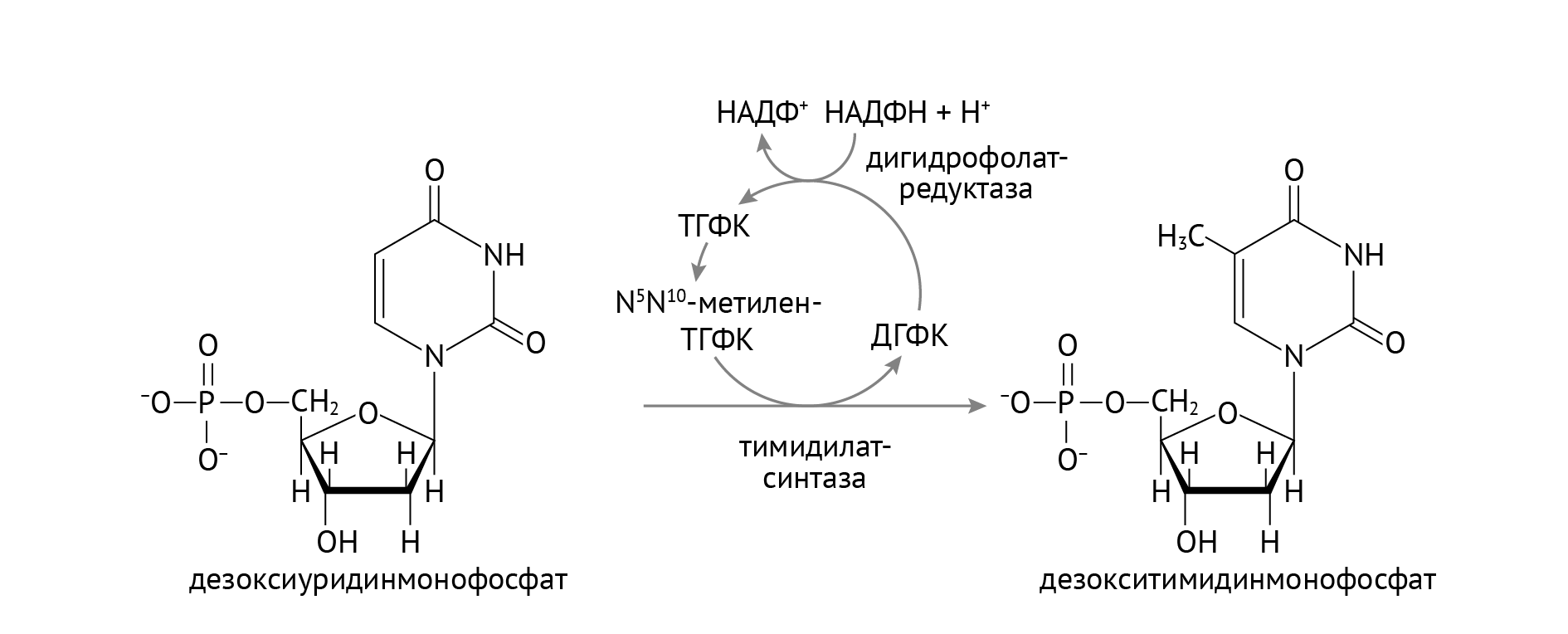
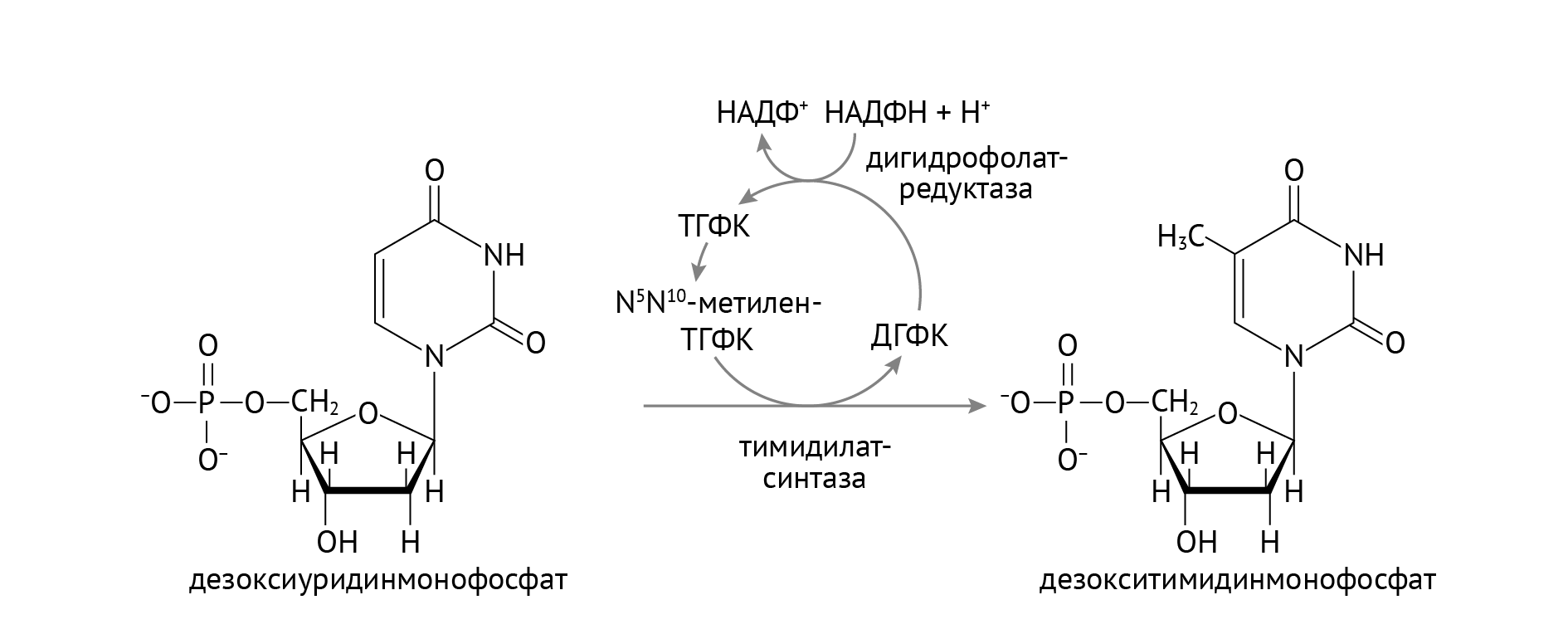
Стоит обратить внимание на важную роль НАДФН, который участвует в восстановлении тиоредоксина в тиоредоксинредуктазной реакции (см. рис. 1). Источником НАДФН является пентозофосфатный цикл глюкозы, о котором я расскажу в следующей статье. В отличие от РНК, в состав ДНК входят нуклеотиды с тимином, а не с урацилом. Откуда берется тимин, показано в реакции, изображенной на рис. 2.
Рисунок 2 | Образование дезокситимидинмонофосфата
Здесь также большое значение имеет НАДФН из пентозофосфатного цикла. Однако помимо НАДФН, важными участниками образования тимина (если быть занудой, дезокситимидинмонофосфата) являются фолиевая кислота и витамин В12 (восстанавливает фолиевую кислоту до активной формы, не указан на данном рисунке) [1]. Это объясняет механизм мегалобластной анемии, а также именно эта реакция является фармакологической мишенью таких противоопухолевых препаратов, как 5-фторурацил и метотрексат.
Субстратом для синтеза нуклеиновых кислот, как известно из прошлой статьи, служат пуриновые (аденин, гуанин, которые часто реутилизируются) и пиримидиновые (урацил, цитозин, тимин) нуклеотиды. Образование азотистых оснований требует активного вовлечения аминокислот (аспартат, глутамин, глицин), фолиевой кислоты и даже аммиака (в виде NH4+ иона). Нуклеотиды синтезируются эндогенно, и биохимическую цепочку превращений здесь можно представить в упрощенном виде следующим образом: аминокислоты → азотистые основания → нуклеотиды → нуклеиновые кислоты. Поэтому белковая недостаточность (ситуация, когда белков и аминокислот в организме расходуется больше, чем поступает) может привести к ухудшению пролиферативных и регенераторных процессов [1, 3, 8].
Для понимания того, что далее будет описано в этой статье, тебе следует помнить об уровнях структуры ДНК. Материал для меня самого очень непростой, но фундаментальный, и потому крайне важный.
Первичная структура ДНК — последовательность дезоксирибонуклеотидов (ДРН) в виде единой полинуклеотидной цепи.
Вторичная структура ДНК — это две полинуклеотидные цепи, соединенные между собой водородными связями и упакованные в виде спирали.
В ходе последовательной укладки при участии гистоновых белков формируется третичная структура ДНК, которую называют хромосомой. В клетке она располагается в комплексе с белками (нуклеопротеидами), и весь этот комплекс (хромосома + белки) носит название хроматина. Чуть позже мы рассмотрим, каковы современные представления относительно пространственной организации хроматина в клетке, и выясним, почему здесь все не так просто, как говорят в университете и пишут в учебниках.
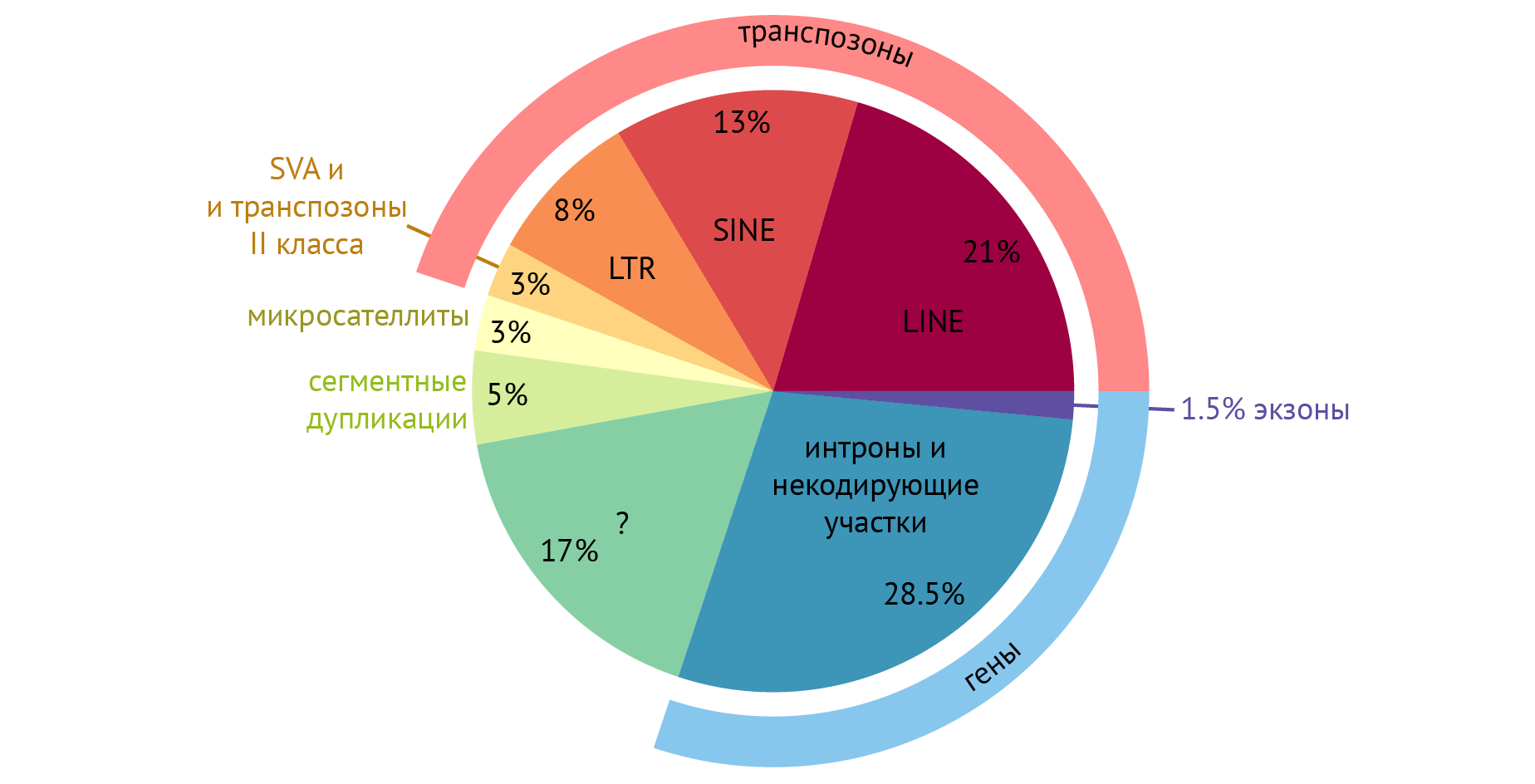
На рис. 3 схематически представлены функциональные составляющие нашего генома. Можно обратить внимание на то, что гены — участки ДНК, кодирующие информацию о структуре различных полипептидов, составляют всего 30 % от всего генома. Если посмотреть еще внимательнее, то на схеме можно найти такое слово, как экзоны — последовательности ДНК, которые несут информацию о структуре полипептидов и РНК. Удивительно, но получается, что лишь 1,5 % нашего генома что-либо кодирует. А зачем тогда вообще остальные составляющие? Попробуем разобраться и не сойти с ума. Начнем по порядку.
Рисунок 3 | Типы последовательностей в геноме человека
Ген — участок ДНК, несущий информацию о функциональным полипептиде или о молекуле РНК. Ген кодирует первичную последовательность аминокислот.
Согласно центральной догме молекулярной биологии (которая, кстати, уже давно не догма), биологическая информация, заключенная в геноме, превращается в функционально активные белки путем серии процессов (ранее считалось, что они однонаправлены), которые можно схематично изобразить так:
- ДНК → (транскрипция) → РНК → (трансляция) → белок
Нетрудно заметить, что первым процессом является транскрипция — процесс считывания информации об аминокислотной последовательности пептидов с ДНК и перенос этой информации на рибонуклеиновую кислоту (РНК).
Информация о структуре полипептидов заключена именно в генах. Ген в структурном отношении представляет из себя совокупность кодонов — участков ДНК, состоящих из трех нуклеотидов. Каждый кодон кодирует одну аминокислоту: это достаточно простой принцип кодирования [3].
Как уже стало ясно, далеко не все участки ДНК обязательно что-то кодируют… Или нет?
«Около 99 % ДНК человека в принципе ничего не кодирует и не несет какой-либо информации о белках или РНК». Этот тезис разбивается в пух и прах при знакомстве с результатами работы проекта ENCODE, с которыми можно ознакомиться тут. Один из главных выводов заключается в следующем: бо́льшая часть (80,4 %) генома человека участвует по крайней мере в одном биохимическом событии, связанном с РНК и/или хроматином [16].
Если говорить непосредственно о генах, то в них все же встречаются некодирующие последовательности, и называются они интронами. Они к месту или не к месту вставлены внутри генов между кодирующими участками ДНК, которые несут какую-либо информацию и называются экзонами [6]. В генах интроны перемешаны с экзонами. Количество интронов в одном гене может достигать 85 %. К чему такие сложности?
У прокариот лишь немногие гены содержат интроны, а у эукариот интронов очень много. Сравни сложность организации бактерий и сложность организации студента обыкновенного. Еще больше вопросов вызывает тот факт, что генов-то у нас не намного больше.
Считается, что такое усложнение в структуре ДНК является следствием сложности нашей биологической организации: чтобы построить такое произведение биологического искусства, как наш организм, требуется очень тонкая регулировка процессов реализации генетической информации. Один из аспектов этой тонкой регулировки — жонглирование экзонами и интронами на посттранскрипционном этапе, который называется альтернативным сплайсингом. Об этом информация будет чуть ниже, но пока могу сказать, что явление альтернативного сплайсинга позволяет получить множество разнообразных белков из ограниченного числа генов. По-видимому, для достижения биологического разнообразия клеткам проще было научиться управлять малым числом генов, чем увеличивать их количество.
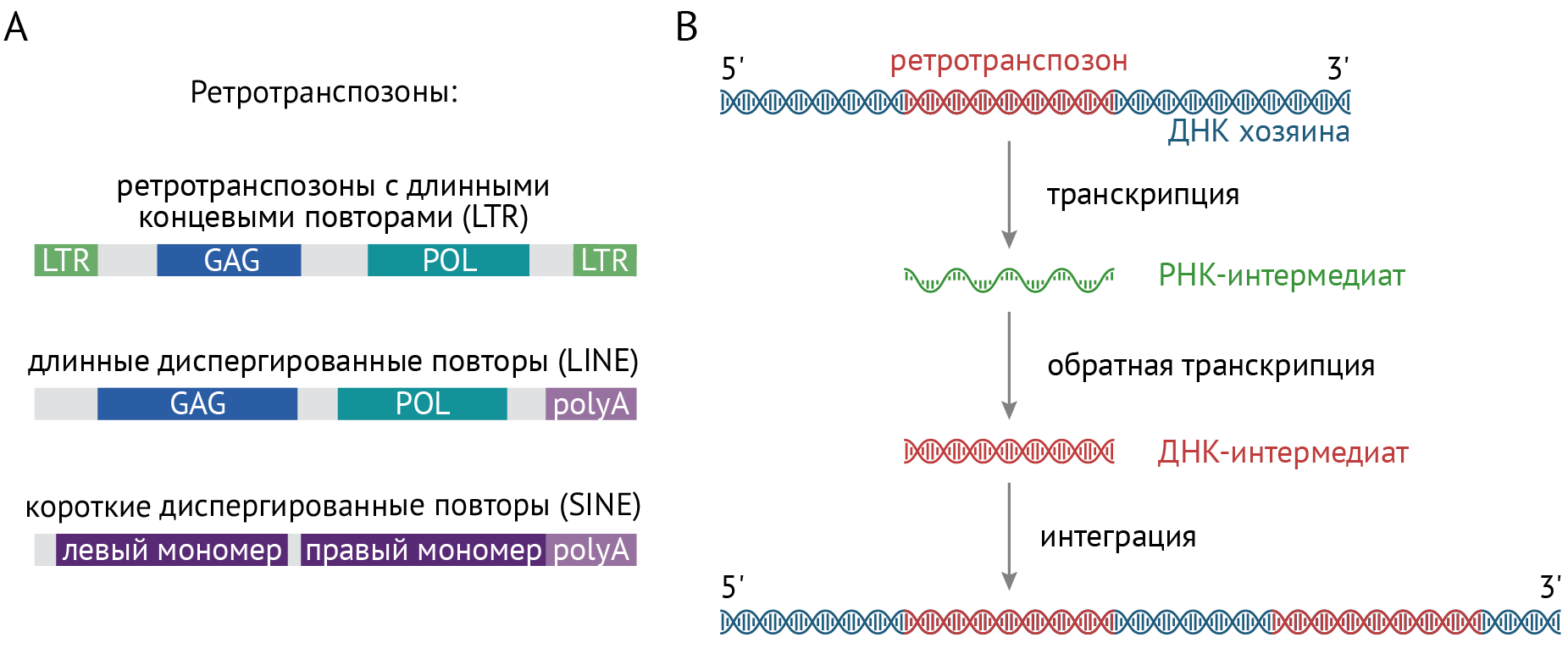
Транспозоны — подвижные генетические элементы, которые перемещаются с места на место внутри генома по не до конца изученным принципам. Транспозоны составляют до половины нашего генома, и у многих исследователей возникает логичный вопрос: почему? Каково их значение?
На сегодняшний день накоплены данные, свидетельствующие о видообразующей роли транспозонов [14]. Считается, что именно транспозоны, эти активные, подвижные, часто мутирующие элементы ДНК, могут быть одной из причин генетического разнообразия среди разных видов. Между тем, в контексте отдельно взятой бренной человеческой жизни, роль транспозонов сводится к реализации программы онтогенеза, а еще к возникновению различных заболеваний. Связано это с тем, что под действием различных стимулов, в том числе стрессовых для клетки, транспозоны способны менять свое расположение в геноме. В ряде случаев это способно изменить структуру генов и характер их считывания, а следовательно, структуру и функцию кодируемого генами белка. К слову, именно транспозоны являются участками ДНК, которые претерпевают мутации наиболее часто.
Выделяют аж четыре класса транспозонов, но функционально активным считается только один класс — ретротранспозоны, а именно элементы с длинными вкраплениями (LINE1 — TE). Существование транспозонов является одним из опровержений догмы молекулярной биологии, поскольку механизм встраивания транспозона в различные участки генома включает в себя процессы обратной транскрипции (см. рис. 4).
Рисунок 4 | Механизм встраивания транспозона
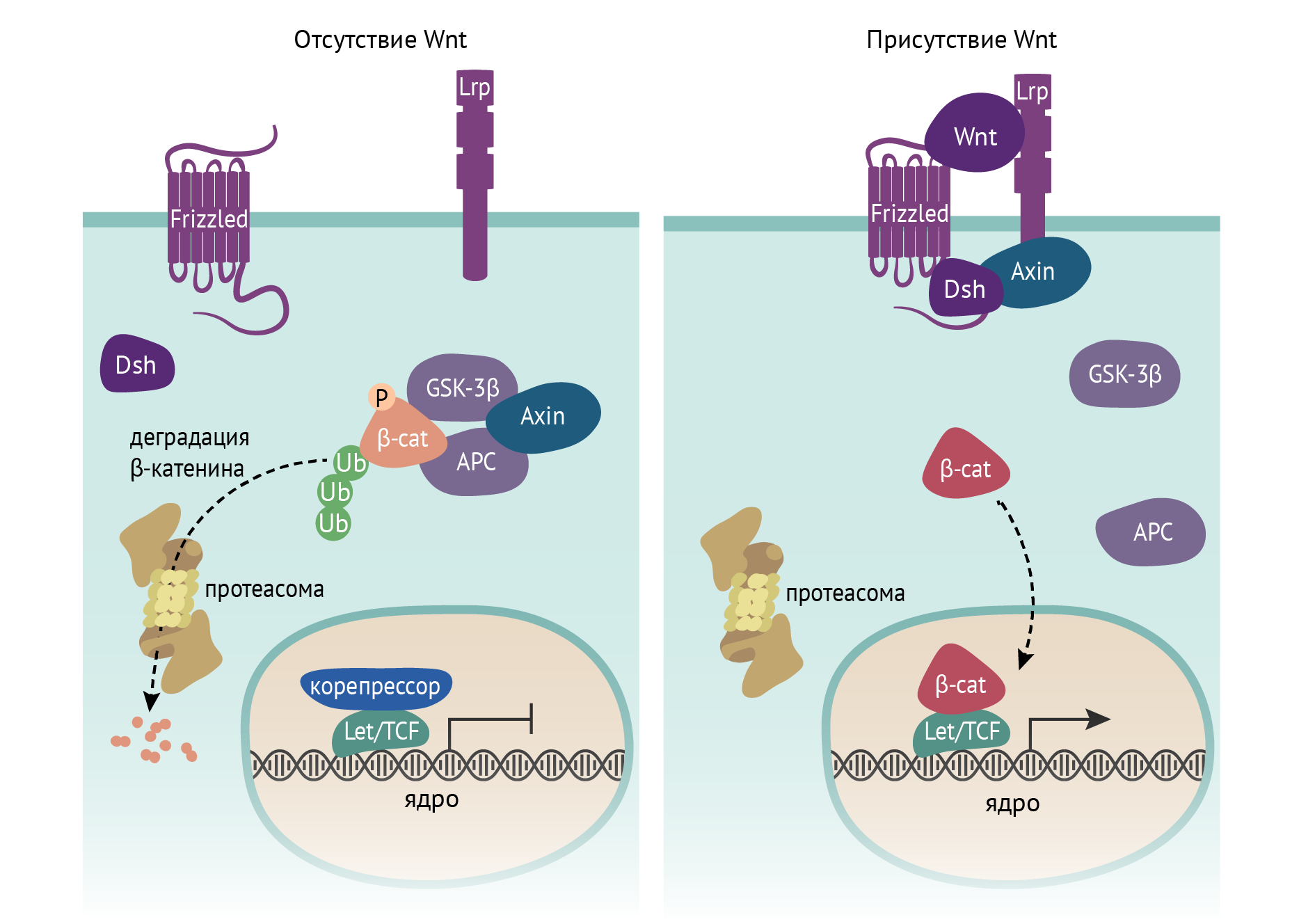
В результате перемещения транспозонов по геному возможны изменения экспрессии определенных генов, что может вносить свой вклад в развитие различных заболеваний, главным образом опухолевых. Одним из примеров является мутантная вставка (транспозиция) L1 в гене аденоматозного полипа (adenomatous polyposis coli, АРС), что лежит в основе формирования тубулярных аденом толстой кишки и колоректального рака. В результате такой транспозиции выключается функция данного белка и наступает постоянная активация сигнального молекулярного пути, приводящего к пролиферации клетки и развитию новообразований (cм. рис. 5).
Рисунок 5 | Транспозоны. Выпадение функции белка АРС в результате транспозиции L1 с затрагиванием гена АРС приводит к конститутивной (постоянной) активности β-катенинового сигнального пути и развитию аденом и карцином толстой кишки. Белок АРС является ключевым компонентом мультибелкового комплекса, ингибирующего β-катенин путем запуска его протеасомной деградации.
Как уже было сказано, транспозоны имеют важное значение в онтогенезе, и их роль в развитии заболеваний является лишь обратной стороной медали нашего биологического разнообразия. В некоторых статьях раскрывается значение транспозонов в эволюции и онтогенезе нейронов [20]. Без транспозонов невозможна реаранжировка генома лимфоцитов, необходимая для обеспечения разнообразия синтеза антител и рецепторов к различным антигенам [1, 3, 6]. Когда-нибудь выйдет отдельный лонгрид на эту тему, но сейчас нам нужно двигаться дальше.
В геноме можно найти малопонятные по своему значению элементы, и одними из таких являются SSR. В структурном отношении это короткие последовательности пар нуклеотидов (приблизительно штук 10), которые повторяются миллионы раз. Они ничего не кодируют, но играют сателлитную (вспомогательную) роль, определяя ряд очень важных функций в клетке. В частности, такие сателлитные последовательности локализованы в теломерах и в центромере хромосом, что позволяет реализовывать процессы, происходящие при делении клеток [3].
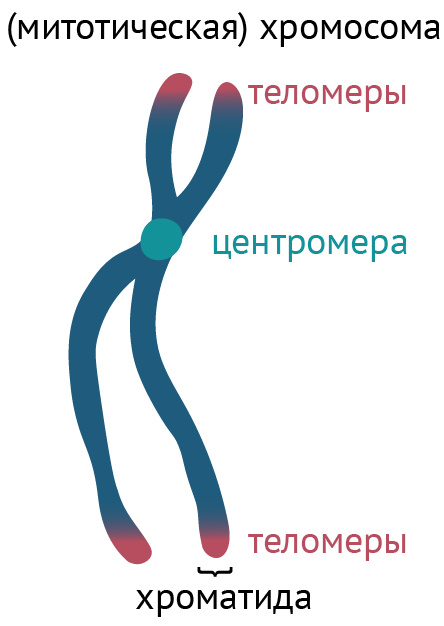
Говоря о структуре хромосом, нельзя пройти мимо центромер.
Рисунок 6 | Упрощенное изображение хромосомы
Центромера — это участок хромосомы, который соединяет собой сестринские хроматиды (см. рис. 6), но главное даже не это. Центромера является местом прикрепления белков, связывающих хромосомы и веретено клеточного деления, тем самым обеспечивая расхождение хроматид во время деления клеток. Это необходимо для распределения генетического материала по дочерним клеткам.
Сателлитные последовательности имеют важное клиническое значение. Опухолевый процесс в ряде случаев сопровождается возникновением так называемой микросателлитной нестабильности, когда в сателлитных участках возникает бесчисленное множество мутаций. Такое бывает при наличии дефектов в системе репарации, и данный феномен является предиктором высокой иммуногенности опухоли (продукции опухолью множества антигенов, способных индуцировать иммунный ответ), а также эффективности иммунотерапии — специфического варианта лекарственного лечения опухолевых заболеваний, который реализуется путем ингибирования контрольных точек иммунного ответа и помогает клеткам иммунной системы (Т-киллерам, натуральным киллерам, макрофагам) уничтожать опухолевые клетки. Положительная предиктивная роль микросателлитной нестабильности в отношении эффекта иммунотерапии продемонстрирована во множестве исследований и обзоров [15].
Оставляю тебя с этой информацией, и как только ты вернешься, мы продолжим постигать азы биохимии.
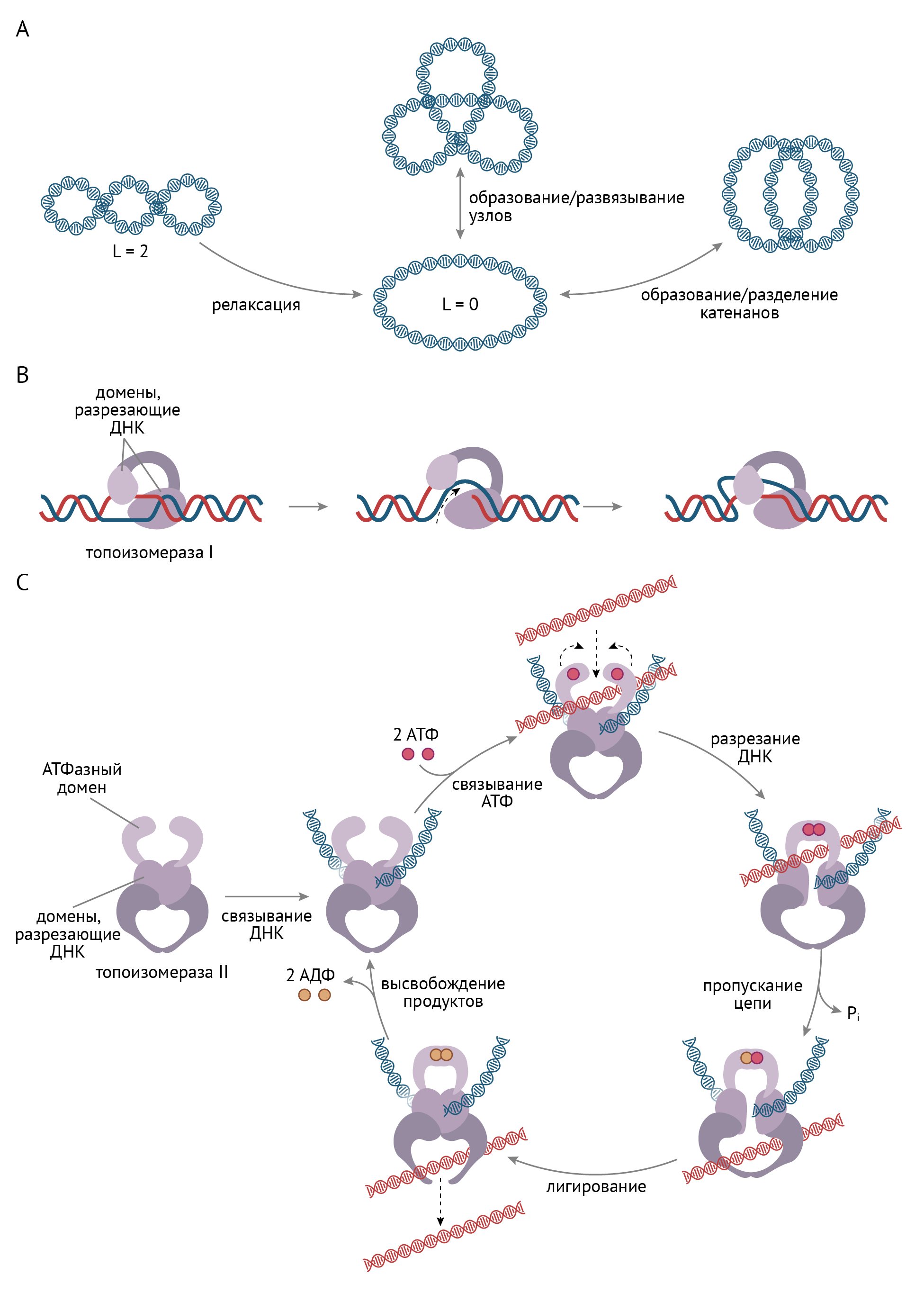
ДНК в ходе репликации может подвергаться сверхспирализации. Этот вариант сворачивания ДНК не позволяет считать с нее что-либо. В состоянии сверхспирализации молекула ДНК наиболее стабильна в энергетическом отношении. То есть она приобретает такую конформацию, которая требует минимального (насколько это возможно) количества энергии. Это не ее причуда: данный феномен имеет термодинамическое обоснование.
Чтобы считать с нее информацию или продолжить репликацию, эту суперспираль нужно распаковать, причем это одинаково важно как в прокариотических (бактериях), так и в эукариотических клетках. Для этого есть ферменты, получившие название топоизомераз (рис. 7), которые различаются у прокариот и эукариот. Без топоизомераз клетка не может экспрессировать гены, что приводит к ее смерти [3].
Рисунок 7 | Сверхспирализация ДНК в ходе репликации и функция топоизомераз
Как ясно из рис. 7, топоизомеразы нужны для того, чтобы молекула ДНК не превратилась в непонятную кашу, информацию с которой невозможно считать. К концу статьи ты также узнаешь, как и почему топоизомераза стала мишенью для ряда очень важных фармакологических препаратов.
Гистоны выводят ДНК на новый уровень, накручивая ее на себя самым причудливым образом. В этом участвует несколько фракций гистоновых белков (Н1, Н2А, Н2В, Н3, Н4). Гистоны глубоко консервативны, то есть их структура идентична гистонам более простых организмов, что для меня (убедительный уровень аргументации, правда?) подчеркивает высокое биологическое значение этих белков [1, 3, 8]. Однако как именно гистоны укладывают ДНК в более компактную структуру, которая не мешает клетке выполнять ее функции, не вполне ясно и сейчас.
Что касается третичной структуры ДНК, на сегодняшний день наши представления довольно размыты. Во многих учебниках биологии и биохимии (преимущественно русскоязычных) отражена иерархическая модель укладки ДНК. Согласно этой модели, ДНК-нуклеосомы размером 11 нанометров складываются в 30 нанометров, а затем в волокна размером от 120 до 700 нм.
Проблема в том, что данная модель была продемонстрирована в условиях in vitro. То есть из клетки были удалены другие компоненты, применялись детергенты и растворы с очень высоким содержанием солей. Поэтому вопрос, как же на самом деле уложен хроматин в клетке, долгое время оставался открытым.
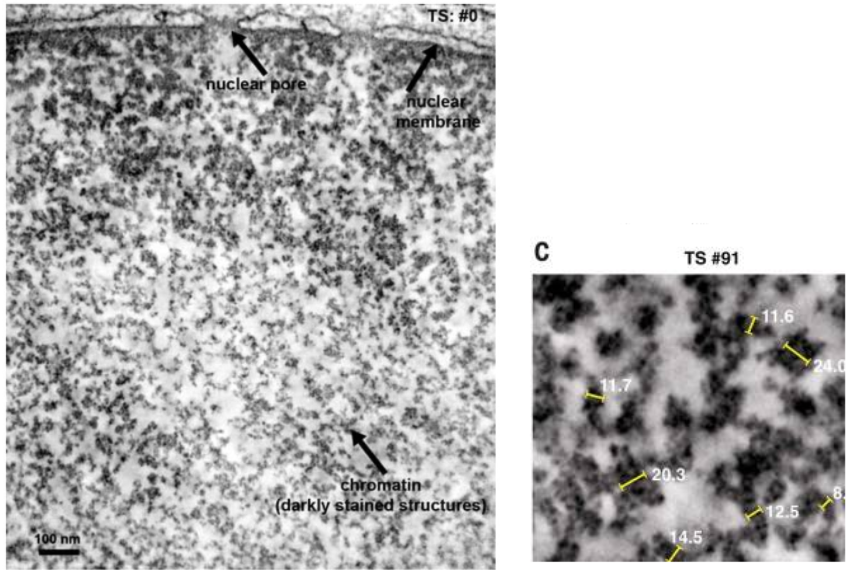
Пролить свет на этот вопрос получилось у группы исследователей с помощью особого метода визуализации — ChromEMT [14]. Исследователи применили осмиофильный полимер, который позволил избирательно увеличить контрастность хроматина и лучше рассмотреть его пространственную организацию при помощи электронного микроскопа.
С помощью этой методики исследователям удалось выяснить, что диаметр хроматина в разных фазах клеточного цикла колеблется от 5 до 24 нм и что сам хроматин представляет собой неупорядоченную цепь с различными диаметрами (от 5 до 24 нм) с множеством вариантов расположений нуклеосомных частиц, бесчисленным количеством структурных конформаций и способностью изгибаться в различных плоскостях для достижения компактной ориентации в ядре. Для того, чтобы укомплектовать хроматин в ядре, не нужно формировать из него дискретные волокна более высокого порядка (в 30, 300 нм и т. д.), как считалось ранее. Нуклеосомные частицы диаметром 30 и более нм в различных фазах клеточного цикла найти просто не удалось [13]. Ниже прикреплена иллюстрация, изображающая трехмерную структуру генома в клеточном ядре (рис. 8, 9).
Рисунок 8 и 9 | Укладка хроматина в ядре. Данные полученные методом визуализации ChromEMT.
В целом функция гистонов сводится к компактному упаковыванию ДНК, а также к регуляции процессов считывания ДНК: репликации и транскрипции.
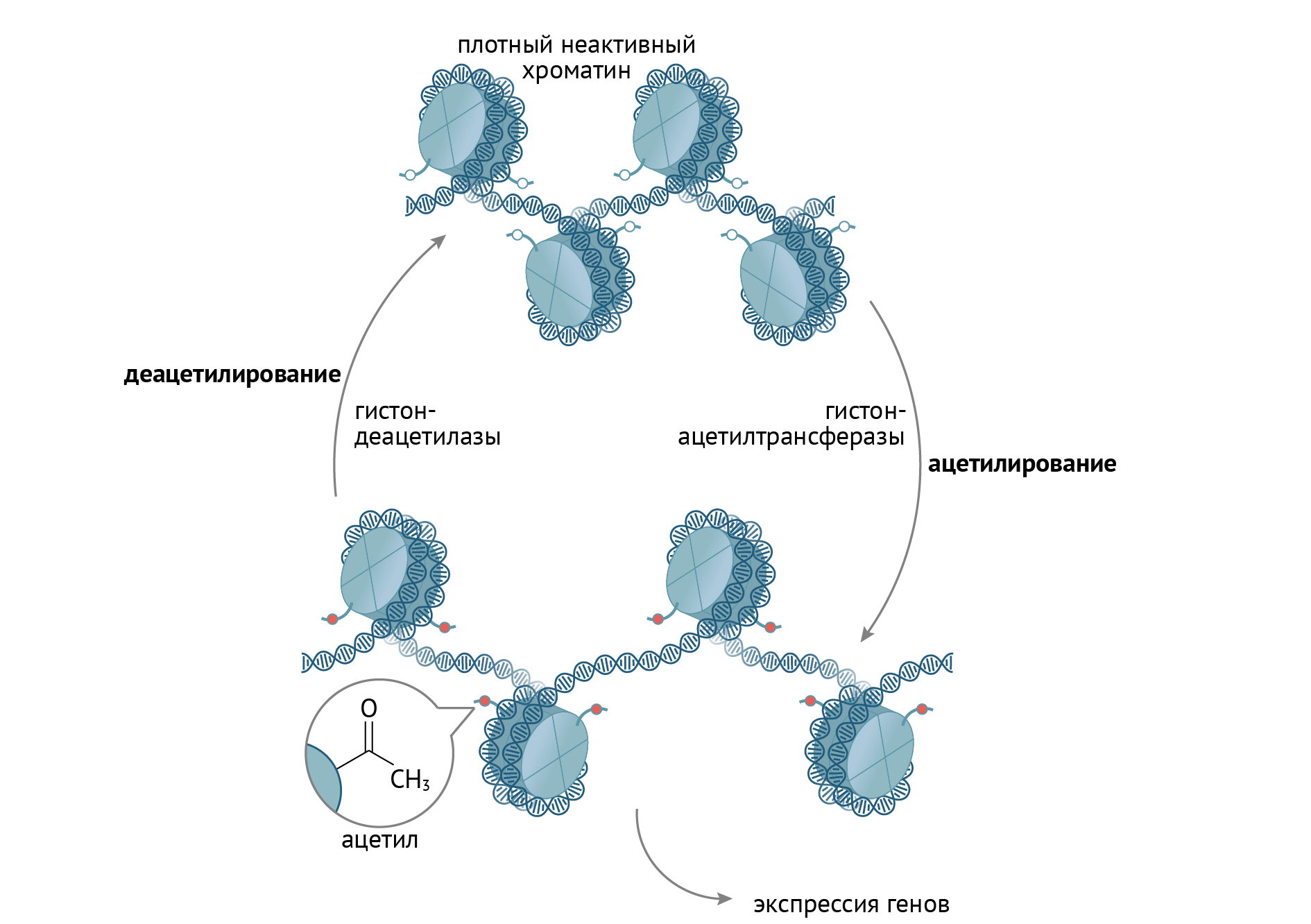
Структура гистонов изменяется при действии на них различных транскрипционных факторов. Эти факторы химически модифицируют N-конец гистона (путем ацетилирования, фосфорилирования, деацетилирования, метилирования), что ведет к изменению конформации гистоновых белков в целом. В ряде случаев это приводит к увеличению доступности соответствующих генов для процессов транскрипции. В виде упрощенной схемы это выглядит так (рис. 10):
Рисунок 10 | Химическая модификация гистонов, лежащая в основе эпигенетической регуляции транскрипции генов
Мы подошли к самому сложному и интересному. Проследим цепь событий. У нас есть клетка, которая живет своей жизнью и которой, в общем-то, все равно, что происходит вокруг нее: она выполняет свою функцию, перебрасываясь с другими клетками цитокинами и метаболитами, и меряется с ними размерами своих цитоподий. Внезапно она получает «пинок» — молекулярный сигнал от старшего товарища по ткани в виде паракринных факторов роста (например, EGF — эпидермальный фактор роста; IGF-1 — инсулиноподобный фактор роста 1 и др.) или ловит своим рецептором гормон (например, эстрадиол). При воздействии на клетку вышеуказанных молекул она понимает только одно: ей приказано делиться. Химический сигнал, словно бестактное восклицание соседки: «А когда замуж?», выводит клетку из состояния покоя, когда воздействует на ее рецепторы к факторам роста. Серия реакций внутри клетки приводит к тому, что гистоны (после ацетилирования) всеми фракциями отсоединяются от ДНК, делая ее доступной для репликации, и, неожиданно, словно твое отчисление из вуза, наступают пресинтетическая и синтетическая фазы клеточного цикла. Теперь перед нами — обнаженная ДНК в виде двойной спирали, из которой нужно сделать таких две. На первый взгляд миссия более чем невыполнимая, но, как и везде, нужно подходить к этому процессу последовательно. Предлагаю не тянуть с этим.
В главных ролях:
- ДНК-полимераза;
- ДНК-хеликаза;
- ДНК-топоизомеразы;
- ДНК-праймаза;
- ДНК-гираза;
- ДНК-связывающие белки.
Во второстепенных ролях:
- Факторы, инициирующие транскрипцию ДНК (их великое множество);
- Белки клеточного цикла (о которых мы поговорим позднее).
Этапы репликации ДНК:
- инициация;
- элонгация;
- терминация.
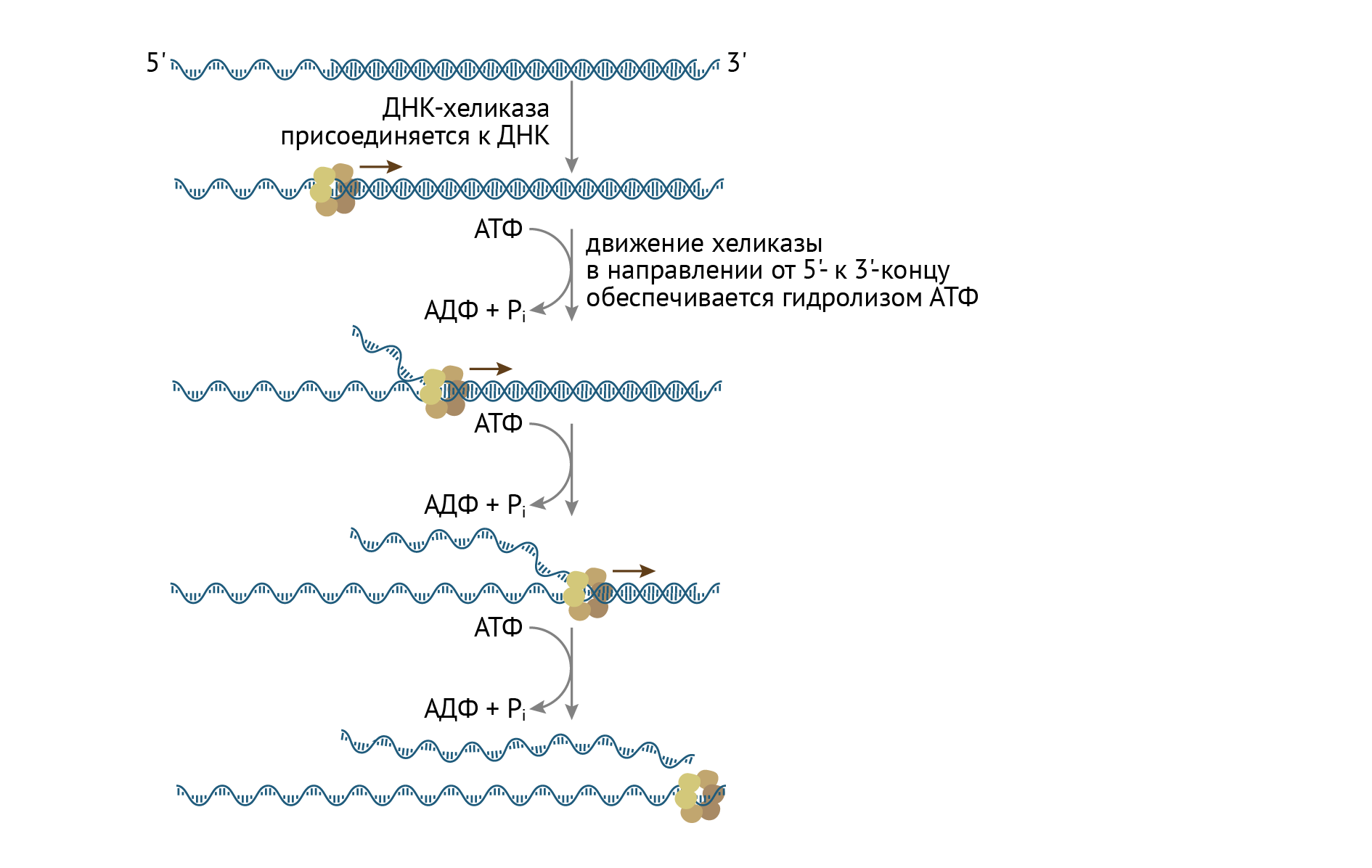
Уже известный нам белок, ДНК-хеликаза, присоединяется к точке инициации на молекуле ДНК. Эта точка характеризуется множеством ТА-пар в структуре и является сайтом связывания репликативного комплекса. Это связывание возможно после предварительной денатурации данного участка ДНК. Далее хеликаза движется от 5′ к 3′-концу, раскручивая ДНК по мере продвижения. Параллельно действуют не только ДНК-связывающие белки, удерживающие разъединяющиеся цепи ДНК от необдуманных поступков, но и уже известные топоизомеразы (ДНК-гираза или ДНК-топоизомераза 2), которые снимают топологическое напряжение (стремление к спирализации и замыканию в себе) с цепей ДНК (рис. 11) [1, 3, 6, 8].
Рисунок 11 | Процесс расплетания двойной спирали ДНК с помощью ДНК-хеликаз и ДНК-связывающих белков
ДНК-полимераза не спешит работать. Она до последнего будет тянуть с синтезом нуклеиновой кислоты. Связано ли это с ее тенденцией к созидательному созерцанию или с ее природным высокомерием, но она возьмется за работу только после того, как будет установлен праймер. Праймер — это своеобразная РНК-затравка, фрагмент РНК, синтезированный РНК-праймазами. Он нужен для того, чтобы ДНК-полимеразе было что удлинять, ибо главная причина ее долгого включения в работу — неспособность синтезировать РНК-фрагмент de novo, то есть с нуля. Она может лишь удлинять имеющийся фрагмент. С формированием праймеров связан переход фазы инициации в фазу элонгации (удлинения) цепи.
ДНК-хеликаза связывается с РНК-праймазой, и это взаимодействие обусловливает синтез лидирующей цепи ДНК (рис. 12) [3].
Рисунок 12 | Фаза элонгации
Синтез лидирующей цепи осуществляет ДНК-полимераза 3. Синтез на данной цепи осуществляется непрерывно, путем простого присоединения дезоксирибонуклеотидов к 3′-концу предыдущего нуклеотида. Это называется синтезом от 5′ к 3′-концу.
Но события разворачиваются так, что ДНК-полимераза 3 работает на два фронта и синтезирует также и отстающую цепь. ДНК-полимераза способна работать только в направлении от 5′ к 3′-концу. Отстающая цепь характеризуется противоположным направлением нуклеотидов, и, если бы ее синтез тоже был непрерывным, репликативная вилка бы полностью распалась. А вот РНК-праймаза может синтезировать цепи в направлении 3′-5′. Она делает небольшой фрагмент, который затем просто удлиняется ДНК-полимеразой. Такие кусочки называются фрагментами Оказаки. РНК-участок потом вырезается эндонуклеазой и РНК-азой. Но что самое шокирующее: синтез происходит одновременно и скоординированно. А ты жалуешься, что тебе трудно совмещать учебу с работой!
Секрет успешной работы ДНК-полимеразы 3 прост: на отстающей цепи также работает комплекс ДНК-хеликазы и ДНК-праймазы. Все вместе это можно назвать праймосомой. Далее фрагменты Оказаки сшиваются ДНК-лигазой [1, 3].
Получилось много текста, поэтому резюмирую:
- Для начала репликации нужно найти сайт связывания репликативного комплекса.
- ДНК-хеликаза необходима для разъединения цепей, иначе считать их невозможно.
- ДНК-праймаза и ДНК-полимераза необходимы для синтеза и удлинения нуклеиновой кислоты (ДНК), а ДНК-топоизомераза и ДНК-связывающие белки — для того, чтобы цепи ДНК не приняли «нечитаемую» конформацию.
- Одна дочерняя цепь синтезируется непрерывно, другая — прерывисто с помощью фрагментов Оказаки.
* Теломеры и теломеразы. В ДНК есть также концевые фрагменты, состоящие из множества повторяющихся пар нуклеотидов и не несущие существенной смысловой нагрузки. Эти фрагменты несут название теломеров (см. рис. 6).
В ходе репликации эти концевые теломеры не воспроизводятся полностью, и с каждым делением клетки теломеры постепенно укорачиваются на 5–6 пар нуклеотидов. В контексте данного вопроса выделяют такое понятие, как лимит Хейфлика — число делений, при которых еще есть чему укорачиваться. В среднем после 50–52 делений клетки теломеры укорачиваются до такой степени, что репликация в определенный момент становится невозможной, и клетка останавливается в G0-фазе (фаза покоя) клеточного цикла или запускает программу апоптотической гибели. Выходит, что по достижении данного лимита становится невозможной регенерация клеток и тканей организма. Считается, что это один из ведущих факторов, обусловливающих старение организма и конечность нашего существования (об этом говорит эпигенетическая теория старения). В этом есть свой биологический смысл, ведь при большом количестве делений происходит накопление структурных нарушений в ДНК — мутаций, которые способны стать причиной развития опухолевых заболеваний.
Однако существуют клетки (например, эмбриональные, половые и опухолевые), в которых есть теломераза — фермент, который достраивает теломеры в ДНК [2, 3]. Такое достраивание теломер делает опухолевые клетки бессмертными, поскольку возможное количество делений клеток при наличии теломеразы становится практически неограниченным.
* Топоизомеразы и мишени для фармакологических препаратов. В бактериальных клетках, как и в эукариотических, после репликации хромосомы принимают конформацию, которая наиболее выгодна в термодинамическом отношении (требует минимального количества энергии для ее поддержания), но не выгодна в отношении жизнедеятельности клетки. Что это значит? По окончании репликации цепи ДНК переплетены между собой таким образом, что транскрипция (образование мРНК в результате считывания генетической информации с ДНК) невозможна: ферментам, обеспечивающим процесс транскрипции, просто не подобраться к необходимому участку ДНК, поскольку она упакована для этого самым неподходящим образом, в виде конгломерата. Этот конгломерат цепей не распутать без участия ДНК-топоизомеразы IV (топоизомеразы II типа). Они вносят кратковременный разрыв в обе цепи ДНК, и одна из цепей ДНК может пройти через этот разрыв (рис. 7) [3].
* Топоизомераза IV является важной лекарственной мишенью для противомикробных препаратов широкого (очень) спектра действия — хинолонов и фторхинолонов. Препараты избирательны по отношению к топоизомеразе IV и не проявляют интереса к топоизомеразам эукариот, что делает их применение очень удобным (и подчас спасает жизни). Как ты понимаешь, если вновь образовавшиеся хромосомы похожи на сыр «косичка», адекватно считать с них информацию бактериальная клетка не может. И ей ничего не остается, как погибнуть. Несмотря на селективность данных препаратов, их нельзя назвать абсолютно безопасными, но об этом ты узнаешь чуть позже на фармакологии [3, 9].
Синтез РНК в общих чертах напоминает репликацию ДНК с некоторыми нюансами:
- РНК-полимераза самодостаточна: ей не нужен праймер для начала работы.
- Субстратом для образования РНК являются рибонуклеотиды с аденином, гуанином, цитозином и урацилом (вместо тимина).
- Если при репликации копируется вся цепь ДНК, то в случае с транскрипцией читается лишь определенный участок ДНК, а именно ген, кодирующий определенный полипептид.
- Синтез РНК начинается после связывания РНК-полимеразного комплекса с промотором. Это участок ДНК, который сигнализирует: синтез данного полипептида нужно начать отсюда. Промотор богат ТАТА-последовательностями нуклеотидных пар, за что получил кличку «ТАТА-бокс» [1, 3].
Даже стадии транскрипции такие же, как и стадии репликации: инициация, элонгация и терминация. Но опять же с некоторыми нюансами.
Сначала нужно образовать транскрипционный комплекс. В него входят:
- белки, обладающие хеликазной (т. е. «распутывающей нити») активностью;
- белки, связывающие ТАТА-бокс;
- белки, стабилизирующие всю эту машину;
- белки, связывающие РНК-полимеразу II с ДНК в области ее промотора;
- РНК-полимераза II типа (да, у эукариот их три) и белки, которые ее фосфорилируют.
Более того, в этой машине для синтеза РНК есть даже белки, которые обладают репаративной активностью, т. е. во время транскрипции осуществляют эксцизионную репарацию. Эксцизионная репарация — метод устранения структурных нарушений в ДНК (мутаций) путем «вырезания» или так называемой эксцизии участка ДНК, имеющего структурный дефект, и последующей достройки недостающего участка по принципу комплементарности.
В целом все эти белки можно обозвать факторами транскрипции, которым на Западе дали различные буквенные обозначения, но они сейчас нас мало интересуют. Получается здоровая такая бюрократическая машина, но с совсем не бюрократическими целями [1].
Инициация запускается в области промотора, но сама структура промотора не имеет ничего общего с кодирующей областью ДНК и с кодирующим полипептидом соответственно. Запускается она путем множественного фосфорилирования РНК-полимеразы двумя участниками транскрипционного тандема.
Удлинение цепи без регистрации и СМС путем простого присоединения нуклеозидтрифосфатов по направлению к 3′-концу. РНК-полимераза II типа на стадии элонгации обладает нереально высокой активностью, которая поддерживается связанными с нею белками (факторами элонгации) [3].
Когда весь здоровенный комплекс натыкается на сайты терминации, РНК-полимераза дефосфорилируется и слезает с ДНК, выдавая готовую прематричную РНК. Из нее уже можно получить что-то дельное [8].
Комментарий
У эукариот выделяют три РНК-полимеразы, но главную роль в генной экспрессии действительно играет именно РНК-полимераза II. РНК-полимераза II образует прерибосомные РНК, которые участвуют в образовании рибосом — подпольных фабрик по синтезу белка. РНК-полимераза III участвует в образовании специализированных РНК, функции которых до конца не охарактеризованы [3].
* РНК-полимеразы тоже плачут. Нечасто используемый, но чрезвычайно сильный антибиотик рифампицин (из группы ансамицинов) способен подавлять синтез бактериальных РНК путем связывания с -субъединицей бактериальных РНК-полимераз. В результате ее инактивации не происходит высвобождение промотора при транскрипции (по сути, не начинается транскрипция). Это позволяет использовать рифампицин в самых тяжелых случаях: при стафилококковом остеомиелите, эмпиеме плевры и даже различных формах туберкулеза [8, 9].
После образования первичного транскрипта (первичной, или пре-мРНК) происходит ее обработка в виде процессинга. Он включает в себя:
Кэпирование (присоединение 7-метилгуанозина, связанного с 5′-концевым остатком мРНК). Функция этой метки — защита мРНК от рибонуклеаз, а еще он имеет значение для инициации трансляции.
Полиаденилирование — присоединение множества нуклеотидов с аденином на конец пре-мРНК, имеет ту же цель, что и кэпирование — защитить от рибонуклеаз ядра и цитоплазмы (защита недолгая, но какая есть). Полиаденилирование также способствует инициации трансляции: полиаденилированный конец мРНК способствуют правильной взаимной пространственной ориентации малой субъединицы рибосом и мРНК.
Сплайсинг. Это самая интересная часть, которая заключается в вырезании интронов — участков ДНК, не несущих в себе информации. Вновь синтезированная молекула РНК называется первичным транскриптом, и именно она подвергается дальнейшей модификации в виде сплайсинга. Вырезание интронов происходит под действием сплайсосом (кстати, они являются РНК по своей природе). На выходе мы получаем пептид, состоящий только из экзонов: в процессе сплайсинга интроны удаляются из первичного транскрипта, а экзоны соединяются с образованием непрерывной последовательности, которая и соответствует тому или иному функциональному полипептиду (рис. 13) [1, 3, 6, 8].
Рисунок 13 | Сплайсинг первичного транскрипта [6]
Наиболее интересно во всей этой истории явление альтернативного сплайсинга. Мы говорили о нем, когда упоминали, что клетка научилась виртуозно жонглировать экзонами и интронами и получать различные полипептиды из ограниченного числа генов. При альтернативном сплайсинге могут «нарезаться» самые разные комбинации экзонов. В итоге на выходе получаются различные белки из одного первичного транскрипта (т. е. из одного гена) [3]. Это очень удобно для клетки.
Как же это происходит? Первичный транскрипт содержит молекулярные сигналы для всех альтернативных путей сплайсинга (т. е. потенциально способен преобразоваться в любой вариант матричной РНК), но предпочтительный в данный момент путь определяется факторами процессинга — РНК-связывающими белками, которые и запускают один конкретный путь сплайсинга. Одним из наиболее ярких примеров альтернативного сплайсинга является образование антител В-лимфоцитами.
Этот процесс сложнее, чем кажется на первый взгляд. Для его осуществления клетке нужно сделать очень много чего.
В первую очередь нужно перевести аминокислоты в такую форму, в которой они смогут участвовать в биосинтезе белка. Для этого к аминокислоте (любой) присоединяются S-KoA группы с последующим добавлением к ней тРНК. Схематично и упрощенно процесс изображен на рис. 14 [6, 8]:
Рисунок 14 | Активация тРНК для ее участия в трансляции
Только в такой форме аминокислоты способны пройти фейсконтроль на входе в рибосомы. Для этого процесса, кстати, нужны ионы магния [1]. Без него машина под названием «аминоацил-тРНК-синтетаза» не работает. В целом весь процесс трансляции (биосинтеза белка) изображен на рис. 15.
МРНК, образованная в ядре за счет транскрипции и процессинга, наконец-то попадает на место сходки. И сразу взаимодействует с меньшей субъединицей рибосомы и с активированной аминоацил-тРНК. После присоединения большой субъединицы рибосомы образуется инициаторный комплекс. Важно сказать, что инициаторной кислотой будет являться N-формилметионил- аминоацил-тРНК.
Но и это еще не все. Для инициации трансляции нужна энергия в виде ГТФ и присутствие факторов инициации трансляции [8].
Рисунок 15 | Фазы трансляции
Факторы элонгации, которых в клетке достаточно, осуществляют присоединение вновь прибывающих аминоацил-тРНК к предыдущей молекуле. Здесь, кстати, тоже соблюдается принцип комплементарности (англ. complement — дополнение) между мРНК и тРНК. Примечательно, что элонгация полипептида — это процесс, который требует энергии для осуществления, но ее источником служит не АТФ, а ГТФ. Сложно сказать, с чем связаны эти гастрономические предпочтения клетки [6, 8].
Терминация трансляции и высвобождение полипептида осуществляются тогда, когда тРНК натыкается на стоп-кодон. В результате этой встречи рибосома понимает, что никто не вечен, и распадается на субъединицы. А довольный полипептид проходит следующие круги капиталистического синтеза и попадает в ЭПР и комплекс Гольджи, где происходит укладка полипептидов и их посттрансляционный процессинг.
Для того, чтобы стать полноценными в функциональном отношении белками, полипептиды должны принять третичную (нативную) структуру. Этот этап занимает важное место в жизни белка и называется фолдингом (от англ. folding — укладка). К белкам, помогающим другому белку стать «большим», относятся белки-шапероны, или белки теплового шока.
Сворачивание белка проходит через кинетически предпочтительные стадии, определяемые особенностями первичной структуры (у разных полипептидов они разные). Это значит, что процесс будет протекать тем быстрее, чем меньше энергии необходимо. Цепочка из аминокислот не может просто так взять и превратиться в третичную структуру, это требует затрат энергии, а процесс включает определенные пространственные и химические превращения. Белковой молекуле надо помочь, и делают это белки-шапероны [3, 6]. Проследим механизм их действия по рис. 16.
Рисунок 16 | Фолдинг белков
Шапероны предотвращают агрегацию белковых молекул путем защиты от других пептидов и связывания гидрофобных групп. Используя энергию АТФ, шапероны помогают пептиду преодолеть энергетический барьер на пути к формированию нативной белковой молекулы.
Для тех, у кого не получилось стать нормальным белком, клетка предусмотрела механизм убиквитин-протеасомной деградации [2, 6] (рис. 17).
Рисунок 17 | Протеасомная деградация неудачно свернутых пептидов
К неудачному в структурно-функциональном отношении пептиду присоединяется убиквитин под действием убиквитин-активирующего фермента. С этого момента неудачный пептид является прокаженным, ведь он обладает убиквитиновой меткой. Эта метка нужна для протеасом, которые захватывают пептиды и подвергают их гидролизу. Если дефектные белки не уничтожать, то клетка заполнится хламом в виде неудачно свернутого белка (как твоя комната в общаге на второй неделе учебы), в которой невозможно будет осуществлять нормальную жизнедеятельность (ну ты понял) [2, 5, 6].
Но бывают и более благоприятные варианты развития событий. Большая часть белка подвергается другому варианту посттрансляционного процессинга в ЭПР и в комплексе Гольджи. Здесь возможны самые разные варианты химического извращения, например, присоединение глюкозы и ее производных с образованием разнообразных гликопротеидов.
Биосинтез белка и репликация ДНК, как ты мог догадаться, протекают и в бактериальных клетках, причем достаточно интенсивно. Отдельные представители размножаются со скоростью три деления в час, и это нереально быстро. Размножение бактерий сопряжено с повреждением тканей макроорганизма в месте данного безобразия, что вызывает воспалительную реакцию и становится патологоанатомической основой большинства инфекционных заболеваний бактериальной этиологии. Данные заболевания требуют назначения антибактериальных препаратов, без вариантов. Большинство этих препаратов воздействует на метаболизм белка или нуклеиновых кислот в бактериальных клетках.
Ингибиторы топоизомеразы II типа (ДНК-гиразы IV). Роль данных ферментов ты уже знаешь, но я напомню: ДНК-топоизомераза 2 типа разрывает обе цепи молекулы ДНК и пропускает в образующуюся брешь другой участок молекулы ДНК, что предотвращает спирализацию (скручивание) молекулы ДНК (рис. 7). Есть данные, что отсутствие ДНК-гиразы приводит к пространственному разобщению цепей ДНК в ходе их спирализации.
Для бактериальных клеток фермент имеет колоссальное значение, и при его отсутствии репликация попросту не начнется. Именно поэтому человечество создало препараты, способные угнетать данные ферменты, и это хинолоны/фторхинолоны [3, 6, 9].
Рисунок 18 | Формула фторхинолонов
Препаратов данного класса много, наиболее «ходовые» — ципрофлоксацин, левофлоксацин, норфлоксацин, моксифлоксацин. Общим для них является достаточно широкий спектр действия, но они не действуют на анаэробные бактерии, листерии (факультативный анаэроб), спирохеты (к ним относится возбудитель сифилиса Treponema pallidum), на микобактерии (среди них — возбудители лепры и туберкулеза). Хотя стоит заметить, что офлоксацин и ципрофлоксацин проявляют определенную активность и в отношении возбудителей туберкулеза. Препараты обладают серьезными преимуществами: они хорошо проникают в ткани, даже если поступают в организм в таблетированной форме, к ним долго развивается устойчивость бактерий, у них адекватный профиль токсичности. Однако их нельзя применять у детей (только по жизненным показаниям, off-label, через консилиум), поскольку есть данные о негативном влиянии на хрящевые зоны роста [17]. У пожилых на фоне применения фторхинолонов может развиться специфическое осложнение — разрыв ахиллова сухожилия [18]. В силу широкого распространения антибиотикорезистентности фторхинолоны сейчас являются препаратами резерва и используются преимущественно тогда, когда другие антибактериальные препараты неэффективны.
Примечательно и то, что фторхинолоны не ингибируют топоизомеразы эукариотических клеток в терапевтических дозах. Это делает их сравнительно безопасными, хотя и не означает, что они лишены побочных явлений [9].
Ингибиторы биосинтеза белка бактерий. У бактерий рибосомы отличаются меньшим коэффициентом седиментации (70S vs 80S у эукариотических клеток). Существует ряд препаратов, селективно угнетающих биосинтез белка на бактериальных рибосомах.
Макролиды неравнодушны к пептидилтрансферазному центру 50S-субъединицы рибосом бактерий. Когда молекула макролида связывается с ним, нарушаются процессы транслокации аминокислот (то есть страдает фаза элонгации), и белок не собирается.
Несмотря на то, что биосинтез белка протекает во всех бактериальных клетках, макролиды не обладают достаточно широким спектром противомикробной активности. Он ограничивается преимущественно грамположительной микрофлорой. Но главным достоинством макролидов является их высокая эффективность против внутриклеточных бактерий, паразитирующих в эукариотических клетках. К таким относят микоплазмы и хламидии, в том числе уретральные.
Представители: азитромицин, кларитромицин, рокситромицин, телитромицин, старый как мир эритромицин и прочие. Препараты характеризуются удовлетворительной переносимостью и безопасностью, что обусловливает их широкое применение [3, 9].
Рисунок 19 | Азитромицин
К особенностям макролидов относят их способность создавать высокую концентрацию в очаге воспаления. Макролиды внедряются в макрофаги, которые добираются до очага воспаления (под действием соответствующих хемоаттрактантов) к концу первых суток от повреждения ткани. К другой особенности относят способность макролидов проникать в клетки микоплазм и хламидий. Особо важное значение это имеет для педиатрии: макролиды — практически единственные антибиотики, которыми можно победить респираторный микоплазмоз у детей младшего возраста. Другие эффективные по отношению к микоплазме препараты у детей используются лишь по жизненным показаниям в силу их профиля токсичности.
Аминогликозиды. Угнетают 30S-субъединицу рибосом, что затрудняет движение рибосомы по нити мРНК. Также нарушают считывание кода мРНК и повреждают бактериальную мембрану клеток, но это уже другая история [9].
Рисунок 20 | Амикацин
Аминогликозиды применялись бы широко, если бы не их нефро-, ото- и вестибулотоксичность. Механизм повреждения слухового анализатора и вестибулярного аппарата все еще не понятен. Есть данные, что аминогликозиды активно накапливаются в пери- и эндолимфе внутреннего уха, достигают токсической концентрации в ней, угнетают биосинтез белка и нарушают целостность клеточных мембран [19]. Нефротоксичность обусловлена канальцевой секрецией аминогликозидов и токсическим повреждением эпителия канальцев почек.
Аминогликозиды — препараты с узким терапевтическим диапазоном, поэтому применяются по строгим показаниям.
Похожая ситуация сложилась с тетрациклинами. Среди них сейчас используется в основном доксициклин (рис. 21)
Рисунок 21 | Доксициклин
Тетрациклины обладают хорошей биодоступностью (в силу высокой липофильности) и исходно действуют против большого количества микроорганизмов. Но получилось так, что многие бактерии приобрели к ним устойчивость в результате бесконтрольного применения. Их применение у детей ограничено из-за токсического действия на хрящевые зоны роста. Препараты разрешено применять лишь после 8 лет. Тем не менее тетрациклины успешно используются в лечении некоторых опасных зоонозных инфекций, например, туляремии и бруцеллеза.
Рост и пролиферация клетки в обычных условиях находится под жестким контролем регуляторных систем более высокого уровня. Другими словами, пока клетке не скажут: «Делись, мать!», та не делится. Вся жизнь клетки подчинена клеточному циклу [2]. Рассмотренная нами в предыдущих параграфах репликация ДНК происходит в синтетическую фазу S, тогда как биосинтез белка может происходить во все остальные фазы. Движущей силой клеточного цикла является последовательная активация сменяющих друг друга циклинзависимых протеинкиназ, набор которых в зависимости от фазы цикла различается, во многом в результате действия на клетку различных биохимических сигналов (факторов роста, цитокинов, гормонов) [2, 3]. Схематично сигнальные каскады клетки проиллюстрированы на рис. 22.
Рисунок 22 | Сигнальные каскады, запускающие деление клетки [1]
Различные рецепторы к факторам роста (эпидермальному, фибробластическому, тромбоцитарному, инсулиноподобным) при взаимодействии со своим лигандом индуцируют активацию каскада внутриклеточных биохимических реакций, приводящих к изменению транскрипции различных циклинзависимых киназ и других участников, обусловливающих смену фаз клеточного цикла [2 ,6].
Реакции, запускающие смену фаз клеточного цикла, сложны и многогранны, но их суть сводится к активации определенных транскрипционных факторов, которые в свою очередь обеспечивают считывание генов, ответственных за экспрессию белков-участников клеточного цикла [4]. В схеме ниже факторы роста обозначены как «факторы выживания».
Представляя эту схему (рис. 22), не могу не отметить, что для многих клеток взаимодействие с их микроокружением (в том числе с внеклеточным матриксом) является необходимым условием для пролиферации. К таким клеткам можно отнести эпителиальные клетки. Для инициации клеточного деления им необходим контакт с внеклеточным матриксом соединительной ткани, и этот контакт реализуется путем взаимодействия белков внеклеточного матрикса с интегринами [2, 4]. Как показано на схеме, интегрины участвуют в активации белков Ras — центральных внутриклеточных протеинкиназ сигнальных путей МАРК (МАРК — mitogen activated protein kinase — киназы, активируемые митогенными факторами и приводящие к митозу клеток). По последним данным, гормоны щитовидной железы, в частности, тетрайодтиронин, служит лигандом интегриновых ICAM-белков (белков межклеточной адгезии), тем самым способствуя пролиферации клеток.
Это во многом определяет важную роль гормонов щитовидной железы в развитии нервной системы не только в зародышевом периоде, но и у детей, и объясняет задержку психомоторного развития при врожденном гипотиреозе — первичной недостаточности щитовидной железы. С другой стороны, это объясняет повышенный риск возникновения и прогрессирования злокачественной опухоли на фоне гипертиреоза [11].
Бывает так, что в генах, кодирующих участников этой передачи ростового сигнала, происходит мутация — стойкое и необратимое изменение структуры того или иного гена. Это происходит при воздействии самых разных факторов: физических (радиация в виде ионизирующего излучения) или химических (нитриты, канцерогены в примесях сигарет, различные фенолы). Отдельное значение имеют биологические факторы канцерогенеза. К таковым на сегодняшний день относят вирус Эпштейна — Барр, онкогенные типы вируса папилломы человека (16, 18, 31 и целое множество других), бактерию Helicobacter pylori. При сочетании этих канцерогенных факторов, скажем, с дефектом системы репарации (системы «починки» имеющихся дефектов) или системы апоптоза (генетически детерминированной гибели клетки) или с каким-то другим вариантом молекулярно-генетических нарушений возникает очень опасная ситуация — функциональная аномалия клетки, выражающаяся в ее автономии. Теперь такая клетка живет и растет только по своим законам. Происходит гиперпродукция и/или чрезмерная спонтанная активность определенного участника митогенных внутриклеточных каскадов, обусловливающих полную клеточную независимость от каких-либо внешних сигналов и отрицательной обратной связи.
В нормальных условиях протоонкогены обеспечивают выживание клетки, когда это необходимо в рамках гистогенеза и строго при воздействии митогенных сигналов извне.
Чтобы продемонстрировать, как все это происходит, я предлагаю углубиться в дебри молекулярной онкологии.
Как это работает? На рис. 22 можно заметить сигнальный каскад, начинающийся от RTK (ТКР). RTK — это тирозинкиназный рецептор (ТКР), т. е. рецептор, обладающий тирозинкиназной активностью. Но приобретает он ее только после своей активации.
При воздействии лиганда (факторы роста) на ТКР происходит димеризация (удвоение) двух тирозинкиназных рецепторов. В активированном состоянии ТКР фосфорилирует по остаткам тирозина нижележащие участники сигнального каскада, в частности, белки SOS и GRB2. Далее указанные белки фосфорилируют нижележащие белки — RAS → RAF→ MEK→ ERK (в соответствии с рис. 22).
Последовательная активация данных белков заканчивается фосфорилированием транскрипционных факторов, запускающих экспрессию генов, необходимых для пролиферации.
В опухолевых клетках происходит все то же самое, что и в обычных, с одним отличием: если нормальным клеткам для запуска пролиферации нужен сигнал извне, то опухолевая клетка сама себе хозяин.
Так, при мутации гена EGFR (наиболее известный ТКР) активность рецептора сохраняется постоянно, даже в отсутствии лиганда, что приводит к постоянной активации сигнального каскада, описанного выше. Более того, поломки могут происходить на любом участке каскада: мутации могут возникать в гене, кодирующем белки RAS, RAF, MEK и множество других, и результат будет тот же самый: неконтролируемая пролиферация клетки. Мутации гена EGFR возникают в некоторых случаях аденокарциномы легкого, плоскоклеточного рака кожи, мутации RAS — при раке поджелудочной железы, некоторых случаях рака толстой кишки, некоторых случаях немелкоклеточного рака легкого, мутации RAF — при той же аденокарциноме легкого, меланоме, в некоторых случаях рака толстой кишки. Список можно продолжать бесконечно, потому что подобных сигнальных путей в клетках очень много. В случае каждой конкретной опухоли «ломается» один или несколько сигнальных путей. Все это создает почву для создания таргетной терапии. Таргетные препараты нацелены на инактивацию конкретного белка, опосредующего онкогенез, тем самым достигается остановка опухолевого роста, а в ряде случаев даже уменьшение имеющихся опухолевых очагов.
К наиболее известным протоонкогенам относят [2, 4, 6]:
- тирозинкиназные рецепторы к факторам роста (EGFR, FGFR, PDGFRA, IGF, c-KIT, VEGFR A-C и прочие): при мутации в данных генах происходит постоянная активация нижележащих сигнальных путей, приводящих к пролиферации клеток [12]. Их мутации лежат в основе патогенеза различных опухолевых заболеваний.
- мутации в «нижележащих точках» сигнальных каскадов, приводящие к гиперэкспрессии генов внутриклеточных участников трансдукции сигнала (на рис. 27 это белки RAS, BRAF, МЕК, а также множество других, которые просто не поместятся в эту статью).
- антиапоптотические факторы, например, Bcl- 2 [12].
Зачем это знать? Многие из вышеперечисленных белков являются мишенями для препаратов таргетной терапии (целенаправленная терапия). Существующие препараты сильно поменяли тактику лекарственного лечения ряда опухолевых заболеваний.
В качестве наиболее распространенных примеров: аденокарцинома легкого при наличии мутаций гена EGFR поддается лечению ингибиторами EGFR (осимертиниб, гефитиниб, афатиниб — в зависимости от вида мутации). Меланома при мутации RAF (в частности, BRAFV600E) поддается лечению BRAF-ингибиторами (вемурафениб, дабрафениб). Более подробно мы расскажем об этом в другой раз.
Иногда происходит так, что мутация задевает гены, кодирующие белки-онкосупрессоры. Это белки, способные заблокировать клеточный цикл в случае наличия неисправимых повреждений ДНК и включить программу апоптоза.
К наиболее известным белкам-онкосупрессорам относят p53, pRb, PTEN. Их функции различны. Так, р53 запускает программу апоптоза путем активации каспаз 3, 8, 9 и других молекул-участников апоптоза. РRb, или белок ретинобластомы, останавливает движение клеточного цикла в фазе G1, не давая клетке пролиферировать (рис. 23).
Рисунок 23 | Переход из G1 в S фазу клеточного цикла
Белок ретинобластомы (RB1) выступает контрольной точкой между этими двумя фазами. При фосфорилировании pRB1 распадается комплекс RB1-E2F, который тормозил прохождение клеткой клеточного цикла. Тем самым E2F в отсутствие угнетающего влияния RB1 запускает экспрессию генов, необходимых для репликации ДНК.
Происходит это за счет инактивации соответствующих факторов репликации, в частности, EEF2 (эукариотический фактор элонгации 2). PTEN (рис. 28) является инактиватором различных участников МАРК-путей. Нарушение работы онкосупрессоров в результате мутации их гена — важный фактор формирования большинства опухолей у человека [2, 8, 12], а также предиктор неблагоприятного исхода онкологического заболевания.
В результате мутаций в протоонкогенах и генах-онкосупрессорах мы получаем клетки, неадекватно реагирующие на ростовые сигналы. Такие клетки способны к автономному росту, инвазии в окружающие ткани, а затем — к метастазированию в отдаленные уголки организма [2]. Все это составляет суть опухолевого процесса.
На сегодняшний день достигнуты значительные успехи в лечении злокачественных новообразований. Разработаны схемы и режимы цитостатической химиотерапии для опухолей различной локализации и морфологической природы. Несмотря на различие этих схем, принцип действия химиотерапевтических цитостатических препаратов в глобальном и общем смысле является универсальным. Он заключается в остановке клеточного цикла и угнетении пролиферации опухолевых клеток. Каждая группа препаратов делает это по-своему. Главным недостатком цитостатической химиотерапии является низкая селективность препаратов: они угнетают все пролиферирующие клетки организма.
Ингибиторы топоизомераз. В опухолевых клетках в силу высокой пролиферативной активности прослеживается высокая активность топоизомераз (преимущественно I и II типов). Теканы (топотекан, иринотекан) ингибируют топоизомеразу I типа. Антрациклины (доксорубицин, идарубицин эпирубицин), эпиподофиллотоксины (производные подофиллотоксина, такие как этопозид, тенопозид) являются ингибиторами топоизомераз II типа. Поскольку топоизомеразы поддерживают пространственную ориентацию нитей ДНК при репликации, их ингибирование является фатальным для опухолевой клетки. Указанные выше группы препаратов нашли широкое применение в онкологии. Так, антрациклины входят в схемы лечения солидных опухолей (в частности, рака легкого, желудка, рака молочной железы, мочевого пузыря, сарком мягких тканей), онкогематологических заболеваний [3, 7].
К сожалению, данные типы топоизомераз присутствуют и в здоровых тканях организма. Из-за этого развиваются побочные эффекты, часто специфичные для некоторых ингибиторов топоизомераз. Так, в последние годы появляется все больше сообщений о развитии антрациклиновой кардиотоксичности.
Антрациклин-индуцированная кардиотоксичность — феномен, характеризующийся постоянно прогрессирующим снижением фракции выброса левого желудочка миокарда с последующим развитием хронической сердечной недостаточности. Развитие данного осложнения связано с тем, что механизм противоопухолевого действия антрациклинов включает не только ингибирование топоизомеразы опухолевых клеток, но и продукцию в них активных радикалов кислорода, разрушительно влияющих на ДНК.
Опасность антрациклиновой кардиотоксичности заключается и в том, что зачастую очень сложно отследить развитие сердечной недостаточности в силу ее поздней клинической манифестации. Между тем Европейское общество кардиологов (ESC), а также Европейское общество медицинской онкологии (ESMO) предложили рекомендации для ведения пациентов, получающих кардиотоксичную химиотерапию. Более подробно об этом можно узнать здесь.
Механизмы развития аутоиммунных заболеваний сложны, но достаточно часто они включают в себя пролиферацию аутореактивных (опасных в отношении тканей собственного организма) лимфоцитов. Это обусловлено угнетением негативной селекции аутореактивных лимфоцитов, избеганием ими апоптоза. Лимфоциты относятся к группе быстро пролиферирующих клеток, поэтому в лечении множества аутоиммунных (иммунопатологических) заболеваний применяются цитостатики. Наиболее известными являются антиметаболиты фолиевой кислоты, в частности, метотрексат [10].
Метотрексат является ингибитором дигидрофолатредуктазы и тимидилатсинтетазы (рис. 24)
Рисунок 24 | Образование дТМФ. Тетрагидрофолатредуктаза как мишень для метотрексата.
Конкурентное ингибирование данных ферментов приводит к снижению синтеза одного из субстратов, необходимых для репликации ДНК — дезокситимидинтрифосфата. Механизм действия обусловливает применение метотрексата в лечении как опухолевых заболеваний (преимущественно гемобластозов), так и аутоиммунных, например, ревматоидного артрита, болезни Крона и неспецифического язвенного колита (один из препаратов резерва), а также диффузных заболеваний соединительной ткани. Хотя сейчас появились более безопасные и эффективные препараты, метотрексат и по сей день не потерял своего значения. Особое место он занимает в лечении ревматоидного артрита — аутоиммунного поражения суставов и периартикулярных тканей, которое без лечения заканчивается контрактурой суставов, ограничением подвижности, инвалидностью, амилоидозом внутренних органов и множеством других проблем.
Синтез ДНК, процесс считывания и реализации генетической информации таит в себе множество вопросов. Однако именно в этих сложных процессах можно найти ключ к лечению многих заболеваний. Для меня это был самый интересный раздел за все годы обучения в университете, потому что это фундаментальный вопрос, в котором можно копаться бесконечно. Коснувшись процессов репликации ДНК и синтеза белка, мы с тобой попутно рассмотрели вопросы антибактериальной терапии, аспекты возникновения опухолей и их лечения, а также терапию аутоиммунных заболеваний, и это я вовремя остановился. Я осветил лишь те моменты, которые казались мне наиболее интересными и важными, но, если у меня получилось заинтересовать тебя и побудить разбираться самостоятельно, значит, я писал все это не напрасно.
- Наглядная биохимия / Я. Кольман, К.-Г. Рём ; пер. с англ. Т. П. Мосоловой. — 5-е изд., перераб. и доп. — М. : Лаборатория знаний, 2018.
- Патологическая биохимия /Таганович А.Д., Олецкий Э.И., Котович И.Л./Под общей редакцией Тагановича А.Д. – М.: БИНОМ, 2015 г..
- Нельсон Д., Кокс М. Основы биохимии Ленинджера: в 3 т. Т. 3. – М.: Лаборатория знаний, 2015 г.
- Тараховский Ю.С., Ким Ю.А., Абдрасилов Б.С., Музафаров Е.Н. Флавоноиды: биохимия, биофизика, медицина, 2013 г.
- «Регуляция активности протеасом в клетке с помощью специфического выключения гена, кодирующего одну из субъединиц протеасомы метода РНК-интерференции». Монахов М.В, Институт Молекулярной биологии им. В.А. Энгельгардта РАН, 2004 г.
- Тимин О.А. Основы биологической химии, 2018 г.
- Cristiana Sessa, Luca Guanni et al. ESMO HANDBOOK OF CLINICAL PHARMACOLOGY OF ANTI-CANCER AGENTS, 2012.
- Портал «Биохимия для студента», раздел «Матричные биосинтезы». URL: https://biokhimija.ru/lekcii-po-biohimii.html.
- В. М. Виноградов, Е. Б. Каткова. Фармакология с рецептурой, 2016 г.
- Федеральные клинические рекомендации «Ревматоидный артрит», 2017 г.
- Глушаков Р.И., Власьева О.В., Соболев И.В., Прошин С.Н., Тапильская Н.И. Тиреоидный статус как прогностический маркер в онкологии. Злокачественные опухоли, 2015.
- C. Зилбернагль, Ф. Ланг. Клиническая патофизиология, 2016 г.
- Serrato-Capuchina A, Matute DR. The Role of Transposable Elements in Speciation. Genes (Basel), 2018. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5977194/
- Ou HD, Phan S, Deerinck TJ, Thor A, Ellisman MH, O’Shea CC. ChromEMT: Visualizing 3D chromatin structure and compaction in interphase and mitotic cells. Science. 2017 Jul 28. https://doi.org/10.1126/science.aag0025
- Mismatch repair deficiency/microsatellite instability-high as a predictor for anti-PD-1/PD-L1 immunotherapy efficacy Pengfei Zhao, Li Li, Xiaoyue Jiang, and Qin Li J Hematol Oncol. 2019; 12: 54. Published online 2019 May 31. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6544911
- The ENCODE Project Consortium., Overall coordination (data analysis coordination)., Dunham, I. et al. An integrated encyclopedia of DNA elements in the human genome. Nature 489, 57–74 (2012). https://doi.org/10.1038/nature11247
- Sendzik J, Lode H, Stahlmann R. Quinolone-induced arthropathy: an update focusing on new mechanistic and clinical data. Int J Antimicrob Agents. 2009 Mar;33(3):194-200. https://doi.org/10.1016/j.ijantimicag.2008.08.004
- van der Linden PD, Sturkenboom MCJM, Herings RMC, Leufkens HMG, Rowlands S, Stricker BHC. Increased Risk of Achilles Tendon Rupture With Quinolone Antibacterial Use, Especially in Elderly Patients Taking Oral Corticosteroids. Arch Intern Med. 2003;163(15):1801–1807. https://doi.org/10.1001/archinte.163.15.1801
- Guan MX, Fischel-Ghodsian N, Attardi G. A biochemical basis for the inherited susceptibility to aminoglycoside ototoxicity. Hum Mol Genet. 2000 Jul 22;9(12):1787-93. https://doi.org/10.1093/hmg/9.12.1787
- Reilly MT, Faulkner GJ, Dubnau J, Ponomarev I, Gage FH. The role of transposable elements in health and diseases of the central nervous system. J Neurosci. 2013;33(45):17577-17586. https://dx.doi.org/10.1523%2FJNEUROSCI.3369-13.2013
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.