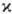Мультиплетность
- Мультиплетность
-
число возможных ориентаций в пространстве полного Спина атома или молекулы. Согласно квантовой механике, М. χ = 2S + 1, где S — спиновое квантовое число (См. Квантовые числа). Для систем с нечётным числом N электронов S = 1/2; 3/2; 5/2,… и М. чётная (χ = 2, 4, 6,…). Для них возможны дублетные, квартетные, секстетные и т. д. квантовые состояния. Если N чётно, S = 0, 1, 2,… и М. нечётная (χ = 1, 3, 5,…) — возможны синглетные, триплетные, квинтетные и т. д. состояния. Так, для систем с 1 электроном (атом Н, ион H2+, S = 1/2, χ = 2) получаются лишь дублетные состояния; с 2 электронами (атом Не, молекула H2) — синглетные состояния (S = 0, χ = 1, спины электронов антипараллельны) и триплетные состояния (S = 1, χ = 3, спины электронов параллельны). Для N электронов максимальная М. (χ = N + 1) соответствует параллельному направлению их спинов.
М. определяет кратность вырождения уровней атома или молекулы. 2S + 1 квантовых состояний, соответствующих уровню энергии с заданным S, отличаются значениями проекции полного спина и характеризуются квантовым числом Ms = S, S — 1,…, —S, определяющим величину этой проекции. Вследствие спин-орбитального взаимодействия (См. Спин-орбитальное взаимодействие) уровень энергии может расщепиться на χ = 2S + 1 подуровней (мультиплетное расщепление, приводящее к расщеплению спектральных линий, см. Тонкая структура).
Значения М. для квантовых состояний атомов и молекул определяются электронами в незамкнутых оболочках, т. к. в заполненных оболочках спины электронов компенсируются. Для уровней энергии щелочных металлов с 1 внешним электроном χ = 2, как и для атома Н; для уровней энергии сложных атомов с заполняющимися p-, d- и f-оболочками М. могут быть высокими (до 11). Для химически устойчивых молекул, имеющих, как правило, чётное число электронов, характерны М. χ = 1 для основного и χ = 1 и 3 для возбуждённых уровней энергии; для свободных радикалов с одним электроном с некомпенсированным спином типична М. χ = 2.
М. А. Ельяшевич.
Большая советская энциклопедия. — М.: Советская энциклопедия.
1969—1978.
Полезное
Смотреть что такое «Мультиплетность» в других словарях:
-
МУЛЬТИПЛЕТНОСТЬ — число возможных ориентаций в пространстве спина атома или молекулы. Мультиплетность определяет число подуровней, на которое может расщепляться уровень энергии вследствие спин орбитального взаимодействия … Большой Энциклопедический словарь
-
МУЛЬТИПЛЕТНОСТЬ — число 2S+1 возможных ориентации в пространстве полного спина атомной системы (где S спиновое квантовое число системы). В случае LS свя зи (нормальной связи, см. Связь векторная )при L>=S (L орбитальное квантовое число) M. равна числу возможных … Физическая энциклопедия
-
мультиплетность — – число компонентов, на которые расщепляется вырожденное квантовое состояние атома или молекулы вследствие каких либо взаимодействий электронов (спин орбитального, спин спинового) или при наложении внешнего магнитного поля. Общая химия : учебник… … Химические термины
-
мультиплетность — число возможных ориентаций в пространстве спина атома или молекулы. Мультиплетность определяет число подуровней, на которое может расщепляться уровень энергии вследствие спин орбитального взаимодействия. * * * МУЛЬТИПЛЕТНОСТЬ МУЛЬТИПЛЕТНОСТЬ,… … Энциклопедический словарь
-
Мультиплетность — в химии величина, характеризующая спин атома или молекулы. Мультиплетность рассчитывается по формуле: , где число электронов в молекуле или атоме, спиновое квантовое число каждого электрона. Так как большинство электронов в… … Википедия
-
мультиплетность — multipletumas statusas T sritis chemija apibrėžtis Atomo ar molekulės elektronų pilnutinio sukinio galimų krypčių erdvėje skaičius. atitikmenys: angl. multiplicity rus. мультиплетность … Chemijos terminų aiškinamasis žodynas
-
мультиплетность — daugialypumas statusas T sritis fizika atitikmenys: angl. multiplicity vok. Multiplizität, f; Vielfachheit, f rus. мультиплетность, f pranc. multiplicité, f … Fizikos terminų žodynas
-
мультиплетность термов — termų daugialypumas statusas T sritis fizika atitikmenys: angl. multiplicity of terms vok. Multiplizität der Terme, f; Vielfachheit der Terme, f rus. мультиплетность термов, f pranc. multiplicité de termes, f … Fizikos terminų žodynas
-
МУЛЬТИПЛЕТНОСТЬ — число возможных ориентации в пространстве спина атома или молекулы. М. определяет число подуровней, на к рое может расщепляться уровень энергии вследствие спин орбитального взаимодействия … Естествознание. Энциклопедический словарь
-
мультиплетность — мультипл етность, и … Русский орфографический словарь
МУЛЬТИПЛEТНОСТЬ (от
лат. multiplex-многократный), число квантовых состояний молекулы, различающихся
только ориентацией суммарного электронного спина. Для мол. систем, в к-рых спин-орбитальное
взаимодействие пренебрежимо мало, состояния с разл. ориентацией спина имеют
одинаковую энергию; в этом случае мультиплетность-кратность вырождения энергетического
уровня, обусловленная спином. Вырождение снимается под действием магн. поля,
что отражается в спектрах как появление групп спектральных линий (мульти-плетов),
в к-рых расстояние между линиями существенно меньше, чем расстояние между группами.
Снятие вырождения в магн. поле используется для эксперим. изучения частиц с
ненулевым спином методом ЭПР.
Мультиплетность определяется квантовым
числом S для квадрата электронного спина молекулы: 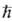
(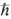
Планка). Состоянию с данным S отвечают 2S + 1 значение проекции
спина на ось, т. е. мультиплетность
=2S+1. Поскольку спин электрона полуцелый, то 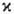
число, причем для N-электронной молекулы с четным N возможные значения
мультиплетности равны 1, 3, 5,…; соответствующие состояния наз. син-глетными, т р и п л
е т н ы м и, к в и н т е т н ы м и и т.д. При нечетных N 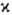
значения 2, 4, 6,… (д у б л е т н ы е, к в а р т е т н ы е, с е к с т е т
н ы е и т.д. состояния); во всех случаях 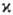
N + 1. При обозначении электронных состояний молекулы мультиплетность указывается
слева вверху от букв. обозначения состояния. Так, осн. (низшее по энергии) состояние
ОН.-дублетное p-состояние обозначается как 2П (см. Возбужденные
состояния).
Как правило, для осн. состояний
молекул мультиплетность мала (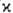
2 или 3). В рамках теории мол. орбиталей это связывают с тем,
что в соответствии с Паули принципом низшие по энергии одноэлектронные
уровни (мол. орбитали) заняты двумя электронами и дают нулевой вклад в суммарный
спин. Состояниям с 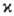
1 отвечают лишь частично заполненные электронные оболочки. В этом случае относит.
положение по энергии состояний с одной и той же электронной конфигурацией определяется
правилом Хунда: энергия убывает с ростом мультиплетности (см. Хунда правила). Наиб.
высокие значения мультиплетности для осн. состояний наблюдаются в соед. РЗЭ и лантаноидов;
напр., для GdO в осн. состоянии мультиплетность равна 9.
Мультиплетность состояния-важная характеристика
хим. поведения частицы, о чем свидетельствует, напр., существенно разное поведение
синглетного и триплетного карбена :С2. Молекулы в дублетных осн.
состояниях называют радикалами, в триплетных-бирадикалами. Считается, что молекулы
в не-синглетных состояниях обладают повыш. реакц. способностью из-за частичной
заполненности электронных оболочек (имеют неспаренные электроны). Однако это
не всегда справедливо (напр., молекула О2-бирадикал).
Мультиплетность используют для классификации
квантовых переходов: переходы между состояниями с разной мультиплетностью наз. интерк о м
б и н а ц и о н н ы м и; если спин-орбитальное взаимод. слабо,
такие переходы маловероятны (см. Квантовые переходы).
Анализ тонкой структуры
спектра атомов и молекул требует учета спин-орбитального и др. взаимодействий.
Напр., у атома с орбитальным (угловым) моментом кол-ва движения L
и спином S состояния с разными значениями суммарного момента I
= L + S из-за спин-орбитального взаимод. различаются по
энергии (т. наз. мультиплетное расщепление). Число таких состояний наз. мультиплет-ностью
терма; оно равно |L + S| — |L— S| + 1 и совпадает
с 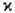
+ 1 лишь если L >= S. При L = 0 мультиплетность терма, по определению,
считается равной 2S + 1. Мультиплетное расщепление при сильном спин-орбитальном
взаимод. м. б. столь заметным, что близкими по энергии оказываются состояния
с разл. спином. В подобных случаях, типичных для атомов и соед. тяжелых элементов,
классификация состояний по спину (а значит, и по мультиплетности) теряет значение. При этом
требуется изменить набор квантовых чисел, характеризующих молекулу или атом.
Лит. см. при ст.
Спин. В. И. Пупышев.
===
Исп. литература для статьи «МУЛЬТИПЛEТНОСТЬ»: нет данных
Страница «МУЛЬТИПЛEТНОСТЬ» подготовлена по материалам химической энциклопедии.

|
3 |
||||||||||
|
25 |
He |
|||||||||
|
Ne |
||||||||||
|
20 |
F |
|||||||||
|
Ar |
||||||||||
|
N |
||||||||||
|
эВ |
15 |
Cl |
||||||||
|
H |
||||||||||
|
IP, |
Be |
C |
O |
P |
||||||
|
10 |
Si |
|||||||||
|
Mg |
||||||||||
|
S |
||||||||||
|
B |
||||||||||
|
5 |
Li |
Na |
Al |
|||||||
|
0 |
||||||||||
|
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
Атомный номер
Потенциалы ионизации атомов первых трех периодов Периодической таблицы Д.И. Менделеева. Черные точки – экспериментальные значения; белые – квантовохимический расчет по методу ∆ССП, т.е. в виде разницы полной хартрифоковской энергии атома и соответствующего однозарядного катиона. Расчет IP в рамках теоремы Купманса дает близкие значения, однако, не воспроизводится качественный вид зависимости (например, IP(O) > IP(N), IP(S) > IP(P) и т.д.).
2.В каждом периоде IP возрастает слева направо, но имеются исключения. Например, IP(Be) > IP(B) или IP(N) > IP(O). Причина отступлений от
общей зависимости заключается в особой устойчивости замкнутых оболочек ns2, а также большая устойчивость конфигураций с максимальной мультиплетностью ns2np3, что соответствует правилу Хунда.
10.4.1.Полные орбитальные и спиновые квантовые числа.
При сильном межэлектронном взаимодействии, превышающем энергию спин-орбитального взаимодействия, квантовые числа отдельных электронов теряют свой смысл из-за их неразличимости. В этом случае целесообразно говорить лишь о полном орбитальном и спиновом моментах совокупности электронов. Для них справедливы выражения:
|
L = h L(L +1), |
S = h S(S +1). |
где L и S – соответственно полное орбитальное и полное спиновое квантовые числа.

4
Величина L определяется через значения li отдельных электронов. Замкнутые электронные оболочки s2, p6, d10 имеют L = 0. Для вычисления полного орбитального квантового числа необходимо рассматривать электроны только в незаполненных оболочках. Для двух электронов с орбитальными квантовыми числами l1 и l2 (l1 ≥ l2) квантовое число L принимает значения:
L = (l1 + l2), (l1 + l2 — 1), …, (l1 — l2 + 1), (l1 — l2),
всего 2l2 + 1 значение. Например, для атома углерода 1s22s2p2 l1 = l2 = 1 (два p–электрона) L = 0, 1, 2. Аналогично обозначениям орбиталей в атоме водорода состояния с различным L обозначают следующим образом
|
L |
0 |
1 |
2 |
3 |
4 |
5 |
|
Обозначение |
S |
P |
D |
F |
G |
H |
Полное спиновое квантовое число S находится по тем же правилам. В зависимости от того, является ли число электронов на незамкнутой оболочке четным или нечетным, значения S соответственно будут целыми или полуцелыми. Так, для атома углерода S = 0 или 1.
Аналогично проекциям орбитального m и спинового ms моментов электрона в водородоподобном атоме для многоэлектронных систем вводятся проекции полного орбитального ML и полного спинового MS моментов, которые могут принимать дискретный ряд значений:
|
ML = L, L — 1, …, -L + 1), -L, |
всего 2L + 1 значение; |
|
MS = S, S — 1, …, -S + 1), -S, |
всего 2S + 1 значение. |
Величина 2S + 1 определяет мультиплетность данного состояния:
|
S |
2S + 1 |
Состояние |
|
0 |
1 |
синглет |
|
1/2 |
2 |
дублет |
|
1 |
3 |
триплет |
|
3/2 |
4 |
квартет и т.д. |
10.4.2. Спин-орбитальное взаимодействие.
Как известно, движущийся заряд создает магнитное поле. Взаимодействие магнитных полей, обусловленных орбитальным движением электрона и его спином, называется спин-орбитальным взаимодействием. Хотя энергия спин-орбитального взаимодействия меньше разности энергий электронных уровней, она приводит к снятию вырождения состояний с одним и тем же квантовым числом орбитального движения. Это проявляется в наличии тонкой структуры атомных спектров в отсутствие внешних полей.
В связи с этим возникает необходимость введения полного углового момента атома J:
|
J = L + S, |
J = h J (J +1). |
J – квантовое число полного углового момента атома, принимающее положительные целые или полуцелые значения:
J = L + S, L +S — 1, …, |L – S| + 1, |L – S|.
5
При L > S число возможных значений J равно 2S + 1, при L < S J = 2L + 1. Проекция полного момента J на ось z принимает дискретный ряд значений:
|
MJ = J, J — 1, …, -J + 1), -J, |
всего 2J + 1 значение. |
10.4.3. Термы атомов в приближении спин-орбитального взаимодействия.
Изложенные выше соображения имеют важное значение в атомной спектроскопии, в частности, для классификации атомных состояний и их энергетической последовательности. Определенное энергетическое состояние атома называется атомным термом и обозначается 2S+1LJ.
Порядок расположения термов по энергии определяется эмпирическими правилами Хунда:
1.Терм основного состояния всегда имеет самое высокое значение спиновой мультиплетности.
2.Если несколько термов имеют одинаковую мультиплетность, то наиболее стабильным будет тот, который имеет максимальное L.
3.Для конфигураций, заполненных менее чем наполовину, самым ста-
бильным является терм с минимальным значением J и наоборот.
Например, атом углерода (p2—оболочка) характеризуется S = ½ + ½ = 1,
2S + 1 = 3. Возможные значения ML = 1 + 0; 1 – 1; 0 – 1, т.е. L = 1
(P-состояние). В соответствии с третьим правилом Хунда Jmin = S – L = 0. Таким образом, наиболее устойчивое состояние атома углерода 3P0.
Для классификации всех возможных термов атома необходимо перебрать все возможные комбинации микросостояний, т.е. все возможные соче-
тания ML и MS в совокупности с возможными значениями m и ms всех электронов. Затем определяется обозначение данного состояния и по правилам Хунда – его относительная стабильность.
В качестве примера рассмотрим последовательность действий для определения терма наиболее устойчивого состояния многоэлектронного атома. Для этого следует:
А) Написать электронную конфигурацию атома; Б) Распределить электроны в частично заполненной оболочке так, чтобы
1)получить максимальную мультиплетность атома;
2)заполнить ячейки с максимальным значением квантового числа m;
В) По сумме однократно заполненных ячеек определить L; Г) Рассчитать суммарный спин и 2S + 1;
Д) Рассчитать L – S для оболочек, заполненных менее чем наполовину, и L + S для остальных случаев.
Результаты определения наиболее устойчивого терма некоторых атомов
|
сведены в таблицу: |
L |
S |
J |
||
|
Атом |
Конфигурация |
Терм |
|||
|
Mg |
…3s2 |
0 |
0 |
0 |
1S0 |
|
P |
…3p3 |
0 |
3/2 |
3/2 |
4S3/2 |
|
S |
…3p4 |
1 |
1 |
2 |
3P2 |
|
Cl |
…3p5 |
1 |
1/2 |
3/2 |
2P3/2 |
|
Ti |
…4s23d2 |
3 |
1 |
2 |
3F2 |

|
6 |
|||||
|
V |
…4s23d3 |
3 |
3/2 |
3/2 |
4F3/2 |
|
Cr |
…4s1 |
0 |
1/2 |
– |
– |
|
(4s) |
…3d5 |
||||
|
Cr |
0 |
5/2 |
– |
– |
|
|
(3d) |
…4s13d5 |
7S3 |
|||
|
Cr |
0 |
3 |
3 |
В последнем случае неспаренные электроны есть в двух оболочках. Поэтому сначала находят L и S в каждой, а затем суммарное значение в соответ-
|
ствии с правилами Хунда. |
|||||
|
Fe |
…4s23d6 |
2 |
2 |
4 |
5D4 |
|
Co |
…4s23d7 |
3 |
3/2 |
9/2 |
4F9/2 |
|
Ni |
…4s23d8 |
3 |
1 |
4 |
3F4 |
и т.д.
10.4.4. Спектры многоэлектронных атомов.
Как и в атоме водорода, в многоэлектронном атоме переход с электронного уровня i, характеризующегося волновой функцией Ψi, на уровень k с
функцией Ψk считается разрешеннымr , если отличен от нуля интеграл
Dki = Ψk ∑rvµ Ψi ,
µ
где rµ – радиус-вектор µ-го электрона в атоме.
Вычисления Dki показывают, что для многоэлектронного атома выполняются следующие правила отбора:
1.∆S = 0 (закон сохранения мультиплетности).
2.∆L = 0, ±1; ∆J = 0, ±1, причем переход из состояния с L = 0 в состояние с L = 0 запрещен. Следовательно, J = 0 → J = 0 – также запрещенный переход.
3.Во внешнем поле энергия уровня зависит от MJ. Правила отбора до-
полняются соотношением ∆MJ = 0, ±1.
Спектры многоэлектронных атомов гораздо сложнее спектров атомарного водорода, т.к. на появление новых полос влияет целый комплекс взаимодействий в многоэлектронном атоме. Широко известно проявление дублетной структуры спектров щелочных металлов, что явилось важнейшим экспериментальным основанием для введения представления о спине электрона.
|
Причиной дублетной |
структуры |
Na |
||||||
|
спектров атомов щелочных металлов яв- |
3p |
2P |
2P3/2 |
|||||
|
ляется спин-орбитальное взаимодейст- |
2 |
P1/2 |
||||||
|
вие, которое расщепляет каждый уро- |
||||||||
|
вень с L = 1 и S = 1/2 на два уровня с J = |
589 нм |
|||||||
|
1/2 и 3/2, тогда как s-уровни с L = 0 не |
589.5 нм |
|||||||
|
связаны спин-орбитальным |
взаимодей- |
3s |
2 |
S |
2 |
S1/2 |
||
|
ствием. Например, для атома натрия |
||||||||
|
Эффект дополнительного расщепления |
спектральных линий |
атома в |
магнитном поле, называется эффектом Зеемана (1896). Расщепление уров-

7
ней зависит от MJ, которое может принимать 2J + 1 значение. Вектор полного момента J взаимодействует с вектором напряженности внешнего магнитного поля B, или усиливая, или ослабляя его. Это вызывает изменение энергии соответствующего данному J состояния, т.е. расщепление линий спектра.
Таким образом, если в атоме водорода все состояния с одним и тем же главным квантовым числом вырождены и имеют одну и ту же энергию, то в многоэлектронных атомах существует целый комплекс причин, обуславливающих снятие вырождения: электрон-электронное взаимодействие или эффект экранирования (снимает вырождение по орбитальному квантовому числу), спин-орбитальное взаимодействие (снимает вырождение по квантовому числу полного углового момента), взаимодействие с внешним магнитным полем (снимает вырождение по проекции полного углового момента).
Схема снятия вырождения электронных состояний многоэлектронного атома в зависимости от различных эффектов взаимодействия показана на примере np2—электронной конфигурации (например, для атома углерода 2p2):
|
3P |
|||||||||||||||||||||||||
|
3P |
2 |
||||||||||||||||||||||||
|
3P1 |
|||||||||||||||||||||||||
|
3P |
|||||||||||||||||||||||||
|
0 |
|||||||||||||||||||||||||
|
np2 |
|||||||||||||||||||||||||
|
Эффект |
Спин-орбитальное |
Эффект |
|||||||||||||||||||||||
|
экранирования |
взаимодействие |
Зеемана |
|||||||||||||||||||||||
|
n=1 |
l=0 |
l=1 |
|||||||||||||||||||||||
|
↑↓ |
↑↓ |
↑↓ |
|||||||||||||||||||||||
|
n=2 |
↑↓ |
↑↓ |
↑↓ |
↑ |
↓ |
↑↓ |
↑ |
↑ |
|||||||||||||||||
|
1S |
1D |
3P |
При действии на атом внешнего электрического поля также наблюдается эффект расщепления линий, называемый эффектом Штарка. Он также обусловлен квантованием полного момента атома и его взаимодействием с внешним электрическим полем.
Если ядро имеет ненулевой спин, то существует взаимодействие между ядерным спиновым магнитным моментом, спиновым и орбитальным магнитными моментами электрона, которое ведет к так называемой сверхтонкой структуре атомных спектров. Например, сверхтонкое взаимодействие магнитных моментов протона и электрона в атоме водорода обуславливает линию 1420 мГц, испускаемую водородом в космическом пространстве.