Муравьиная кислота – как найти, как защититься
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Семенова Д.С. 1
1МОУ Лицей № 5 имени Ю.А.Гагарина
Руссиян А.Б. 1
1МОУ Лицей № 5 имени Ю.А.Гагарина
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Введение
Однажды летом на прогулке я обожгла руку крапивой. Спустя какое-то время я задумалась – а почему так случилось? Почему обжигает только крапива, а не другие растения или деревья?
Я решила разобраться – почему крапива такая жгучая? И где еще можно получить такие ожоги, и можно ли это свойство крапивы как-то использовать?
Актуальность. Знание свойств природы – это очень важно. Это может пригодиться чтобы обезопасить себя от угроз или чтобы получить от этого какую-либо пользу.
Цель: Узнать, где встречается муравьиная кислота в природе, и как она используется людьми. Изучить свойства муравьиной кислоты.
Задачи:
Узнать историю открытия муравьиной кислоты, где она встречается в природе.
Раскрыть свойства муравьиной кислоты, выяснить как она используется людьми.
Провести опыты с муравьиной кислотой, чтобы проверить ее свойства.
Методы исследования:
Поиск информации в библиотеках и Интернете.
Проведение опытов с муравьиной кислотой.
Муравьиная кислота – что это?
Каждый из нас хотя бы раз получал ожог от укусов муравьев или от прикосновения к крапиве. При этом ощущения от ожога очень похожи.
Это происходит из-за того, что и волоски крапивы, и муравьи содержат в себе одно и то же вещество – это муравьиная кислота.
Впервые, муравьиная кислота была получена в 1670 году английским натуралистом, ботаником и зоологом, Джоном Рэем из рыжих лесных муравьёв. Он заинтересовался болеутоляющими и противовоспалительными свойствами жгучих выделений рыжих муравьев, и решил получить из них лекарство.
Джон Рей получил раствор неизвестной кислоты следующим путем: Он поместил в сосуд рыжих лесных муравьев, налил в сосуд воды, нагрел ее до кипения и пропустил через сосуд струю горячего пара. Этот процесс по-научному называется перегонка паром. После конденсации пара получилсяраствор кислоты. Именно поэтому открытая кислота и получила свое название.
В чистом виде муравьиную кислоту впервые получил в 1749 г. немецкий химик Андреас Сигизмунд Маргграф.
Долгое время главным источником муравьиной кислоты были муравьи, реже ее получали из фруктов и растений. Муравьиная кислота была искусственно получена (синтезирована) только в ХІХ веке французским химиком Джозефом Гей-Люссаком. С тех пор муравьиную кислоту получают химическим путем.
Муравьиная кислота – это бесцветная жидкость с едким и резким запахом. При попадании на коду человека она вызывает болезненные ожоги. По силе воздействия муравьиная кислота находится между уксусной и соляной кислотами.
Где встречается муравьиная кислота?
Как я уже выяснила из названия муравьиная кислота содержится в муравьях. Ученые выяснили, что в брюшной полости у муравьев находятся ядовитые железы, которые вырабатывают кислоту как средство защиты от нападения.
Муравьиная кислота есть не только в муравьях. Муравьиная кислота, хоть и в меньших объемах, обнаружена в пчелином яде, в выделениях медуз и гусениц шелкопряда, сосновой хвое, крапиве, фруктах, а также в выделениях животных и даже человека.
Она является составной частью крови и тканей человека, а также играет важную роль в обмене веществ.
Муравьиная кислота используется не только человеком. Также муравьиную кислоту используют медведи, чтобы очистить свою шкуру от паразитов после зимней спячки. Для этого они просто ложатся на муравейник. Муравьи кусают медведей, тем самым впрыскивая кислоту им в шерсть, до кожи яд не добирается. Паразиты боятся кислот, поэтому начинают покидать медведя.
Не только медведи, но и другие животные и птицы используют муравьиную кислоту для защиты от паразитов. Для этого они раскапывают муравьиные гнезда и суют туда голову. Муравьи атакуют их и таким образом избавляют животных и птиц от паразитов.
Муравьи используют различные кислоты как средство общения друг с другом точно так же, как многие общественные насекомые. Так муравьиная кислота, выделяемая муравьями в момент опасности, служит сигналом для всех остальных муравьев колонии и является средством защиты при нападении хищников.
Муравьи также умеют взрывать себя при помощи муравьиной кислоты. Для этого они собирают в области брюшка накопления в виде кислоты и потом разрезают или прокалывают это место после чего происходит небольшой взрыв, который может остановить врагов.
Где применяется муравьиная кислота?
Муравьиная кислота – достаточно сильная кислота. При попадании на кожу вызывает ожог и жжение. Она может растворять многие вещества.
В народной медицине муравьиная кислота издавна применялась для лечения многих болезней, например таких как: радикулит, ревматизм, остеопороз, подагра, педикулез.
Муравьиная кислота известна своими бактерицидными свойствами, поэтому она широко используется при дезинфекции.
Муравьиная кислота применяется во многих сферах деятельности человека:
Сельское хозяйство – муравьиная кислота используется для заготовки кормов. Из-за своих свойств она используется как вещество, замедляющее разложение и гниение. Благодаря муравьиной кислоте заготовленные осенью корма (сено и силос) не портятся и сохраняют свой вкус и полезные свойства до весны.
Пчеловодство – муравьиная кислота применяется для борьбы с паразитами.
Химическая промышленность – муравьиная кислота используется как растворитель.
Парфюмерия и косметология – муравьиная кислота входит в состав многих профессиональных уходовых средств. Муравьиная кислота способна помочь в избавлении от многих проблем с кожей.
Пищевая промышленность – муравьиная кислота используется как консервант, который получил обозначение E236. Муравьиная кислота увеличивает срок годности пищевых продуктов, усиливает их запах и вкусовые качества. Наиболее широко муравьиную кислоту используют при производстве варений и соков, консервированных овощей и фруктов.
Медицина – муравьиную кислоту применяют как антисептическое, очищающее и болеутоляющее средство, а в некоторых случаях – как бактерицидное и противовоспалительное.
Муравьиная кислота содержится в составе лекарственных препаратов для наружного применения.
Итак, я выяснила, что муравьиная кислота – это вещество, которое широко применяется в разных сферах деятельности: в пищевой и химической промышленности, сельском хозяйстве, медицине, парфюмерии и косметология.
На что способна муравьиная кислота?
Муравьиная кислота – это полезное вещество, если правильно его использовать.
В больших концентрациях муравьиная кислота отравляет организм, оказывая токсическое действие, поэтому в пищевой промышленности это вещество используется как консервант в ограниченном количестве. Аптечную муравьиную кислоту категорически запрещено употреблять вовнутрь.
Муравьиную кислоту не рекомендуется употреблять людям с повышенной чувствительностью. Также не рекомендуется использовать средства, в состав которых входит муравьиная кислота, при наличии ран и раздражений на коже. Попадание муравьиной кислоты внутрь организма может привести к поражению желудочно-кишечного тракта.
При попадании муравьиной кислоты на кожу возникает сильный химический ожог, а вдыхании ее паров может привести к сильному раздражению дыхательных путей. Пары муравьиной кислоты могут повредить глаза. Муравьиная кислота легко воспламеняется.
Неразбавленная муравьиная кислота вызывает сильные химические ожоги, раствор с содержанием муравьиной кислоты 10% и более обладает разъедающим эффектом, с содержанием муравьиной кислоты менее 10% — раздражающим.
В случае ожога рекомендуется обработать рану содовым раствором – он нейтрализует оставшуюся на коже кислоту.
Во время работы с муравьиной кислотой специалисты обязаны надевать специальную защитную одежду, которая включает в себя очки, фартуки, сапоги и перчатки. Размер открытых участков кожи должен быть минимальным.
Помещения, в которых ведутся работы с муравьиной кислотой, должны быть отделаны огнеупорными материалами и оснащены системами принудительной вентиляции.
Изучение свойств муравьиной кислоты (исследовательская часть)
Я решила самостоятельно проверить то, что я узнала о муравьиной кислоте. Для этого я решила проверить свойства муравьиной кислоты, проведя опыты.
Огромную помощь в проведении опыта оказал нам учитель химии МОУ Лицея №5 им. Ю.А. Гагарина Ковалев Евгений Геннадьевич.
Для проведения эксперимента мною была использована следующая химическая посуда: химические стаканы (на 50 мл.), мерный цилиндр и стеклянная палочка. Также я использовала следующие химические реактивы и доступные в быту вещества: универсальную индикаторную бумагу, муравьиную кислоту, пищевую соду, чай каркаде и краснокочанную капусту.
Ход эксперимента:
1 этап. Приготовление исходных растворов кислоты и пищевой соды. Я налила в два химических стакана по 20 мл. муравьиной кислоты с концентрацией 10%. В два других химических стакана я насыпала одинаковое количество пищевой соды (1/2 чайной ложки), добавила 20 мл. воды и тщательно перемешала стеклянной палочкой.
2 этап. Определение среды в полученных растворах муравьиной кислоты и пищевой соды. Я взяла две полоски универсальной индикаторной бумаги: полоска в пробирке с муравьиной кислотой стала розовой, полоска в пробирке с растворенной пищевой содой стала зеленой. Я доказала, что муравьиная кислота имеет кислую среду (индикаторная бумага стала розовой в кислотной среде), а раствор пищевой соды – щелочную (индикаторная бумага стала зеленой в щелочной среде). В кислотной среде индикаторная бумага приобретает красные и оранжевые оттенки, в щелочной среде – зеленые, синие и фиолетовые. Цвет зависит от того, насколько сильной является кислота или щелочь.
Рисунок 1. Применение универсальной индикаторной бумаги
3 этап. Приготовление природных индикаторов. Я приготовила два природных индикатора. Первый на основе чая каркаде, а второй на основе сока краснокочанной капусты. Для этого я поместила в первый химический стакан чай каркаде, а во второй – мелконарезанные листья краснокочанной капусты. Оба стакана залила кипящей водой. Через 10 минут я слила полученный раствор в новый химический стакан и остудила их. Индикаторы готовы.
Рисунок 2. Приготовление природных индикаторов
4 этап. Изучение изменения окраски природных индикаторов в кислой и щелочной средах.
В химический стакан с пищевой содой я налила раствор чая каркаде, цвет раствора изменился с розового на темно-синий. Затем я налила чай каркаде в химический стакан с муравьиной кислотой, Цвет изменился, но не так явно: с розового на ярко-розовый.
Далее я провела такой же опыт с соком краснокочанной капусты. Раствор с соком краснокочанной капусты приобрел зеленый цвет, а с муравьиной кислотой – розовый.
Данный этап эксперимента позволил нам доказать, что для определения кислотной и щелочной среды можно использовать и природные индикаторы. Более тусклые цвета в пробирках от краснокочанной капусты получились от того, что сок краснокочанной капусты получился менее насыщенным чем заваренный чай каркаде.
Рисунок 3. Использование чая каркаде и краснокочанной капусты как индикаторов
Этап 5. Нейтрализация кислоты щелочью. Как я узнала, нейтрализовать действие кислоты помогает щелочь. Это очень важно знать, чтобы, когда получишь ожог муравьиной кислоты можно было бы ослабить ее действие.
Я решила проверить как это можно сделать. В пробирку с муравьиной кислотой, которая от сока краснокочанной капусты приобрела розовый цвет, я стала подливать раствор пищевой соды.
Пока я подливала раствор соды постепенно розовый цвет пропадал, это связано с исчезновением кислотной среды. В это время активно выделялся газ – это углекислый газ, продукт взаимодействия муравьиной кислоты и пищевой соды.
Рисунок 3. Нейтрализация действия муравьиной кислоты
Выводы:
Муравьиная кислота имеет кислую среду, а раствор питьевой соды – щелочную.
Определить среду раствора можно не только с помощью универсальной индикаторной бумаги (она есть в химической лаборатории), но и с помощью природных индикаторов.
Кислота нейтрализуется щелочью. Это свойство можно использовать при обработке ран от действия муравьиной кислоты (укус муравья, ожог от крапивы или медузы). Для этого достаточно обработать ранку ваткой, смоченной раствором соды (щелочь, содержащаяся в соде, нейтрализует кислоту).
Заключение
Цель и задачи моей работы достигнуты.
Я узнала историю открытия муравьиной кислоты, где она встречается в природе, и то, как она используется людьми. Узнала о свойствах муравьиной кислоты, и много интересных фактов о ней. Муравьиная кислота имеет широкое применение во многих сферах деятельности: в пищевой и химической промышленности, сельском хозяйстве, медицине, парфюмерии и косметология.
Исследуя свойства муравьиной кислоты, я научилась работать с различными источниками информации. Я провела опыты, которые позволили подтвердить ее свойства, я доказала, что муравьиная кислота – вещество, которое может быть полезно и опасно для людей различных ситуациях.
Список источников и литературы
Для чего используют муравьиную кислоту? // https://ldhim.ru/tpost/czhub8id51-dlya-chego-ispolzuyut-muravinuyu-kislotu
Дмитриенко Э.Б. Предметная неделя химии в школе / Э.Б. Дмитриенко, Н.И. Шевченко, А.М. Радецкий и др.; под ред. К.Н. Задорожного. – Ростов на Дону: Феникс, 2008. — 250 с.
Интересные факты о карбоновых кислотах // http://diva106.blogspot.com/2012/04/blog-post_7637.html
Муравьиная кислота // https://ru.wikipedia.org/wiki/Муравьиная_кислота
Муравьиная кислота // https://foodandhealth.ru/komponenty-pitaniya/muravinaya-kislota/
Муравьиная кислота – королева органических кислот // https://cyberleninka.ru/article/n/muravinaya-kislota-koroleva-organicheskih-kislot/viewer
Муравьиная кислота: общая характеристика и применение // https://hothim.ru/articles/muravinaya-kislota
Муравьиная кислота. Свойства // https://pcgroup.ru/blog/muravjinaya-kislota-svojstva/
Муравьиная кислота: свойства, вред и польза, применение // https://chtoikak.ru/muravinaya-kislota.html
Просмотров работы: 151
| Муравьиная кислота | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Метановая кислота |
| Традиционные названия | Муравьиная кислота |
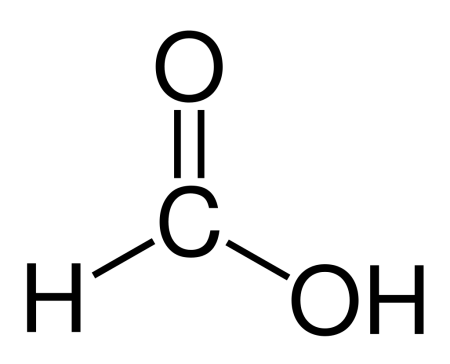
| Хим. формула | CH₂O₂ |
| Рац. формула | HCOOH |
| Состояние | Жидкость |
| Молярная масса | 46,025380 г/моль |
| Плотность | 1,2196 г/см³ |
| Динамическая вязкость | 0,16 Па·с |
| Энергия ионизации | 11,05 ± 0,01 эВ |
| Т. плав. | 8,25 °C |
| Т. кип. | 100,7 °C |
| Т. всп. | 60 °C |
| Т. свспл. | 520 °C |
| Пр. взрв. | 18 ± 1 об.% |
| Тройная точка | 281,40 K (8,25 °C), 2,2 кПа |
| Кр. точка | 588 K (315 °C), 5,81 МПа |
| Мол. теплоёмк. | 98,74 Дж/(моль·К) |
| Энтальпия образования | −409,19 кДж/моль |
| Давление пара | 120 мм. рт. ст. (16 кПа) при 50 °C |
| pKa | 3,75 |
| Показатель преломления | 1,3714 |
| Дипольный момент | 1,41 (газ) Д |
| ГОСТ | ГОСТ 5848-73 ГОСТ 1706-78 |
| Рег. номер CAS | 64-18-6 |
| PubChem | 284 |
| Рег. номер EINECS | 200-579-1 |
| SMILES |
O=CO |
| InChI |
1S/CH2O2/c2-1-3/h1H,(H,2,3) BDAGIHXWWSANSR-UHFFFAOYSA-N |
| Рег. номер EC | 200-579-1 |
| Кодекс Алиментариус | E236 |
| RTECS | LQ4900000 |
| ChEBI | 30751 |
| ChemSpider | 278 |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Муравьиная кислота (систематическое наименование: метановая кислота) HCOOH — органическое соединение, первый представитель в ряду насыщенных одноосновных карбоновых кислот. Зарегистрирована в качестве пищевой добавки под обозначением E236. Своё название муравьиная кислота получила потому, что впервые она была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв. В природе также обнаружена у пчёл, в крапиве, хвое. Соли и анионы муравьиной кислоты называются формиатами.
Содержание
- 1 Физические и химические свойства
- 2 Получение
- 3 Безопасность
- 4 Нахождение в природе
- 5 Применение
- 6 Производные муравьиной кислоты
Физические и химические свойства
При стандартных условиях муравьиная кислота представляет собой резко пахнущую бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
Константа диссоциации: 1,772⋅10−4.
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например:
-
- 2KMnO4 + 5HCOOH + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2 + 8H2O
При нагревании с сильными водоотнимающими средствами (H2SO4 (конц.) или P4O10) разлагается на воду и моноксид углерода:
-
- HCOOH → H2O + CO
Муравьиная кислота реагирует с аммиачным раствором оксида серебра:
-
- HCOOH + 2[Ag(NH3)2]OH → 2Ag + (NH4)2CO3 + 2NH3 + H2O
Взаимодействие муравьиной кислоты с гидроксидом меди:
-
- HCOOH + 2Cu(OH)2 → CO2 + Cu2O + 3H2O
Проявляет все свойства одноосновных карбоновых кислот:
Образует формиаты с металлами:
-
- HCOOH + KOH → HCOOK + H2O
- 2HCOOH + CaCO3 → (HCOO)2Ca + H2O + CO2
Со спиртами образует сложные эфиры:
-
- HCOOH + CH3OH → HCOOCH3 + H2O
Получение
- Побочный продукт в производстве уксусной кислоты жидкофазным окислением бутана.
- Окисление метанола:
CH3OH → HCHO → HCOOH - Реакцией монооксида углерода с гидроксидом натрия:
NaOH + CO → HCOONa → (+H2SO4, −Na2SO4) HCOOH
Это основной промышленный метод, который осуществляют в две стадии: на первой стадии монооксид углерода под давлением 0,6—0,8 МПа пропускают через нагретый до 120—130 °C гидроксид натрия; на второй стадии проводят обработку формиата натрия серной кислотой и вакуумную перегонку продукта. - Разложением глицериновых эфиров щавелевой кислоты. Для этого нагревают безводный глицерин со щавелевой кислотой, при этом отгоняется вода и образуются щавелевые эфиры. При дальнейшем нагревании эфиры разлагаются, выделяя углекислый газ, при этом образуются муравьиные эфиры, которые после разложения водой дают муравьиную кислоту и глицерин.
Безопасность
Опасность муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10 % обладает раздражающим эффектом, больше 10 % — разъедающим.
При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Контакт с концентрированными парами муравьиной кислоты может привести к повреждению глаз и дыхательных путей. Случайное попадание внутрь даже разбавленных растворов вызывает явления тяжёлого некротического гастроэнтерита.
Муравьиная кислота быстро метаболизируется и выводится организмом. Тем не менее, муравьиная кислота и формальдегид, образующиеся при отравлении метанолом, вызывают повреждение зрительного нерва и ведут к слепоте.
По данным ПДК в воздухе рабочей зоны равна 1 мг/м3 (максимально-разовая). Может попадать в организм при вдыхании. Порог восприятия запаха может достигать, например, 453 мг/м3. можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию муравьиной кислоты на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от неё следует использовать более эффективные изменение технологии и средства коллективной защиты.
Нахождение в природе
В природе муравьиная кислота обнаружена в хвое, крапиве, фруктах, едких выделениях медуз, пчёл и муравьёв. Муравьиная кислота впервые была выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв, чем и объясняется её название.
В больших количествах муравьиная кислота образуется в качестве побочного продукта при жидкофазном окислении бутана и лёгкой бензиновой фракции в производстве уксусной кислоты. Муравьиную кислоту получают также гидролизом формамида (~35 % от общего мирового производства); процесс состоит из нескольких стадий: карбонилирование метанола, взаимодействие метилформиата с безводным NH3 и последующий гидролиз образовавшегося формамида 75%-ной H2SO4. Иногда используют прямой гидролиз метилформиата (реакцию проводят в избытке воды или в присутствии третичного амина), гидратацию СО в присутствии щёлочи (кислоту выделяют из соли действием H2SO4), дегидрогенизацию CH3OH в паровой фазе в присутствии катализаторов, содержащих Cu, а также Zr, Zn, Cr, Mn, Mg и др. (метод не имеет промышленного значения).
Применение
В основном, муравьиную кислоту используют как консервирующий и антибактериальный агент при заготовке корма. Муравьиная кислота замедляет процессы гниения и распада, поэтому сено и силос, обработанные муравьиной кислотой, дольше сохраняются. Муравьиная кислота также используется в протравном крашении шерсти, для борьбы с паразитами в пчеловодстве, как растворитель в некоторых химических реакциях.
В лабораториях используют разложение жидкой муравьиной кислоты под действием горячей концентрированной серной кислоты, либо пропуская муравьиную кислоту над оксидом фосфора P2O5, для получения монооксида углерода.
В медицине используется для приготовления растворов пермуравьиной кислоты («первомур», или рецептура «С-4» (смесь перекиси водорода и муравьиной кислоты)). Первомур используют в хирургии в качестве предоперационного антисептического средства, в фармацевтической промышленности для дезинфекции оборудования.
Производные муравьиной кислоты
Соли и эфиры муравьиной кислоты называют формиатами.
Определение и формула
Органическое соединение, относится к насыщенным одноосновным карбоновым кислотам.
Альтернативное название
Метановая кислота
Формула
HCOOH
Свойства муравьиной кислоты
Физические свойства
Муравьиная кислота – прозрачная жидкость с резким характерным запахом.
С водой, этиловым спиртом и диэтиловым эфиром она смешивается во всех отношениях, растворима в ацетоне и в ароматических углеводородах (бензоле, толуоле), нерастворима в алифатических углеводородах (бензине, гексане, уайт-спирите). Муравьиная кислота в концентрации 77,5 % образует азеотропную смесь, кипящую при температуре 107,3°С.
| Свойство | Описание |
|---|---|
| Внешний вид | Прозрачная жидкость белого цвета |
| Молярная масса | 46,025 г/моль |
| Плотность при 20°С | 1,220 г/см3 |
| Показатель преломления при 20°С | 1,37142 nD20 |
| Температура плавления | 8,25°С |
| Температура кипения | 100,7°С |
Химические свойства
При взаимодействии с основаниями образует соли – формиаты:
NaOH + НСООН = HCOONa + H2O.
Формиаты легко растворимы в воде.
При нагревании муравьиной кислоты со спиртами в присутствии серной кислоты образуются сложные эфиры:
CH3OH +НСООН = НСООСН3 + H2O.
Муравьиную кислоту можно считать альдегидом угольной кислоты, поэтому она легко окисляется перманганатом калия:
5НСООН + KMnO4 + H2S04 = 6H2O + 5СО2 + MnSO4.
Наличие альдегидной группы в соединениях определяют при помощи реакции серебряного зеркала:
НСООН + 2[Ag(NH3)2]OH → 2Ag + (NH4)2CO3 + 2NH3 + H2O.
Муравьиная кислота горюча:
2НСООН + О2 = H2O + 2CO2.
При нагревании в присутствии иридия она разлагается на углекислый газ и водород:
НСООН = H2 + CO2,
При нагревании с серной кислотой выделяется монооксид углерода:
НСООН = Н2О+ СО.
Последняя реакция является лабораторным способом получения монооксида углерода (угарного газа).
Получение
Естественные способы получения
Муравьиной эта кислота названа Джоном Рэйем, который получил ее в 1670 году из муравьев. Она встречается также в пчелином яде, в крапиве и хвое. Присутствует в некоторых плодах и ягодах.
Лабораторный способ получения
Муравьиная кислота получается при нагревании щавелевой кислоты в присутствии глицерина:
(СООН)2 = НСООН + СО2.
Получение в промышленности
Самый распространенный промышленный метод получения муравьиной кислоты – это реакция между монооксидом углерода СО и едким натром:
NaOH + СО = HCOONa.
Получающийся формиат натрия переводят в муравьиную кислоту:
2HCOONa + H2SO4 = 2НСООН + Na2SO4.
Значительная часть муравьиной кислоты получается в производстве уксусной кислоты методом окисления бутана в жидкой фазе как побочный продукт.
Есть и множество других способов, но они пока не получили большого распространения.
Применение
Муравьиную кислоту применяют наружно при болезнях суставов в виде 1,75% спиртового раствора, который называют муравьиным спиртом. В косметике ее включают в состав лосьонов от угревой сыпи.
Применяется она при выделке кожи и при крашении тканей. В химической промышленности из нее получают растворитель метилформиат НСООСН3 (метиловый эфир муравьиной кислоты).
В животноводстве муравьиную кислоту добавляют в корма с целью профилактики кишечных заболеваний у скота, в особенности молодняка. Пчеловоды пользуются ей для лечения варроатоза.
Муравьиная кислота, маркируемая как Е236, входит в состав напитков, конфет, пирожных и других кондитерских изделий. Добавляют ее и при мариновании овощей.
Муравьиная кислота из пищевых продуктов легко усваивается организмом. А вот растворы ее с концентрацией больше 10% могут вызвать ожоги. Очень опасна концентрированная кислота, поскольку легко проникает в ткани и оставляет очень глубокие ожоги. При попадании на кожу или в глаза следует немедленно смыть ее раствором соды.
Пример решения задачи
Осуществите следующие превращения:
СН4→CH3Cl→СН3ОН→НСНО→НСООН→НСООСН3.
Решение
СН4 + Cl2 = CH3Cl + HCl;
CH3Cl + NaOH = СН3ОН + NaCl;
2СН3ОН + O2 = 2НСНО + Н2О;
НСНО + Cu(OH)2 = НСООН + Cu2O + 2Н2О;
СН3ОН + НСООН = НСООСН3 + Н2О.
Тест по теме «Муравьиная кислота»
Муравьиная кислота – вещество, входящее в группу карбоновых насыщенных одноосновных кислот. Оно имеет широкую сферу применения, активно используется в разных областях. В этой статье рассмотрим основные свойства муравьиной кислоты, способы её получения и другие особенности.
Формула и альтернативные названия
Муравьиная кислота, формула которой – HCOOH (в сокращённом варианте – CH2O2), имеет несколько альтернативных наименований. Корректное общепринятое химическое название – метановая кислота. Если вещество используется в качестве пищевой добавки, то производители продуктов питания обозначают его маркировкой E236. В косметических средствах и медикаментах встречается наименование Formic acid.
Муравьиная кислота название получила с подачи учёного из Англии Джона Рея в XVII столетии. Тогда исследователь изучал обезболивающий эффект выделений муравьёв и для получения лекарства провёл эксперимент – довёл до кипения несколько десятков насекомых, а затем осуществил дистилляцию. Образовался конденсат с кислотными свойствами, характерным вкусом. Эту жидкость учёный назвал муравьиной кислотой.
Двумя веками позже химиком французского происхождения Бертело был открыт иной метод получения вещества – путём выделения из оксида углерода. Джозеф Гей-Люссак сумел синтезировать соединение из уксусной кислоты. В 19-м столетии был разработан промышленный способ производства. Стали использовать иное название – метановая кислота (формула та же).
Свойства
Муравьиная кислота является жидкостью с резким специфическим запахом, кислым вкусом. В любых пропорциях вещество хорошо смешивается с диэтиловым эфиром, обычной водой, этиловым спиртом.
Метановая кислота растворяется в ацетоне, глицерине, нефтепродуктах, углеводородах ароматического ряда – толуоле, бензоле. В углеводородах алифатического типа вещество не меняет структуру. При нагреве муравьиная кислота разлагается на двуокись углерода и водород. Вещество горючее, пожароопасное.
Полезная информация! Муравьиная кислота цвета не имеет. Жидкость абсолютно прозрачная.
Муравьиная кислота относится к сильным карбоновым кислотам, она сильнее более известной уксусной в 10 раз. Главное отличие от прочих подобных соединений – проявление не только кислотных свойств, но и отдельных характеристик альдегидов. Это обусловлено молекулярным строением, в котором присутствуют альдегидная связь H-CO и кислотная составляющая CO-OH. При вступлении метановой кислоты в реакцию с гидроокисью меди формируется не соль, а комбинация углекислого газа, оксида меди и воды. Кислотные свойства вещество демонстрирует при контактах с солями, металлами, гидроксидами.
Польза и вред
Возможны опасные свойства для человека, и их выраженность зависит от концентрации вещества. Так, если муравьиная кислота содержится в растворе в объеме до 10%, то она считается относительно безвредной. При концентрации 10-15% вещество демонстрирует раздражающий эффект при контактах со слизистыми оболочками и с кожей. Если метановая кислота содержится в растворах в количестве более 15-20%, то она оказывает разъедающее воздействие.
При более высоких концентрациях вещество при попадании на слизистые оболочки или кожные покровы оставляет сильнейшие химические ожоги, в тяжёлых случаях провоцирует анафилактический шок. При продолжительном периоде и обширных зонах контактов вероятен летальный исход.
Но нельзя недооценивать пользу муравьиной кислоты, ведь она выполняет важные функции, поддерживает нормальную жизнедеятельность живых существ – людей и животных. Вещество участвует в синтезе нуклеиновых кислот, пуриновых оснований, метионина. Оно запускает важные реакции в клетках, соединительных тканях и внутренних органах. Также свойства метановой кислоты включают обезболивающий, противопаразитарный, антисептический, противовоспалительный и прочие эффекты.
Содержание муравьиной кислоты в продуктах
Есть ли муравьиная кислота в продуктах? Да, она встречается в природе и обнаружена в разных концентрациях в авокадо, клубнике, папайе, яблоках, киноа, диком ямсе, малине, питайе, китайском личи.
Есть метановая кислота и в некоторых растениях: крапиве, хвойных деревьях. Вещество присутствует в организмах живых существ – в телах и некоторых выделениях человека, медуз, пчёл. Но получить метановую кислоту из природных источников крайне сложно, так как её содержание в них обычно невысокое.
Получение муравьиной кислоты
Муравьиную кислоту можно получить разными способами.
- Нагрев щавелевой кислоты. Муравьиная кислота выделяется из её глицериновых эфиров.
- Изготовление уксусной кислоты. Метановая кислота является побочным продуктом, образующимся в жидкой фазе реакции окисления бутана.
- Вступление едкого натра в реакцию с монооксидом углерода. Получение муравьиной кислоты таким путём является самым популярным, поэтому часто применяется в промышленных масштабах.
- Разложение формамида. Метановая кислота образуется при вступлении этого вещества в реакцию с серной кислотой высокой концентрации.
- Окисление метанола. Процесс преобразования метилового спирта протекает последовательно, в несколько этапов и с использованием разных катализаторов.
- Воздействие на углеродсодержащие соединения. Пример – реакция хлороформа и разбавленной щёлочи.
Применение муравьиной кислоты
Муравьиная кислота, производство которой налажено в Китае, Германии, России, имеет широкую сферу применения. Её используют в промышленности, в медицине, в быту, сельском хозяйстве. Ниже рассмотрим все существующие направления.
Применение в пищевой промышленности
Муравьиная кислота останавливает развитие патогенной микрофлоры в еде, благодаря чему эффективно применяется в пищевой промышленности качестве консерванта, продлевающего сроки хранения продуктов и обеспечивающего их свежесть.
Добавка с маркировкой E236 входит в состав:
- маринадов для рыбы;
- напитков без содержания алкоголя;
- мёда;
- консервов из мяса, рыбы, морепродуктов;
- соусов;
- консервированных фруктов, овощей, ягод;
- кондитерских изделий – тортов, конфет, пирожных;
- продуктов с содержанием сыров.
Также вещество применяют в промышленности для дезинфицирующей обработки бочек, в которых изготавливается алкогольная продукция – вино, пиво. Часто добавку комбинируют с иными консервантами, такими как бензойная кислота.
Максимальная суточная доза муравьиной кислоты – 3 миллиграмма на каждый килограмм веса человека. Вещество в организме не накапливается, быстро усваивается, перерабатывается печенью, выводится вместе с каловыми массами. Высокие концентрации метановой кислоты способны оказывать мочегонное воздействие.
Важная информация! В качестве пищевой добавки вещество с маркировкой E236 разрешено использовать в странах-членах Евразийского экономического союза – Казахстане, Армении, России, Киргизии, Белоруссии. В государствах Евросоюза можно добавлять метановую кислоту только в косметические продукты. В США допустимо применять вещество при изготовлении синтетических пищевых ароматизаторов.
Применение в медицине
Муравьиная кислота в медицине применяется только наружно. Самая популярная форма выпуска – муравьиный спирт 1,4%, который обладает местнораздражающим эффектом, благодаря чему снимает воспаление, борется с болевыми ощущениями, расширяет сосуды и нормализует кровоснабжение, питание тканей. Также отмечаются бактерицидные свойства.
Муравьиный спирт можно использовать при:
- миозите;
- травмах: ушибах, вывихах, гематомах, растяжениях;
- артралгии;
- миалгии;
- артритах;
- невралгии;
- грибке ногтевых пластин или кожи;
- ревматизме;
- болях в голове, суставах;
- варикозе;
- пролежнях у лежачих больных;
- туберкулёзе (в составе многокомпонентных средств);
- радикулите.
Полезно знать! На основе муравьиной кислоты выпускаются другие средства для наружного местного использования – мази, кремы, гели, спреи.
Применение в косметологии
Благодаря дезинфицирующим, противовоспалительным и очищающим свойствам метановая кислота применяется в косметологии для:
- борьбы с акне, чёрными точками;
- матирования жирной кожи;
- очищения пор;
- улучшения цвета кожных покровов за счёт расширения сосудов и нормализации кровообращения;
- получения ровного загара в солярии (нужно соблюдать осторожность);
- купирования воспалений;
- борьбы с нежелательными волосками на теле – замедления их роста после депиляции, а также разрушения фолликулов (при регулярном применении).
Муравьиная кислота входит в состав различных косметических средств, например, лосьонов, тоников, кремов, сывороток. Также вещество можно использовать в домашних условиях, добавляя в народные средства – самодельные маски, кремы, отвары для умывания.
Применение в быту
Муравьиную кислоту используют предприятия химической промышленности. Вещество справляется с удалением извести, патины, цемента, ржавчины, кальциевого мыла, а также иных органических и минеральных неорганических частиц.
Метановая кислота входит в состав бытовой химии для:
- удаления налёта накипи на сантехнике и посуде;
- чистки унитазов и ванн;
- предотвращения образования накипи в посудомоечных, стиральных машинах;
- очищения металлических изделий, включая автомобильные диски и прочие детали;
- стирки или кондиционирования белья;
- дезинфекции поверхностей.
Так как муравьиная кислота – вещество биоразлагаемое, то все средства на его основе не вредят окружающей среде и являются экологически чистыми.
Применение в других отраслях
Применение муравьиной кислоты очень широко и включает несколько других направлений:
- Пчеловодство. Вещество защищает насекомых-медоносов от клещей, уничтожающих целые ульи.
- Кожевенные, меховые производства. Кожа и мех с помощью метановой кислоты очищаются от загрязнений и дезинфицируются, обретают равномерный оттенок и эластичную структуру.
- Сельское хозяйство. Обработка кормов муравьиной кислотой при заготовке продлевает сроки хранения пищи для скота и птицы, сохраняет её пользу и защищает от паразитов.
- Борьба с гололёдом. Вещество добавляется в реагенты, используемые для обработки скользких замёрзших дорог в зимнее время.
- Строительство. В бетонных растворах кислота используется в качестве добавки, препятствующей промерзанию конструкций.
- Животный мир. Муравьиная кислота, запах и раздражающие свойства которой отпугивают паразитов, используется медведями. Эти животные, просыпаясь после зимнего сна, намеренно усаживаются на муравейники. Насекомые, защищаясь, выделяют кислоту. Вещество оседает в густом мехе и защищает представителей фауны от укусов кровососущих насекомых.
Меры безопасности
Чтобы муравьиная кислота не навредила, следует соблюдать такие меры безопасности:
- Не превышать суточную норму потребления.
- Не контактировать с концентрированными формами вещества – более 10%. Если необходимо работать с ними, следует надевать перчатки, защитный костюм и очки. Водные растворы с содержанием менее 10% муравьиной кислоты входят в 3-й класс умеренно опасных соединений.
- Не использовать средства на основе муравьиной кислоты в косметологических или медицинских целях при повреждениях кожи, а также индивидуальной непереносимости вещества. Перед применением надо провести аллергический тест – нанести немного состава на локтевой сгиб и подождать полчаса. При отсутствии реакций косметическое или лечебное средство можно использовать.
- Если концентрированная кислота попала на кожные покровы, то следует незамедлительно промыть поражённую поверхность, но не водой, а раствором соды либо нашатырного спирта.
- Не применять вещество для ухода за кожей, лечения или профилактики заболеваний без предварительной консультации специалиста – косметолога или лечащего врача.
- Не нюхать метановую кислоту, не подносить к лицу. Вдыхание её паров крайне опасно. Оно провоцирует раздражение верхних дыхательных путей с першением и кашлем, отёк лёгких (в тяжёлых случаях), сильную аллергию, поражение зрительного нерва (вплоть до полной слепоты). Во избежание таких последствий при работе с концентрированными соединениями надевайте маску-респиратор.
Муравьиная кислота давно и активно используется в разных сферах. В высоких концентрациях она опасна. Но если знать и соблюдать правила применения и меры предосторожности, то можно извлечь из вещества максимум пользы и избежать негативных последствий.
Муравьиная кислота, получение, свойства, химические реакции.
Муравьиная кислота (также – метановая кислота) – органическое вещество, относящееся к насыщенным одноосновным карбоновым кислотам.
Муравьиная кислота, формула, характеристики
Физические свойства муравьиной кислоты
Химические свойства муравьиной кислоты
Получение муравьиной кислоты
Безопасность при обращении с муравьиной кислотой. Требования ГОСТа
Применение муравьиной кислоты
Муравьиная кислота, формула, характеристики:
Муравьиная кислота (также – метановая кислота) – органическое вещество, относящееся к насыщенным одноосновным карбоновым кислотам.
Химическая формула муравьиной кислоты CH₂O₂. Рациональная формула муравьиной кислоты HCOOH. Изомеров не имеет.
Строение молекулы муравьиной кислоты:
Муравьиная кислота (метановая кислота) – простейшая карбоновая кислота, родоначальник класса карбоновых кислот.
Муравьиная кислота – бесцветная жидкость, обладающая резко пахнущим запахом.
Муравьиная кислота – легковоспламеняющаяся жидкость с температурой вспышки 60 °С, температурой самовоспламенения 504 °С.
Водный раствор, содержащий 85% муравьиной кислоты, также является горючей жидкостью с температурой вспышки (в открытом тигле) 71 °С, температурой воспламенения 83 °С.
При температуре выше 69°C муравьиная кислота может образовывать взрывоопасныe смеси пар/воздух.
Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом.
В качестве пищевой добавки муравьиная кислота зарегистрирована как E236.
Муравьиная кислота своё название получила из-за того, что была впервые выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв.
В природе муравьиная кислота содержится в яде пчел, в крапиве, хвое, выделениях медуз, фруктах (яблоках, малине, клубнике, авокадо и пр.).
Соли и анионы муравьиной кислоты называются формиатами.
Название муравьиной кислоты на английском – formic acid.
Муравьиная кислота обладает токсическим действием, опасна для жизни и здоровья (опасность зависит от концентрации), обладает разъедающими свойствами.
Физические свойства муравьиной кислоты:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | резкий запах |
| Вкус | кислый |
| Агрегатное состояние (при 25 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (при 25 °C и атмосферном давлении 1 атм.), г/см3 | 1,2196 |
| Плотность (при 25 °C и атмосферном давлении 1 атм.), кг/м3 | 1219,6 |
| Температура плавления, °C | 8,25 |
| Температура кипения, °C | 100,7 |
| Тройная точка, °C | 8,25 при 2,2 кПа |
| Критическая точка, °C | 315 при 5,81 МПа |
| Температура вспышки, °C | 60 |
| Температура самовоспламенения, °C | 504 |
| Константа диссоциации | 1,772⋅10-4 |
| Константа диссоциации кислоты | 3,75 |
| Взрывоопасные концентрации смеси с воздухом, % объёмных | от 18 до 57 |
| Удельная теплота сгорания, МДж/кг | 4,58 |
| Молярная масса, г/моль | 46,03 |
Химические свойства муравьиной кислоты:
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные.
Для нее характерны следующие химические реакции:
- 1. реакция муравьиной кислоты с щелочами:
HCOOH + NaOH → HCOONa + H2O,
HCOOH + KOH → HCOOK + H2O.
В ходе данной реакции образуется формиат натрия (формиат калия) и вода.
- 2. реакция муравьиной кислоты с гидроксидами:
HCOOH + 2Cu(OH)2 → CO2 + Cu2O + 3H2O.
В ходе данной реакции образуется углекислый газ, оксид меди и вода.
- 3. реакция разложения муравьиной кислоты при нагревании:
HCOOH → CO + H2O (to, kat = H2SO4 (конц.) или P4O10).
При нагревании с сильными водоотнимающими средствами, такими как концентрированная серная кислота или оксид фосфора, разлагается на моноксид углерода (угарный газ) и воду.
- 4. реакция образования сложных эфиров:
Муравьиная кислота, вступая в реакцию со спиртами, образует сложные эфиры.
HCOOH + СН3ОН→ HCOOCH3 + H2O.
В результате химической реакции муравьиной кислоты с метанолом (метиловым спиртом) образуется метилформиат (метиловый эфир муравьиной кислоты) и вода.
- 5. реакция с аммиачным раствором оксида серебра (реакция серебряного зеркала):
HCOOH + 2[AgNH3)2]ОН→ 2Ag + (NH4)2CO3 + 2NH3 + H2O.
Поскольку муравьиная кислота проявляет свойства альдегидов, то для нее характерна реакция «серебряного зеркала». Реакция «серебряного зеркала» является качественной реакцией на альдегиды. В результате реакции образуется металлическое серебро. Если реакция проводится в сосуде с чистыми и гладкими стенками, то серебро осаждается на них в виде тонкой плёнки, образуя зеркальную поверхность. При наличии малейших загрязнений серебро выделяется в виде серого рыхлого осадка.
Получение муравьиной кислоты:
Муравьиную кислоту получают:
– окислением метанола (СН3ОН);
– как побочный продукт при окислении бутана в производстве уксусной кислоты;
– реакцией монооксида углерода с гидроксидом натрия (основной промышленный способ) в две стадии.
NaOH + CO → HCOONa → HCOOH
На первой стадии получают формиат натрия, затем его обрабатывают серной кислотой;
– разложением глицериновых эфиров щавелевой кислоты.
Безопасность при обращении с муравьиной кислотой. Требования ГОСТа:
Муравьиная кислота относится к веществам 2-го класса опасности (ГОСТ 12.1.007-76). Предельно допустимая концентрация ее в воздухе рабочей зоны производственных помещений (ПДК) составляет 1 мг/м3 (см. ГОСТ 5848-73 Реактивы. Кислота муравьиная. Технические условия (с Изменениями N 1, 2, 3)).
При превышении предельно допустимой концентрации пары муравьиной кислоты действуют раздражающе на слизистую оболочку верхних дыхательных путей и глаз; муравьиная кислота вызывает также ожог кожи.
Муравьиная кислота и ее растворы – легковоспламеняющиеся жидкости. Все работы с муравьиной кислотой следует проводить вдали от огня.
Все помещения, в которых проводятся работы с муравьиной кислотой, должны быть оборудованы общей приточно-вытяжной механической вентиляцией. Анализ муравьиной кислотой следует проводить в вытяжном шкафу лаборатории.
При работе с ней следует применять индивидуальные средства защиты. Не допускать попадания препарата внутрь организма. Первая помощь при ожогах – обильное промывание водой.
Применение муравьиной кислоты:
Муравьиная кислота применяется:
– в медицине,
– в сельском хозяйстве, как консервант сена и силоса,
– в химической промышленности в качестве растворителя,
– в пищевой промышленности в качестве консерванта,
– в текстильной промышленности для окрашивания шерсти,
– в пчеловодстве как средство для борьбы с паразитами.
Примечание: © Фото //www.pexels.com, //pixabay.com
Коэффициент востребованности
12 042