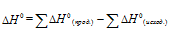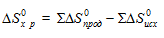Расчет температуры, при которой наступает равновесие системы. Определение направления реакции
Температура наступления равновесия системы
Задача 10.
Термохимическое уравнение реакции: СО(г) + 2H2(г) = CH3OH(ж) + 128 кДж.
Вычислите, при какой температуре наступает равновесие в этой системе?
Решение:
Так как при реакции выделяется тепло, то это экзотермическая реакция. При экзотермических реакциях энтальпия системы уменьшается и ∆H < 0 (Н2 < H1). Тепловые эффекты выражаются через ∆H.
В основе термохимических расчетов лежит закон Гесса (1840 г.): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
В термохимических расчетах применяют чаще следствие из закона Гесса: тепловой эффект реакции (∆Hх.р.) равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
Энтропия S, так же как энтальпия Н, является свойством вещества, пропорциональным его количеству. Энтропия является функцией состояния, т.е. ее изменение (∆S) зависит только от начального (S1) и конечного (S2) состояния и не зависит от пути процесса:
∆Sх.р. = ∆S0прод. – ∆S0исх.
Так как энтропия растет с повышением температуры, то можно считать, что мера беспорядка (– Т∆S). При Р = const и Т = const общую движущую силу процесса, которую обозначают ∆G, можно найти из соотношения:
∆G = (Н2 – H1) – (TS2 – TS1); ∆G = ∆H – T∆S.
Химическое равновесие — состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
В состояния равновесия:
∆G = 0 и ∆H = T∆S.
Находим ∆S. для данной системы:
S0(СО) = 197,55·10-3 кДж/моль·К;
S0(Н2) = 130,52·10-3 кДж/моль·К;
S0(СН3ОН) = 126,78·10-3 кДж/моль·К;
∆Sх.р. = 126,78·10-3-(197,55·10-3) + (2·130,52·10-3) = -331,81·10-3.
Из условия равновесия :
∆H = T∆S находим Т = ∆H/∆S.
Т = (-128 кДж/моль)/(-331,81·10-3 кДж/моль·К) = 385,7 K.
Ответ: при 385,7 K наступит равновесие в системе.
Определение направления протекания реакции
Задача 11.
Определить направление протекания реакции:
СН4(г) + СО2(г) ⇔ 2СО(г) + 2Н2(г) при стандартных условиях. Вычислить ∆G0298
Решение:
В основе термохимических расчетов лежит закон Гесса (1840 г.): тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
В термохимических расчетах применяют чаще следствие из закона Гесса: тепловой эффект реакции (∆Hх.р.) равен сумме энтальпий образования ∆Hобр продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов:
∆Нх.р. = [2∆Н(СО(г)] + [2∆Н(Н2(г)] — [∆Н(СН4(г)]+ [∆Н(СО2(г)]
т.к. ∆Н для простых веществ равна 0, то выражение принимает вид:
∆Нх.р. = [2∆Н(СО(г)] — [∆Н(СН4(г)]- [∆Н(СО2(г)]
∆Нх.р. = 2(-110,53)-(-74,85)-(-393,51) = 247,3 кДж/моль.
Энтропия — функция состояния, т.е. ее изменение (∆S) зависит только от начального (S1) и конечного (S2)состояния и не зависит от пути процесса:
∆Sх.р. = [2∆S(СО(г)] + [2∆S(Н2(г)] — [∆S(СН4(г)] + [∆S(СО2(г)] =
= 2(197,55) + 2(130,52) — 186,27 — 213,66 = 256,26·10-3 кДж/моль·К.
∆G, можно найти из соотношения:
∆G = ∆H – T∆S.
Необходимо рассчитать возможность самопроизвольного протекания реакции при стандартных условиях (Т = 298 K), получим:
∆G = 247,3 — (298·256,26·10-3) = +170,9 кДж.
Ответ: ∆G = +170,9 кДж. Так как ∆G > 0, следовательно, при стандартных условиях невозможно протекание прямой реакции. Реакция может протекать в обратном направлении.
Изменения
энтальпии в ходе химической реакции не
может быть критерием
возможности
или невозможности осуществления данной
реакции, ибо реакции могут самопроизвольно
протекать не только при выделении, но
и при поглощении тепла в ходе химической
реакции. Рассмотрение этого вопроса в
термохимии основывается на втором
законе термодинамики, при этом используются
понятия энтропии вещества S,
участвующих в реакции, и энтропии
химической реакции ΔS.
Понятие энтропии может быть трактовано
как в терминах степени упорядоченности
системы, так и в терминах статистической
термодинамики (уравнение Больцмана).
Универсальным
критерием возможности самопроизвольного
протекания реакции является такая
функция состояния системы, как свободная
энергия Гиббса ΔG.
Если для некоторой реакции ΔG
< 0, то такая реакция может протекать
самопроизвольно, если же ΔG
> 0, то — нет. Данное утверждение
представляет собой термодинамическое
услoвие
сaмoпрoизвoльнoгo
прoтeкaния
химичeской
реакции. Если для некоторого химического
процесса ΔG
= 0, то состояние системы называется
равновесным, оно характеризуется
константой равновесия Kравн
= 1.
На
термодинамическую систему, находящуюся
в состоянии химического равновесия,
оказывает влияние изменение
термодинамических параметров: температуры,
давления, количества вещества. Система
при этом соответственным образом
перестраивается, что может быть описано
принципом Ле-Шателье.
Термины и определения
Термодинамической
системой
называется такая совокупность тел, в
которой возможен тепло- и массообмен
между ними. Частным случаем термодинамической
системы является химическая система,
в которой протекают химические процессы.
К
термодинамическим
параметрам
(или переменным) системы относятся:
давление p,
объем V, температура T, количество молей
вещества ν. Иногда к ним относят и
количество теплоты Q,
подводимое к системе или отводимое от
нее извне. Основные термодинамические
параметры связаны между собой известным
уравнением Менделеева-Клапейрона: pV
= ν RT.
К
термодинамическим
функциям
состояния системы относятся: внутренняя
энергия U,
энтальпия H,
теплоемкость при постоянном давлении
cp,
теплоемкость при постоянном объеме cv
,
энтропия S,
свободная энергия Гиббса G.
Первый
закон
термодинамики
утверждает, что сообщенная системе
теплота расходуется на приращение
внутренней энергии системы и на совершение
работы против внешних сил, в частности
на расширение системы:
Q
= ΔU
+ pΔV.
Внутренняя
энергия U
есть
общий запас энергии в системе, за
исключением потенциальной и кинетической
энергии системы как целого. Внутренняя
энергия системы определяется энергией
движения молекул, энергией движущихся
электронов в атомах, энергией
внутримолекулярных колебаний атомов
и атомных групп, электрическими
взаимодействиями, внутриядерной энергией
и т.д. Поэтому определить абсолютное
значение внутренней энергии не
представляется возможным.
Теплота
Q,
подведенная извне или отведенная от
системы, представляет собой термодинамическую
переменную. Вызванное этим изменение
состояния системы характеризуется
изменением соответствующей функции
состояния, называемой энтальпией
системы
Н: ΔН
= ΔU
+ pΔV.
Как
и в случае внутренней энергии, определить
абсолютное значение энтальпии не
представляется возможным.
Тепловым
эффектом
химической реакции
называется изменение энтальпии химической
системы ΔН в результате прохождения
реакции.
Эндотермической
реакцией называется
реакция, сопровождаемая поглощением
энергии, для нее характерно положительное
значение теплового эффекта при данной
температуре ΔН > 0.
Экзотермической
реакцией
называется реакция, сопровождаемая
выделением энергии, для нее характерно
отрицательное значение теплового
эффекта при данной температуре ΔН <
0.
Под
стандартным
условиями протекания
химической реакции понимают следующие:
р = 1,013·105
Па, Т = 298 К, ν = 1 моль. Стандартные функции
состояния системы ΔНº298,
ΔUº298,
ΔGº298
выражаются в системе СИ в кДж/моль.
Стандартная
энтальпия
образования
ΔНºобр.298
,
или ΔНºf.298,
есть
тепловой эффект реакции образования
сложного вещества из простых, приведенный
к стандартным условиям. Энтальпии
образования простых веществ считаются
равными нулю.
Первый
закон
термохимии:
Тепловой эффект реакции образования
сложного вещества из простых равен по
абсолютному значению, но противоположен
по знаку тепловому эффекту реакции
разложения данного соединения на простые
вещества: ΔНºобр
= –ΔНºразл
.
Второй
закон термохимии:
Тепловой эффект химической реакции,
протекающей
при постоянном давлении или при
постоянном объеме, не зависит от
числа, последовательности и характера
ее промежуточных стадий, но определяется
только начальным и конечным состоянием
системы.
Первое
следствие из
второго закона термохимии: Тепловой
эффект химической реакции равен сумме
энтальпий образования продуктов реакции
за вычетом суммы энтальпий образования
реагентов при данной температуре:
ΔНх.р
= ΣΔНобр.прод
–
ΣΔНобрреаг.
Энтальпи
образования простых веществ принимается
равной нулю.
Второе
следствие из
второго закона термохимии: Тепловой
эффект химической реакции равен сумме
энтальпий сгорания реагентов реакции
за вычетом суммы энтальпий сгорания
продуктов при данной температуре:
ΔНх.р
= ΣΔНсгорреаг
–
ΣΔН
сгор.прод
.
Энтальпия
сгорания негорючих веществ принимается
равной нулю.
Под
теплоемкостью
понимают количество теплоты, которое
необходимо сообщить системе, чтобы
повысить ее температуру на 1 К. Различают
теплоемкость при постоянном давлении
cp
= ΔН/ΔT,
теплоемкость при постоянном объеме cv
=
ΔU/ΔT.
Они связаны между собою таким образом:
cp
= cv
+
R .
Термохимический
закон Кирхгофа:
Тепловой эффект химической реакции при
некоторой температуре ΔНТ1
связан с тепловым эффектом той же реакции
при иной температуре ΔНТ2
через изменения теплоемкостей продуктов
и реагентов реакции Δср
следующим
образом:
ΔНТ2
=
ΔНТ1
+
ΣΔср
·
ΔT.
Суммарный,
или общий
тепловой эффект
реакции, включает в себя вклад собственно
энтальпии химической реакции ΔНх.р.,
изменения энтальпии в результате
изменения температуры ΔНТ
и изменения энтальпии при фазовых
переходах в системе ΔНф.п.:
ΔН
=
ΔНх.р.
+
ΔНТ
+
ΔНф.п
.
Наиболее
существенное значение для термохимии
имеет следующая формулировка второго
закона термодинамики:
Изменение энтропии
при любом изменении системы равно
отношению притока тепла в систему Q
(т.е. ΔН) к абсолютной температуре Т: ΔS
= ΔН/Т.
Энтропия
S
есть количественная мера степени
неупорядоченности системы. Согласно
второму закону термодинамики, энтропия
определяется через ее изменение при
изменении энтальпии системы. Различают
энтропию конкретного вещества в
определенных условиях, например, в
стандартных ΔSº,
и изменение энтропии в результате
некоторого процесса, в частности,
химической реакции в стандартных
условиях ΔSºх.р..
Последняя может быть найдена из выражения,
аналогичного первому следствию из
второго закона термохимии:
ΔSх.р
= ΣΔSºпрод
–
ΣΔSºреаг
.
Уравнением
Больцмана
дается статистическое представление
энтропии:
S
= R ln W,
где
R
есть универсальная газовая постоянная,
а W
— термодинамическая вероятность
осуществления данного состояния системы
(количество микросостояний, которыми
может осуществиться данная система).
Свободная
энергия
Гиббса
G
есть функция состояния системы, включающая
в себя энтальпию и энтропию, ее изменение
в ходе химического процесса дается
выражением: ΔG
= ΔН –
ТΔS
.
Термодинамическое
услoвие
сaмoпрoизвoльнoгo
прoтeкaния
химичeской
реакции состоит в требовании уменьшения
свободной энергии Гиббса: Если для
некоторой реакции ΔG
< 0, то такая реакция может протекать
самопроизвольно в прямом направлении,
если же ΔG
> 0, то — нет.
Состояние
химического равновесия характеризуется
константой
равновесия
химической реакции, которая равна
отношению констант скоростей прямой и
обратной реакций: Kр
= kпрям
/ kобр.
Константа
равновесия реакции связана со свободной
энергией Гиббса: ΔG
= – RT · ln
Kр.
Если Kр
=
1, то ΔG
= 0, и протекание реакции равновероятно
в обе стороны. Если Kр
> 1, то ΔG
< 0, и реакция смещена в сторону
образования продуктов. Если Kр
<
1, то ΔG
> 0, реакция протекает преимущественно
в сторону образования реагентов, то
есть преобладает обратная реакция.
Принцип
Ле-Шателье
состоит в следующем: Если на термодинамическую
систему, находящуюся в состоянии
химического равновесия, оказывается
внешнее воздействие, то система
перестраивается таким образом, чтобы
эффект внешнего воздействия был уменьшен.
…
Чтобы дать ответ на вопрос о возможности протекания той или иной реакции, о ее направлении и глубине необходимо снова воспользоваться II – законом термодинамики, который может быть сформулирован следующим образом: любой самопроизвольно протекающий процесс, а также и химическая реакция, идет в том направлении, которое сопровождается уменьшением свободной энергии в системе (при постоянных температуре и давлении) или энергии Гельмгольца (при постоянных температуре и объеме).
Свободная энергия или Энергия Гиббса G – это та часть всей энергии системы, которую можно использовать для совершения максимальной работы.
Энергия Гельмгольца A — это та часть внутренней энергии системы, также определяющая работоспособность и может быть применена для совершения максимальной работы.
При протекании химических реакций единовременно совершаются два направления: стремление простых частиц объединиться в более сложные, а также стремление сложных частиц к распаду на более простые.
Они не зависят друг от друга и их величины противоположны, и процесс идет в сторону той реакции, при которой изменение величины больше. Разность между этими величинами определяет свободную энергию реакции (при постоянных температуре и давлении). Ее изменение в реакции определяется разностью сумм энергий Гиббса конечных продуктов реакции и исходных веществ:
ΔG= Gкон – Gисх
При постоянных температуре и давлении изменение энергии Гиббса связано с энтальпией и энтропией следующим выражением:
ΔG = ΔH– TΔS
Здесь изменение энергии Гиббса учитывает одновременно изменение энергетического запаса системы и степень ее беспорядка (самопроизвольность протекания процесса).
Т.к. энергия Гиббса является мерой самопроизвольности протекания процесса, то между знаком ΔG для любой реакции и ее самопроизвольным протеканием (при постоянных температуре и давлении) существуют такие зависимости:
- Если ΔG отрицательно (ΔG<0), то реакция протекает самопроизвольно в прямом направлении.
- Если ΔG равно нулю (ΔG=0), то реакция находится в равновесном состоянии.
- Если ΔG положительно (ΔG>0), то реакция протекать самопроизвольно в прямом направлении не может. Однако обратная реакция идет самопроизвольно.
Энтальпийный и энтропийный факторы и направление процесса
Выясним, как функция свободной энергии зависит от изменений энтропии и энтальпии идущего процесса. Вернемся к выражению, связывающему энергию Гиббса с энтальпией и энтропией:
ΔG= ΔH – TΔS
Без энтропийных факторов все экзотермические реакции (ΔH˂0) должны были быть самопроизвольными. Но энтропийный фактор, который определяется величиной – TΔS, может привести к росту или, наоборот, к падению способности самопроизвольного протекания.
Так, при ΔS>0, член – TΔS вносит отрицательный вклад в общую величину ΔG, следовательно он повышает возможность реакции протекать самопроизвольно.
А при при ΔS<0, член – TΔS напротив уменьшает возможность реакции протекать самопроизвольно.
Если ΔH и – TΔS имеют противоположные знаки, то от их величины зависит будет ли ΔG отрицательным или положительным. В таком случае, необходимо учитывать температурный фактор. Т.о. при высоких температурах роль энропийного фактора становится значительным.
Далее приведена таблица, наглядно показывающая влияние температуры на самопроизвольное протекание реакции.
|
ΔH |
ΔS | ΔG |
Протекание реакции |
| ˂0 | >0 | Всегда ˂0 | Реакция самопроизвольна при любых температурах, обратная реакция всегда несамопроизвольна |
| >0 | ˂0 | Всегда >0 | Реакция несамопроизвольна при любых температурах, обратная реакция самопроизвольна |
| ˂0 | ˂0 | При низких температурах ˂0, при высоких температурах >0 | Реакция самопроизвольна при низких температурах, обратная реакция становится самопроизвольной при высоких температурах |
| >0 | >0 | При низких температурах >0, при высоких температурах ˂0 | Реакция несамопроизвольна при низких температурах, но при высоких температурах становится самопроизвольной |
Изменение энергии Гиббса. Для удобства принято сравнивать значения ΔG при стандартных условиях – концентрации равны 1 моль/л, парциальное давление газообразных веществ равно 101,3 кПа, температура 298,15 К. Тогда свободную энергию обозначают через ΔG0, на основе значений которой можно вычислить изменение энергии Гиббса химической реакции:
ΔG0р-ции = Σ ΔG0прод — Σ ΔG0исх
Величина ΔG0р-ции позволяет определить, будет ли данная реакция, находящаяся в стандартных условиях, протекать самопроизвольно в прямом или обратном направлении. Аналогично теплоте образования, энергии Гиббса образования простых веществ равны нулю.
Энергия Гельмгольца системы с определенной внутренней энергией (U), энтропией (S) при абсолютной температуре (Т) определяется уравнением:
A = U – TS
Изменение энергии Гельмгольца для процессов (при постоянных температуре и объеме) можно определить соотношением:
ΔA= ΔU – TΔS
ΔA — величина, которая не зависит от пути, а зависит только от исходного и конечного состояния системы, т.е. ΔA также, как и другие рассмотренные термодинамические величины, является функцией состояния.
Энергия Гельмгольца подобно энергии Гиббса связана с самопроизвольностью протекания процесса. Если допустить, что система изолирована, а объем и температура постоянны, то самопроизвольно будут протекать только те процессы, при которых А уменьшается.
Таким образом, при ΔA<0 процесс идет самопроизвольно в прямом направлении,
при ΔA>0 – в обратном направлении,
а при ΔA=0 система находится в состоянии равновесия.
Энергию Гельмгольца и энергию Гиббса в стандартных состояниях можно связать с константой равновесия:
ΔG0Т = ΔH0Т – TΔS0Т = —RTlnK,
Где R– универсальная газовая постоянная, K – константа равновесия, Т – абсолютная температура.
Если K>>1, т.е. реакция идет в прямом направлении, то ΔG0˂˂0.
Если K<<1, т.е. реакция идет в обратном направлении, то ΔG0>>0
Если K=1, то ΔG0=0
В случае химической реакции, протекающей в гальваническом элементе при стандартных условиях ΔG0 можно связать с ЭДС гальванического элемента следующим соотношением:
ΔG0=-nFE0, где
nF – количество прошедшего электричества
E0 – электродвижущая сила, при условии что все вещества, принимающие участие в реакции, находятся в стандартном состоянии.
При самопроизвольном протекании процесса, его ΔG<0, а ЭДС>0.
Порог реакционной способности веществ для большинства реакций имеет значение ΔG0≈41 кДж/моль.
То есть, если ΔG0<-41 кДж/моль, то процесс осуществим,
если ΔG0>+41 кДж/моль, то процесс неосуществим в любых реальных и стандартных условиях.
Учет знака потенциала окислительно-восстановительной реакции ( > О, < О, = 0) позволяет определять направление протекания реакции в заданных условиях. [c.159]
Направленность протекания реакций при разных [c.80]
Изменение энергии Гиббса, таким образом, характеризует направление протекания реакций. Если AG<0, то реакция может протекать самопроизвольно. При AG>0 процесс самопроизвольно протекать не может. Если AG=0, то система находится в равновесии. Чем большим уменьшением энергии Г иббса сопровождается реакция, тем больше сродство реагирующих веществ друг к другу. Изменение энергии Гиббса можно, следовательно, рассматривать как меру химического сродства, которое велико при АЯ< 0 и TAS O. [c.46]
Оба уравнения описывают реакцию получения аммиака, однако численные значения теплоты реакции и константы равновесия реакции по уравнению (165) отличаются от соответствующих значений уравнения (166). Пока еще не известно, являются ли вещества, стоящие в левой части уравнения, исходными веществами, а с правой — продуктами реакции. Задача термодинамического исследования как раз состоит в том, чтобы определить направление протекания реакции. При записи уравнений реакции можно использовать и дробные коэффициенты [уравнение (166)]. Однако, вообще говоря, в качестве коэффициентов всегда стремятся использовать минимальные целые числа, и уравнение реакции записывают таким образом, чтобы оно соответствовало самопроизвольному протеканию реакции слева направо. [c.206]
Если окислительный потенциал реакции отрицателен, более благоприятным направлением протекания реакции является переход в восстановленное состояние, а не в окисленное. Например, реакция [c.431]
При определении численной величины АЯ, необходимо учитывать форму записи стехиометрического уравнения, направление, протекания реакции, температуру, давление и физическое состояние реагентов. [c.22]
Запишите электрохимическую схему этого элемента, определите его стандартную ЭДС и укажите направление протекания реакции при его работе. Укажите составы катода и анода этого элемента. [c.190]
Существуют два основных подхода -к изучению химической реакции 1) термодинамический, с помощью которого определяют возможность и направление протекания реакции и 2) кинетический,— рассматривающий механизм реакции и ее скорость. Рассмотрим обобщенное уравнение химической реакции [c.147]
Энергетическая возможность и направление протекания реакций. [c.224]
В случае окислительно-восстановительных реакций направление протекания реакции определяется самопроизвольным пере- [c.345]
Максимальная работа изотермической реакции при постоянном давлении и постоянной температуре определяется изменением так называемого изобарного потенциала ДС. Эта величина характеризует максимальную полезную работу реакции и указывает на направление протекания реакции. [c.193]
Объяснить направление протекания реакции, используемой для иодометрического определения меди. [c.89]
Полученное значение ДЯ°(298) положительно, но мало по абсолютной величине. Поэтому оно не может служить критерием направления протекания реакции даже при невысоких температурах, тем более, что в рассматриваемом случае в результате реакции изменяется число молекул газов. [c.185]
Расчеты химических равновесий имеют большое значение, так как экспериментальное определение константы равновесия может быть сопряжено с большими трудностями (высокие температуры или давления, медленные реакции, нарушение равновесия процессом измерения и др.)- Практическое значение таких расчетов связано с нахождением направления протекания реакций, выхода продуктов и соответст-вуюш,их энергетических эффектов. [c.132]
Изучение процесса протекания химических реакций. По мере проникновения структурного анализа в повседневную жизнь химических лабораторий и увеличения пропускной способности структурных центров эта задача постепенно выходит на передний план. Какие преобразования происходят в многостадийном процессе химического реагирования — один из самых актуальных и сложных вопросов многих реакций. Структурное изучение исходных веществ, промежуточных и конечных продуктов, возникающих в разных термодинамических условиях, позволяет уяснить многие (хотя, конечно, не все) стороны процесса. При этом следует иметь в виду, что чисто стерические эффекты, пространственные возможности или, наоборот, затруднения являются немаловажными факторами в определении направления протекания реакций. Особенно существенно в этом аспекте структурное изучение продуктов, возникающих на разных стадиях каталитических реакций. [c.176]
Условия равновесия позволяют предсказать направление протекания реакции. Заданное начальное состояние системы можно выразить в форме закона действующих масс отношением Q . Условие /Сс будет определять имеющуюся возможность протекания реакции, т. е. в каждом случае исходные концентрации будут изменяться так, что в конце концов установится состояние равновесия Q = Кс- Подобная оценка смещения равновесия имеет значение для качественных выводов, естественно, при условии, что соответствующие реакции обратимы и протекают достаточно быстро. [c.44]
Направление протекания реакций [c.167]
Указать для каждой реакции окислитель и восстановитель и установить направление протекания реакции. Какая реакция будет протекать наиболее интенсивно (судя по величинам э.д.с. цепей) [c.158]
Следует, однако, отметить, что делать априорГный расчет состава продуктов алкилирования на основе только стабильности карбокатионов нельзя, так как важную роль имеют и кинетические факторы, которые вносят значительные коррективы в направленность протекания реакции. Например, в соответствии с термодинамическими данными, пропилхлорид должен преимущественно превращаться в более стабильный изопропил-катион, который при атаке бензола должен давать изопропилбензол. Образование значительных количеств пропилбензола при алкилировании бензола этим агентом в присутствии А1С1з можно объяснить тем, что пер ичный алкил-катион в силу своей высокой реакционной способности присоединяется к ароматическому ядру раньше, чем произойдет его перегруппировка. [c.109]
Направление протекания реакции зависит от строения дикарбоно вой КИС ОТЫ. [c.369]
Итак, действительно, знание знака потенциала реакции позволяет сделать вывод о направлении протекания реакции в данных условиях. Рассмотрим некоторые примеры. [c.160]
В данном случае для определения направления протекания реакции необходимо рассчитать ее стандартный потенциал, поскольку все реагенты находятся в стандартных состояниях. Согласно изложенному выше Е° = Е°-Е° = 1,77-0,77 = 1,00 В > 0. Следовательно, в заданных условиях реакция протекает в прямом направлении в соответствии с записью уравнения реакции ионы Ре » окисляются ионами Се «. [c.160]
Направление протекания реакции [c.27]
Данный пример показывает, что, применяя неводный растворитель, можно изменить направление протекания реакции обмена. Это обусловлено различной растворимостью солей в воде и пиридине. [c.103]
Напротив, перегруппировка по типу 15]у2-замещепия способствует стереохимически направленному протеканию реакции. При ]у2-реакциях мигрирующая группа атакует неискаженный, тетраэдрический заряженный атом углерода. Такой атаке более доступна сторона, противоположная элиминированному заместителю (в рассматриваемых случаях это гидрид-ион). Следствием определенной ориентации реакционных центров является фиксированное положение входящего (мигрирующего) заместителя, а отсюда — высокая степень стереоспецифичности замещения. В этом случае уже невозможно существование двух, разделенных Энергетическим барьером ионов, как это имеет место в реакциях типа а существует лишь один неклассический ион , про- [c.162]
В первом случае стадия каждого цикла входит в один простой цикл. В числителе для скорости стадии в формуле (11.14) будет фигурировать только одна циклическая характеристика С, соответствующая этому циклу. Наличие дополнительного цикла сказывается лишь на величине параметра сопряжения Р. Скорость по циклу может изменяться лишь количественно, но ни в коем случае не меняется направление протекания реакции. Такая ситуация соответствует так называемому кинетическому сопряжению (см., напр., [40]). Общее число каркасов в предположении, что все стадии обратимы, составляет где rii, Пг — числа стадий в обоих циклах. [c.97]
С помощью новых высокоэффективных методов — ЯМР, ЭПР, ИКС, меченых атомов и др.— от изучения вопросов о направленности протекания реакции электрофильного замещения исследователи смогли перейти на более углубленную разработк задач, связанных с установлением причин, обусловливающих эти превращения. Количественная оценка различных характеристик реакций электрофильного замещения в ароматическом ряду связана с реакционной способностью атакующих групп и электронной структурой ароматических компонентов. Известно, что энтальпия образования ДЯ°ст ионов карбонияв значительной степени характеризует их стабильность и реакционную способность (табл. 4.1). [c.86]
Если константа равновесия имеет значения от Ю до 10 , направление протекания реакции может быть изменено увеличениеи коицеитрации исходных реагентов или продуктов реакции. [c.68]
Кислород в асфальтенах находится в четырех основных функциональных группах гидроксильной, карбонильной, карбоксильной и сложноэфирной. При термодеструктивных процессах кислород способен перераспределяться между этими группами, одновременно выделяясь или поглощаясь из внешней среды, что может существенно повлиять на направление протекания реакций и соотнетст-венно на качество промежуточных и конечных продуктов, получаемых из асфальтенов. Наибольшее количество зольных компонентов (в том числе вачадия и никеля) концентрируется в первой фракции и в остатке асфальтенов. Предполагают, что ванадийпорфириновыс комплексы могут быть составной частью асфальтенов, хотя и не исключается их присутствие как сольватирующего агента. [c.28]
Теория графов является одной из ветвей топологии и отличается геометрическим подходом к изучению объектов. Основное понятие теории, гра0 —система линий, соединяющих заданные точки. В дорожном деле —это дороги, соединяющие населенные пункты, в электротехнике — проводники, соединяющие различные детали схемы в химической кинетике при изображении кинетических схем реакций точками могут быть предста(влены химические соединения (исходные или промежуточные), а линиями — стрелки, указывающие направление протекания реакции. В общем случае линии графа могут быть прямыми, кривыми или извилистыми в зависимости от конкретной задачи. [c.285]
Вычислить химическое сродство веществ, вступающих в реакцию по уравнению М2+ЗН2 2МНз, при 450° С определить направление протекания реакции, если константа равновесия [c.132]
В формировании природных полимеров принимают участие соответствуюш,ие ферменты и катализаторы, которые обеспечивают направленное протекание реакций. В начальный период развития химии синтетических полимеров, когда еще не были най-дены совершенные катализаторы синтеза, получали полимеры с нерегулярной структурой, малой молекулярной массой и вследствие этого с низкими физико-механическими показателями. По мере развития этой отрасли химической науки и производства были разработаны способы получения пространственно и химически регулярных полимеров (стереоспецифическая полимеризация) из промышленнодоступных мономеров (этилен, пропилен, стирол и др.), что привело к громадному росту производства различных полимеров. Большинство этих полимеров в природе не существует, [c.13]
Понятие о химической кинетике. Скорость химических реакций. Термодинамический подход к описанию химических процессов позволяет оценить энергию взаимодействия и наиболее вероятные направления протекания реакций. При этом нет необходимости прибегать к конкретному рассмотрению механизма процесса, к экспериментальному его осуществлению. Однако классическая термодинамика рассматривает только равновесные системы и равновесные процессы, т. е. процессы, которые протекают бесконечно медленно. С термодинамических позиций невозможно анализировать развитие процесса во времени, поскольку время (как переменная) не учитывается при термодинамическом описании. Поэтому вторым этапом в изучении закономерностей протекания химических процессов является рассмотрение их развития во времени, что представляет собой основную задачу химической кинетики. В реальных уело-ВИЯХ протекание химических реакций связано с преодолением энергетических барьеров, которые иногда могут быть весьма значи тельными. Именно поэтому термодинамическая возможность осуществления данной реакции (AG<0) является необходимым, но недостаточным условием реализации процесса в действительности. Хи мическая кинетика кроме выяснения особенностей развития процесса во времени (формально-кинетическое описание) изучает [c.212]
НАУЧНАЯ НОВИЗНА. При ароматизации парафинов С3-С7 использованы опытно-промышленные партии катализаторов облагораживания прямогонных бензинов (процессы Цеоформинг, Цеокат) после модифицирования цинком. Изученные закономерности ароматизации газообразных и жидких парафинов на этих катализаторах свидетельствуют о двух конкурирующих направлениях протекания реакции прямой и деструктивной ароматизации. Выявлено, что при температурах 450 — 580 °С, мольном соотношении бутана к бензолу 3,15 1 скорости ароматизации бутана и алкилирования бензола продуктами крекинга сопоставимы, [c.4]
Обновлено: 24.05.2023
В предыдущих параграфах мы рассмотрели несколько примеров, показывающих, что при определенных условиях каждая химическая реакция самопроизвольно протекает в определенном направлении. Так, при низких температурах экзотермическая реакция образования парообразной воды
практически нацело протекает в прямом направлении. Но при высоких температурах эта реакция начинает идти в обратном направлении: водяной пар разлагается на водород и кислород. Во всех случаях в результате реакции может быть достигнуто состояние устойчивого химического равновесия, но само положение равновесия при разных условиях оказывается различным.
Возникает вопрос; в чем причина определенной направленности химических процессов, какие факторы обусловливают то или иное состояние химического равновесия?
Известно, что в механических системах устойчивое равновесие соответствует минимуму потенциальной энергии системы. Так, шарик самопроизвольно скатывается из положения а на наклонной поверхности (рис. 69), причем его потенциальная энергия переходит сначала в кинетическую энергию движения шарика как целого, а затем в энергию теплового движения молекул. В положении б шарик находится в равновесии.
Естественно предположить, что и химические процессы должны самопроизвольно протекать в направлении уменьшения внутренней энергии системы, т. е. в направлении, отвечающем положительному тепловому эффекту реакции. Действительно, опыт показывает, что при обычных условиях самопроизвольно протекают преимущественно экзотермические реакции.
Однако попытка объяснить направленность химических процессов только стремлением к минимуму внутренней энергии приводит к противоречиям с фактами.
Рис. 69. Шарик самопроизвольно скатывается из положения а в положение б.
Рис. 70. Сосуд, состоящий из дзух частей: в части А находится разреженный газ, в часта Б — вакуум.
Так, уже при обычных температурах самопроизвольно протекают эндотермические процессы растворения многих солей и некоторые эндотермические химические реакции. С повышением температуры все большее число реакций начинает самопроизвольно протекать в направлении эндотермического процесса; примерами таких реакций могут служить упомянутое выше разложение воды или протекающий при высоких температурах синтез оксида азота
Более того, принцип стремления к минимуму внутренней энергии требует, чтобы все экзотермические реакции доходили до конца, т. е. исключает возможность обратимых реакций; однако такие реакции реально существуют.
Вспомним теперь, что среди механических систем имеются такие, поведение которых тоже нельзя описать только направленностью процессов к достижению минимума потенциальной энергии. Это системы, состоящие из очень большого числа частиц. Например, молекулы, входящие в состав воздуха, распределяются вокруг Земли в виде атмосферы многокилометровой толщины, но не падают на Землю, хотя минимуму потенциальной энергии каждой молекулы соответствует наиболее низкое ее положение.
Из громадного числа частиц состоят и химические системы. Поэтому неудивительно, что и здесь тенденция к достижению минимума внутренней энергии не является единственным фактором, определяющим их поведение.
Для того чтобы составить представление о втором факторе, влияющем на направление реакций, рассмотрим какой-либо самопроизвольно протекающий процесс, не сопровождающийся тепловым эффектом. Примером такого процесса может служить расширение разреженного газа.
Пусть в части А сосуда, разделенного на две части (рис. 70), находится разреженный газ. В таком газе среднее расстояние между молекулами велико; при этом условии внутренняя энергия газа не зависит от степени его разрежения. Вторая половина сосуда (Б) газа не содержит. Если открыть кран, соединяющий обе части сосуда, то газ самопроизвольно распространится по всему сосуду.
Внутренняя энергия газа при этом не изменится; тем не менее, самопроизвольно произойдет именно процесс расширения газа, а обратный процесс — самопроизвольное сжатие газа — не происходит.
Причины такой направленности процесса можно понять, если сначала рассмотреть систему, содержащую небольшое число молекул. Пусть в сосуде находятся всего две молекулы, которые обозначим 1 и 2. Равномерное распределение газа между обеими частями сосуда, соответствующее определенному макросостоянию газа, может осуществиться двумя микросостояниями;
Макросостояние, при котором весь газ сосредоточен в одной из частей сосуда (например, в части А), осуществляется единственным микросостоянием:
Очевидно, что то или иное макросостояние системы тем более вероятно, чем большим числом микросостояний оно может осу-ществиться. В рассматриваемом случае (две молекулы) равномерное распределение газа по сосуду вдвое вероятнее, чем переход всего газа в часть сосуда А.
Пусть теперь в сосуде находится четыре молекулы, которые мы вновь пронумеруем. Переходу всего газа в часть сосуда А по-прежнему соответствует единственное микросостояние:
Между тем, равномерное распределение газа между обеими частями сосуда может теперь осуществляться шестью различными микросостояниями:
Теперь, следовательно, вероятность равномерного распределения молекул газа по всему объему сосуда оказывается заметно более высокой, чем вероятность их перехода в одну из его частей. Естественно, что равномерное распределение газа будет наблюдаться гораздо чаще, чем полное его сосредоточение в части сосуда.
Если в сосуде находится шесть молекул, то переходу их в одну из частей сосуда (т. е. самопроизвольному сжатию газа до половины занимаемого им первоначального объема), как и раньше, соответствует только одно микросостояние. Но равномерному распределению газа между обеими частями сосуда отвечает уже 20 возможных комбинаций молекул, т. е. 20 различных микросостояний:
Теперь явление самопроизвольного сжатия газа, т. е. сосредоточения всех его молекул в одной из частей сосуда, будет наблюдаться еще реже; равномерное же распределение газа по всему сосуду становится еще более вероятным.
Таким образом, с ростом числа молекул вероятность беспорядочного, равномерного распределения газа в сосуде очень быстро возрастает, а самопроизвольное сжатие газа становится все менее вероятным процессом. Если мы вспомним теперь, что макроскопические количества газа содержат огромное число молекул, то станет ясно, что в реальном опыте самопроизвольное сжатие газа представляет собой процесс практически невозможный, и что самопроизвольно будет протекать обратный процесс расширения газа, приводящий к равномерному, беспорядочному распределению его молекул по всему объему сосуда.
Рассмотренное нами явление расширения газа представляет собой пример проявления принципа направленности процессов к наиболее вероятному состоянию, т. е. к состоянию, которому соответствует максимальная беспорядочность распределения частиц. Направление самопроизвольного протекания химических реакций и определяется совокупным действием двух факторов: тенденцией к переходу системы в состояние с наименьшей внутренней энергией и тенденцией к достижению наиболее вероятного состояния.
Так, в приведенном примере с воздухом тенденция к минимуму потенциальной энергии заставляет молекулы, входящие в состав воздуха, падать на Землю, а тенденция к максимальной вероятности заставляет их беспорядочно распределяться в пространстве.
В результате создается некоторое равновесное распределение молекул, характеризующееся более высокой их концентрацией у поверхности Земли и все большим разрежением по мере удаления от Земли.
В системах соль—вода минимум внутренней энергии в большинстве случаев соответствует кристаллическому состоянию соли. Однако наиболее вероятное состояние системы достигается при беспорядочном распределении соли в жидкой воде. В результате совместного действия этих двух факторов устанавливается равновесие, соответствующее определенной концентрации насыщенного раствора соли.
При химических реакциях в силу принципа направленности процессов к минимуму внутренней энергии атомы соединяются в такие молекулы, при образовании которых выделяется наибольшее количество энергии. В силу же принципа направленности процессов к наиболее вероятному состоянию протекают такие реакции, в ходе которых возрастает число частиц (например, реакции разложения молекул на атомы) или чисто возможных состояний атомов.
Так, в случае реакции
минимальной внутренней энергии системы соответствует аммиак, образующийся при протекании реакции до конца вправо. Однако наиболее вероятному состоянию системы отвечает азото-водородная смесь, образующаяся при полном разложении аммиака, ибо при этом в 2 раза возрастает число молекул газов. Вследствие действия обоих фактором в системе устанавливается равновесие, отвечающее определенному при данной температуре соотношению концентраций всех веществ.
В случае реакции
минимальной внутренней энергии отвечает азото-кислородная смесь, образующаяся при полном разложении оксида азота. Поскольку в ходе этой реакции число частиц не изменяется, то протекание реакции до конца как в прямом, так и в обратном направлении не увеличивает вероятности состояния системы. Не изменяется при этом и число возможных состояний атомов: в исходных веществах каждый атом и азота, и кислорода связан с атомом того же элемента (молекулы и ), а в продукте реакции каждый атом связан с атомом другого элемента (молекула ). Иначе обстоит дело при частичном протекании процесса в прямом или в обратном направлении. В результате частичного прохождения реакции, т. е. при сосуществовании исходных веществ и продуктов реакции, атомы азота и кислорода находятся в двух состояниях: часть их связана в молекулы и , а часть — в молекулы .
Таким образом, число возможных микросостояний рассматриваемой системы, а следовательно, и вероятность соответствующего ее макросостояния возрастают при частичном протекании реакции. Итак, тенденция к уменьшению внутренней энергии способствует протеканию данной реакции до конца в обратном направлении, а тенденция к увеличению вероятности состояния вызывает ее частичное протекание в прямом направлении. Вследствие одновременного действия обоих факторов часть азотокислородной смеси при нагревании превращается в и устанавливается равновесие между исходными веществами и продуктом реакции.
Тенденция к переходу в состояние с наименьшей внутренней энергией проявляется при всех температурах в одинаковой степени. Тенденция же к достижению наиболее вероятного состояния проявляется тем сильнее, чем выше температура. Поэтому при низких температурах в большинстве случаев практически сказывается только влияние первой из этих тенденций, в результате чего самопроизвольно протекают экзотермические процессы. По мере возрастания температуры равновесие в химических системах все больше и больше сдвигается в сторону реакций разложения или увеличения числа состояний атомов. При этом каждой температуре отвечает состояние равновесия, характеризующееся определенным соотношением концентраций реагирующих веществ и продуктов реакции.
Оба рассмотренных фактора, а также результат их совместного действия можно выразить количественно. Величины, с помощью которых это делается, изучаются в разделе физики — термодинамике и называются термодинамическими величинами. К ним относятся, в частности, внутренняя энергия, энтальпия, энтропия и энергия Гиббса.
Многие химические реакции протекают самопроизвольно, т.е. без затрат энергии извне. Одной из движущих сил самопроизвольного химического процесса является уменьшение энтальпии системы, т.е. экзотермический тепловой эффект реакции. Другой – стремление частиц (молекул, ионов, атомов) к хаотическому движению, беспорядку. Мерой хаотичности, неупорядоченности состояния системы служит термодинамическая функция, называемая энтропией (S).
При переходе системы из более упорядоченного состояния в менее упорядоченное состояние (нагревание, испарение, плавление) энтропия возрастает (DS>0). В случае перехода системы из менее упорядоченного состояния в более упорядоченное (охлаждение, конденсация, кристаллизация) энтропия системы уменьшается (DS 0) – это суть второго закона термодинамики.
Энтропия вещества в стандартном состоянии называется стандартной энтропией (S o ) и имеет единицу измерения Дж/моль•К (Приложение, табл.1). Изменение энтропии системы в результате протекания химической реакции (DS o ) равно сумме энтропий продуктов реакции за вычетом энтропий исходных веществ с учетом стехиометрических коэффициентов:
DS o = SS o прод — SS o исх.
Энтропия вещества в газообразном состоянии существенно выше, чем в жидком и твердом состояниях, поэтому об изменении энтропии в химической реакции судят по изменению числа молей газообразных веществ. Например, в реакции
из одного моля СО2 образуется 2 моля СО, следовательно энтропия возрастает (DS>0).
В реакции образования аммиака
энтропия уменьшается, т.к. число молей NH3 меньше суммы молей N2 и Н2.
Возможность самопроизвольного протекания химического процесса определяется двумя факторами:
— стремлением к образованию прочных связей между частицами, к возникновению более сложных веществ, что сопровождается понижением энергии системы – энтальпийный фактор (DH 0).
Эти факторы объединяет функция, называемая энергией Гиббса (DG), равная:
Изменение энергии Гиббса служит критерием самопроизвольного протекания химической реакции:
— химическая реакция принципиально возможна, если энергия Гиббса в ходе реакции уменьшается (DG 0), протекает обратная реакция;
— химическая реакция может протекать как в прямом, так и в обратном направлении, т.е. система находится в состоянии равновесия (DG=0).
Из уравнения DG=DH-T•DS следует:
— если DН 0, то всегда DG 0 и DS 0, т.е. реакция с поглощением теплоты и увеличением степени порядка невозможна ни при каких условиях;
— DH>0, DS |DH|. Эти реакции протекают при высокой температуре;
— DH 0. Условие самопроизвольного протекания реакции: |DH|>|T•DS|. Такие реакции идут обычно при низких температурах.
Температуру, при которой происходит смена знака энергии Гиббса реакции, можно определить из условия равновесия:
где Тр – температура, при которой устанавливается равновесие.
Изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых в стандартных условиях, называется стандартной энергией Гиббса образования вещества (DG o f). Стандартная энергия Гиббса образования простых веществ принимается равной нулю.
Стандартную энергию Гиббса химической реакции (DG o r) можно рассчитать как сумму стандартных энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов:
Пример 1. На основании стандартных энтальпий образования и стандартных энтропий веществ вычислите DG реакции, протекающей по уравнению:
В каком направлении будет протекать данная реакция? Рассчитайте температуру, при которой наступит равновесие.
Многие химические реакции протекают самопроизвольно, т.е. без затрат энергии извне. Одной из движущих сил самопроизвольного химического процесса является уменьшение энтальпии системы, т.е. экзотермический тепловой эффект реакции. Другой – стремление частиц (молекул, ионов, атомов) к хаотическому движению, беспорядку. Мерой хаотичности, неупорядоченности состояния системы служит термодинамическая функция, называемая энтропией (S).
При переходе системы из более упорядоченного состояния в менее упорядоченное состояние (нагревание, испарение, плавление) энтропия возрастает (DS>0). В случае перехода системы из менее упорядоченного состояния в более упорядоченное (охлаждение, конденсация, кристаллизация) энтропия системы уменьшается (DS 0) – это суть второго закона термодинамики.
Энтропия вещества в стандартном состоянии называется стандартной энтропией (S o ) и имеет единицу измерения Дж/моль•К (Приложение, табл.1). Изменение энтропии системы в результате протекания химической реакции (DS o ) равно сумме энтропий продуктов реакции за вычетом энтропий исходных веществ с учетом стехиометрических коэффициентов:
DS o = SS o прод — SS o исх.
Энтропия вещества в газообразном состоянии существенно выше, чем в жидком и твердом состояниях, поэтому об изменении энтропии в химической реакции судят по изменению числа молей газообразных веществ. Например, в реакции
из одного моля СО2 образуется 2 моля СО, следовательно энтропия возрастает (DS>0).
В реакции образования аммиака
энтропия уменьшается, т.к. число молей NH3 меньше суммы молей N2 и Н2.
Возможность самопроизвольного протекания химического процесса определяется двумя факторами:
— стремлением к образованию прочных связей между частицами, к возникновению более сложных веществ, что сопровождается понижением энергии системы – энтальпийный фактор (DH 0).
Эти факторы объединяет функция, называемая энергией Гиббса (DG), равная:
Изменение энергии Гиббса служит критерием самопроизвольного протекания химической реакции:
— химическая реакция принципиально возможна, если энергия Гиббса в ходе реакции уменьшается (DG 0), протекает обратная реакция;
— химическая реакция может протекать как в прямом, так и в обратном направлении, т.е. система находится в состоянии равновесия (DG=0).
Из уравнения DG=DH-T•DS следует:
— если DН 0, то всегда DG 0 и DS 0, т.е. реакция с поглощением теплоты и увеличением степени порядка невозможна ни при каких условиях;
— DH>0, DS |DH|. Эти реакции протекают при высокой температуре;
— DH 0. Условие самопроизвольного протекания реакции: |DH|>|T•DS|. Такие реакции идут обычно при низких температурах.
Температуру, при которой происходит смена знака энергии Гиббса реакции, можно определить из условия равновесия:
где Тр – температура, при которой устанавливается равновесие.
Изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых в стандартных условиях, называется стандартной энергией Гиббса образования вещества (DG o f). Стандартная энергия Гиббса образования простых веществ принимается равной нулю.
Стандартную энергию Гиббса химической реакции (DG o r) можно рассчитать как сумму стандартных энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов:
Пример 1. На основании стандартных энтальпий образования и стандартных энтропий веществ вычислите DG реакции, протекающей по уравнению:
В каком направлении будет протекать данная реакция? Рассчитайте температуру, при которой наступит равновесие.
Движущие силы химической реакции обусловлены ее стремлением к уменьшению запаса энергии, т.е. к уменьшению энтальпии при p = const и ее стремлением к увеличению энтропии.
В ходе химической реакции участвующие частицы перегруппировываются таким образом, чтобы уменьшалась энергия системы; это проявляется в их сближении и взаимодействии. Вместе с тем реагирующие частицы обладают отчетливой тенденцией к беспорядочному расположению. Эти два фактора обусловливают химическую обратимость реакций; преобладающее направление реакции определяется значением и знаком величин ΔH иΔS.
критерием самопроизвольного протекания химических реакций является отрицательное значение энергии Гиббса: ΔG 0вычитаемое будет всегда отрицательным, а при ΔS 0), имеющих ΔS 0. Для реакций с ΔS > 0 их протекание возможно, но только при таких высоких температурах, когда вычитаемое (- TΔS) превысит положительное значение энтальпии реакции.
Таким образом, принципиальную возможность протекания химического процесса и его направление можно определить, рассчитав значение ΔG.
По значению стандартной энергии Гиббса реакции можно рассчитать значение константы равновесия K и сделать вывод о положении равновесия. Для рассчета энергии Гиббса реакции необходимо использовать выражение:
ΔG° = -RTlnK = -RT·2.3lgK
где R — универсальная газовая постоянная: 8.31441 Дж/(моль·K).
Для обратимых реакций можно найти такое значение температуры, при которой K = 1 и ΔG° = 0. При этой температуре (она обозначается так:T↔) протекание прямой и обратной реакции равновероятно; эта температура называется температурой равновесия протекания реакции.
Между энергией Гиббса реакции и константой равновесия существует соответствие:
Таким образом, преобладающее направление протекания обратимой реакции определяется знаком энергии Гиббса; практически важное прямое направление реакции, т.е. сдвиг равновесия в сторону образования продуктов преобладает при условии ΔGT > 1.
Для кислотно-основных реакций, протекающих в водном растворе, величина ΔG°T определяется выражением:
ΔG°T = 2,3RT(pKkI — pKkII)
где pKkI = -lgKkI и pKkII = -lgKkII; KkI — константа кислотности реагента — кислоты (справочное значение), KkII — константа кислотности реагента — основания (справочное значение).
Для окислительно-восстановительных реакций, протекающих в водном растворе, величины ΔG°T рассчитывают по соотношению:
где
ze — число электронов, переданное от восстановителя к окислителю в реакции;
E°Ox — стандартный потенциал окислителя (справочная величина);
E°Red — стандартный потенциал восстановителя (справочная величина);
F — постоянная Фарадея (96485 Кл).
4-вопрос) Скорость химической реакции. Факторы, влияющие на скорость реакции. Приведите примеры.
Скорость реакции определяется изменением молярной концентрации одного из
где С1 и С2 — молярные концентрации веществ в моменты
времени t1 и t2 соответственно (знак (+) – если скорость
определяется по продукту реакции, знак (–) – по исходному веществу).
Реакции происходят при столкновении молекул реагирующих веществ. Ее скорость
определяется количеством столкновений и вероятностью того, что они приведут к
превращению. Число столкновений определяется концентрациями реагирующих
веществ, а вероятность реакции — энергией сталкивающихся молекул.
Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих веществ. Большую роль играет характер химических
связей и строение молекул реагентов. Реакции протекают в направлении разрушения
менее прочных связей и образования веществ с более прочными связями. Так, для
разрыва связей в молекулах H2 и N2 требуются высокие
энергии; такие молекулы мало реакционноспособны. Для разрыва связей в
сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и
скорость реакции значительно выше. Реакции между ионами в растворах
электролитов протекают практически мгновенно.
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с
водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид
меди — не реагирует.
2. Концентрация. С увеличением концентрации (числа частиц в единице объема)
чаще происходят столкновения молекул реагирующих веществ — скорость реакции
Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.)
Скорость химической реакции прямо пропорциональна произведению концентраций
Константа скорости реакции k зависит от природы реагирующих веществ,
температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости
реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости
реакции не входит.
3. C скорость°Температура. При повышении температуры на каждые 10
реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры
от t1 до t2 изменение скорости реакции можно рассчитать
| (t2 — t1) / 10 | |
| Vt2 / Vt1 | = g |
(где Vt2 и Vt1 — скорости реакции при температурах t2
и t1 — температурный коэффициент даннойgсоответственно;
Правило Вант-Гоффа применимо только в узком интервале температур. Более
точным является уравнение Аррениуса:
A — постоянная, зависящая от природы реагирующих веществ;
R — универсальная газовая постоянная [8,314 Дж/(моль • К) = 0,082 л •
Ea — энергия активации, т.е. энергия, которой должны обладать сталкивающиеся
молекулы, чтобы столкновение привело к химическому превращению.
Энергетическая диаграмма химической реакции.
| Экзотермическая реакция | Эндотермическая реакция |
А — реагенты, В — активированный комплекс (переходное состояние), С — продукты.
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при
4. Поверхность соприкосновения реагирующих веществ. Для гетерогенных
систем (когда вещества находятся в разных агрегатных состояниях), чем больше
поверхность соприкосновения, тем быстрее протекает реакция. Поверхность
твердых веществ может быть увеличена путем их измельчения, а для растворимых
веществ — путем их растворения.
5. Катализ. Вещества, которые участвуют в реакциях и увеличивают ее
скорость, оставаясь к концу реакции неизменными, называются катализаторами
. Механизм действия катализаторов связан с уменьшением энергии активации реакции
за счет образования промежуточных соединений. При гомогенном катализе
реагенты и катализатор составляют одну фазу (находятся в одном агрегатном
состоянии), при гетерогенном катализе — разные фазы (находятся в
различных агрегатных состояниях). Резко замедлить протекание нежелательных
химических процессов в ряде случаев можно добавляя в реакционную среду
ингибиторы (явление «отрицательного катализа«).
5-вопрос) Основные типы химических связей. Приведите примеры соединений с различными типами связей.
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
-
Межмолекулярные — атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: «Окислитель — понижает СО, восстановитель — повышает СО». Запомнив эту информацию таким образом, вы не будете путаться.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Обратимые реакции — такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака «=» ставят знак обратимости «⇆».
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
- Образуются малодиссоциирующие вещества (например — вода, однако есть исключения — реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes — разнородный) — реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
Гомогенные реакции (греч. homogenes — однородный) — реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке — это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции (греч. exo — вне) — химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят «+ Q» (Q — тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Классификация реакций
Эндотермической, обратимой Эндотермической, необратимой Экзотермической, обратимой Экзотермической, необратимой
Реакция углерода с кислородом является необратимой, сопровождается выделением тепла (процесс горения) — экзотермическая.
Горение азота в кислороде, как это ни удивительно, относится к реакции эндотермической. Это связано с наличием в азоте очень прочной тройной связи, для разрыва которой нужно приложить много усилий.
Цинк вытесняет атомы водорода из кислоты, такая реакция относится к реакциям замещения.
Обратимой, экзотермической Обратимой, эндотермической Необратимой, экзотермической Необратимой, эндотермической
Читайте также:
- Лечебное дело это кратко
- Субъект и субъективная сторона преступления в уголовном праве кратко
- Поколение северной африки кратко
- Глобализация и международный терроризм кратко
- Т1ыт1у и дыгъэ шыщ1эр кратко