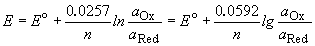Электродный потенциал цинка – это критерий того, насколько легко или трудно цинковый электрод передает электроны в раствор. Его значение равно -0,76 В по отношению к стандартному водородному электроду, что означает, что цинк будет окисляться в присутствии более электроотрицательных веществ, а восстанавливаться в присутствии более электроположительных веществ. Электродный потенциал цинка используется для расчета напряжения элементов гальванических элементов и батарей.
Что такое электродный потенциал?
Электродный потенциал – это мера того, насколько легко или трудно электрод передает электроны в раствор. Он определяется разностью потенциалов между электродом и стандартным водородным электродом при стандартных условиях (температура 25 градусов Цельсия, давление 1 атмосфера и концентрация всех реагентов равна 1 моль/л).
Факторы, влияющие на величину электродного потенциала цинка
- Концентрацию ионов цинка – при изменении концентрации ионов цинка в растворе, электродный потенциал цинка может изменяться.
- Температуру – при изменении температуры, электродный потенциал цинка может изменяться. Это связано с тем, что скорость реакций на электродах зависит от температуры.
- Наличие других растворенных веществ – наличие других растворенных веществ, таких как ионы металлов, может влиять на электродный потенциал цинка.
- Состояние поверхности электрода – чистота и состояние поверхности цинкового электрода также могут влиять на его электродный потенциал.
- Растворитель – тип растворителя, в котором находится цинк, может влиять на его электродный потенциал.
Знание электродного потенциала цинка является важным для понимания электрохимических процессов и может быть использовано для расчета напряжения элементов гальванических элементов и батарей.
Электродный потенциал цинка – практическое использование
Роль цинка в гальванических элементах
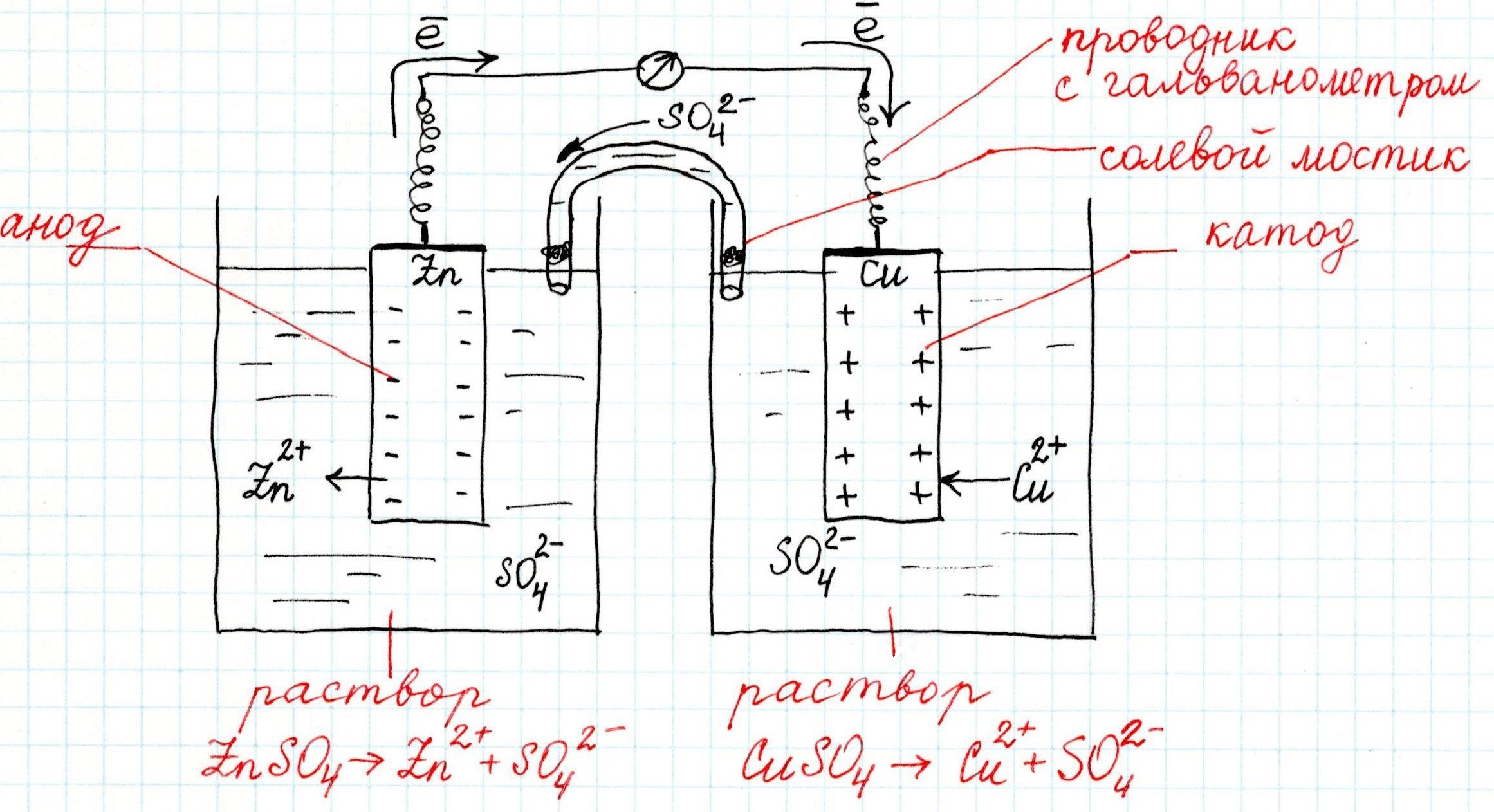
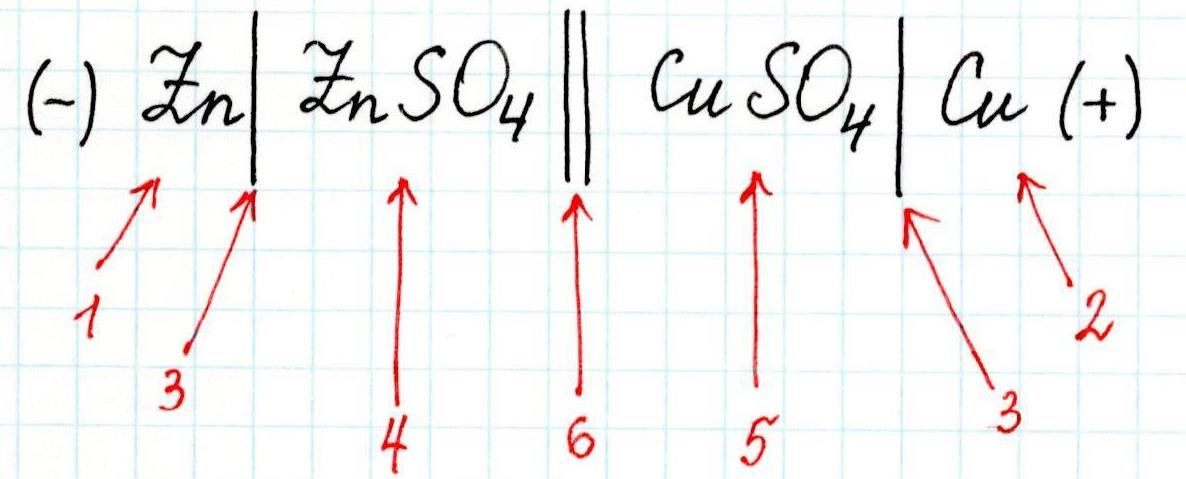
Гальванический элемент – это устройство, которое использует разность потенциалов между двумя электродами для создания электрического тока. Он состоит из двух различных металлов, погруженных в электролит (раствор солей или кислоты), который обеспечивает связь между ними и позволяет ионам двигаться внутри системы.
Гальванический элемент представляет собой устройство, которое генерирует электрический ток из химической энергии. Он состоит из двух половинок, называемых электродами, и электролита, который связывает электроды. При создании гальванического элемента цинк используется как один из электродов. Электродный потенциал цинка в этом случае является критическим параметром, поскольку он определяет напряжение элемента, и его способность генерировать электрический ток.
В гальваническом элементе цинк – электрод. Он обладает хорошими окислительными свойствами, поэтому способен легко отдавать свои электроны (активный электрод). В растворе цинка образуется ион Zn2+, который отдает электроны на электрод, соединенный с ним, тем самым создавая электрический ток.
Цинк в данной ситуации имеет низкий потенциал окисления и отрицательное значение потенциала, что делает его подходящим для использования в качестве электрода с отрицательным потенциалом. При этом цинк способен принимать электроны от более активного металла (например, меди или железа), которые образуют положительно заряженный ион, и таким образом участвует в реакции окисления-восстановления, создающей электрический ток.
Защита металлических конструкций от коррозии с помощью цинка
Защита металлических конструкций от коррозии с помощью цинка основывается на принципе анодной защиты. Для этого на поверхность защищаемого металла (например, стали) наносят слой цинка, который становится анодом в электрохимической паре с металлом. При этом потенциал цинка более отрицательный, чем потенциал металла, что приводит к тому, что цинк начинает корродировать вместо защищаемого металла.
Происходит катодная реакция на поверхности металла, а не анодная, что позволяет защитить металл от коррозии. При этом электролитические реакции происходят на поверхности защищаемого металла, а не на поверхности цинка.
Для эффективной защиты необходимо обеспечить достаточный уровень покрытия цинком и правильно организовать электрический контакт между цинком и защищаемым металлом. Также необходимо следить за состоянием покрытия цинка и при необходимости проводить его ремонт или замену.
Применение цинка в электротехнике и электронике
Один из наиболее распространенных способов использования цинка – это в качестве анодного материала в гальванических элементах. Цинковые батареи, которые широко используются в бытовых и промышленных приложениях, используют цинк в качестве анода. В такой батарее, цинк работает как электрод, на котором происходит окисление. Это процесс осуществляется путем выделения электронов, которые перемещаются через электрическую цепь и заряжают устройство.
Цинк также может быть использован в электронных приборах в качестве компонента в микрочипах и других электронных компонентах. Он используется как материал для проводов, паяльной пасты, а также в качестве материала для электродов в микроэлектронике.
Электродный потенциал цинка – методы измерения
Электродный потенциал цинка. Измерение с помощью стандартного водородного электрода
Метод измерения стандартного водородного электрода (СВЭ) основан на сравнении потенциала цинка с потенциалом СВЭ, который определяется как ноль вольт при стандартных условиях (температура 25 °C, давление 1 атмосфера, pH 0).
Для измерения электродного потенциала цинка с помощью СВЭ необходимо:
- Подготовить образец цинка, очистив его от загрязнений и окислов.
- Подготовить стандартный водородный электрод. В стакан с дистиллированной водой помещается платиновый электрод, на который наносятся небольшие кусочки металла водорода. Другой электрод (обычно серебряный/хлоридсеребряный) используется в качестве опорного электрода.
- Измерить электродный потенциал цинка относительно СВЭ. Для этого образец цинка помещается в раствор с известным pH, а затем в ту же точку опускается СВЭ. Затем измеряется разность потенциалов между образцом цинка и СВЭ при том же pH.
- После измерения разности потенциалов между образцом цинка и СВЭ, можно вычислить абсолютный потенциал цинка относительно стандартного водородного электрода.
Метод измерения электродного потенциала цинка с помощью стандартного водородного электрода – это классический метод, который используется в химии для определения электродных потенциалов различных металлов.
Измерение электродного потенциала цинка с помощью ртути
Для измерения электродного потенциала цинка можно использовать метод сравнения с ртутным электродом. Этот метод основан на том, что ртуть образует с цинком стабильный электрод, известный как ртутно-цинковый электрод.
Для измерения потенциала цинка необходимо собрать такой электрод и подключить его к вольтметру. Для этого можно использовать стекло с мембраной, на которую наносятся слои ртути и цинка. Затем мембрана погружается в раствор с ионами цинка, и регистрируется разность потенциалов между ртутным и цинковым электродами.
Для более точных измерений следует обеспечить достаточную стабильность температуры и состава раствора, а также правильное позиционирование электродов. Также следует учитывать влияние других ионов в растворе, которые могут изменять электродный потенциал.
Измерение электродного потенциала цинка с помощью других металлов
Существует несколько методов измерения электродного потенциала цинка. Один из наиболее распространенных методов – это измерение с помощью других металлов, которые могут служить эталоном.
Для этого используются металлы с известным электродным потенциалом, такие как медь, серебро или свинец. Эти металлы взаимодействуют с цинком и создают гальваническую пару, которая позволяет измерить потенциал цинка.
Процесс измерения состоит в том, чтобы поместить образец цинка и образец эталонного металла в раствор электролита и соединить их проводником. Затем измеряется разность потенциалов между образцами с помощью вольтметра.
Электродный потенциал цинк. Перспективы исследований в области электрохимии и использования цинка в промышленности
Цинк также широко используется в промышленности – в производстве литейных сплавов, гальванических элементов, термисторов и фармакологических препаратов. Цинк является важным компонентом питательных смесей и добавок для животных и птиц, а также используется в медицине для лечения дефицита цинка и других заболеваний.
Исследования в области электрохимии и использования цинка в промышленности сосредоточены на улучшении производственных процессов, повышении эффективности использования цинка и создании новых материалов на его основе. Исследования в области аккумуляторной технологии направлены на повышение емкости и длительности работы аккумуляторов на основе цинка. Также проводятся исследования в области биотехнологии и медицины, направленные на изучение свойств цинка и его роли в живых организмах.
Применение электродного потенциала цинка имеет много перспектив исследований в области электрохимии и использования цинка в различных отраслях промышленности, что может привести к созданию новых материалов и технологий, улучшению производственных процессов и повышению эффективности использования ресурсов.
06.05.2015
Электролиз — завершающая стадия гидрометаллургического производства цинка Показатели электролиза в значительной мере зависят от качества выполнения предыдущих операций: обжига концентратов, выщелачивания огарка и очистки растворов от примесей.
Очищенный нейтральный раствор сульфата цинка с содержанием последнего 100—150 г/л непрерывно подается в электролитные ванны со свинцовыми анодами и алюминиевыми катодами. При прохождении через ванны постоянного тока на катодах осаждается металлический цинк, а на анодах выделяется кислород и регенерируется серная кислота. В ходе электролиза раствор обедняется цинком и обогащается серной кислотой. Отработанный раствор (электролит), содержащий цинка 40—60 г/л и серной кислоты 100—150 г/л, непрерывно отводится из ванн и поступает на выщелачивание огарка. Через каждые 24 час. (значительно реже — через 48 час.) катоды вынимают из ванн, цинк в виде листов сдирают с них и направляют на переплавку. По содержанию примесей катодный цинк близок к чушковому металлу.
Теоретические основы электроосаждения цинка
В общем виде электроосаждение цинка из чистого сульфатного раствора может быть представлено уравнением
В действительности процесс электролиза много сложнее. На катоде и аноде протекают электрохимические реакции, связанные с разрядом катионов и анионов. Рассмотрим отдельно катодный и анодный процессы, приняв для упрощения, что цинковый раствор He содержит ионов других металлов.
Катодный процесс. На катоде могут разряжаться положительно заряженные ионы цинка и водорода:
Как известно нормальный потенциал цинка равен — 0,763 в, а водорода +0,000 в, т. е. EH2>EZn. Согласно ряду напряжений, на катоде должен идти процесс (2). Однако в практических условиях электролиза на катоде осаждается преимущественно цинк и затраты электроэнергии на выделение водорода не превышают 10—12% общего расхода. Объясняется это высоким перенапряжением разряда ионов водорода, благодаря которому потенциал его делается в определенных условиях отрицательнее потенциала цинка, т.е. EZn становится больше EН2. Степень перенапряжения водорода зависит от материала катода, плотности тока, состояния катодной поверхности, температуры, концентрации ионов водорода и других ионов в электролите, а также в присутствии в растворе коллоидов. Так, перенапряжение водорода на различных металлах (при катодной плотности тока 500 а/м2) составляет, в:
С повышением плотности тока перенапряжение водорода на цинке, как и на других металлах, возрастает. Существует линейная зависимость между величиной перенапряжения водорода и логарифмом плотности тока, которая выражается уравнением
η = a + b ln i.
Значение констант а и b равно соответственно 1,24 и 0,118 в. В.В. Стендером и А.Г. Печерской определены следующие величины перенапряжения водорода при различных плотностях тока:
Из приведенных данных становится понятным, почему в практике электролиза стремятся к работе на повышенных плотностях тока.
На шероховатой катодной поверхности вследствие уменьшения истинной плотности тока перенапряжение водорода понижается. Этим объясняется необходимость получения на катодах по возможности гладкого цинкового осадка.
Увеличение температуры электролита влечет за собой снижение перенапряжения водорода на цинке, что видно из следующих данных, полученных при плотности тока 500 а/м2:
С повышением концентрации водородных ионов, т.е. с увеличением кислотности электролита, перенапряжение водорода уменьшается, так как абсолютный потенциал его растет.
Добавление коллоидов в электролит увеличивает перенапряжение водорода, но до известного предела, так как чрезмерная концентрация в растворе поверхностно активных веществ действует в обратном направлении.
Присутствие в растворе ионов других металлов, на которых перенапряжение водорода меньше, чем на цинке, приводит к разряду ионов водорода и выделению его на катоде.
Выделение водорода на катоде — сложный процесс, включающий дегидратацию ионов гидроксония (H3O), разряд дегидратированного иона на катоде, объединение атомов водорода в молекулы и десорбцию молекул водорода. Явление перенапряжения водорода вызывается за медленным разрядом дегидратированных ионов.
Процесс осаждения цинка состоит из трех стадий разряд ионов на катоде, внедрение атомов цинка в кристаллическую решетку алюминия, пополнение убыли ионов в прикатодном слое. Стадия разряда ионов протекает практически мгновенно. Поэтому снижение потенциала разряда цинка, или, иначе, явление поляризации, объясняется замедлением второй и особенно третьей стадий в рабочих условиях электролиза (по некоторым воззрениям, однако, поляризация вызывается также замедленным разрядом ионов цинка на катоде). Причинами так называемой концентрационной поляризации могут быть повышенная плотность тока, низкая температура электролита и присутствие в растворе поверхностно активных веществ.
Для получения высоких технико-экономических показателей электролиза учитываются факторы, способствующие повышению перенапряжения водорода и снижению поляризации цинка.
Анодный процесс. На свинцовом аноде в чистом электролите наблюдаются следующие процессы:
По реакции (1) происходит разряд ионов ОН с одновременным выделением молекулярного кислорода и повышением концентрации водородных ионов (процесс регенерации серной кислоты). Кислород также обладает некоторым перенапряжением при выделении на аноде. По литературным данным, перенапряжение кислорода на свинце составляет 0,3 в. В отличие от перенапряжения водорода это явление нежелательно, так как оно увеличивает расход электроэнергии на электролиз.
Реакция (2) имеет существенное значение для стойкости свинцовых анодов и качества катодного осадка. Она объясняет частичное растворение «нерастворимого» свинцового анода и переход в раствор ионов свинца Процесс растворения свинца замедляется образованием на аноде твердой пленки перекиси PbO2, Этому способствует также низкая температура электролита и присутствие в растворе ионов марганца. Стойкость свинцовых анодов повышается присадкой к свинцу серебра (1 %) и .некоторых других металлов.
Выход по току и напряжение на ванне
Один из важнейших на практике показателей эффективности процесса электролиза — расход электроэнергии на тонну катодного цинка, является функцией выхода по току и напряжения на ванне и рассчитывается по формуле
где N — удальный расход электроэнергии, квт*ч/т,
v — напряжение на ванне, в;
η — выход цинка по току, %;
а — электрохимический эквивалент (для цинка 1,2193 г/а*ч).
Под коэффициентом полезного использования тока, или выходом цинка по току, подразумевается выраженное в процентах отношение фактически осажденного металла к теоретическому количеству, рассчитанному по закону Фарадея Теоретический расход электроэнергии получается при выходе по току 100% и напряжении разложения сульфата цинка 2,45 в:
В производственных условиях выход по току не превышает 88—93%, а напряжение на ванне достигает 3,3—3,6 в, вследствие чего фактически расход электроэнергии колеблется в пределах 3000—3300 квт*ч/т.
На выход по току влияют содержание примесей в растворе, плотность тока, кислотность, температура и скорость циркуляции электролита, а также коллоидные добавки.
Сопротивление ванны слагается из сопротивлений электролита, анода, катода и переходных контактов. В балансе падения напряжения на зажимах электролитной ванны на долю напряжения разложения сульфата цинка приходится 65—70%, поляризации электродов 20—25% и сопротивления ванны 8—10%.
Напряжение на ванне зависит от плотности тока, температуры и кислотности электролита, коллоидных добавок, расстояния между электродами, состояния поверхности контактов, концентрации цинка и щелочноземельных металлов в электролите и других факторов.
Состав электролита
Химический состав электролита, из которого осуществляется электроосаждение цинка, определяется в основном составом исходного нейтрального очищенного раствора и кислотным режимом электролиза. Для процесса электроосаждения цинка большое значение имеют не только концентрация пинка в электролите, но и содержание примесей в нейтральном растворе.
Электролиз протекает обычно в электролите с концентрацией цинка 40—60 г/л. При меньших содержаниях (ниже 40 г/л) выход цинка по току из-за концентрационной поляризации резко снижается. Повышение же концентрации сверх 60 г/л экономически невыгодно, так как не дает большой экономии электроэнергии, но снижает степень использования раствора (съем цинка с 1 м3 раствора).
Концентрацию цинка в нейтральном растворе поддерживают максимально допустимой по условиям отстаивания пульпы. Наиболее выгодное содержание цинка находится в пределах 140—160 г/л.
Медь, кадмий и свинец как металлы более электроположительные, чем цинк, осаждаются на катоде в первую очередь, ухудшая качество осадка. В очищенном растворе не должно присутствовать более 0,3—0,5 мг/л меди и 1—5 мг/л кадмия. При больших содержаниях этих металлов снижается выход по току и ухудшается качество катодного цинка. Свинец попадает в электролит с нейтральным раствором и в результате растворения свинца анодов.
Железо является также нежелательной примесью в электролите, так как обладая переменной валентностью, оно окисляется на аноде и восстанавливается на катоде, увеличивая тем самым расход электроэнергии. Незначительная доля железа осаждается вместе с цинком на катоде, что приводит к загрязнению металла. На некоторых современных цинковых заводах растворы очищают от железа практически нацело. Обычно содержание железа составляет 20—30 мг/л.
В небольших количествах (1—3 г/л) марганец необходим для образования на аноде пленки MnO2, препятствующей переходу свинца в раствор. Однако при значительной концентрации марганца выход по току несколько снижается и, кроме того, увеличивается нежелательное накопление марганцевого шлама в ваннах. На некоторых заводах концентрация марганца в растворе достигает 15—17 г/л. На катоде марганец не осаждается.
Мышьяк вреден для электролиза, так как снижает выход по току. Предельно допустимая концентрация мышьяка в нейтральном растворе составляет 0,05—0,1 мг/л в зависимости от присутствия других примесей.
Сурьма — одна из самых вредных примесей. При очистке раствора стремятся снизить концентрацию сурьмы до 0,02—0,05 мг/л и ниже. Сурьма резко снижает выход по току и легко обнаруживается по характерным желобчатым полосам на поверхности катодного цинка, особенно в местах с пониженной плотностью тока (края катода). Действие сурьмы усиливается в присутствии кобальта. Замечено также, что с новыми анодами вредное влияние сурьмы проявляется сильнее. В практике электролиза выявлены не только отрицательные, но и положительные свойства некоторых растворимых солей сурьмы. Так, с целью улучшения сдирки цинка и повышения выхода по току на ряде отечественных заводов в электролитные ванны вводят небольшое количество растворимой соли сурьмы. Механизм положительного действия добавок сурьмы еще не выяснен.
Кобальт и никель вызывают усиленную коррозию цинкового осадка, проявляющуюся в образовании сквозных отверстий и каверн нa поверхности цинка, прилегающей к алюминиевому листу (никель дает более крупные отверстия). Содержание кобальта в электролите рекомендуется иметь не выше 3—5 мг/л, а никеля 1—2 мг/л, хотя на некоторых заводах концентрация кобальта и доходит до 10—12 мг/л. Повышенное содержание кобальта и никеля приводит к резкому уменьшению выхода по току и заставляет снижать кислотность электролита.
Германий так же вреден, как и сурьма Незначительные количества германия в растворе (менее 0,1 мг/л) вызывают снижение выхода по току. В присутствии кобальта активность германия увеличивается.
Таллий, галлий и индий заметно не влияют на показатели электролиза Таллий осаждается вместе с катодным цинком.
Селен и теллур, даже при малых концентрациях, менее 1 мг/л, резко снижают выход по току.
Присутствие в электролите олова вредно отражается на коэффициенте использования тока. Несмотря на получение гладких блестящих осадков цинка, выход по току при содержании олова в растворе более 2 мг/л сильно снижается.
Калий, натрий, магний и кальций увеличивают сопротивление электролита и повышают расход электроэнергии. Сульфат кальция в виде плотного осадка иногда выпадает на стенках электролитных ванн. Много гипса выпадает в аппаратуре и коммуникациях установок для централизованного охлаждения электролита. Отрицательное влияние примесей значительно усиливается при их совместном присутствии.
Вредное влияние хлора и фтора проявляется в разрушении свинцовых и алюминиевых катодов. Фтор, кроме того, вызывает срастание цинкового осадка с алюминиевым листом.
Помимо указанных примесей, в электролите иногда присутствуют органические соединения, остающиеся в растворе после очистки от кобальта и случайно попадающие в процесс. Все они вредно влияют на выход по току.
Кислотность электролита. В процессе электролиза на каждый грамм высаженного цинка регенерируется округленно 1,5 г H2SO4. Если в ванну не добавлять свежего нейтрального раствора, кислотность электролита может подняться до величины, при которой начнется растворение осадка цинка на катодах. На практике содержание кислоты в электролите поддерживают на постоянном оптимальном уровне путем регулирования скорости подачи в ванны свежего нейтрального раствора сульфата цинка. На многих заводах электролиз осуществляется при кислотности 90—100 г/л. Однако все большее чисто предприятий переходит на работу с кислотностью 140—160 г/л. Один из заводов США (в Келлоге) работает на высококислотном режиме (280—300 г/л H2SO4).
При возрастании кислотности уменьшается сопротивление электролита, снижается напряжение на ванне, повышается чистота осажденного цинка, а его поверхность на катодах получается ровной, без шишек и дендритов. При работе с высокой кислотностью из единицы объема раствора высаживается много цинка, что приводит к сокращению объема циркулирующих растворов и способствует увеличению пропускной способности аппаратуры цеха выщелачивания.
Вместе с тем при повышенной кислотности электролита усиливается вредное действие примесей, ускоряется коррозия цинка в серной кислоте и понижается перенапряжение водорода. Чем чище исходный раствор сульфата цинка, тем более высокую кислотность электролита можно допускать при электролизе.
Температура электролита. Процесс электролита протекает с выделением тепла. Без применения специального охлаждения электролита температура в ванне при плотности тока 500 а/м2 может подняться до 80° и более. При такой температуре электролиз цинка невозможен вследствие активизации действия примесей и усиления коррозии катодного осадка. Повышенная температура способствует также растворению свинцовых анодов и загрязнению цинка свинцом. В то же время с повышением температуры уменьшается сопротивление электролита и снижается напряжение на ванне. Чаще всего температуру электролита в ваннах поддерживают на уровне 30—36°, более высокая температура допускается только при очень чистом электролите Электролит в ваннах обычно охлаждают водой с помощью погруженных в электролит алюминиевых или свинцовых змеевиков. Реже электролит охлаждают в ящиках со змеевиками, либо в градирнях (централизованное охлаждение). Последняя система предполагает обязательное применение усиленной многократной циркуляции электролита через ванны.
Перемешивание электролита в ваннах
Перемешивание электролита необходимо для выравнивания концентрации цинка в электролите и уменьшения тем самым концентрационной поляризации. При повышенных плотностях тока (более 400 а/м2) требуется усиленное перемешивание электролита, что достигается двумя путями: ускорением циркуляции электролита через ванны за счет подачи в них наряду с нейтральным раствором отработанного электролита и созданием в межэлектродном пространстве турбулентного движения электролита под действием выделяющихся на электродах водорода и кислорода. На практике часто применяют оба способа одновременно.
Скорость обычной циркуляции электролита через ванну, зависящая от активной поверхности катодов и плотности тока, составляет 3—5 л/мин. При централизованном охлаждении с многократной циркуляцией электролита скорость прохождения электролита через ванны возрастает в 6—10 раз. При малых расстояниях между электродами и низком содержании цинка в кислом электролите усиленная циркуляция особенно полезна.
Проведенные Вниицветметом в промышленном масштабе исследования усиленной циркуляции электролита показали возможность увеличения выхода по току на 0,5—1,0% и некоторого снижения напряжения на ваннах.
Плотность тока
Плотность тока, выражаемая в амперах на единицу поверхности электродов, является важным параметром электролиза. Для возникновения процесса электроосаждения цинка необходима минимальная, так называемая критическая плотность тока. Дальнейшее повышение плотности тока сопровождается возрастанием перенапряжения водорода, ослаблением влияния вредных примесей и улучшением структуры катодного осадка. По достижении определенного значения силы тока в цепи ванн начинают сказываться отрицательные проявления чрезмерного увеличения плотности тока: резко возрастает расход электроэнергии из-за увеличения напряжения на ванне, усиливается концентрационная поляризация цинка, снижается выход по току и ухудшается структура катодного осадка.
Каждой плотности тока соответствует определенная оптимальная кислотность электролита. В мировой практике электролиз осуществляется при следующих значениях плотности тока на катоде: 300—450 а/м2 при кислотности электролита 90 HO г/л H2SO4, 600—700 а/м2 при кислотности 150—170 г/л H2SO4 и 1000 а/м2 при кислотности 280—300 г/л H2SO4.
Коллоидные добавки
Плотная мелкокристаллическая структура и гладкая поверхность катодного цинка способствуют достижению хороших технико-экономических показателей электролиза. При гладкой поверхности выше перенапряжение водорода и меньше возможностей для образования коротких замыканий. Плотная мелкокристаллическая структура катодного осадка отвечает металлу высокого качества и уменьшает дроссообразование при переплавке катодного цинка.
С целью придания катодному осадку цинка указанных свойств стремятся проводить электролиз в оптимальном режиме и применяют коллоидные добавки, столярный клей, желатин, гуммиарабик, жидкое стекло и др. На отечественных заводах добавляют только клей в количестве 200—400 г на 1 т цинка, Коллоиды увеличивают перенапряжение водорода, уменьшают дендритообразование и парализуют вредное влияние некоторых примесей. В присутствии окислителей коллоиды разрушаются. Существует несколько воззрений, объясняющих действие поверхностно активных веществ. Наиболее распространенные из них основываются на явлении адсорбции коллоидов на выступающих гранях кристаллов цинка, препятствующих росту дендритов и шишек.
Оборудование электролитных цехов
Технико-экономические показатели при электролизе растворов сульфата цинка зависят не только от режима, но и от аппаратурного оформления процесса. Большое значение имеют конструкция ванн, анодов. катодов и коммутация тока.
В промышленности применяются три типа ванн: деревянные, железобетонные и стальные. Широко распространены деревянные ванны. Стоимость их невелика, а изготовление и ремонт не представляют затруднении. Срок службы ванн из сосны, футерованных свинцом или винипластом, 8—10 лет. Размеры ванн: ширина 750—900 мм, длина 2100—3000 мм, глубина 1100—1400 мм К недостаткам деревянных ванн следует отнести возможность усадки, коробления, огнеопасность и относительно малый срок службы.
На заводе «Укрцинк» установлены стальные ванны, футерованные кислотоупорным кирпичом Как показала практика, стальные ванны не обладают преимуществами перед деревянными. Они быстрее разрушаются кислым электролитом, небезопасны в обслуживании, требуют более надежной футеровки и тщательной защиты от коррозии наружной поверхности Размеры стальных ванн такие же, как и деревянных.
В последние годы на отечественных цинковых заводах получают распространение железобетонные ванны, футерованные винипластом. Железобетонная ванна не дает усадки, несгораема, допускает индивидуальное изготовление и установку, имеет большой срок службы (15 лет). Эти ванны изготовляются из обычного армированного бетона с толщиной стенок 80—100 мм. Железобетонные ванны Усть-Каменогорского цинкового завода имеют отверстия в днище с клапаном для выпуска марганцевого шлама.
Наибольшим распространением в практике цинковых заводов пользуются ванны, изготовленные из обычного железобетона или дерева. В единичных случаях (заводы Флин-Флон, «Укрцинк») ванны выполнены из асфальто-бетона (продорита) и стали.
Ванны футеруются кислотостойкими материалами: рольным свинцом, винипластом или керамической плиткой. Наиболее надежна свинцовая футеровка, хотя она и требует периодической замены через 3—4 года. Винипласт легко дает трещины, которые трудно обнаружить при ремонте. Керамическая футеровка занимает большой объем.
Аноды должны обладать минимальной растворимостью в серной кислоте под действием электрического тока, высокой электропроводностью и быть удобными в эксплуатации. Таким условиям отвечают аноды из свинца. Они практически не растворимы в серной кислоте, имеют достаточную электропроводность, просты в изготовлении и удобны для обслуживания. Анод состоит из свинцового полотна толщиной 5—10 мм и медной освинцованной штанги. Один конец штанги фрезеруется под контакт. Площадь рабочей поверхности анода (с двух сторон) составляет 1,0—1,25 M2. Примерные размеры анодного полотна 1000х600х6 мм, штанги 940x40x14 мм. Вес анода 45—60 кг. Для отливки анодных листов применяют свинец высших марок: СЭ и CO.
Заводы России перешли на изготовление анодов из сплава свинца с 1 % серебра. Свинцовосеребрянные аноды обладают высокой устойчивостью в серной кислоте, повышенной жесткостью и обеспечивают нужное качество катодного цинка. Срок службы таких анодов достигает 2—3 лет.
Уменьшение напряжения на ваннах и увеличение их производительности достигается максимальным сближением электродов. На современных заводах расстояние между центрами анодов не превышает 56—60 мм, при этом в ванне размещается 28—32 анода. Во избежание коротких замыканий между катодами и анодами свинцовые аноды снабжены резиновыми ограничителями или винипластовыми изоляторами. Последние закрепляются на боковых кромках анодов и создают частично замкнутое пространство вокруг катода, что способствует усиленной циркуляции электролита в межэлектродном пространства. Конструкция анода с винипластовыми изоляторами показана на рис. 48.
Изношенные анодные полотна отрезают и переплавляют. Новые полотна из свинцово-серебрянного сплава припаивают к освинцованным штангам водородной сваркой.
Катоды состоят из листа и штанги с контактом. Лист и штанги изготовляют из алюминия, а контакт — из меди. Размер катодов несколько превышает размеры анодов, что позволяет свести к минимуму дендритообразование по краям катодов. Для изготовления катодов применяют твердоканатный нагартованный листовой алюминий высших марок толщиной 4—5 мм. Катодные штанги штампуют из алюминиевого проката Т-образного сечения 70×20 мм. Большое значение имеет качество выполнения медного контакта. При хорошем болтовом креплении контакта переходное сопротивление его не превышает 3—5 мв, а в приваренном 1—2 мв. Для предупреждения зарастания цинком кромок катода, вызывающего затруднения при сдирке катодного осадка, на края алюминиевого листа надевают резиновые планки. Срок службы катодов 8—10 месяцев. Вышедший из строя лист отрезают вблизи штанги и к ней приваривают новое алюминиевое полотно. Обычные в России размеры катодов 1100х660х4 мм и площадь рабочей поверхности 1,2—1,3 м2. Число установленных в ванне катодов на единицу меньше числа анодов. Конструкция катода видна из рис. 49.
Коммутация тока. Цинковая электролитная ванна в электротехническом отношении имеет некоторые особенности. Через нее пропускается ток большой силы (20000 а и выше) при низком напряжении (3,3—3,6 в). В соответствии с этим рассчитываются и проектируются преобразовательные подстанции и шинопроводы для питания ванн постоянным током. В качестве источников последнего на старых заводах применяют мотор-генераторы, а на более новых — ртутные и контактные выпрямители. В последнее время получают распространение полупроводниковые выпрямители, имеющие наиболее высокий к. п. д.
Электролитные ванны соединены последовательно в серии. Число ванн в серии зависит от напряжения тока на зажимах выпрямителя и составляет при номинальном напряжении 600 в 160—168, а при 800 в 200—225. Электроды в ванне включены в цепь параллельно. Через каждый катод проходит ток силой 500—700 а. Каждая серия ванн разделена на группы (ряды). В группе насчитывается 20—27 ванн.
Коммутация тока осуществлена ошиновкой двух видов: межгрупповой и межванной. Группы соединены пакетами медных или алюминиевых шин, рассчитанных на прохождение максимальной силы тока. От ванны к ванне ток передается различными способами: путем непосредственного контакта анодных и катодных штанг, через промежуточною бортовую шину треугольного сечения, рассчитанную на силу тока, проходящего через один электрод, и шинными перемычками, рассчитанными на всю силу тока в цепи ванн. Первые два способа используются на заводах России и характеризуются минимальным расходом меди, последний распространен на зарубежных заводах и создает большие удобства в обслуживании ванн. Однако при нагрузке на серии, превышающей 20000 а, межванные шинные перемычки становятся чрезмерно массивными и конструктивно трудно выполнимыми. Установка электродов в ванне без промежуточных шин показана на рис. 50.
Электролитные цехи оборудованы насосами для перекачки нейтрального и кислого электролита, подъемниками для катодов, машинами для чистки катодов и другой вспомогательной аппаратурой.
Практика ведения процесса электролиза
Работа по обслуживанию электролитных ванн слагается из трек основных операций: наблюдения за режимом электролиза, сдирки катодного цинка и отключения ванн на чистку и ремонт. Первая операция выполняется дежурными по электролизу, на обязанности которых лежит поддержание заданного кислотного и температурного режимов, добавка коллоидов, а также устранение коротких замыканий между электродами.
Постоянное содержание серной кислоты в электролите поддерживается путем регулирования подачи нейтрального раствора или смеси его с отработанным электролитом (при усиленной циркуляции). Нейтральный раствор подается в цех из сборных емкостей и распределяется между группами ванн по желобам или трубам Против каждой ванны имеется шланговый отвод с винтовым зажимом, через который раствор поступает в ванну. Отработанный кислый электролит переливается из ванны в сборный желоб и отводится в цех выщелачивания. Так как измерение кислотности раствора титрованием отнимает много времени, дежурные по электролизу пользуются ареометрами, посредством которых можно с точностью до ±2 г/л регулировать кислотность электролита в ваннах по удельному весу раствора.
Заданную температуру электролита выдерживают путем изменения количества холодной воды, поступающей в змеевики.
При усиленной циркуляции и централизованном охлаждении электролита операции регулирования кислотного и температурного режима могут быть совмещены и автоматизированы. При десятикратной циркуляции электролита изменение скорости поступления раствора в ванны на 10% вызывает изменение кислотности раствора всего на 1—1,5 г/л, а температуры на 0,5—1,0°, что вполне допустимо.
Выемку катодов из ванн и сдирку цинка производят чаще всего через 24 часа. Цинковые листы с катодов сдирают у ванн или на отдельных площадках. После очистки полотен и контактов катоды вновь устанавливают в ванны. Периодически, через 10—12 дней, поверхность катодов очищают на катодоочистительных машинах (рис. 51). Сдирку цинка проводят без выключения ванн и преимущественно в дневную смену.
До последнего времени на заводах эпизодически наблюдалась трудная сдирка цинка, вызываемая срастанием цинка с алюминиевым катодом. Причины трудной сдирки кроются как в загрязнении раствора примесями (фтор и др ), так и в шероховатости поверхности полотна алюминиевого катода. На отечественных заводах удается предупреждать затруднения при сдирке путем введения в электролит соединений сурьмы. При высоком качестве растворов, регулярной чистке и шлифовке катодов явление трудной сдирки обычно не возникает.
С течением времени на поверхности анодов образуется корка из марганцевого шлама, состоящего в основном из MnO2. Часть шлама падает с анодов и накапливается на дне ванны. Для удаления из ванн шлама и ремонта футеровки несколько электролитных ванн периодически по графику останавливаются на чистку. Отключение ванн при отсутствии шин между ними производят с помощью набора медных перемычек, заменяющих штанги вынутых анодов и катодов. После выемки электродов раствор отсифонивают, а шлам выгребают черпаками. На заводе «Электроцинк» внедрен механический способ очистки ванн с помощью насосов На Усть-Каменогорском цинковом заводе шлам выпускают через донные отверстия по желобам Марганцевый шлам используется в цехе выщелачивания как окислитель.
Переплавка катодного цинка
Получаемые при электролизе листы катодного цинка отвечают по химическому составу техническим условиям ГОСТ, но неудобны для транспортировки и использования Общесоюзный стандарт предусматривает выпуск цинка в виде чушек определенной формы и веса (рис. 52)
Чушковый металл получается переплавкой катодного цинка. Жидкий цинк разливают в изложницы. При переплавке добавляют хлористый аммоний, который растворяет пленку окиси цинка на металлических корольках, способствуя тем самым уменьшению дроссообразования и увеличению выхода чушкового цинка.
Для переплавки катодного цинка широко применяют электрические индукционные низкочастотные печи. Плавка в пламенных отражательных печах имеет ряд существенных недостатков и поэтому отходит в прошлое. Преимущества электроплавильных печей по сравнению с отражательными заключаются в более высоком выходе чушкового металла, продолжительном сроке службы, простоте обслуживания и лучших условиях труда, возможности автоматизации процесса и меньшем расходе огнеупорных материалов.
Конструкция индукционной печи представлена на рис. 53. Основной элемент ее — печной трансформатор, состоит из медной первичной катушки и железного сердечника; роль вторичной обмотки трансформатора выполняет цинковое кольцо. В зависимости от подаваемого напряжения катушка выполняется на 40 или 80 витков из меди прямоугольного сечения. Внутри катушки и по сторонам цинкового кольца расположены элементы сердечника из трансформаторного железа. Цинковое кольцо посте расплавления образует в футеровке трансформатора канал, сообщающийся с ванной печи и заполненный все время жидким металлом. В канале трансформируется ток большой силы при низком напряжении, под действием которого нагревается расплавленный цинк.
Печь заключена в металлический прямоугольный кожух из листовой стали толщиной 10—12 мм, длиной 4 м, шириной и высотой 2 м.
Печь и трансформаторы футерованы набивной огнеупорной массой, состоящей из 70 частей обожженной, 20 частей пластичной глины и 10 частей каолина. Внутри печь разделена огнеупорной перегородкой на плавильное и зумпфовое отделения. В первом происходит расплавление катодного цинка и осуществляется снятие дроссов, а из второго чистый металл разливается в изложницы.
Емкость ванны электропечей составляет 15—20 т цинка. Мощность всех трансформаторов достигает 550 квт. Производительность печей колеблется в пределах 75—110 т цинка в сутки. Запроектировано и начато изготовление печи на суточную производительность 200—300 т. Описание особенностей обслуживания электропечей имеется в литера туре.
Цинк загружают через вертикальную коробку в крышке печи пачками вручную или с помощью крана На Усть-Каменогорском комбинате сконструировано и освоено автоматически действующее загрузочное устройство. Листы цинка в плавильном пространстве погружаются в расплавленную ванну с температурой около 500°. При расплавлении образуются дроссы — смесь окиси цинка с металлическими частицами. Дроссы периодически после перемешивания с хлористым аммонием снимают с поверхности ванны и направляют на переработку. Жидкий цинк через отверстие в перегородке поступает в зумпфовое отделение и затем разливается в изложницы. Температуру ванны поддерживают за счет циркуляции цинка между плавильным пространством и кольцевыми каналами печных трансформаторов. Проходя через канал, цинк нагревается до 800—900° и выталкивается из него в печь.
Разлив цинка производится ложкой вручную в стационарные водоохлаждаемые изложницы или в изложницы карусельной машины. На Усть Каменогорском и Челябинском цинковых заводах работают автоматические карусельные машины конструкции И.И. Котова. На заводе «Электроцинк» осваивается прямолинейная автоматическая машина конструкции Казгипроцветмета. В настоящее время на большинстве отечественных цинковых заводов разлив цинка осуществляется на автоматических машинах без применения тяжелого ручного труда.
На тонну чушкового металла расходуется 100—120 квт*ч электроэнергии. Выход цинка в чушковый металл составляет 97,5—98,0%
Электролитные заводы России выпускают чушковый цинк, соответствующий по ГОСТ марке Ц0. Незначительная часть цинка отвечает по качеству маркам ЦВ и Ц1.
- Очистка раствора сульфата цинка от примесей
- Выщелачивание цинка
- Транспортирование и подготовка огарка цинка
- Рафинирование цинка
- Получение цинка в шахтной печи
- Электротермический способ получения цинка
- Дистилляция цинка в вертикальных ретортах
- Получение цинка в горизонтальных ретортах
- Теоретические основы пирометаллургии цинка
- Пирометаллургия цинка
При электроосаждении цинка из водного раствора его серно-кислой соли, содержащего свободную серную кислоту и примеси, возможно протекание следующих электрохимических реакций:
В зависимости от потенциала катода, состава электролита и условий электроосаждения протекает та или иная электрохимическая реакция. Потенциал разряда ионов на катоде выражается формулой Нернста:
где E0 — нормальный потенциал иона;
R — газовая постоянная;
T — абсолютная температура;
F — константа Фарадея;
n — число зарядов иона;
а — активность иона, равная произведению концентрации на коэффициент активности f;
η — поляризация.
Для ионов цинка и водорода потенциалы разряда их могут быть представлены следующими выражениями:
Экспериментально установлено, что разряд ионов водорода на цинковом катоде сопровождается высоким перенапряжением, около 1 в, в то время как поляризация разряда ионов цинка составляет всего десятки милливольт. Это означает, что при активности ионов цинка и водорода, равных единице (аН = аZn = 1), т. е. при сравнительно близких концентрациях обоих ионов, потенциал разряда ионов водорода будет более отрицателен, чем ионов цинка.
При катодной поляризации скорость разряда ионов цинка заметно выше скорости разряда ионов водорода, поэтому даже при высокой кислотности электролита и при значительных плотностях тока сила тока разряда ионов цинка больше силы тока разряда ионов водорода, что определяет высокие выходы по току для цинка. Все факторы, снижающие перенапряжение водорода на цинке, меняют положение в сторону, невыгодную для электроосаждения цинка. Скорость разряда ионов водорода возрастает, а скорость разряда ионов цинка мало меняется, что приводит к возрастанию совместного выделения водорода и снижению выхода цинка по току.
Перенапряжение водорода на цинке зависит от ряда факторов: плотности тока на катоде, температуры электролита, содержания примесей и поверхностно активных добавок, состояния катодной поверхности и др. Теория перенапряжения водорода изложена в специальных работах. Здесь же рассмотрим влияние отдельных факторов на величину перенапряжения водорода на цинке. Связь величины перенапряжения водорода с плотностью тока выражается уравнением Тафеля; — η = а + blgi.
Константа а, т. е. величина перенапряжения водорода при плотности тока равной единице (i = 1 a/см2), зависит от природы металла электрода, от состояния его поверхности, состава раствора и температуры. Константа b практически не зависит от природы материала и состава поверхности. Наиболее надежные значения константы а и b для реакции выделения водорода на цинке при температуре 20 °С составляют а = 1,24 в, h = 0,118 в. Величина перенапряжения водорода на техническом цинке, измеренная разными исследователями, характеризуется данными табл. 50.
Величина водородного перенапряжения в большой степени зависит от температуры. На рис. 91 приведена зависимость величины перенапряжения водорода от плотности тока при различных температурах в 2-н. растворе H2SO4. Из приведенных данных видно, что повышение температуры с 20 до 40 °С снижает величину перенапряжения примерно на 55—60 мв. Перенапряжение водорода сильно зависит от состояния поверхности. На полированных поверхностях металлов оно всегда выше, чем на электролитически осажденных поверхностях этих же металлов. В концентрированных растворах по мере роста концентрации кислоты перенапряжение водорода снижается, в разбавленных растворах чистых кислот оно не зависит от концентрации кислоты. Кривые перенапряжения водорода в кислоте более разбавленной, чем 0,1-н., практически совпадают с кривой для 0,1-н, раствора. Изменение величины водородного перенапряжения наблюдается при адсорбции поверхностно активных ионов. Адсорбция поверхностно активных анионов уменьшает перенапряжение водорода, адсорбция поверхностно активных катионов, наоборот, увеличивает перенапряжение. В табл. 51 приведены данные, характеризующие влияние желатина на величину перенапряжения водорода на цинке.
Как видно из данных таблицы, малые количества желатина повышают перенапряжение водорода на цинке. При низких плотностях тока достигается некоторый максимум, затем величина перенапряжения снижается; при высоких плотностях тока после концентрации 0,1 % желатина дальнейшая добавка его дает очень малый эффект.
Добавление в раствор ионов металлов, на которых перенапряжение водорода ниже, чем на цинке, делает величину перенапряжения водорода менее отрицательной (табл. 52).
В табл. 53 приведены данные перенапряжения разряда ионов водорода на цинке и металлах, обычно сопутствующих цинку в виде примесей. Из данных табл. 52 и 53 следует, что присутствие в растворе примесей, которые могут попадать в катодный цинк, приводит к увеличению скорости разряда ионов водорода. Вследствие этого снижается скорость разряда ионов цинка, а следовательно, и выход по току.
В практике электроосаждения цинка очень важно повысить перенапряжение водорода на цинке. Как следует из приведенных закономерностей, это достигается повышением плотности тока, снижением температуры электролита, максимальной очисткой раствора от примесей, имеющих низкое перенапряжение водорода, добавкой в раствор поверхностно активных веществ.
Поляризация при разряде ионов цинка из кислых сернокислых растворов невелика, при плотности тока выше 100 а/м2 имеет место только концентрационная поляризация. При низкой плотности тока (ниже 100 а/м2) возникает дополнительная поляризация около 60 мв, мало изменяющаяся с плотностью тока, однако точно проследить ее трудно вследствие большой коррозии в этих условиях.
Если Б цинковом электролите присутствуют поверхностно активные вещества, поляризация во всех случаях возрастает. Высказаны различные взгляды на механизм влияния поверхностно активных веществ на поляризацию. Наиболее достоверным можно считать адсорбционный механизм, согласно которому повышение поляризации под действием поверхностно активных веществ объясняется тем, что эти вещества, адсорбируясь, экранируют растущие части кристалла. Разряд ионов происходит или только на активных участках, или в тем случае, если поверхностно активные вещества образуют сплошную пленку, через пленку. Адсорбционный механизм действия добавок подтверждается полулогарифмической зависимостью между концентрацией добавки и ее количеством в осажденном металле, усилением действия добавок с понижением температуры и др.
Было исследовано влияние ряда поверхностно активных веществ на поляризацию цинка. Такие вещества, как спирты, камфора, крезол, очень слабо влияют на величину поляризации, более сильное действие оказывает желатин, клей.
Наиболее заметное торможение катодного процесса вызывают вещества, диссоциирующие с образованием поверхностно активного катиона. При этом с повышением концентрации добавки торможение катодного разряда ионов цинка усиливается. Однако существует определенный предел повышения концентрации поверхностно активного вещества, выше которого потенциал заметно не увеличивается, что характеризуется кривой рис. 92.
При достижении потенциала десорбции, при котором адсорбционный слой исчезает с поверхности электрода, торможение электродных реакций уменьшается. Подобное же влияние оказывает повышение температуры. С повышением температуры резко снижается эффективность действия поверхностно активных веществ, что выражается в снижении катодной поляризации; это может быть объяснено частичной десорбцией (табл. 54).
Систематические наблюдения за характером и структурой осадков цинка показали, что вещества, вызывающие сильное торможение электродных реакций, приводят к образованию на катоде гладкого равномерного мелкокристаллического осадка. Такие вещества, как клей, желатин, тетрабутиламмонийиодид, являются наиболее эффективно действующими добавками, в их присутствии образуются осадки с весьма высокими антикоррозионными свойствами.
Некоторые поверхностно активные вещества, такие как тимол, резорцин, амидол, вызывают торможение разряда ионов цинка в большей степени, чем разряда ионов водорода, вследствие чего выход по току водорода в присутствии этих веществ сильно возрастает. Это делает нецелесообразным использование их при электроосаждении цинка.
Электрокристаллизация цинка. Получение электролитических осадков цинка с определенными свойствами важно для гальваностегии, а также и при электролитическом получении цинка. В последнем случае к электролитическим осадкам предъявляют следующие требования: структура осадков должна быть плотной, поверхность гладкой, что обеспечивает высокое использование тока при электроосаждении цинка, при этом осадки должны обладать малым сцеплением с основным металлом, что позволит легко снимать их с матрицы.
Качество электролитических осадков сильно зависит от их структуры, которая характеризуется формой, величиной кристаллов и положением их по отношению к плоскости катода. От этих основных свойств зависят плотность (или пористость), блеск, твердость, прочность сцепления с основным металлом, а также способность осадка в большей или меньшей степени адсорбировать примеси. Величина электродного потенциала также в большой степени зависит от кристаллической структуры. Установлено, что различные грани монокристалла цинка имеют неодинаковый электродный потенциал, который, следовательно, зависит от кристаллографического направления.
Цинк кристаллизуется в гексагональной системе: грань основания призмы монокристалла цинка обладает более положительным потенциалом, чем грань призмы (в 1-н. растворе сернокислого цинка на 10—15 мв и в растворе хлористого аммония на 50 мв). Потенциал поликристаллического осадка цинка более отрицательный, чем потенциал грани основания призмы монокристалла.
Определенная ориентация кристаллов цинка (текстура) была найдена Палатником в осадках, полученных при электроосаждении цинка с добавками декстрина. Ось текстуры при этом совпадала с направлением, перпендикулярным поверхности катода. Было обнаружено, что текстура цинка возникает также при электроосаждении его без добавок коллоидов, но в присутствии Al2(SO4)3.
Все факторы, увеличивающие катодную поляризацию, способствуют возрастанию степени ориентации кристаллов цинка (увеличение плотности тока, снижение температуры, отсутствие перемешивания). При этом установлено, что с возрастанием степени ориентации кристаллов цинка увеличивается их дисперсность. Все текстурированные осадки мелкозернистые, нетекстурированные — крупнозернистые. Поверхность текстурированных осадков более гладкая, светлая и менее пористая, чем нетекстурированных.
Влияние различных добавок на возникновение определенной оси текстуры связано с адсорбцией их гранями кристаллов. Преимущественный рост имеют плоскости кристаллов, слабо адсорбирующие примеси. Влияние коллоидов на текстуру проявляется при умеренном содержании их в растворе; при избытке коллоидов текстура становится несовершенной, так как исчезает избирательная адсорбция для различных плоскостей.
Катодные осадки цинка, полученные при плотности тока 500 а/м2 из электролита, содержащего 60 г/л цинка и 100 г/л свободной серной кислоты без коллоидных добавок, крупнокристаллические и не имеют определенной оси текстуры. Введение в электролит 24 мг/л клея позволяет получить мелкокристаллические осадки с определенной ориентацией кристаллов по оси текстуры в плоскости, перпендикулярной поверхности катода. Содержание в чистом электролите 0,2 мг/л Sb также вызывает образование мелкокристаллических, текстурированных осадков с осью текстуры. При этом кристаллы расположены в плоскости под углом к поверхности катода.
От расположения кристаллов в большей степени зависит прочность сцепления катодно осажденного цинка с основным металлом, она определяется силами притяжения, действующими между атомами их кристаллических решеток. При прочих одинаковых условиях прочность сцепления тем выше, чем больше площадь контакта кристаллов цинка с поверхностью основного металла. В связи с этим ориентация кристаллов цинка по направлению оси текстуры неблагоприятна с точки зрения сцепления катодного осадка с матрицей, так как при этом кристаллы цинка расположены под углом к поверхности катода и соприкасаются с ней только вершинами. Это свойство кристаллических осадков используют на практике. Для уменьшения сцепления катодно осажденного цинка с алюминиевой матрицей и облегчения съема цинка в электролит вводят некоторое количество ионов сурьмы в первый момент формирования катодного осадка цинка на поверхности алюминия.
Коррозия цинка в серной кислоте
При электролитическом выделении цинка из кислого раствора сульфата цинка выход цинка по току зависит не только от соотношения, в котором протекает разряд катионов цинка и водорода, но и от скорости обратного растворения цинка, т. е. от скорости его коррозии.
Уже давно было замечено, что чем чище цинк и чем меньше он загрязнен такими примесями, как железо, сурьма, медь, тем труднее он растворяется. Более 100 лет назад швейцарский физико-химик де ля Рив обратил внимание, что на цинке, погруженном в серную кислоту, выделяются пузырьки водорода. Отсюда де ля Рив сделал смелое для своего времени предположение; примеси в цинке образуют на поверхности металла маленькие катоды (микрокатоды), а сам цинк является при этом анодом, т. е. поверхность цинка в кислоте можно рассматривать как состоящую из множества маленьких короткозамкнутых гальванических элементов (микроэлементов). В результате работы этих микроэлементов, называемых местными, или локальными элементами, растворяется цинк (анод); на микрокатодах (примесях), как и в обычном гальваническом элементе, выделяется водород. Впоследствии эта точка зрения подтвердилась и стала одной из основных идеи учения о коррозии. Особенно ценный вклад в теорию локальных элементов сделан советскими исследователями Г.В. Акимовым и его сотрудниками. Согласно современным представлениям, основой коррозии является электрохимический процесс — действие гальванических элементов.
Чтобы процесс электрохимического растворения происходил, необходимы следующие условия: потенциал анодной реакции, т. е. в данном случае электродный потенциал металла, должен быть более отрицательным, чем потенциал сопряженной реакции восстановления на катоде.
Поверхность раздела металл — электролит должна быть электрохимически неоднородна. Степень неоднородности поверхности может быть различна и вызывается она либо химически отличными от основного металла включениями, либо участками одного и того же металла в разном физическом состоянии (например, различные грани кристаллов). Гальванические пары могут возникать вследствие разного характера защитных пленок на отдельных участках металлической поверхности, а также неоднородности состава раствора.
Степень неоднородности двух участков поверхности выражается разностью их электродных потенциалов.
В работе микроэлемента имеется строгая эквивалентность анодных и катодных процессов. Поэтому об интенсивности коррозии можно судить не только по скорости анодного растворения металла, но и по количеству разряжающихся на катоде ионов водорода.
При работе микроэлемента цинк — примесь цинк теряет два электрона и переходит в раствор, а водород приобретает электроны и разряжается на катоде, выделяясь в виде газа. Скорость растворения цинка в серной кислоте определяется уравнением
где ρ — скорость растворения цинка;
х — удельная электропроводность жидкости;
z — число микроэлементов на единицу растворяющейся поверхности;
φZn — потенциал выделения цинка;
φH2 — потенциал выделения водорода;
r1+r2— сумма омических сопротивлений жидкости и металла;
s — величина растворяющейся поверхности. Скорость растворения цинка возрастаете повышением температуры и с увеличением кислотности.
На рис. 93 приведены данные, характеризующие скорость коррозии электролитного цинка, содержащего примеси. Как видно на рисунке, скорость коррозии тем больше, чем выше содержание примесей в катодном цинке. При одном и том же содержании такие примеси, как кобальт и никель, вызывают в десятки раз большую скорость коррозии, чем, например, медь. По интенсивности коррозии металлы-примеси в катодном цинке могут быть расположены в следующий ряд: Co, Ni, Fe, Sb, Cu. Скорость коррозии цинка уменьшается в присутствии поверхностно активных веществ; при наличии в электролите 50 мг/л Ni или Co скорость коррозии уменьшается при введении 10 мг/л клея в 27 раз, 10 мг/л бета-нафтола в 26 раз.
В табл. 55 приведены данные, характеризующие скорость коррозии катодного цинка, полученного из электролита с добавкой клея и без него, при равном coдeржании в цинке примесей. Из этих данных видно, что и чистый цинк, и цинк, содержащий примеси, корродируют быстрей в том случае, если они были получены из электролита, не содержащего клея. Особенно сильно проявляется положительное влияние добавки клея в раствор на уменьшение скорости коррозии полученного из него цинка при содержании в электролите сурьмы. Скорость коррозии цинка при этом снижается более чем в 30 раз.
Уменьшение скорости коррозии цинка, полученного из электролита, содержащего клей, объясняется влиянием клея на структуру катодного осадка. Катодный цинк, полученный из электролита, содержащего клей, как уже указывалось, отличается мелкокристаллической структурой с определенной ориентацией кристаллов. Такие катодные осадки обладают большой стойкостью против коррозии.
А.И. Левин и В.И. Фаличева провели исследование по изучению скорости растворения катодного цинка в 2-н. H2SO4 под током при увеличении катодной поляризации. Они показали, что образцы катодного цинка, полученные из чистого электролита, растворяются с наибольшей скоростью при отсутствии внешнего тока. При наложении тока с ростом катодной поляризации скорость коррозии уменьшается и при достижении определенного защитного потенциала прекращается. Таким образом, в системе цинк — раствор серной кислоты под влиянием наложенного извне тока может быть достигнута катодная защита металла от коррозии.
Механизм защитного действия тока электрохимический, он связан с процессом перестройки двойного электрического слоя на границе фаз металл — раствор. При отсутствии тока в раствор переходит некоторое количество цинка в результате чего поверхность приобретает отрицательный заряд, а в прилегающем слое появляется избыток положительно заряженных катионов цинка и водорода На границе фаз металл — раствор устанавливается стационарный потенциал. При наложении постоянного тока от внешнего источника и катодной поляризации цинка к поверхности его будут поступать электроны. Когда количество их оказывается достаточным для удержания катионов от перехода их из двойного слоя в объем электролита, наступает катодная защита.
Влияние концентрации цинка и кислоты в растворе, плотности тока и температуры на выход по току и расход электроэнергии
Экспериментальные данные о влиянии различных факторов на выход по току и расход электроэнергии при электролитическом осаждении цинка были получены С.А. Хансеном в 1915—1918 гг.; затем П.П. Федотьевым с учениками в 1920—1929 гг., позже, в 1950—1960 гг.. В.В. Стендером с сотрудниками. Данные, полученные в разное время исследователями, не противоречат одни Другим. Все исследования проведены с электролитом, содержащим только цинк и серную кислоту и не содержащим примесей.
На рис. 94 показана зависимость выхода по току от концентрации цинка в электролите при различных концентрациях кислоты. Выход по току понижается с падением концентрации цинка, особенно сильно при уменьшении концентрации цинка ниже 50 г/л. При всех концентрациях цинка выход по току возрастаете уменьшением концентрации кислоты в электролите.
При одном и том же содержании кислоты в электролите выход по току тем больше, чем выше применяемая плотность тока (рис. 95).
На рис. 96 видно, что повышение температуры ведет к снижению выхода по току.
Удельный расход электроэнергии выражается уравнением
где U — напряжение на ванне;
1,219 — электрохимический эквивалент;
η — выход по току.
Напряжение ка ванне складывается из следующих величин:
где φа, φк — анодный и катодный потенциалы;
Δφ — анодная и катодная поляризация;
r1 — сопротивление корки шлама;
r2 — сопротивление шин, контактов, токоподводов и электродов;
ρ — удельное сопротивление электролита;
l — расстояние между электродами;
S — общая поверхность катодов в ванне.
Как следует из этих уравнений, значение удельного расхода электроэнергии будет тем меньше, чем выше выход по току и чем ниже напряжение на ванне.
Как было видно из рис. 94 и 95, по мере увеличения кислотности раствора выход по току снижается. Однако известно, что сопротивление раствора уменьшается с увеличением содержания кислоты. Поэтому удельный расход электроэнергии при электроосаждении цинка зависит от двух противоположно действующих факторов, зависящих от кислотности раствора, — величины выхода по току и падения напряжения в растворе. В результате получается зависимость удельного расхода электроэнергии от концентрации кислоты, приведенная на рис. 97, из которого следует, что с повышением плотности, тока минимум удельного расхода электроэнергии смещается в сторону более высокой кислотности раствора.
Много исследований проведено при высокой плотности тока. На рис. 98, 99, 100 приведены данные, характеризующие влияние плотности тока, температуры и содержания кислоты на выход по току и расход электроэнергии в интервале плотностей тока 800/3000 а/м2. Здесь наблюдается та же закономерность, что и при низкой плотности тока, т. е. с увеличением концентрации кислоты выход по току снижается тем больше, чем ниже плотность тока и выше температура электролита. Расход электроэнергии, как правило, возрастает с повышением плотности тока. Увеличение концентрации кислоты в электролите в интервале от 100 до 200 г/л не вызывает резкого изменения расхода электроэнергии при всех плотностях тока, так как здесь наблюдается взаимно противоположное влияние двух факторов; снижения выхода по току, приводящее к увеличению расхода электроэнергии, и уменьшение напряжения на электродах, вызывающее снижение расхода электроэнергии. С повышением концентрации кислоты от 200 до 300 г/л снижение выхода по току превалирует над уменьшением напряжения на электродах, что в итоге приводит к наибольшему увеличению расхода электроэнергии при плотности тока 400—800 а/м2.
Электрический баланс ванны
В табл. 56 приведены данные, характеризующие электрический баланс ванны, работающей с кислотностью 91 г/л, при температуре 32 °С, расстоянии между осями одноименных электродов 76 мм, плотности тока 373 а/м2.
Главная составляющая общего напряжения — разность потенциалов на электродах, незначительно меняющаяся с плотностью тока.
Расчет процесса электролиза цинка из сульфатного раствора
Расчет
процесса электролиза цинка из сульфатного раствора
Содержание
Введение
1 Общие сведения
.1 Физические свойства
.2 Химические свойства
1.3 Применение цинка
Вещественный состав цинкосодержащих
руд и концентратов
Способы
переработки цинкового концентрата
3.1 Обжиг цинковых
концентратов перед выщелачиванием
3.2 Выщелачивание
обожженного концентрата
.3 Очистка раствора
сульфата цинка от примесей
Электроосаждение цинка
.1 Теоретические
положения
.2 Основные показатели
процесса электролиза
.3 Конструкция ванн и
электродов
.4 Циркуляция и
охлаждение электролита
.5 Обслуживание процесса
электролиза
.6 Интенсификация
процесса электролиза
Практическая часть
Список использованных
источников
Введение
Переработка цинковых руд началась в глубокой
древности при выплавки латуни (сплав цинка с медью). Еще в V
в. до н. э. в Индии окисленную руду переплавляли в небольших горнах с углем и
медью. Позднее латунь начали выплавлять в Китае и других странах Востока.
До середины XVII
в. Цинк в Европе не производили, хотя еще в конце XIII
в. Марко Поло описал, как получают цинк в Персии. Крупнейшие ученые XVI
в. Парацельс и Агрикола в своих трудах уделяли место выплавке цинка. Однако
заводское получение цинка организовать не удалось.
Цинк пытались получить точно так же, как и
другие металлы: обжигали руду, превращая соединения цинка в оксид, и
восстанавливали его углем, предполагая выплавить металл. Цинк при этом
восстанавливался до металлического, но не выплавлялся, так как при температуре
процесса он весь испарялся и, окисляясь в газовой фазе печи кислородом воздуха,
снова превращался в оксид цинка. Наладить производство цинка в странах Европы
удалось лишь после того, как руду стали восстанавливать в закрытых ретортах без
доступа воздуха.
В 1743 г. в Бристоле (Англия) заработал первый в
Европе цинковый завод. На американском континенте первый цинковый завод был
построен в 1850 г.
В настоящее время производство
цинка по масштабам уступает только производству железа, алюминия и меди
Отечественная цинковая промышленность была
создана после Великой Октябрьской социалистической революции. До революции в
России работал один цинковый завод в г. Орджоникидзе, который удовлетворял
потребности страны в цинке не более чем на 5%. В 1929 г. был построен
цинкдистилляционный завод в г. Константинове, в 1931 г. начал работать такой же
завод в г. Белово, в 1933 г. пустили первый в стране завод “Электроцинк” (г.
Орджоникидзе), а в 1935 г. Челябинский цинкэлектролитный завод.
Цинковая промышленность России не играет
сколько-нибудь важной роли в мире, однако очень важна для отечественной
экономики. Добыча цинка в России составляет лишь 1,7% от мировой, а
производство рафинированного цинка — 2,7%. Низким остается уровень потребления
цинка в стране — около 1 кг/чел., это намного ниже среднемирового.
В России цинк извлекается из медноколчеданных
месторождений Урала, а также из полиметаллических месторождений в горах Южной
Сибири и Приморья. На долю месторождений Уральского региона (Башкирия,
Челябинская и Оренбургская обл.) приходится более 75% объема выпуска российских
цинковых концентратов. Обеспеченность разведанными запасами эксплуатируемых
месторождений в целом по стране хорошая и составляет 27 лет — на столько
времени хватит известных ныне достоверных запасов, чтобы обеспечить нынешний уровень
добычи.
Мировые цены на цинк в последние годы
стремительно падают: среднегодовая цена 1 т цинка в 2000 г. на бирже равнялась
1128 долл., в 2001 г. — 885, а в 2002 г. — 778 долл. Все это стало следствием
избыточного выпуска цинка, особенно в странах Азии, а также отражением того,
что в мире имеется множество бездействующих мощностей по выплавке этого
металла. При нынешней ситуации на рынке цинка около четверти всех цинковых
рудников мира не покрывают свои эксплуатационные расходы. Прибыль некоторые цинковые
предприятия получают только в результате извлечения попутно с цинком других
металлов, например серебра, индия, кадмия, а также от реализации серной
кислоты, получаемой как побочный продукт при выплавке. [1], [3]
1
Общие сведения
.1
Физические свойства
Металлический цинк обладает характерным
голубоватым блеском на свежей поверхности, который он быстро теряет во влажном
воздухе. Температура плавления 419,58° С, температура кипения 906,2° С,
плотность 7,133 г/см3. При комнатной температуре цинк хрупок, при 100-150° С
становится пластичным и легко прокатывается в тонкие листы и проволоку, а при
200-250° С вновь становится очень хрупким и его можно быть истолочь в порошок.
Полиморфных модификаций не имеет.
Кристаллизуется в гексагональной решетке с параметрами а = 2,6594Å,
с
= 4,9370Å.
Атомный
радиус 1,37Å; ионный Zn2+ — 0,83Å.
Плотность
твердого цинка 7,133 г/см3 (20 °С), жидкого 6,66 г/см3 (419,5 °С); tпл 419,5
°С; tкип 906 °С. Температурный коэффициент линейного расширения 39,7·10-3
(20-250 °С), коэффициент теплопроводности 110,950 вт/(м ·К) 0,265 кал/см·сек·°С
(20 °С), удельное электросопротивление 5,9·10-6 ом·см (20 °С), удельная
теплоемкость Цинка 25,433 кдж/(кг·К.) [6,07 кал/(г·°С)]. Предел прочности при
растяжении 200-250 Мн/м2 (2000-2500 кгс/см2), относительное удлинение 40-50%,
твердость по Бринеллю 400-500 Мн/м2(4000-5000 кгс/см2). Цинк диамагнитен, его
удельная магнитная восприимчивость -0,175·10-6.
Радиус атома Zn 0,139 нм, радиус иона Zn2+ 0,060
нм (координационное число 4), 0,0740 нм (координационное число 6) и 0,090 нм
(координационное число 8). Энергии последовательной ионизации атома
соответствуют 9,394, 17,964, 39,7, 61,6 и 86,3 эВ. Электроотрицательность по
Полингу 1,66.[4]
цинк руда концентрат электролиз
1.2
Химические свойства
Цинк является довольно активным металлом. Он
легко взаимодействует с кислородом, галогенами, серой и фосфором:
Zn + О2 = 2 ZnО (оксид цинка); (1)+ Сl2 = ZnСl2
(хлорид цинка); (2)+ S = ZnS (сульфид цинка); (3)
Zn + 2 Р = Zn3Р2 (фосфид цинка). (4)
При нагревании взаимодействует с аммиаком, в
результате чего образуется нитрид цинка:
Zn + 2 NН3 = Zn2N3 + 3 Н2, (5)
а также с водой:
+ Н2О = ZnО + Н2 (6)
и сероводородом:
+ Н2S = ZnS + Н2. (7)
Образующийся на поверхности цинка сульфид
предохраняет его от дальнейшего взаимодействия с сероводородом.
Цинк хорошо растворим в кислотах и щелочах:
+ Н2SO4 = ZnSO4 + Н2; (8)
Zn + 10 НNО3 = 4 Zn(NО3)2 + NН4NО3 + 3 Н2О; (9)+
2 КОH + 2 Н2О = К2[Zn(ОН)4] + Н2. (10)
В отличие от алюминия цинк растворяется в водном
растворе аммиака, так как образует хорошо растворимый аммиакат:
+ 4 NН4ОН = [Zn(NН3)4](ОН)2 + Н2 + 2 Н2О. (11)
Цинк вытесняет менее активные металлы из
растворов их солей:
СuSO4 + Zn = ZnSO4 + Сu; (12)
СdSO4 + Zn = ZnSO4 + Сd. (13) , [4]
1.3
Применение цинка
Положение цинка в таблице электрохимических
потенциалов металлических элементов указывает, что он способен защитить железо,
сталь и медные сплавы от коррозии. Это свойство известно как анодная защита, и
половина производимого в мире цинка расходуется на покрытие стали. Старейший
метод цинкования путем погружения в расплав все еще остается наиболее удобным
методом нанесения покрытий на металлические оконные рамы и другие механически
обработанные изделия. Следующее по важности применение цинка — латунь и другие литейные
сплавы на основе цинка. Такие сплавы имеют хорошую коррозионную стойкость;
цинк, расходуемый на их получение, потребляется примерно в том же количестве,
что и цинк, идущий на цинкование. Цинковые сплавы прочны, стойки и обладают
прочностью на растяжение до 300 МПа. Легкость и точность, с которыми могут
формоваться изделия из них методами литья в кокиль, обусловливают их
использование в качестве материалов для автомобильных деталей, скобяных
изделий, игрушек и другой продукции. Оксид цинка применяется в покрытиях, а
цинковая пыль — в антикоррозийных красках. Литопон — продукт соосаждения
сульфида цинка и сульфата бария — используется в красках и пластмассах. Цинк с
небольшими добавками других металлов применяется как кровельный материал, для
изготовления фрикционных накладок барабанных тормозов, сухих гальванических
элементов и электрических конденсаторов.
Примерно 50%
мирового производства цинка расходуется на покрытие
железных изделий с целью защиты их от ржавления.
Более 30% всего
производства в мире цинка употребляется на производство сплавов. Различные
сорта бронз широко применяют в машиностроении. Сплавы цинка с медью и никелем
называют мельхиором и нейзильбером. Благодаря
способности давать сплавы с серебром и золотом, цинк используется в
металлургии для извлечения благородных металлов.
Цинковая пыль применяется для
осаждения золота и серебра из растворов при их получении гидрометаллургическим
путем, для очистки растворов от меди и кадмия перед электролизом растворов
цинка.
Оксид цинка
широко используют при производстве резины и ее обработке. Он улучшает качество
резиновых шин и ряда других резиновых изделий. Широко используют чистый
цинковый купорос при производстве корда-осных шин.
Соединения цинка,
в частности его антимонид, используют в качестве интерметаллических
полупроводников в приборах для превращения электрической энергии в тепловую.
Антимонид цинка применяют также для точечного охлаждения детекторных приборов
при изучении космоса.[1]
2.
Вещественный состав цинксодержащих руд и концентратов
Цинксодержащие руды делят на
сульфидные и окисленные в зависимости от того, какими минералами представлены в
них металлы. В сульфидных рудах цинк обычно находится в виде сфалерита ZnS (67,1 % Zn), иногда
вюртцита ZnS (67,1 % Zn), реже — в
виде марматита
Цинк обычно не образует
самостоятельных руд, а входит в состав полиметаллических свинцово-цинковых или
медно-свинцово-цинковых руд.
В этих рудах наряду со сфалеритом,
присутствуют сульфиды свинца, меди, кадмия, марганца, серебра, мышьяка, сурьмы,
кобальта. В сфалерите зачастую в виде примесей содержатся редкие элементы —
индий, таллий, галлий и германий, а также золото в количестве от тысячных до
сотых долей процента.
Свинец в сульфидных цинковых рудах
представлен обычно в виде галенита PbS. В
окисленных зонах месторождений цинксодержащих руд цинк присутствует в виде
следующих минералов: цинкита ZnO (80,3 % Zn),
франклинита (Zn, Mn) (6-18 % Zn), виллемита
(58,6% Zn), каламина
(57,1 % Zn),
смитсонита ZnC03
(52,1 % Zn) и
гидроцинкита (47,6 % Zn). Из
породообразующих компонентов в цинковых рудах содержатся кварц, глина,
карбонаты кальция и магния, барит и др.
Низкое содержание цинка (1-3.%) и
сложность состава цинксодержащих руд обусловливают необходимость их
предварительного обогащения. Селективная флотация полиметаллических руд
обеспечивает получение высококачественных цинковых концентратов, содержащих, %:
(51 ±3,5) Zn; (32±2,5) S; (8,0±3,5) Fe; (0,2±0,05)
Cd; (1±0,5) Pb; (l±0,5)Cu; (2,5±1,5)
карбонатов и силикатов.
Кроме основных составляющих, в
концентратах содержится незначительное количество золота; серебро(75-100 г/т);
индий, ртуть, галлий, таллий; вредные примеси (0,01-0,1 % As; 0,01-0,03
% Sb; 0,01-0,02
% CI; -0,01% F;
0,001-0,01% Co; 0,01-0,05%
Ni; германий,
селен, теллур). Таким образом, цинковые концентраты представляют собой
комплексное сырье. Отечественные предприятия к настоящему времени освоили
извлечение из них 11-17 элементов с высокой экономической эффективностью.[1]
Для извлечения цинка из концентратов применяют
два способа: пирометаллургический (дистилляционный), показанный на рисунке 1 и
гидрометаллургический (электролитический), показанный на рисунке 2. В России
основное количество цинка получают гидрометаллургическим способом.
Исторически первым способом переработки был
пирометаллургический. Технология способа и его аппаратурное оформление связаны
с особенностями восстановления цинка из оксида. Восстановление оксида цинка до металла
углеродом и СО происходит при температуре свыше 1000-1100 °С (температура
кипения цинка 906°С).
Реакции восстановления сопровождаются выделением
газообразного цинка, его возгонкой (дистилляцией). Компоненты пустой породы
остаются при этом в твердом виде. Конденсацией паров можно получить жидкий
металлический цинк.
ZnO + CZn + CO; (1)+
CОZn + CO2. (2)
Поэтому пирометаллургический способ
производства цинка называют дистилляционным или просто дистилляцией.
Дистилляционный способ связан с
большой затратой топлива и огнеупорных материалов и дает цинк только низших
марок, а для получения высококачественной продукции требуется рафинирование.
Принципиальная схема
гидрометаллургического способа переработки цинковых концентратов приведена на
рисунке 2. В основе гидрометаллургической схемы заложено выщелачивание оксида
цинка из обожженного цинкового концентрата разбавленной серной кислотой:
ZnO + H2S04
= ZnS04
+ H20. (3)
Цинк из раствора выделяют путем
электролитического восстановления на катоде. На аноде в это время
регенерируется серная кислота, что позволяет использовать отработанный
электролит в качестве растворителя при выщелачивании огарка.
Так как в раствор при выщелачивании
переходят многие сопутствующие элементы-примеси (Си, Cd, Co и др.), то
перед электролизом раствор подвергают тщательной очистке. Чем чище поступает на
электролиз раствор, тем более высокого качества получают товарный цинк.
При электролизе происходит следующая
реакция:
ZnS04
+ Н20 = Zn + H2S04
+ 0,5O2. (4)

3.1
Обжиг цинковых концентратов
На гидрометаллургическую переработку поступают
сульфидные цинковые концентраты, содержащие, %: 45- 60 Zn; 29-35 S; 6-; 6-12 Fe; 1,5-5,0 Аl2О3;
0,2-4,0Рb; 0,1- 3,0Cu;
0,4-3,0 SiO2; 0,5-1,5 СаО; 0,2-1,0 MgO; 0,25- 0,80 Cd; 0,01-0,4 As;
0,01-0,3 Sb, а также 20-160 г/т Ag и 0,5-10 г/т Au.
Сульфид цинка ZnS практически нерастворим в
разбавленных кислотах. Выщелачивание его в концентрированной серной кислоте
(60-65 % H2SO4) возможно при 150-170 °С, но сложно в
аппаратурном оформлении и экономически нецелесообразно. Поэтому перед
выщелачиванием цинковые сульфидные концентраты подвергают окислительному
обжигу, продукты которого хорошо растворимы в разбавленных растворах серной
кислоты при низких температурах. Обжиг позволяет применить к переработке
цинковых концентратов гидрометаллургическую технологию, принципиальная схема
которой приведена на риснуке 3.1.
При осуществлении окислительного обжига цинковых
концентратов стремятся получить огарок, как можно полнее соответствующий
требованиям последующих гидрометаллургических процессов. Очень важно, чтобы
продукт обжига был порошкообразным. Чем мельче порошок, тем выше скорость его
выщелачивания. Обжиг следует вести в основном с получением оксида цинка ZnO и
некоторого количества сульфата цинка ZnSO4.
Наиболее полно удовлетворяет требованиям обжиг в
печах кипящего слоя (КС). Поэтому в настоящее время на всех отечественных
цинковых заводах обжиг ведут в печах КС.[1]
3.2
Выщелачивание обожженного концентрата
Взаимодействие компонентов огарка с серной
кислотой. Назначение операции выщелачивания огарка — растворить как можно
полнее соединения цинка, содержащиеся в огарке, и получить чистые растворы для
электролиза. Растворение происходит в сернокислых растворах. Выбор серной
кислоты как растворителя обусловлен хорошей растворимостью в ней ZnO, условиями
последующей операции электролитического восстановления цинка, а также наличием
на любом цинковом заводе в достаточном количестве серной кислоты, получаемой
при электролизе и производимой на месте из обжиговых газов.
Оксид цинка хорошо растворим в слабых растворах
серной кислоты, сульфат цинка — в воде:
+ H2SO4
= ZnSO4
+ H2O.
Сульфид цинка ZnS можно растворить только в
концентрированной серной кислоте при нагревании. При этом выделяется токсичный
сероводород:
+ H2SO4
= ZnSO4
+ H2S.
В ходе обжига образуется некоторое количество
силикатов (ZnO·mSiO2),
ферритов (xZnO·Fe2O3)
и алюмината (ZnO·Al2O3)
цинка, малорастворимых в раствоpax серной кислоты. Их растворимость возрастает
по мере повышения концентрации Н2SO4
и температуры раствора. Так, для перевода в раствор цинка из ферритных,
соединений необходима концентрация H2SO4
200- 300 г/л и температура 80-90 °С.
Для непрерывного выщелачивания обычно применяют
агитаторы с пневматическим перемешиванием (пачуки).
Для обеспечения необходимой продолжительности
выщелачивания устанавливают несколько последовательно соединенных пачуков.
Исходную пульпу подают в головной пачук, а из последнего пачука пульпу
направляют в сгустители.
При периодическом выщелачивании огарка процесс
проводят в агитаторах с механическим перемешиванием. [1]
3.3
Очистка раствора сульфата цинка от примесей
Примеси в растворе сульфата цинка в соответствии
со способами выведения их из раствора можно разделить на группы. Первая группа
объединяет примеси, которые можно удалить из раствора гидролизом, соосаждением,
адсорбцией и коагуляцией: железо, медь, алюминий, мышьяк, сурьма, индий,
германий, галлий, кремнезем. Гидролитическая очистка происходит при нейтральном
выщелачивании огарка и сгущении нейтральной пульпы. Во вторую группу входят
металлы, более электроположительные, чем цинк (медь, кадмий, никель, кобальт,
таллий), которые можно вывести из раствора цементацией металлическим цинком.
Для удаления из раствора примесей третьей группы
необходимо применять специальные реагенты, образующие с этими примесями
труднорастворимые соединения. К этой группе относятся кобальт, хлорид-ион и
фторид-ион. Примеси четвертой группы (калий, натрий, магний, марганец) не
извлекаются применяемыми методами очистки растворов и накапливаются. Для
поддержания их концентрации на определенном уровне приходится часть рабочего
раствора выводить из процесса и заменять свежеприготовленным, не содержащим
примесей этой группы.[1]
4.
Электроосаждение цинка
.1
Теоретические положения
Выделение цинка из очищенного раствора сульфата
цинка с получением готового продукта осуществляют путем электролиза раствора.
Для осуществления процесса подводят электрический ток к электродам
электролизной ячейки: катоду и аноду. На катоде идет восстановление ионов Zn2+
из раствора до металлического состояния. На аноде электрическая энергия
расходуется на анодные реакции. При электролитическом рафинировании металлов на
аноде происходит полезный процесс — растворение чернового металла. В случае же
электролиза цинка анод растворять нельзя, так как металл анода или примеси,
растворяясь, загрязнит раствор, а затем и цинковый катодный осадок. Полезных
анодных реакций при электроосаждении цинка из раствора практически нет.
Следовательно, при реализации электролитического восстановления цинка из раствора
необходимо, чтобы продукты анодного процесса не загрязняли электролит, а сам
процесс шел с минимальным расходом энергии; кроме того, выделяющиеся на аноде
вещества не должны быть токсичными, В наибольшей степени этим требованиям
удовлетворяет процесс анодного разложения воды с образованием газообразного
кислорода:
E0=+1,229 В
Правда, при этом все-таки образуется
нежелательная примесь — ионы водорода, которые могут восстанавливаться на
катоде вместе с цинком, снижая выход по току и выход по энергии.
Чтобы осуществить процесс (276),
нужно изготовить анод из такого материала, который бы при анодной поляризации
до 1,23 В (а с учетом перенапряжения кислорода- до 2 В) не окислялся и не
растворялся в электролите.
Для сульфатного электролита анод
может быть изготовлен из свинца, хотя В, что значительно
электроотрицательнее , и
растворение свинца на аноде должно предшествовать разложению воды. Возможность
применения свинцового анода объясняется следующим. В сульфатном растворе ионы Pb2+ связываются
в труднорастворимый сульфат свинца PbSO4. Это
облегчает ионизацию свинца, и на свинцовом аноде в сульфатной среде протекает
электродный процесс
В прианодном слое быстро наступает
предел растворимости сульфата свинца, и на поверхности анода
выкристаллизовывается PbSO,}. Сульфат свинца обладает низкой
электропроводностью, и для поддержания заданной скорости электролиза (плотности
тока) приходится увеличивать анодную поляризацию.
При более высоком анодном потенциале
свинец окисляется до диоксида PbO2, который откладывается в
порах рыхлой пленки PbSO4 и закрывает их:
Pb + 2Н2O — 4еPbO2 + 4Н+
После этого растворение свинцового
анода прекращается. Но так как PbO2 обладает
электронной проводимостью, то при дальнейшей поляризации анода может протекать
процесс (276). Однако выделение кислорода на PbO2 идет с
большим перенапряжением, и процесс (276) протекает с необходимой скоростью (ia=500 — 600
А/м2)| при анодном потенциале около 2 В. Образование тончайшей
пленки PbO2,
предохраняющей анод от дальнейшего растворения, происходит быстро, но
формирование устойчивой пленки длится не менее 24 ч.
Для повышения химической
устойчивости и механической прочности анода в его состав вводят серебро (0,75 —
1 %). Свинцовосеребряные аноды меньше разрушаются в ходе электролиза и срок
службы их больше. Они дают меньше взвесей PbO2 и позволяют
получать цинк с меньшим содержанием свинца.
Катодный процесс восстановления
цинка из его кислого сульфатного раствора оказывается возможным потому, что
выделение водорода на цинке сопровождается очень высоким перенапряжением (не
менее 0,7 В). На катоде происходит следующие две основные и конкурирующие
электродные реакции:
2+ + 2eZn;
;
Н+ aq + 1е 0,5Н2;
.
На электродах в первую очередь
реализуются менее энергоемкие процессы, поэтому на катоде сначала
восстанавливаются более электроположительные элементы.
Перенапряжение (Dj) зависит от условий
образования на поверхности катода новой фазы. Так, если кристаллизация металла
на металле — малоэнергоемкий процесс и требует перенапряжения порядка
нескольких сотых вольта, то образование молекулы водорода на металлическом
катоде — весьма энергоемкий процесс, который требует отрицательной поляризации
электрода в несколько десятых вольта.
Перенапряжение водорода на цинке
зависит от ряда факторов: катодной плотности тока, температуры электролита,
содержания примесей и поверхностно-активных добавок, состояния катодной
поверхности и др.
Зависимость перенапряжения водорода
на цинке от катодной плотности тока при 25 °С выражают уравнением:
-Dj
= 0,77 + 0,118 lg ik
где ik — катодная
плотность тока, А/м2.
Повышение плотности тока
обусловливает увеличение перенапряжения водорода. Однако разогрев электролита,
вызванный повышением плотности тока, уменьшает перенапряжение водорода. В
интервале температур 20 — 80 °С зависимость Dj
от температуры приближенно можно выразить уравнением:
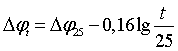
где t — температура электролита, °С;
Djt и Dj25 —
перенапряжение водорода на цинке соответственно при температуре электролита и
при 25 °С.
В слабокислых растворах (<0,1 н.
H2SO4) перенапряжение водорода практически не зависит от
концентрации H2SO4, но в более кислых растворах
перенапряжение водорода снижается с повышением концентрации серной кислоты.
Влияние перечисленных факторов на
перенапряжение восстановления ионов Zn2+ на цинковом катоде
сказывается в значительно меньшей степени, чем на перенапряжение восстановления
ионов Н+. Поэтому характер зависимости выхода по току от различных
факторов при электроосаждении цинка идентичен подобной зависимости для
перенапряжения водорода. Так, зависимость выхода по току от плотности тока, температуры
электролита и концентрации серной кислоты согласуется с влиянием этих факторов
на перенапряжение водорода.
Снижение концентрации в электролите
цинка в соответствии с уравнением обусловит увеличение поляризации цинкового
катода, что закономерно ухудшит выход по току.
Если рассматривать процесс
электролиза раствора сульфата цинка в целом, то электроэнергия в
электролитической ячейке расходуется на осуществление следующих суммарных
электрохимических процессов:
ZnSO4
+ H2O Zn + H2SO4
+ 0,5O2;
H2O H2
+ 0,5О2.
Уравнение описывает основной процесс
— электроосаждение цинка из раствора сульфата цинка, а уравнение — побочный
процесс разложения воды, сопровождающийся выделением водорода на катоде и
снижающий выход по току. Кроме этих процессов, электроэнергия тратится на
перемещение ионов в электролите: катионов — к катоду, анионов — к аноду.
На электроосаждение цинка приходится
около 70 % электроэнергии, в том числе на восстановление ионов до металла около
21,5 %; на разложение воды до газообразного водорода и кислорода 7- 8 %; на
преодоление сопротивления электролита переносу ионов к электродам примерно 15
%.
Если рассматривать затраты
электроэнергии только на катоде, то примерно 90 % их можно отнести к основному
процессу — восстановлению ионов Zn2+, а около 10 % — к побочному
процессу — восстановлению ионов Н+ (выход по току — 90%).
Большую роль в процессе
электроосаждения играют примеси. По электрохимическим свойствам примеси можно
разделить на четыре группы: группа — катионы, более положительные, чем цинк;
группа — катионы, более отрицательные, чем цинк; группа — анионы;группа —
органические примеси.
Катионы, более положительные, чем
цинк действуют следующим образом. Металлы-примеси разряжаются на катоде,
образуя участки с повышенным перенапряжением водорода, на которых ионы водорода
разряжаются от внешнего источника тока и вследствие работы короткозамкнутых
гальванических элементов. Степень осаждения примеси на цинковом катоде зависит в
основном от потенциала ее разряда, концентрации в растворе и скорости диффузии.
Катионы, более отрицательные, чем цинк — магний, натрий, калий, марганец — не
очень влияют на электроосаждение цинка, так как эти примеси не разряжаются на
катоде и не загрязняют цинк, но накопление таких катионов ведет к повышению
вязкости и удельного сопротивления электролита, вследствие чего увеличивается
напряжение на ванне и возрастает расход электроэнергии при электролитическом
выделении цинка.
Органические примеси можно разделит
на 2 группы: 1)Примеси, переходящие в электролит из деревянной аппаратуры,
фильтровальной ткани, смазочных материалов , сырья и реагентов , и 2)
поверхностно активные и коллоидные добавки.
Органические примеси первой группы
отрицательно влияют на процесс электролиза, присутствие их в электролите
снижает их выход по току и приводит к получению хрупких катодных осадков цинка.
4.2
Основные показатели процесса электролиза
Выход по току при электролитическом осаждении
цинка характеризует эффективность использования электрического тока в процессе
катодного восстановления цинка. Определяют выход по току как долю
электрического тока, затраченного на осаждение цинка, от количества прошедшего
через катод электричества:
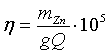
где η — выход по
току, %; mZn — масса
цинка, осажденного на ванне или серии ванн, кг; Q — количество электричества,
затраченного на электролиз на ванне или серии ванн за тот же период времени,
А·ч; g — электрохимический эквивалент цинка [g = l,22 г/(А·ч)].
Выход по току при электроосаждении
цинка зависит от концентрации цинка и серной кислоты в электролите, плотности
тока, температуры, загрязненности электролита примесями и состояния катодной
поверхности.
Повышение концентрации цинка в
электролите при постоянной концентрации H2SO4 повышает эффективность
использования электрического тока. Напротив, обеднение электролита цинком в
ходе электролиза приводит к снижению выхода по току, которое становится
особенно ощутимым при концентрации цинка ниже 50 г/л. Повышение концентрации серной
кислоты и ходе электролиза обусловит снижение выхода по току за счет
интенсификации реакции выделения водорода. Увеличение катодной плотности тока
повышает выход по току, несколько компенсируя влияние возрастания кислотности
электролита.
Эффективность использования
электроэнергии в процессе электролитического осаждения цинка оценивают по
расходу электроэнергии на 1 кг катодного цинка, который вычисляют по уравнению
,
где W — удельный расход
электроэнергии, кВт-ч/кг; U — напряжение на ванне, В; η — выход по
току, %; g — электрохимический эквивалент цинка [g=l,22 г/(А·ч)].
Повысить эффективность использования
электроэнергии, т. е. уменьшить удельный расход энергии, можно пустей снижения
напряжения на ванне и увеличения выхода по току.
Напряжение на ванне складывается из
следующих величин:
где Еа и Ек —
электродный потенциал анода и катода, В; Djа и Djк — анодная и
катодная поляризация, В; DUэл — потеря
напряжения в электролите, В; DUш — потеря
напряжения в шламовой корке, В; DUкон — падение
напряжения в металлических проводниках и контактах, В;
Примерное соотношение составляющих
напряжения на ванне в производственных условиях следующее, %: электродные
потенциалы и поляризация электродов 75 — 77; падение напряжения в электролите
15 — 17; в шламе на аноде 1 — 5, в контактах 1 — 2, в катодных штангах 0,5 — 4,
в анодных штангах 0,5 — 0,6. Как следует из приведенных данных, на напряжение
на ванне существенно влияет падение напряжения в электролите, которое зависит
от плотности тока, расстояния между анодом и катодом и удельного сопротивления
электролита.
Сближение электродов обеспечивает
снижение напряжения на ванне и удельного расхода электроэнергии. Поэтому
расстояние между электродами стремятся поддерживать минимальным. В настоящее
время в зависимости от конструкции ванны и условий электролиза расстояние между
осями одноименных электродов составляет 55 — 70 мм.
Повышение плотности тока
положительно влияет на выход по току, но напряжение на ванне при этом
увеличивается.
Характер зависимости удельного
расхода электроэнергии от плотности тока во многом определяется величиной
концентрации в электролите серной кислоты. Наименьшее значение удельного
расхода электроэнергии наблюдается при концентрации H2SO4
120 — 140 г/л. При меньшей кислотности электролита удельный расход
электроэнергии резко возрастает с повышением плотности тока, и минимальные
значения W достигаются только при низких плотностях тока.
Повышение температуры электролита
приводит к уменьшению U и η. Но если U изменяется монотонно, то
зависимость η
от
t имеет четко выраженный максимум при 36 — 38°С. В этом интервале температур
наблюдается минимум W.
Таким образом, для применяемых в
мировой практике плотностей тока i = 400 — 700 А/м2
оптимальная температура электролита составляет 35 — 38°С.
Однако влияние температуры
электролита на электроосаждение цинка нельзя рассматривать только с точки
зрения возможности снижения расхода электроэнергии. От температуры электролита
зависит чистота катодного осадка, срок эксплуатации свинцовых анодов и
алюминиевых катодов.
С повышением температуры возрастает
скорость коррозионного разрушения электродов, усиливается отрицательное влияние
примесей в электролите на катодное восстановление цинка, ослабляется действие
поверхностно-активных добавок и пенообразующих веществ, ухудшаются условия
труда в цехе и т. п. С этих позиций разогрев электролита в процессе электролиза
нельзя допускать выше 35 — 40°С. [1],[5]
4.3
Конструкция ванн и электродов
Ванны для электролиза цинка изготовляют из
дерева (Рисунок 4) или железобетона (Рисунок 3). Железобетонные ванны дороже и
сложнее в изготовлении, чем деревянные. Но меньшая утечка тока,
пожаростойкость, длительный срок службы (от 4 до 8 лет) обеспечивают им предпочтение.
Внутренние стенки ванны футеруют рольным
свинцом, полихлорвинилом или листовым винипластом. Сначала внутреннюю
поверхность стенок и днища ванны оклеивают рубероидом на битуме в два слоя, а
затем вставляют винипластовый вкладыш толщиной 8 мм. Из винипласта делают также
и обортовку ванн и сливные пробки.
Винипластовая футеровка, в отличие от свинца,
исключает возможность замыкания на корпус, но трудоемкость изготовления и
растрескивание при эксплуатации снижают ее достоинства. Лучше себя
зарекомендовала футеровка из полихлорвинила. Снаружи ванну окрашивают
кислотоупорной краской или битумом.
Корпус ванны устанавливают на железобетонную
раму, покоящуюся на столбах высотой 2 м. Ванна опирается на четыре изолятора из
стекла или фарфора.
Для отвода раствора ванны снабжены сливными
носиками, изготовленными из винипласта или свинца.
Днище ванны имеет отверстие для аварийного стока
электролита и смыва шлама.
В ванну внутренними размерами
(2,08-2,18)х(0,86-0,91)х(l,45-l,50) мм устанавливают 28 — 32 катода и 29 — 33
анода. Ванна рассчитана на I=15-20
кА. Число катодов и анодов зависит от размера ванны и от расстояния между
электродами. Расстояние между осями одноименных электродов на отечественных
заводах принято 58 — 60 мм, на большинстве зарубежных заводов 70 — 80 мм.
Аноды отливают из свинца чистотой 99,99 % с
добавкой 1 % серебра. Поверхность анода выполняют гладкой или рифленой.
Прокатанные аноды толщиной 5 мм в 2 — 3 раза жестче, чем литые толщиной 8 мм, а
срок службы их в 2 раза больше.
Анодные штанги делают из медной освинцованной
шины и приваривают к анодному полотну водородной сваркой. На края анодов
укрепляют ограничители из дерева, прессованного стекла или винипласта. Эти
ограничители упираются в края катода, фиксируют положение электродов,
предупреждая короткие замыкания, улучшают условия циркуляции электролита.
Катоды изготовляют из холоднокатаного
алюминиевого листа толщиной 3 — 4 мм. Для уменьшения дендритообразования на
краях катоды делают на 20 — 25 мм шире и длиннее анодов. На края катодов для
предупреждения осаждения на них цинка надевают деревянные или резиновые рейки.
Катодный лист приваривают к алюминиевой штанге, на одном конце которой
прикрепляют или приваривают медный контакт.
Ванны располагают в здании цеха рядами по 20 —
30 ванн. Между рядами ванн имеются проходы для обслуживания.
Приняты две основные схемы компоновки и ошиновки
ванн. Схема I предусматривает
стыковку ванн длинными торцами. В этом случае ток подводится к двум крайним
(головным) ваннам ряда. Внутри ряда от ванны к ванне ток передается через
промежуточные ходам. Кроме того, при выемке катодов для сдирки цинка контакты
загрязняются стекающим с катодов электролитом. По схеме II
ванны компонуют сдвоенными рядами. По внешним бортам сдвоенных ванн проложены
токоведущие шины, на которые опираются аноды одной ванны и катоды другой. На
средней разделительной стенке уложена промежуточная шина, на которую также
опираются контактные концы анодов одной ванны и катодов другой. Схема II
удобна для обслуживания каждой ячейки всех ванн с проходов, позволяет
механизировать выемку и транспортировку катодов и анодов. Вынос контактов
легкие шины, уложенные на длинных сторонах ванн. Контакт осуществляют
постановкой штанг анодов и катодов на шину или друг на друга.
Схема I
по, сравнению со схемой II
требует меньшего расхода меди для токонесущих шин, но создает неудобства в
обслуживании ванн, обращенных торцами к про
за габариты ряда предотвращает смачивание
контактов электролитом, стекающим с катодов при их транспортировке вдоль ряда.
Для вновь построенных в последнее время
предприятий принимают схему II.[1],[5]
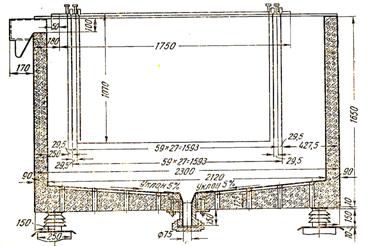
Рисунок 3 Ванна из железобетона для
электролитического осаждения цинка
Рисунок 4 Продольный разрез блока деревянных ванн
для электроосаждения цинка
4.4
Циркуляция и охлаждение электролита
В процессе электролиза раствора сульфата цинка
выделяется значительное количество тепла. При катодной плотности тока 600 А/м2
и осаждении из 1 л раствора 100 г цинка выделившееся тепло может повысить
температуру электролита на 70°С.
Охлаждение цинкового электролита вне ванн
(централизованное) или непосредственно в ваннах (индивидуальное) позволяет
поддерживать его температуру в допустимых пределах. В настоящее время на всех
заводах она составляет 33 — 38° С.
Охлаждение непосредственно в ванне позволяет
непрерывно отводить тепло и иметь скорость циркуляции электролита,
соответствующую осаждению из 1 л раствора 100 г цинка («однократная
циркуляция»). Централизованное охлаждение требует многократной циркуляции
электролита в системе ванна-охладитель. Кратность циркуляции определяется
перепадом температуры
в холодильной установке (при перепаде
температуры 20°С требуется пятикратная циркуляция, при перепаде 10°С —
двадцатикратная). Для приближенного определения оптимальной кратности
циркуляции электролита можно воспользоваться следующим соотношением:
n = iк/100, (304)
где n
— кратность циркуляции (отношение фактической скорости циркуляции электролита к
скорости «однократной циркуляции»); iк — катодная плотность тока,
А/м2.
По способу циркуляции электролита цинковые
заводы можно разделить на три группы. На заводах первой группы ванны
располагают каскадом, перелив каждой ванны идет в следующую. Слив последней
ванны каскада представляет собой отработанный электролит, направляемый на
выщелачивание. Нейтральный раствор подают во все ванны каскада. Скорость
циркуляции электролита в верхних ваннах минимальна и возрастает к концу
каскада.
На заводах второй группы ванны располагают на
одном уровне, и нейтральный раствор подают в каждую ванну индивидуально. С
каждой ванны получают отработанный электролит. В обоих случаях охлаждение
электролита осуществляют змеевиками, установленными в ваннах.
На заводах третьей группы ванны располагают на
одном уровне, а электролит циркулирует через ванны и охладительную установку
многократно. Такую систему циркуляции применяют в том случае, когда при
электролизе выделяется тепла больше, чем можно отвести через змеевики в
электролизных ваннах.
Выбор системы циркуляции зависит от режима
электролиза. При плотности тока 400 — 550 А/м2 достаточно
однократного прохождения раствора через ванны. Если в ванны подают охлажденный
нейтральный раствор, то охлаждение электролита можно обеспечить с помощью
змеевиков в ваннах в сочетании с централизованным охлаждением или без него. При
плотности тока 700 — 1000 А/м2 приходится прибегать к
централизованному охлаждению и интенсивной и многократной циркуляции
электролита через ванны.
Охлаждающие змеевики изготовляют из свинцовых
или алюминиевых труб и устанавливают в ванне у одного из коротких торцов.
Алюминиевые змеевики эффективнее свинцовых, но требуют очистки электролита от
фторид-иона (35 — 50 мг/л) и хлорид-иона (200 — 250 мг/л). Змеевики обрастают
снаружи сульфатом цинка и шламом, а внутри них откладывается соль. Поэтому
теплопроводность их уменьшается со временем. В связи с этим змеевики
периодически вынимают из ванн и очищают.
Охлаждающую воду подводят и отводят от змеевика
через резиновые шланги во избежание утечки тока. Так как для производства 1 т
катодного цинка расходуется до 550 м3 воды, то часто возникает
необходимость применения вакуумно-испарительного охлаждения. В
вакуум-испарительной установке раствор охлаждается за счет интенсивного
испарения воды при пониженном давлении. Разрежение в испарителе обеспечивают с
помощью пароструйных эжекторов. В сопло эжектора подают водяной пар со
скоростью 750 — 1000 м/с. При этом газовая фаза из испарителя увлекается и
отводится в конденсатор.
«Горячий» электролит засасывается в испаритель первой
ступени, где поддерживается остаточное давление 5,3 кПа. За счет испарения воды
температура электролита снижается до 34°С. Далее электролит поступает в
испаритель второй ступени (остаточное давление 4 кПа), где охлаждается до 29°С.
В третьей ступени (остаточное давление 2,7 кПа) электролит охлаждается до 25 —
26°С и направляется на циркуляцию.
При централизованной системе охлаждения
электролита весь цех электролиза работает практически как одна ванна и вся
регулировка параметров процесса (температуры, кислотности, содержания цинка в
растворе) осуществляется с одного пульта. Кроме того, высокие скорости
циркуляции электролита в ваннах при централизованной системе охлаждения
способствуют улучшению технологических и экономических показателей электроосаждения
цинка.
Внутри ванны электролит перемешивается благодаря
перепаду температур по высоте ванны, изменению плотности раствора и выделению
газообразного кислорода и водорода в ходе электролиза. Перемешиванию
электролита в межэлектродном пространстве способствуют ограничители-изоляторы
на анодах, которые, соприкасаясь с ограничительными рейками на катодах,
образуют между электродами замкнутое пространство, открытое сверху и снизу.
Электролит, заполняющий пространство между
электродами, нагревается за счет выделения джоулева тепла и теплоты
экзотермических электродных реакций, плотность его становится меньше, чем у
остального электролита. Плотность электролита в межэлектродном пространстве
снижается также за счет интенсивного газовыделения на электродах. Нагретый и
газонасыщенный электролит вытесняется более плотным и холодным. При этом
образуется восходящий поток. 1 — Вблизи поверхности электролит движется к краям
1 ванны, постепенно освобождаясь от газа и смешиваясь с более холодным
электролитом. В пространстве между краями электродов и стенкой ванны плотность
электролита больше, чем между электродами, и он опускается На дно ванны.
Возникает довольно интенсивная круговая циркуляция электролита в каждом
межэлектродном пространстве, способствующая выравниванию концентрации цинка и
серной кислоты. Изменение концентрации цинка и серной кислоты по высоте ячейки
от 1 Нижнего края электродов до поверхности незначительно. По длине ванны
концентрация цинка постепенно уменьшается, а концентрация серной кислоты
возрастает. Разница концентраций в начале и конце ванны сокращается при
увеличении кратности циркуляции электролита.[1]
4.5
Обслуживание процесса электролиза
О ходе процесса электроосаждения судят по
составу и температуре электролита. Концентрацию в электролите цинка
контролируют по плотности раствора, определяемой с помощью ареометра.
Концентрацию кислоты определяют методом измерения удельного сопротивления
электролита или рассчитывают по разности концентрации цинка в нейтральном и
отработанном электролите.
Один раз в сутки катоды вынимают из ванн с
помощью подъемников и на специальных площадках производят сдирку катодного
осадка с алюминиевой матрицы. Для этого рабочий ударом зубила, направленного
под осадок в верхней части катода, отделяет металл и сдирает его, площадки для
сдирки катодного осадка лучше оборудовать в торце цеха, куда катоды доставляют
тельфером. Однако на многих заводах сдирку производят рядом с ваннами на столах
или на площадках, передвигающихся над ваннами по монорельсам.
Одновременно вынимают из ванны 5 — 10 катодов, а
на место вынутых ставят новые, либо во время сдирки осадков ванна работает на
повышенной плотности тока.
Снятый с катодов цинк складывают на электрокару
и отвозят в плавильное отделение, а алюминиевые катоды после осмотра и зачистки
контактов вновь завешивают в ванны.
Иногда съем цинка бывает затруднен в результате
резкого возрастания сцепления осадков с алюминиевыми матрицами. Возникновение
«трудной сдирки» объясняется нарушением пленки оксида алюминия на поверхности
матрицы в результате коррозии или механического повреждения. Основной причиной
явления «трудной сдирки» считают накопление в растворе фторид-иона выше
критической для данного процесса концентрации. В ряде случаев затруднения со
сдиркой начинаются при содержании фторид-иона в электролите свыше 30 мг/л.
Для предупреждения «трудной сдирки» алюминиевые
матрицы перед установкой в ванны выдерживают несколько минут в отработанном
электролите. На отечественных заводах для облегчения сдирки вводят в ванну
растворимую соль сурьмы. Концентрация сурьмы 0,2 — 0,3 мг/л в электролите в
момент образования первого слоя цинка на алюминиевой матрице обеспечивает
получение прилегающего к матрице слоя катодного цинка со структурой кристаллов,
не плотно сцепленных с матрицей.
В настоящее время на цинкэлектролитных заводах
начинают применять механическую сдирку катодов на катодосдирочных машинах.
Очистку ванн и анодов от шлама производят
периодически в зависимости от содержания в электролите марганца, плотности тока
и состояния поверхности анодов. На большинстве заводов ее производят через 20 —
30 дней. Для откачки шлама вынимают катоды и отключают ванну. При непрерывном
перемешивании электролита сжатым воздухом откачивают пульпу кислотостойким
насосом. Откачка идет 4 — 8 мин. В некоторых случаях пульпу выпускают из ванны
через донный штуцер в сборный зумпф. Шламовую пульпу перекачивают на
выщелачивание огарка, используя его в качестве окислителя железа.[1]
4.6
Интенсификация электролиза цинка
Производительность цинкового завода по готовой
продукции пропорциональна произведению плотности тока на выход по току: iкη.
Поэтому
интенсификация электролитического осаждения цинка сопряжена с увеличением
плотности тока в ячейке. При этом в центре внимания остается катодная плотность
тока, так как от нее зависят качество катодного цинка и условия электролиза.
Однако повышение катодной плотности тока, а также производительности завода
неизбежно сопровождается увеличением эксплуатационных затрат на производство
цинка и себестоимости производства 1 т чушкового цинка. Повышение катодной
плотности тока при электролизе выгодно до тех пор, пока, несмотря на увеличение
себестоимости, общая прибыль и другие экономические показатели завода
возрастают.
Оптимальное условие электроосаждения цинка может
быть выражено формулой S/(iкη)àmin,
Для каждого завода с учетом местных условий
зависимость S от iк
имеет минимум при оптимальном значении катодной плотности тока, которое для
разных заводов может не совпадать.
Расчетная экономическая плотность тока
составляет 700-800 А/м2. Отечественные заводы постепенно
интенсифицируют электроосаждение цинка, повышая плотность тока. В настоящее
время iк
= 550-7-650 А/м2.
Значительное повышение плотности тока против
оптимального значения (700-800 А/м2) потребует увеличения
токоподводящих шин, контактов электродов, что сопряжено с реконструкцией
системы электроснабжения. Поэтому производительность электролизеров стремятся
повысить еще и за счет повышения выхода по току. Это достигают более тщательной
очисткой электролита от примесей, улучшением системы охлаждения электролита,
применением реверсивного или прерывистого электрического тока. В обычных
условиях электроосаждения цинка наращивание катодного осадка происходит при
постоянном токе, неизменном как по величине, так и по направлению. При этом
скачок потенциала между цинковым катодом и раствором, обусловливающий
электроосаждение цинка, равен сумме равновесного потенциала цинкового электрода
(jZn)
и перенапряжения выделения цинка (Djк<0),
соответствующего заданной плотности тока (iк):
jк =jZn
+Djк.
В случае электролиза на прерывистом токе,
периодически на короткое время ванну отключают от питания электрическим током.
На рис. 99, б показана схема изменения тока, проходящего через катод, и
потенциала катода. При отключенном токе цинковый катод и электролит образуют
гальванический элемент, в котором цинковый электрод становится анодом, а
водородный электрод — катодом: Zn|ZnSO4||H2SO4|H2.
ЭДС этого короткозамкнутого гальванического элемента обусловит протекание в
системе катод — раствор электрического тока, сопровождающегося растворением
цинка и выделением водорода:
E=jH2
— jZn
ЭДС максимальна в начальный момент, когда ток
растворения цинка близок к нулю. По мере возрастания тока э. д. с. уменьшается.
В случае электролиза на реверсивном токе периодически на короткое время
переключают полярность электродов в ванне. Какую-то часть времени (1/30- 1/200)
свинцовый анод функционирует как катод, а цинковый катод — как анод. Скачок
потенциала между цинковым анодом и электролитом при этом равен сумме
равновесного электродного потенциала цинка в.растворе данного состава (фгп) и
перенапряжения анодного растворения цинка (Djа
>0) при заданной плотности тока:
jа = jZn
+Djа.
Таким образом, как в случае с реверсированием
тока, так и в случае его прерывания, цинковый катод подвергается периодически
электрохимическому растворению. Так как в первую очередь растворяются Активные
участки поверхности и дендриты, то устраняются условия для роста уже образовавшихся
центров кристаллизации и возникают новые центры кристаллизации. В результате
катодный осадок приобретает мелкокристаллическую структуру, становится плотным
и гладким. Возрастает истинная плотность тока на катоде и повышается выход по
току. Это позволяет увеличить продолжительность наращивания осадка, сократить
число операций сдирки.
При двух — шести переключениях тока в минуту
замена постоянного тока реверсивным позволяет на 25 — 30 % интенсифицировать
электроосаждение цинка. Однако при этом существенно возрастает удельный расход
электроэнергии (в анодный период электроэнергия на катоде расходуется не для
осаждения цинка, а для его растворения).
Чередование при реверсивном токе катодной
активации и анодной пассивации свинцового анода приводит к повышенному
коррозионному разрушению анодов и, как следствие, к увеличению загрязнения
катодного осадка свинцом и другими примесями. Возникают особые требования к
чистоте электролита и электродов. В связи с этим представляет интерес
электроосаждение цинка прерывистым током, при котором на аноде в период
бестоковой паузы не происходят никакие электрохимические реакции.
Электролиз с применением прерывистого тока был
испытан в полупромышленных условиях на Лениногорском цинковом заводе. Испытания
показали, что катодные осадки цинка получаются мелкокристаллическими с очень
гладкой поверхностью, благодаря чему при электролизе поддерживается высокая
истинная плотность тока. Последнее повышает перенапряжение выделения водорода и
уменьшает коррозию на катоде цинка, в результате чего выход цинка по току
возрастает. Одновременно за счет уменьшения среднего значения анодного
потенциала снижаются напряжение на ванне и расход электроэнергии.
Результаты испытаний свидетельствуют о
перспективности интенсификации электролиза цинка с применением прерывистого
тока .[1], [5]
5.
Практическая часть
Производительность электролизного цеха 180000 т
чушкового цинка в год, число рабочих дней в году 365, среднее число рабочих
часов для электролизной ванны 23,5 (коэффициент машинного времени ванны 98%),
выход цинка по току 93%, угар и переход в дросс при переплавке катодного
металла 4%. На приготовление цинковой пыли, используемой для очистки растворов,
расходуется 5% чушкового цинка. Катодная плотность тока 600 А/м2.
Состав отработанного электролита, г/л: 50 Zn;
150 H2SO4.
Температура электролита 35 ºС,
температура окружающей среды в цехе 25 ºС,
температура наружных стен ванны 30 ºС.
Определение размеров и числа
электродов в ванне, силы тока на ванне и количества ванн в цехе
Зная суммарную величину потерь цинка и
количество металла, затрачиваемое на изготовление цинковой пыли, находим, что
общее количество катодного цинка должно быть на 4+5=9 % больше количества
чушкового металла. Тогда годовая производительность цеха по катодному цинку
составит, т/год:
·1,09=196200,
а суточная, т/сут:
:365=537,5
Суммарная поверхность катодов в цехе определяем
по уравнению
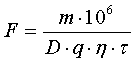
где m — суточная
производительность цеха по катодному цинку, т; D — катодная
плотность тока, А/м2; q — электрохимический эквивалент
цинка, q=1,219
г/(А·ч); η
— выход
цинка по току, η=0,93;
τ — продолжительность
работы ванны в сут/ч.
Подставляя известные данные в
уравнение, будем иметь, м2:
F=537,5·106:(600·1,219·0,93·23,5)=3,73·104
м2.
Определим размеры катода. Катоды
изготавливают из алюминиевого листа размером 1000x666x6 мм. На
края катода помещают резиновые рейки для уменьшения дендритообразования и
облегчения съема осадка цинка. Рейки уменьшают рабочую ширину катода на 10 мм с
каждой стороны. При коэффициенте заполнения ванны электролитом, равном 0,85 —
0,90, катод погружается на глубину 0,86 м, тогда рабочая поверхность одного
катода (с двух сторон), м2:
fк =
0,86·0,646·2=1,11.
Общее число катодов в цехе равно,
шт.:
,73·104:1,11=33661
(округленно 33660 шт.)
На основании опыта работы
отечественных и зарубежных цинковых заводов принимаем силу тока на электролизной
ванне равной 16000 А. Тогда суммарную рабочую поверхность катодов в одной ванне
определим из соотношения, м2:
f=J:D=16000:600=26,6
Зная суммарную поверхность катодов в
ванне и поверхность одного электрода, находим число катодов в ванне, шт.:
nк=f:fк=26,6:1,11=24.
Определяем число анодов, шт.:
nа=nк+1=24+1=25.
Находим число постоянно работающих
ванн в цехе, шт:
Nр=33660:24=1403.
Так как часть ванн постоянно
находится на ремонте и на очистке от шлама, то общее число ванн в цехе должно
быть увеличено с учетом резерва. Принимая амортизационный период ванны 10 лет,
находим общее число ванн в цехе, шт:
Nобщ=1403·(1+1:10)=1543,
или округленно, с учетом удобства
расположения ванн в цехе, 1544.
Определение линейных размеров
электролизной ванны
Внутреннюю длину ванны можно
рассчитать по формуле:
,
Где na —
количество анодов в ванне; δa — толщина
анода, δa=8 мм; nк — число
катодов в ванне; δк — толщина
катода, δк=6 мм; l —
расстояния от крайних анодов до торцевых стенок ванны, обычно k1=k2=200 мм.
Подставляя известные величины, будем
иметь, мм:
L=25·8+24·6+2·24+200+200=1848.
Внутреннюю высоту ванны определим по
уравнению
H=hк+δ,
Где hк — высота
катода, мм; δ —
расстояние от нижней кромки катода до дна ванны, δ=400 мм.
H=1000+400=1400
мм.
Внешние размеры ванны находим путем
сложения соответствующего внутреннего размера с толщиной стенок или дна.
Принимаем толщину торцевых стенок δт=90 мм,
боковых стенок δб=120 мм и
дна δд=100 мм.
Тогда внешняя длина ванны составит, мм
L=L+2δт=1848=2·90=2028.
Внешняя ширина ванны составит, мм:
В=В+2δб=870+2·120=1110.
Внешняя высота ванны составит, мм:
H=H+δд=1400+100=1500.
Определяем внутренний объем ванны, м3:
V=L·B·H=1848·870·1400=2250864000
мм3=2,25.
Ванна заполняется электролитом
примерно на 85 — 90% своего внутреннего объема. Следовательно, объем ванны,
заполненный электродами и электролитом, составит, м3:
V=0,9·V=0,9·2,25=2,025.
Определение состава нейтрального
электролита и скорости подачи нейтрального раствора в ванну
Во время электролиза расходуется
сернокислый цинк, а в электролите образуется эквивалентное количество серной
кислоты. Следовательно, зная содержание цинка и серной кислоты в отработанном
электролите, можно найти концентрацию цинка в нейтральном растворе по уравнению
(CZn)нейтр=(CZn)отр+(СH2SO4)отр·65,4:98.
Так как (CZn)отр=50г/л,
а (СH2SO4)отр=150
г/л, то
(CZn)нейтр=50+150·65,4:98=150г/л.
Количество нейтрального раствора,
подаваемого в ванну в течение одного часа определим по уравнению, л/ч

На все работающие ванны цеха (1403
шт) необходимо подавать в течение одного часа нейтрального раствора в
количестве, м3/ч:
·1403=253943 л/ч=254.
В сутки требуется нейтрального
электролита, м3/сут:
Расчет электрического баланса ванны
Определение величины напряжения на
электролизной ванне.
Напряжение на ванне Uв
описывается уравнением
Uв=jр(а)- jр(к)+( Djа-Djк)+D·r·l+J·r,
где jр(а) и jр(к)
— равновесные потенциалы анода и катода, В;
Djа
и Djк — анодная
и катодная поляризация, В; D — катодная плотность тока, А/см2; r — удельное
сопротивление электролита, Ом·см; l —
расстояние между катодом и анодом, см; r — суммарное
падение напряжения в контактах, шламе, шинах и электродах, В.
Определение величины равновесного
потенциала анода и анодной поляризации. При электролизе на свинцовом аноде
выделяется кислород, равновесный потенциал этого процесса будет описываться
уравнением Нернста:
,
где jо2=0,411 В; R=8,315 Дж;
Т=273+35=308 К; F=96500 Кл.
Рассчитаем активность гидроксил
ионов в электролите, содержащем 150 г/ серной кислоты и 50 г/л цинка.
Концентрация ионов водорода в таком
растворе составляет Cн=150·2:98,05=3,06 г-ион/л, а
концентрация гидроксил-ионов — Сон=Kw:Сн, где Kw — ионное
произведение воды при 35 ºС, Kw=3·10-14
г-ион/л.
Тогда Сон=3·10-14:3,06=0,9810-14
г-ион/л.
Коэффициент активности гидроксил
ионов в указанном растворе равен 0,75. Тогда равновесный потенциал кислородного
электрода (анода) составит, В:
jр(а)=0,411-2,303·8,315·308:96500·lg(0,75·0,98·10-14)=1,273.
Величина анодной поляризации Djа при плотности тока 600 А/м2
составляет 0,75 В. Следовательно, потенциал анода под током, В:
jа=jр(а)+ Djа=1,273+0,75=2,023.
Определение величины равновесного
потенциала катода и катодной поляризации. При электролизе алюминиевый катод
покрыт слоем цинка, поэтому равновесный потенциал катода равен равновесному
потенциалу цинкового электрода в электролите указанного состава при температуре
35 ºС:
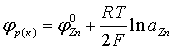
Концентрация ионов цинка в
электролите, содержащем 50г/л цинка и 150 г/л серной кислоты, составит,
г-моль/л:
CZn=50:65,37=0,764.
Коэффициент активности ионов цинка в
указанном растворе составит 0,5. Тогда равновесный потенциал цинкового
электрода (катода), В:
jр(к)=-0,763+2,303·8,315·308:(2·96500)·lg(0,5·0,764)=-0,775.
Учитывая, что катодная поляризация
цинкового электрода имеет небольшую величину (Djк=0,01-0,02
В), потенциал катода под током составит, В:
jк=jр(к)— Djк=-0,775·0,02=-0,795.
Напряжение разложения Енр
сернокислого цинка составит, В:
ЕНРjр(а)- jр(к)=1,273+0,775=2,048,
а разность потенциалов анода и
катода под током, В:
jа-jк=2,023+0,759=2,818.
Определение удельного сопротивления
электролита.
Электролит такого состава при
температуре 35 ºС имеет
удельное сопротивление ρ=2,32
Ом-см
По методу Скворовского учтем влияние
содержащихся в электролите примесей марганца и магния на удельное сопротивление
раствора. Примем, что влияние марганца аналогично влиянию железа, а для магния
будем считать, что 1 г/л магния повышает процентное сопротивление раствора на
2,1 %. Поправка на марганец ПMn=100+2,1·5=110,5
%.
Удельное сопротивление электролита с
учетом указанных поправок составит, Ом·см:
ρ=2,32·108·110,5:(100·100)=2,77.
Учитывая, что в электролите имеется
также кремнекислота, кальций и соли щелочных металлов, увеличиваем удельное
сопротивление на 20 %:
ρ=2,77·1,2=3,32 Ом·см.
Теперь рассчитаем падение напряжения
в электролите по формуле, В:
DUэл=D·ρ·l=600·104·3,32·2,3=0,458.
Определение падения напряжения в
шламе, в электродах, в контактных шинах. Падение напряжения в шламе (на аноде
образуется шлам, состоящий из диоксида марганца) можно принять 30 % от падения
напряжения в электролите, тогда DUшл=0,458·0,3=0,138
В. По данным практики, падение напряжения на аноде равно 0,02 В, в контактах —
0,03 В. Падение напряжения в катодных штангах составляет 0,02 В, в бортовых
шинах — 0,03 В. Таким образом, суммарное падение напряжения в шламе,
электродах, контактах и шинах составляет, В:
J·r=0,138+0,02+0,03+0,02+0,03=0,238.
Общее напряжение на ванне, В:
Uв=jр(а)+ Djа(jр(к)+ Djк )+D·ρ·l+J·r=2,818+0,458+0,238=3,514.
Электрический баланс сведен в
таблице *.1
Таблица 5.1 — Баланс напряжения на
ванне электролиза цинка
|
Составляющие |
Количество |
|
|
В |
% |
|
|
Равновесный |
1,273 |
36,12 |
Определение удельного расхода
электроэнергии
В цехе постоянно работает 1403 ванны. Напряжение
на одной ванне 3,5 В. Если все ванны соединить между собой, то общее напряжение
в электрической сети составит, В:
,5·1403=4910.
Исходя из требований техники безопасности,
максимальное напряжение в цепи последовательно соединенных ванн не должно
превышать 600-700 В. Следовательно, в цехе необходимо иметь 8 цепей ванн, с
общим количеством ванн в каждой серии, шт:
:8=176.
Напряжение на серии ванн составит, В:
,5·176=617,
сила тока в сети равна 16000 А.
Определяем удельный расход электроэнергии на 1 т
катодного цинка.
Расход электроэнергии за сутки составит, кВт·ч/т:
·617·8·24:1000=1895500.
Суточная производительность по катодному цинку
составляет 597 т. Тогда удельный расход электрической энергии будет равен,
кВт·ч/т:
:597=3175.
Зная напряжение на ванне, величину напряжения
разложения сульфата цинка и выход по току, можно рассчитать коэффициент
электроэнергии, используемый при электролизе по уравнению, %:
B=Eнр·h:Uв=2,048·93:3,5=65,8.
Расчет теплового баланса ванны
Рассчитаем тепловой баланс одной ванны за один
час.
Приход тепла.
Количество джоулева тепла можно рассчитать по
формуле, кДж/ч:
q1=J(Uв-DUкш-DUконт-DUш)·3600:1000=197800.
Расход тепла.
Потери тепла с отработанным электролитом (q3)
не рассчитываем, так как q3=q2.
Потери тепла с испаряющей водой с поверхности
электролита (q4)
находим по формуле, кДж/ч:
q4=λ·mH2O·F,
где λ
— скрытая теплота испарения 1 кг воды при заданной температуре, кДж/кг; mH2O
— масса испаряющей воды с 1 м2 поверхности электролита в час при
заданной температуре, кг/м2·ч; F
— площадь свободной поверхности электролита в ванне (зеркало электролита), м2.
Скрытую теплоту испарения λ
находим по уравнению, кДж/кг:
λ=( λ0-tэл)·4,184,
где λ0
— скрытая теплота испарения 1 кг воды при стандартных условиях, λ0=618
ккал/кг; tэл
— температура электролита в ванне, ºС;
4,184 — коэффициент пересчета ккал в кДж:
λ=(618-35)·4,184=2439,27.
Массу воды находим по таблице. mH2O=0,65.
Площадь свободной поверхности электролита в
ванне рассчитываем исходя из размеров электролизной ванны и размеров и
количества электродов, установленных в одной ванне.
Длина ванны составляет 1848 мм, ширина — 870 мм.
В ванне находится 24 катода и 25 анодов. Ширина анода по данным практики
составляет 645 мм, толщина анода — 8 мм. Ширина катода равна 666 мм, толщина
катода — 6 мм. Тогда свободная поверхность электролита в ванне составит, м2:
F=(1,848·0,87)-(0,645·0,008·25+0,666·0,006·24)=1,383.
Находим количество тепла, теряемое ванной за
счет испарения воды с зеркала электролита, кДж/ч:
q4=2439,27·0,65·1,383=2192,78.
Потери тепла зеркалом электролита вследствие
лучеиспускания и конвекции находим по формуле Фурье, кДж/ч:
q5=K·F·(tэл-tок.ср),
где tок.ср
— температура окружающей среды, ºС;
K — коэффициент
теплоотдачи, кДж/м2·ч·град, определяется по формуле Стефана-Больцмана:
Для зеркала электролита С=3,2, tэл=35 ºС, tок.ср=20 ºС, тогда,
кДж/м2·ч·град:
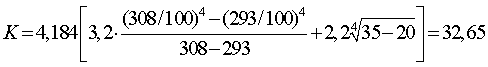
Подставляя данные получим потери
тепла лучеиспусканием, кДж/ч:
q5=32,65·1,383·(35-20)=677,43.
Потери тепла железобетонной
поверхностью ванны в окружающую среду определим также по формуле Фурье, кДж/ч:
q6=K’·F’·(tст-tок.ср),
где tст —
температура железобетонных стен электролизной ванны, tст=30ºС;
F’ — площадь
боковых и торцевых стен ванны и её днища, м2; K’ —
коэффициент теплоотдачи железобетонных стен ванны, кДж/м2·ч·град.
Для железобетонной поверхности C’=4, тогда,
кДж/м2·ч·град:
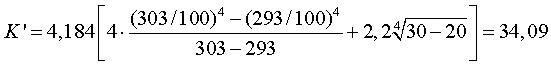
Площадь F’ определим
исходя из габаритов ванны
F’=2(2,028·1,5+1,11·1,5)+2,028·1,11=11,66м2,
q6=34,09·11,66·(30-20)=3974,9
кДж/ч.
Потери тепла с разбрызгиванием
электролита определяем по формуле, кДж/ч:
q7=F·mэл·сэл·tл,
где mэл — масса
раствора, теряющаяся с разбрызгиванием электролита с 1 м2 зеркала
ванны в течение 1 ч, по данным практики mэл=0,3 кг/м2·ч;
сэл — удельная теплоемкость электролита, сэл=3,26
кДж/кг·град.
Тогда, кДж/ч:
q7=1,383·0,3·3,36·35=43,34.
Расход тела, связанный с протеканием
химической реакции при электролизе рассчитываем по формуле, кДж/ч:
q8=DH·mZn·103·M,
где M — молекулярная
масса цинка, M=65,37; mZn — масса
цинка, полученная в одной ванне за 1 ч, кг/ч; DH — тепловой эффект химической
реакции, при t=25 ºС DH=-452,16
кДж/моль. Для температуры электролита 35 ºС принимаем приближенное
значение DH=-452
кДж/моль.
Для определения mZn необходимо
суточную производительность цеха разделить на количество ванн, установленных в
цехе и разделить на количество часов в сутках:
mZn=597000:(24·1403)=17,72
кг/ч,
q8=452·17,56·103:65,37=121418,39
кДж/ч.
Результаты расчета статей прихода и
расхода тепла сводим в таблицу 5.2.
Разность между приходом и расходом
тепла составит, кДж/ч:
Dq=Qприх-Qрасх=(q1+q2)-(q3+q4+q5+q6+q7+q8)=197800-(2192,78+677,43+3974,9+43,34+121418,39)=
69493,16
Таблица 5.2 — Тепловой баланс ванны
электролиза раствора сульфата цинка
|
Приход |
Расход |
||||
|
Статьи |
количество |
Статьи |
количество |
||
|
кДж/ч |
% |
кДж/ч |
% |
||
|
Джоулево |
197800 |
100 |
Тепло |
— |
— |
|
Итого |
197800 |
100 |
Итого |
197800 |
100 Циркуляция раствора должна обеспечивать отвод Используя уравнение, кДж/ч: Dq=υц·ρ·с·(tэл-tохл), где υц Примем температуру охлажденного электролита,
Эта величина в 6,29 раза превышает Зная скорость циркуляции, содержание
Таким образом, при централизованном Суммарная скорость циркуляции (υц)=1403·υц=1403·1138,7=1597596,1 Скорость циркуляции электролита на (υц)с=(υц):8=1597,6:8=199,7м3/ч=200. Список 1 Расчеты 3 Интернет Металлургия Похожие работы на — Расчет процесса электролиза цинка из сульфатного раствора
Другие курсовые работы по химии Не нашли материал для своей работы?
Поможем написать уникальную работу Узнайте © 2003 — 2022 «Библиофонд» Обратная связь Пользовательское соглашение Политика конфиденциальности Полная версия Помощь по учебным работам Консультация по курсовой работе Консультация по дипломной работе ВКР Консультация по реферату Консультация по отчетам о практике |
СХЕМА РАБОТЫ ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА И ТИПОВЫЕ ЗАДАЧИ
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.
Возникает так называемый двойной электрический слой.
Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn 2+ . Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu 2+ из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO4 2- и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):
Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):
Катионы меди Cu 2+ , пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:
Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Источник
Как найти напряжение гальванического элемента
Для гальванического элемента принята следующая форма записи (на примере элемента Даниэля):
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || — солевой мостик. Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Гальванический элемент принято записывать так, чтобы анод находился слева.
Электродные полуреакции принято записывать как реакции восстановления (таблица 12.1), поэтому общая реакция в гальваническом элементе записывается как разность между реакциями на правом и левом электродах:
Правый электрод: Cu 2+ + 2e = Cu
Левый электрод: Zn 2+ + 2e = Zn
Общая реакция: Cu 2+ + Zn = Cu + Zn 2+
Потенциал E электрода рассчитывается по формуле Нернста:
где aOx и aRed — активности окисленной и восстановленной форм вещества, участвующего в полуреакции; E o — стандартный потенциал электрода (при aOx = aRed =1); n — число электронов, участвующих в полуреакции; R — газовая постоянная; T — абсолютная температура; F — постоянная Фарадея. При 25 o C
Стандартные электродные потенциалы электродов измеряются относительно стандартного водородного электрода, потенциал которого принят равным нулю. Значения некоторых стандартных электродных потенциалов приведены в таблице 12.1.
Электродвижущая сила (ЭДС) элемента равна разности потенциалов правого и левого электродов:
Если ЭДС элемента положительна, то реакция (так, как она записана в элементе) протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция.
Стандартная ЭДС равна разности стандартных потенциалов:
Для элемента Даниэля стандартная ЭДС равна
E o = E o (Cu 2+ /Cu) — E o (Zn 2+ /Zn) = +0.337 — (-0.763) = +1.100 В.
ЭДС элемента связана с 

Зная стандартную ЭДС, можно рассчитать константу равновесия протекающей в элементе реакции:
Константа равновесия реакции, протекающей в элементе Даниэля, равна
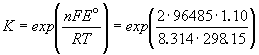
Зная температурный коэффициент ЭДС 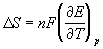




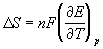
Таблица 12.1. Стандартные электродные потенциалы при 25 o С.
E o , В Li + /Li Li + + e = Li -3.045 K + /K K + + e = K -2.925 Ba 2+ /Ba Ba 2+ + 2e = Ba -2.906 Ca 2+ /Ca Ca 2+ + 2e = Ca -2.866 Na + /Na Na + + e = Na -2.714 La 3+ /La La 3+ + 3e = La -2.522 Mg 2+ /Mg Mg 2+ + 2e = Mg -2.363 Be 2+ /Be Be 2+ + 2e = Be -1.847 A1 3+ /A1 Al 3+ + 3e = Al -1.662 Ti 2+ /Ti Ti 2+ + 2e = Ti -1.628 Zr 4+ /Zr Zr 4+ + 4e = Zr -1.529 V 2+ /V V 2+ + 2e = V -1.186 Mn 2+ /Mn Mn 2+ + 2e = Mn -1.180 WO4 2- /W WO4 2- + 4H2O + 6e = W + 8OH — -1.05 Se 2- /Se Se + 2e = Se 2- -0.77 Zn 2+ /Zn Zn 2+ + 2e = Zn -0.763 Cr 3+ /Cr Cr 3+ + 3e = Cr -0.744 Ga 3+ /Ga Ga 3+ + 3e = Ga -0.529 S 2- /S S + 2e = S 2- -0.51 Fe 2+ /Fe Fe 2+ + 2e = Fe -0.440 Cr 3+ ,Cr 2+ /Pt Cr 3+ + e = Cr 2+ -0.408 Cd 2+ /Cd Cd 2+ + 2e = Cd -0.403 Ti 3+ , Ti 2+ /Pt Ti 3+ + e = Ti 2+ -0.369 Tl + /Tl Tl + + e = Tl -0.3363 Co 2+ /Co Co 2+ + 2e = Co -0.277 Ni 2+ /Ni Ni 2+ + 2e = Ni -0.250 Mo 3+ /Mo Mo 3+ + 3e = Mo -0.20 Sn 2+ /Sn Sn 2+ + 2e = Sn -0.136 Pb 2+ /Pb Pb 2+ + 2e = Pb -0.126 Ti 4+ , Ti 3+ /Pt Ti 4+ +e = Ti 3+ -0.04 D + /D2, Pt D + + e = 1 /2 D2 -0.0034 H + /H2, Pt H + + e = 1 /2 H2 0.000 Ge 2+ /Ge Ge 2+ + 2e = Ge +0.01 Br — /AgBr/Ag AgBr + e = Ag + Br — +0.0732 Sn 4+ , Sn 2+ /Pt Sn 4+ + 2e = Sn 2+ +0.15 Cu 2+ , Cu + /Pt Cu 2+ + e = Cu + +0.153 Cu 2+ /Cu Cu 2+ + 2e = Cu +0.337 Fe(CN)6 4- , Fe(CN)6 3- /Pt Fe(CN)6 3- + e = Fe(CN)6 4- +0.36 OH — /O2, Pt l /2 O2 + H2O + 2e = 2OH — +0.401 Cu + /Cu Cu + + e = Cu +0.521 J — /J2, Pt J2 + 2e = 2J — +0.5355 Te 4+ /Te Te 4+ + 4e = Te +0.56 MnO4 — , MnO4 2- /Pt MnO4 — + e = MnO4 2- +0.564 Rh 2+ /Rh Rh 2+ /Rh +0.60 Fe 3+ , Fe 2+ /Pt Fe 3+ + e = Fe 2+ +0.771 Hg2 2+ /Hg Hg2 2+ + 2e = 2Hg +0.788 Ag + /Ag Ag + + e = Ag +0.7991 Hg 2+ /Hg Hg 2+ + 2e = Hg +0.854 Hg 2+ , Hg + /Pt Hg 2+ + e = Hg + +0.91 Pd 2+ /Pd Pd 2+ + 2e = Pd +0.987 Br — /Br2, Pt Br2 + 2e = 2Br — +1.0652 Pt 2+ /Pt Pt 2+ + 2e = Pt +1.2 Mn 2+ , H + /MnO2, Pt MnO2 + 4H + + 2e = Mn 2+ + 2H2O +1.23 Cr 3+ , Cr2O7 2- , H + /Pt Cr2O7 2- + 14H + + 6e = 2Cr 3+ + 7H2O +1.33 Tl 3+ , Tl + /Pt Tl 3+ + 2e = Tl + +1.25 Cl — /Cl2, Pt Cl2 + 2e = 2Cl — +1.3595 Pb 2+ , H + /PbO2, Pt PbO2 + 4H + + 2e = Pb 2+ + 2H2O +1.455 Au 3+ /Au Au 3+ + 3e = Au +1.498 MnO4 — , H + /MnO2, Pt MnO4 — + 4H + + 3e = MnO2 + 2H2O +1.695 Ce 4+ , Ce 3+ /Pt Ce 4+ + e = Ce 3+ +1.61 SO4 2- ,H + /PbSO4, PbO2, Pb PbO2 + SO4 2- + 4H + + 2e =
PbSO4 + 2H2O +1.682 Au + /Au Au + + e = Au +1.691 H — /H2, Pt H2 + 2e = 2H — +2.2 F — /F2, Pt F2 + 2e = 2F — +2.87
Пример 12-1. Рассчитать стандартный электродный потенциал пары Cu 2+ /Cu + по данным таблицы 11.1 для пар Cu 2+ /Cu и Cu + /Cu.
Cu 2+ + 2e = Cu 
Cu + + e = Cu 
Cu 2+ + e = Cu + 
Пример 12-2. Составить схему гальванического элемента, в котором протекает реакция
Рассчитать стандартную ЭДС элемента при 25 o C, 

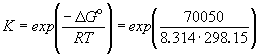
1/K= a(Ag + ) . a(Br — ) = m(Ag + ) . m(Br — ) . ( 

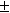
Отсюда, полагая 
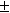
Пример 12-3. 

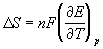
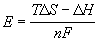
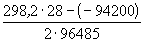
Ответ. 
12-1. Рассчитать стандартный электродный потенциал пары Fe 3+ /Fe по данным таблицы 12.1 для пар Fe 2+ /Fe и Fe 3+ /Fe 2+ . (ответ)
12-2. Рассчитать произведение растворимости и растворимость AgCl в воде при 25 o C по данным таблицы 12.1. (ответ)
12-3. Рассчитать произведение растворимости и растворимость Hg2Cl2 в воде при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-4. Рассчитать константу равновесия реакции диспропорционирования 2Cu + 
12-5. Рассчитать константу равновесия реакции ZnSO4 + Cd = CdSO4 + Zn при 25 o C по данным о стандартных электродных потенциалах. (ответ)
12-6. ЭДС элемента, в котором обратимо протекает реакция 0.5 Hg2Cl2 + Ag = AgCl + Hg, равна 0.456 В при 298 К и 0.439 В при 293 К. Рассчитать 


12-7. Вычислить тепловой эффект реакции Zn + 2AgCl = ZnCl2 + 2Ag, протекающей в гальваническом элементе при 273 К, если ЭДС элемента E= 1.015 В и температурный коэффициент ЭДС = — 4.02 . 10 -4 В . K -1 . (ответ)
12-8. В гальваническом элементе при температуре 298 К обратимо протекает реакция Cd + 2AgCl = CdCl2 + 2Ag. Рассчитать изменение энтропии реакции, если стандартная ЭДС элемента E o = 0.6753 В, а стандартные энтальпии образования CdCl2 и AgCl равны -389.7 и -126.9 кДж . моль -1 соответственно. (ответ)
12-9. ЭДС элемента Pt | H2 | HCl | AgCl | Ag при 25 o C равна 0.322 В. Чему равен pH раствора HCl . (ответ)
12-10. Растворимость Cu3(PO4)2 в воде при 25 o C равна 1.6 . 10 -8 моль . кг -1 . Рассчитать ЭДС элемента Pt | H2 | HCl (pH = 0) | Cu3(PO4)2 (насыщ. р-р) | Cu при 25 o C. (ответ)
12-11. Три гальванических элемента имеют стандартную ЭДС соответственно 0.01, 0.1 и 1.0 В при 25 o C. Рассчитать константы равновесия реакций, протекающих в этих элементах, если количество электронов для каждой реакции n = 1. (ответ)
12-12. ЭДС элемента Pt | H2 | HBr | AgBr | Ag в широком интервале температур описывается уравнением: E o (В) = 0.07131 — 4.99 . 10 -4 (T — 298) — 3.45 . 10 -6 (T — 298) 2 . Рассчитать 


12-13. Для измерения pH раствора можно применять хингидронный электрод. (Хингидрон, Q . QH2, представляет собой комплекс хинона, Q = C6H4O2, и гидрохинона, QH2 = C6H4O2H2). Электродная полуреакция записывается как Q + 2H + + 2e 
12-14. В гальваническом элементе обратимо протекает реакция CuSO4 + Zn = ZnSO4 + Cu. Рассчитать 

12-15. В элементе Вестона протекает реакция Cd + Hg2SO4 = Cd 2+ + 2Hg. Рассчитать ЭДС этого элемента при 303 K, если 

12-16. 


































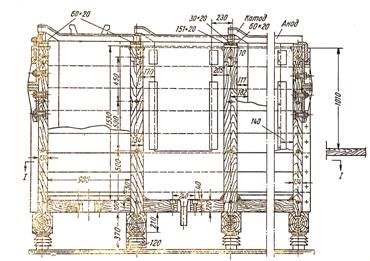
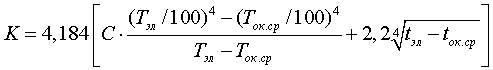
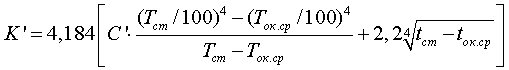
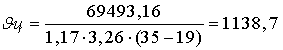 .
. .
.