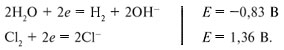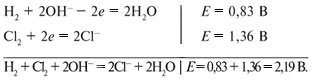Минимальная разность потенциалов,
которую нужно создать между электродами,
чтобы начался электролиз, называется
напряжением разложенияэлектролита.
Эта величина равна суммепотенциалов
разрядаионов на электродах. В
отсутствии перенапряжения на электродах
напряжение разложения равно сумме
равновесных потенциалов электродов,
образующихся после начала электролиза.
В приведенном выше примере электролиза
водного раствора соляной кислоты оно
равно сумме равновесных потенциалов
водородного и хлорного электродов.
Величина напряжения разложения более
или менее точно определяется для
электролита при заданных условиях лишь
в случае выделения на электродах
индивидуальных твердых веществ, например,
чистых металлов. Если в результате
электролиза образуются твердые или
жидкие растворы и, особенно, газы,
напряжение разложения зависит от формы
и размеров электродов, характера их
поверхности, условий отвода газов и др.
Таким образом, напряжение разложения
данного электролита не является для
него однозначной характеристикой и
зависит от условий проведения электролиза.
ЭДС электрохимической поляризации
представляет собой ту реальную ЭДС,
которая возникает при наложении внешней
разности потенциалов и препятствует
электролизу. В некоторых случаях
предельная поляризация электродов
может быть незначительно меньшей, чем
приложенная разность потенциалов. Тогда
эта разность и является величиной
напряжения разложения. Следовательно,
минимальная величина напряжения
разложения равна ЭДС поляризации.
В таблице 26.1 в качестве примера приведены
предельные ЭДС поляризации водных
растворов некоторых электролитов
средних концентраций при электролизе
на платиновых электродах.
Из таблицы видно, что предельная ЭДС
поляризации при электролизе
кислородсодержащих кислот и щелочей
примерно одинаковы. Это может быть
объяснено тем, что в разных растворах
при электролизе протекают одни и те же
процессы. Действительно, при электролизе
этих растворов на катоде происходит
выделение водорода, а на аноде –
кислорода. В растворах кислот выделение
водорода происходит по схеме
2Н3О++ 2е2Н2О + Н2,
т.е. разряжаются ионы гидроксония.
В растворах щелочей также возможен их
разряд, но в таких растворах их концентрация
очень мала. При большой силе тока, который
переносится главным образом ионами
щелочных металлов, к электроду может
подойти лишь незначительное количество
ионов гидроксония, которое не может
обеспечить выделение заметных количеств
водорода. Видимо, выделение водорода
происходит за счет разложения молекул
воды, адсорбированных на электроде:
2H2O + 2e2 OH–+ H2
Таблица26.1
Предельная ЭДС поляризации при электролизе
растворов некоторых веществ
|
Электролит |
Предельная ЭДС поляризации, В |
Электролит |
Предельная ЭДС поляризации, В |
|
H2SO4 |
1,67 |
AgNO3 |
0,70 |
|
HNO3 |
1,69 |
HCl |
1,26 |
|
H3PO4 |
1,70 |
HCl 1 М |
1,31 |
|
NaOH |
1,69 |
HCl 0,5 М |
1,34 |
|
KOH |
1,67 |
HCl 1/6 М |
1,41 |
|
NH4OH |
1,74 |
HCl 1/16 М |
1,62 |
|
Na2SO4 |
2,21 |
HCl1/32 М |
1,69 |
|
ZnSO4 |
2,35 |
Кислород при электролизе растворов
щелочей выделяется в результате разряда
ионов гидроксила на аноде:
4ОН– – 4е2Н2О + О2
При электролизе растворов кислот, где
концентрация ионов гидроксила очень
мала, кислород выделяется в результате
разложения молекул воды:
6Н2О – 4е4Н3О+ + О2
При больших потенциалах (2,5 – 3 В) возможны
и другие анодные процессы. Например,
при электролизе растворов хлорной
кислоты начинается выделение кислорода
из молекул HClO4.
Таким образом, при электролизе растворов
кислот, щелочей, а также соответствующих
солей щелочных и щелочноземельных
металлов на электродах протекает
первичный процесс разложения воды. Роль
остальных ионов сводится к обеспечению
достаточной электропроводности
растворов.
Для растворов других веществ ЭДС
поляризации отличаются, что указывает
на различный характер электродных
процессов для разных веществ. В растворах
солей металлов, менее электроотрицательных,
чем водород, на катоде может выделяться
металл. При электролизе растворов
кислот, молекулы которых не содержат
кислород, на аноде обычно разряжаются
анионы. Интересно в этом отношении
поведение соляной кислоты: в
концентрированных растворах на аноде
выделяется хлор, а в разбавленных –
кислород, при этом изменяется ЭДС
поляризации. Это связано с тем, что при
разбавлении кислоты уменьшается
активность хлорид-ионов. Равновесный
потенциал хлорного электрода становится
более положительным, чем потенциал
разряда ионов ОН–, поэтому
изменяется анодный процесс – уменьшается
разряд ионов хлора и происходит разряд
ионов гидроксила или молекул воды.
УЧЕБНИКИ. ПОСОБИЯ
О.С.ЗАЙЦЕВ
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИКЗАДАЧНИК
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5, 7, 11, 13, 14, 16, 17, 20, 22, 24, 29, 30, 31, 34, 35, 39, 41/2004
§ 8.2. Реакции на границе металл–раствор
(продолжение)
Электролиз
Это слово вам хорошо знакомо. Вы можете
перечислить, где используется электролиз? Сейчас
вы узнаете, что происходит при пропускании
постоянного электрического тока через расплав и
водный раствор хлорида натрия. Вы также узнаете,
что автомобильный аккумулятор при разрядке (его
использовании) работает как гальванический
элемент, а при его зарядке в нем проходит
электролиз. Вам также будет полезно прочитать
некоторые советы по эксплуатации аккумулятора.
При прохождении электрического тока через
металлы (проводники 1-го рода) химические реакции
не идут, и металлы остаются неизменными. Если же
электрический ток проходит через раствор или
расплав электролита (проводники 2-го рода), на
границе электролит – металлический проводник
(электрод) происходят различные химические
реакции и образуются новые вещества. Этот
процесс называется электролизом.
При электролизе положительно заряженные ионы
(катионы) перемещаются к отрицательно
заряженному электроду, катоду, а
отрицательно заряженные ионы (анионы) – к
положительному электроду, аноду. При этом,
однако, не всегда катионы и анионы электролита
разряжаются, принимая или отдавая электроны.
Часто в реакциях электролиза принимает участие
растворитель-электролит, например вода.
Принципиальное различие между реакциями в
гальваническом элементе и электролизере
заключается в их направленности и
самопроизвольности. В замкнутой цепи
гальванического элемента электрохимическая
реакция протекает самопроизвольно, а в
электролизере – только под действием
электрического тока внешнего источника.
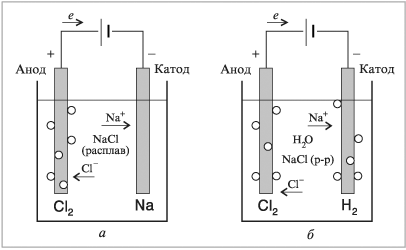
Рассмотрим электролиз расплавленного хлорида
натрия и его водного раствора. На рис. 8.12 показаны
схемы обоих вариантов электролиза. Вам следует
увидеть и объяснить их различия. Опустим в
расплавленный (выше 800 °С) хлорид натрия два
графитовых электрода, которые соединим с
положительным и отрицательным полюсами
источника электрического тока (батарея,
аккумулятор, выпрямитель переменного тока).
|
|
Рис. 8.12.
|
В расплавленном состоянии хлорид
натрия представляет собой отрицательно
заряженные хлорид-ионы и положительно
заряженные ионы натрия. Хлорид-ионы, анионы, в
электрическом поле передвигаются в сторону
положительного электрода – анода, на котором они
отдают электроны и превращаются в атомный хлор и
далее в молекульный хлор, который и выделяется из
электролизера:
2Cl– – 2e = Cl2.
В электрическом поле ионы натрия, катионы,
передвигаются к отрицательному электроду –
катоду, на котором происходит разряжение ионов и
образование жидкого металлического натрия:
Na+ + e = Na.
Поскольку плотность жидкого натрия меньше
плотности расплавленного хлорида натрия, он
всплывает в прикатодном пространстве. Чтобы не
произошло электрического соединения катода с
анодом (замыкание), следует в электролизере
предусмотреть перегородку между катодом и
анодом.
При электролизе катионы и анионы передвигаются
навстречу друг другу.
Теперь посмотрите на схему электролиза
растворенного в воде хлорида натрия и, прежде чем
читать далее, перечислите как можно больше
отличий.
Электролиз раствора хлорида натрия существенно
отличается от электролиза расплава хлорида
натрия, хотя в водном растворе также хлорид
натрия находится в виде ионов натрия и
хлорид-ионов.
Ионы натрия, катионы, в растворе хлорида натрия
направляются к отрицательно заряженному
электроду – катоду. В старых или низкого уровня
учебниках химии можно прочитать, что на катоде
образуется натрий, который сразу же реагирует с
водой, и образуется водород. Но в
действительности дело обстоит совсем не так.
Сравним электродные потенциалы воды и натрия:
Эти данные показывают, что для приема
электронов водой с образованием водорода и
гидроксид-ионов требуется значительно меньшее
напряжение по сравнению с напряжением в случае
приема электронов ионами натрия. Теперь
подумайте, какие вещества будут образовываться
на катоде или концентрироваться в прикатодном
пространстве.
К катоду будут устремляться катионы натрия, но
они разряжаться не будут, а из воды будут
образовываться водород и гидроксид-ионы. Ионы
натрия и гидроксид-ионы сделают раствор вблизи
катода щелочным.
Хлорид-ионы у анода разряжаются, и выделяется
свободный хлор:
2Cl– – 2е = Cl2, E =
–1,36 В.
То, что вы прочитали, – это самое простое
описание электролиза водного раствора хлорида
натрия.
Продукты электролиза раствора хлорида натрия
зависят от его концентрации. Электролиз
разбавленного раствора хлорида натрия проходит
без разряжения хлорид-ионов, а разлагается вода с
выделением кислорода и накоплением ионов
водорода (соляная кислота):
2Н2О – 4е = О2 + 4Н+,
Е = –1,23 В.
По мере повышения концентрации соли на аноде
вместе с кислородом начинает выделяться хлор:
2Cl– – 2e = Cl2.
А в концентрированных растворах образуется
хлор с примесью кислорода, т.е. в этом случае
основными продуктами электролиза являются
водород, хлор и гидроксид натрия.
При электролизе раствора хлорида натрия на
основной процесс образования хлора
накладываются реакции хлора с водой и
последующие превращения образующихся веществ.
Гидролиз хлора проходит с образованием слабой
хлорноватистой кислоты HClO и хлорид-ионов
(сильная соляная кислота):
Сl2 + H2O = H+ + Cl– +
HClO.
При повышении температуры образуются
хлорат-ионы ClO3–:
3Cl2 + 3H2O = ClO3–
+ 5Cl– + 6H+,
3HClO = ClO3– + 2Cl–
+ 3H+,
3ClO– = ClO3–
+ 2Cl–.
Если электролиз разбавленного раствора
хлорида натрия проводится в химическом стакане
или другом подобном сосуде, то растворы ионов
водорода (кислота) и гидроксид-ионов (щелочь)
смешиваются, и электролиз сводится к образованию
водорода и кислорода. Если же анодное и катодное
пространства разделить перегородкой (мембраной),
пропускающей ионы-переносчики электрического
тока, но препятствующей смешению приэлектродных
растворов, то можно в качестве продуктов
электролиза получить растворы кислоты и щелочи.
Напряжением разложения электролита при
электролизе называется минимальное напряжение,
которое нужно приложить к электродам для
получения продуктов электролиза. Напряжение
разложения не может быть меньше ЭДС
соответствующего гальванического элемента.
Например, рассмотрим электролиз раствора
хлорида натрия. Электродные потенциалы равны:
В гальваническом элементе протекают процессы:
ЭДС реакции водорода с хлором в щелочной среде
равна 2,19 В, и самопроизвольно может проходить
именно эта реакция. Но в электролизере не
самопроизвольно, а под воздействием
прилагаемого напряжения проходит
противоположная реакция:
2Cl– + 2Н2О = Н2 + Сl2
+ 2ОН–.
Чтобы реакция проходила, необходимо напряжение
не менее 2,19 В, т.е. напряжение разложения при
электролизе водного раствора хлорида натрия
равно 2,19 В. Напряжение разложения составляется
из потенциалов разряжения ионов.
Однако реальное напряжение, которое следует
приложить к электродам, всегда оказывается
больше расчетного из-за того, что на электродах
по различным причинам возникает повышенное
сопротивление прохождению электрического тока,
которое необходимо преодолеть, прилагая более
высокое напряжение. Разность между реальным
напряжением разложения и теоретически найденным
из электродных потенциалов ЭДС соответствующей
реакции называют перенапряжением.
Перенапряжение зависит от материала электрода,
его формы, состояния поверхности, плотности тока,
температуры раствора, интенсивности
перемешивания раствора и других факторов. При
образовании газообразных продуктов в
большинстве случаев перенапряжение бывает
весьма значительным. При образовании кислорода
перенапряжение особенно велико, а при выделении
галогенов незначительно.
Роль перенапряжения двойственна. С одной
стороны, перенапряжение приводит к повышенному
расходу электроэнергии при электролизе, но, с
другой стороны, благодаря перенапряжению
удается осаждать из водных растворов многие
металлы, которые по значениям их стандартных
электродных потенциалов осаждаться не должны: Fe,
Pb, Sn, Ni, Co, Zn, Cr. Благодаря перенапряжению, а также
влиянию концентрации раствора на электродный
потенциал возможны электролитическое
хромирование и никелирование железных изделий, а
на ртутном электроде удается даже получить из
водного раствора натрий.
Потенциал разряжения катиона иногда называют
потенциалом осаждения металла. Это тот
минимальный потенциал, который должен быть
приложен к электроду для того, чтобы катион
потерял заряд и произошло осаждение металла. Для
некоторых ионов (Fe3+, Cu2+, Ag+, Cd2+)
потенциал осаждения близок к электродному
потенциалу, для других же ионов (Fe2+, Co2+,
Ni2+) потенциалы осаждения значительно
превышают электродные потенциалы металлов, и для
их осаждения электролизом необходимо приложить
определенное перенапряжение.
При электролизе водных растворов электролитов
часто вместо металла на катоде выделяется
водород. Такие катионы, как Na+ или К+, в
водном растворе вообще не разряжаются, а
выделяется водород.
В кислотных средах водород образуется по
реакции:
2Н+ + 2е = Н2,
а в нейтральных и щелочных средах – по реакции:
2Н2О + 2е = Н2 + 2ОН–.
Катионы могут быть сгруппированы по продуктам
электролиза:
| Катионы | Продукты электролиза |
|---|---|
| Li+, K+, Na+, Mg2+, Al3+ |
H2 |
| Mn2+, Zn2+, Cr3+, Fe2+ (pH = 7, нейтральная среда) |
Mеталл + H2 |
| Co2+, Ni2+, Sr2+, Pb2+ (pH = 0, кислотная среда) |
Металл + H2 |
| Cu2+, Ag+, Pt2+, Au3+ | Металл |
Обратите внимание, что для некоторых
катионов возможно одновременное образование
металла и водорода. В ряду катионов от Li+ до
Al3+ металл при электролизе водных растворов
не образуется, а выделяется водород (требуется
значительное перенапряжение) за счет
восстановления воды. В ряду катионов от Mn2+
до Pb2+ при электролизе образуются
одновременно металл и водород, и в совсем
немногочисленной группе катионов от Cu2+ и
до Au3+ образуется только металл.
Следовательно, чем меньше отрицательное
значение электродного потенциала и выше его
положительное значение, тем легче выделить
металл электролизом из водного раствора его
соли.
Если к раствору, содержащему несколько катионов,
приложить постепенно возрастающее напряжение,
то электролиз начинается тогда, когда
достигается потенциал осаждения металла с самым
высоким (наиболее положительным) электродным
потенциалом. Например, при электролизе раствора,
содержащего ионы цинка (Е = –0,76 В) и меди (Е
= 0,34 В), сначала выделяется медь и лишь после того,
как почти все ионы меди разрядятся, начнет
выделяться цинк. Таким образом, если в растворе
одновременно содержатся различные катионы, то
при электролизе можно выделить соответствующие
металлы последовательно согласно значениям их
электродных потенциалов.
Что касается разряжения анионов при электролизе
водных растворов, следует помнить, что
галогенид-ионы (и другие не содержащие кислорода
ионы) разряжаются. Кислородсодержащие анионы
обычно не разряжаются, и вместо них в электролизе
участвуют молекулы воды или гидроксид-ионы в
щелочных растворах:
2Н2О – 4е = О2 + 4Н+,
4ОН– – 4е = О2 + 2Н2О.
Если раствор содержит хлорид-ионы (Е = 1,36 В),
бромид-ионы (Е = 1,09 В) и йодид-ионы
(Е = 0,54 В), то сначала будут разряжаться анионы
с самым низким (наменьшим) потенциалом и далее с
более высоким (йод, бром и хлор). Фторид-ионы в
водном растворе вообще разряжаться не могут (Е
= 2,87 В).
Обсудим несколько примеров.
• При электролизе раствора серной кислоты
(графитовые электроды) происходят следующие
процессы:
на катоде: 2Н+ + 2е = Н2,
на аноде: 2Н2О – 4е = О2 + 4Н+.
Суммарное уравнение:
2Н2О = 2Н2 + О2.
Таким образом, при электролизе раствора серной
кислоты за счет разложения воды выделяются
водород и кислород.
• Электролиз раствора сульфата меди:
на катоде: Сu2+ + 2e = Cu,
на аноде: 2Н2О – 4е = О2 + 4Н+.
Суммарное уравнение:
2Сu2+ + 2Н2О = 2Cu + О2 + 4Н+.
В результате электролиза сульфата меди
образуются медь, кислород и серная кислота.
С законами электролиза вы знакомы из курса
физики. Напомним некоторые наиболее важные
положения.
Если через раствор, содержащий ионы серебра Ag+,
пропустить постоянный ток силой 1 А в течение 1 с,
на катоде выделится 0,001118 г металлического
серебра (точнее, 0,001117975 г). Количество
электричества, выделяющее это количество
серебра, называется кулоном, т.е. 1 Кл = 1А•1с.
Чтобы из раствора выделить 1 моль серебра,
следует пропустить через раствор однозарядных
ионов Ag+ число Авогадро электронов, или 1
моль их. Чтобы из раствора выделить 107,8682 г
серебра (1 моль), через раствор следует пропустить
107,8682/0,001117975 = 96 485 Кл
электричества. Это число называют постоянной
Фарадея F, или числом Фарадея, а иногда
просто Фарадеем. Постоянная Фарадея F – одна
из фундаментальных физико-химических констант.
Число Фарадея равно произведению заряда
электрона e на число Авогадро NA:
1F = 1,6022•10–19•6,022•1023 =
96 485 Кл/моль.
Поскольку 96 485 Кл электричества выделяют при
электролизе массу металла, равную его атомной
массе, если ионы металла однозарядны, то серебра
выделится 107,8682 г. Если же через раствор сульфата
меди пропустить 96 485 Кл электричества, то
выделится не 63,546 г меди, а в два раза меньшее
количество – 31,773 г, т.к. ионы меди двухзарядны.
Если пропустить 1F электричества через
раствор трехзарядных катионов, то будет получено
количество металла, в три раза меньшее его
атомной массы.
Если вам придется заниматься электролизом,
запомните два выражения:
F = 96 485 Кл/моль и 1 Кл = 1А•1с.
Они помогут вам вычислить количество
электричества, необходимое для осаждения
заданного количества металла, и время
пропускания тока известной силы:
1F = 96 485 Кл/моль = 96 485 А•с/моль =
26,8 А•ч/моль.
Масса выделившегося металла m (г), сила тока I
(А), время t (с), атомная масса металла А
(г/моль) и заряд его ионов n связаны
соотношением:
m = AIt/(nF) = AIt/(96 485n).
Лекция 9
Электролиз. Токи обмена. Поляризация электрода, перенапряжение. Концентрационная и электрохимическая поляризация. Напряжение разложения.
КИНЕТИКА ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ.
Равновесные состояния процессов внутри электролитов (электролитическая диссоциация, гидролиз, сольватация и др.) и процессов на электродах (электрохимические реакции и характеризующие их обратимые электродные потенциалы) не зависят от времени, к ним применимы оба закона термодинамики. Поэтому соответствующие закономерности называются термодинамическими, а посвященный им раздел электрохимии – термодинамикой электрохимических процессов. Для электродных процессов равновесие характеризуется отсутствием электрического тока.
Процесс прохождения электрического тока конечной силы не является равновесным, и явления, связанные с прохождением тока, зависят от времени и от силы тока, величина которого может быть регулируема извне. Раздел электрохимии, рассматривающий неравновесные, главным образом стационарные процессы, протекающие на электродах во времени, называется кинетикой электрохимических (электродных) процессов или просто электрохимической кинетикой.
Электрический ток может протекать в результате замыкания электрохимического элемента, образуемого электродами и электролитом, или под влиянием приложенной к системе электроды – электролит внешней разности потенциалов. В последнем случае явления, происходящие на границах электрод – электролит, называются электролизом и состоят в выделении веществ (металлы, газы) из электролита на электроде, в растворении вещества электрода и в изменении состава электролита.
Электрохимическая кинетика основывается как на общих положениях химической кинетики, так и на частных закономерностях, характерных только для электрохимических процессов. Так, для электрохимии справедливы основной постулат химической кинетики, применимость понятия энергии активации для многих электрохимических процессов, положительное влияние температуры на скорость электролиза и т.п.
Достаточно отчетливо выражена и специфичность электрохимических процессов :
1. Электрохимическим путем можно проводить и такие реакции, которые химическим путем при обычной Т не идут (например, реакция разложения воды при обычной Т не идет, а электролизом вода легко разлагается). Самопроизвольные реакции всегда сопровождаются уменьшением свободной энергии; электрохимическим же путем можно проводить реакции, сопровождающиеся увеличением свободной энергии, т.е. возможности электросинтеза шире, чем возможности обычного химического синтеза. Необходимая свободная энергия доставляется системе извне в виде энергии электрического тока.
Рекомендуемые материалы
2. Суммарную скорость электрохимического процесса можно не только легко определить по величине силы тока, протекающего в цепи, но и регулировать путем изменения силы тока.
3. Скорость электрохимического процесса зависит от ЭДС и существенно зависит от условий диффузии ионов. Диффузия ионов часто оказывает определяющее влияние на скорость электродного процесса.
4. Энергия активации электрохимического процесса часто связана с падением потенциала в ДЭС.
Равновесие между раствором и электродом, имеющим определенный потенциал, является динамическим : происходит непрерывный обмен заряженными частицами между электродом и раствором. При равновесии скорости перехода частиц в противоположных направлениях одинаковы. Количество электричества, переходящее в этих условиях в единицу времени от электрода к раствору и обратно, называется током обмена. Существование тока обмена можно доказать методом изотопных индикаторов.
При прохождении электрического тока через границу электрод – раствор двухсторонний ток обмена имеется, но на него накладывается, как правило, несравненно больший односторонний ток, определяемый ЭДС элемента или приложенной внешней разностью потенциалов.
Электрический ток вызывает изменения на поверхности электродов, зависящие от многих факторов и прежде всего от силы тока. Изменение электрического состояния электрода (его потенциала, плотности заряда ДЭС) под влиянием проходящего через границу раздела электрического тока называется поляризацией электрода. При поляризации потенциал электрода изменяется по сравнению с тем «равновесным» значением, которое он имел в данном растворе при отсутствии тока :
Dj = ji – jp
Dj – электродная поляризация; ji – потенциал электрода «под током»; jp – равновесный электродный потенциал. Т.к. при наложении катодного тока потенциал смещается в отрицательную сторону, а при наложении анодного – в положительную, то катодная электродная поляризация всегда отрицательна, а анодная всегда положительна :
Djк = ji – jp < 0 ; Djа = ji – jp > 0
Любой электродный процесс представляет собой сложную гетерогенную реакцию, состоящую из ряда последовательных стадий. По крайней мере на некоторых из них она может протекать по двум или нескольким параллельным путям. Природа и число стадий каждой электрохимической реакции зависят от ее характера.
Из химической кинетики известно, что скорость последовательной реакции определяется скоростью наиболее медленной из ее последовательных стадий, а из ряда параллельных путей наиболее вероятен путь с наименьшими торможениями. Эти же представления справедливы и в случае электрохимических процессов. Стадия, определяющая скорость всего электродного процесса, называется замедленной или лимитирующей стадией. Замедленность той или иной стадии является непосредственной причиной поляризации электрода. Если известна природа замедленной стадии, т.е. ясна причина, обусловливающая появление поляризации, то вместо термина «поляризация» употребляют термин (электродное) перенапряжение (h). Т.о., перенапряжение – это поляризация электрода, обусловленная замедленным протеканием вполне определенной стадии суммарного электродного процесса.
В зависимости от природы замедленной стадии можно говорить о различных видах перенапряжения. Одной из обязательных стадий любого электродного процесса является транспортировка участников реакции – доставка (или отвод) к границе раздела электрод – электролит. Поляризацию, вызванную торможением на стадии транспортировки, называют концентрационной поляризацией, перенапряжением транспортировки или диффузионным перенапряжением hд. Замедленное протекание чисто химической стадии – реакции, предшествующей или следующей за актом разряда – вызывает появление химического или реакционного перенапряжения hх (hр ). Любой электродный процесс включает в себя хотя бы одну стадию, связанную с переходом электронов через границу раздела электрод – электролит. Электродную поляризацию, вызванную замедленным протеканием этой стадии, называют электрохимическим перенапряжением hэ , поскольку именно стадия перехода электронов является собственно электрохимическим актом. Для описания этого вида перенапряжения широко используют также термины перенапряжение замедленного разряда, перенапряжение переноса заряда, перенапряжение (электронного) перехода. Наконец, замедленность стадии построения или разрушения кристаллической решетки, а также замедленность перехода от одной модификации к другой соответствуют фазовому перенапряжению hф.
В общем случае смещение потенциала электрода под током от равновесного значения представляет собой результат наложения всех видов перенапряжения:
Dj = hд + hр + hэ + hф
Однако можно найти такие электродные процессы и создать такие условия, при которых преобладающее значение будет иметь какой-либо один вид перенапряжения.
КОНЦЕНТРАЦИОННАЯ ПОЛЯРИЗАЦИЯ.
Концентрационная поляризация обусловлена уменьшением в процессе электролиза концентрации ионов, определяющих потенциал у поверхности электрода; в результате этого изменяется равновесный потенциал электрода. Влиянием концентрационной поляризации на потенциал электрода под током можно пренебречь лишь при малых плотностях тока (т.е при малых скоростях электрохимической реакции). Напротив, при высоких плотностях тока стадии доставки могут определять скорость всего электродного процесса.
Рассмотрим процесс электролиза раствора AgNO3 с концентрацией со (Моль/л) в присутствии значительного количества KNO3. Катод – серебряная проволока, анод – Pt-жесть с очень большой поверхностью. В отсутствие тока потенциал катода может быть вычислен по уравнению Нернста :
j = jо + 
Приложим к электродам небольшую разность потенциалов. На катоде начнется восстановление ионов серебра в металлическое серебро. При прохождении тока концентрация ионов серебра в непосредственной близости у катода уменьшается, а концентрация их в остальной части раствора остается постоянной. Возникает некоторый градиент концентраций, вызывающий диффузию ионов из объема раствора к поверхности электрода, а электрод принимает потенциал ji , соответствующий новому значению концентрации с(S) у его поверхности :
ji = jо + 
По мере прохождения тока градиент концентрации у катода увеличивается, и подача ионов из глубины раствора путем диффузии усиливается. Через некоторое время создаются такие условия, при которых количество разряжающихся ионов становится равным количеству ионов, которое подводится к поверхности электрода. Устанавливается некоторое стационарное (т.е. не изменяющееся во времени) распределение ионов у катода.
В стационарных условиях сила тока, проходящего через раствор, определяется количеством грамм-ионов ni , продиффундировавших к электроду в единицу времени. Согласно закону Фика это количество равно
ni = DS
D – коэффициент диффузии разряжающегося иона;
S – площадь поверхности электрода;
l – толщина диффузионного слоя (слоя, в котором происходит уменьшение концентрации от со до с(S) ).
Чтобы вычислить силу тока I , текущего к электроду, необходимо величину ni умножить на zF, где z – заряд разряжающегося иона, F – число Фарадея (для AgNO3 z = 1):
I = zF DS
При увеличении силы тока величина с(S) уменьшается и при достижении некоторого предельного значения силы тока, называемого предельным током диффузии Iд, становится равной нулю. Поэтому предельный ток диффузии равен :
Iд = zF DS
Из двух предыдущих уравнений также получим :
с(S) = со
Подставив полученное выражение для с(S) в уравнение для ji и вычтя из результата уравнение для j, найдем, что сдвиг потенциала, обусловленный концентрационной поляризацией, будет равен
Dj = 
Величины Dj обоих электродов складываются в ЭДС концентрационной поляризации, направленную против приложенной к электролитической ванне разности потенциалов, поэтому последняя должна быть увеличена на ЭДС концентрационной поляризации, чтобы была получена необходимая для электролиза сила тока. Т.к. в электрохимических производствах при электролизе применяют токи большой плотности, возникают значительные ЭДС поляризации, что увеличивает расход электрической энергии, поэтому устранение или уменьшение концентрационной поляризации является важной практической проблемой. Одной из основных мер уменьшения концентрационной поляризации является перемешивание растворов. Возникновение концентрационной поляризации снижает ЭДС химических источников тока при их работе. Избежать этого удается путем создания особых условий эксплуатации источников тока или применения насыщенных растворов солей с избытком твердой соли (элемент Вестона).
ЭЛЕКТРОХИМИЧЕСКОЕ ПЕРЕНАПРЯЖЕНИЕ.
Любой электродный процесс обязательно включает в себя одну или несколько стадий, на которых частицы либо присоединяют к себе электроны (акт восстановления), либо теряют их (акт окисления). Однако сущность собственно электрохимической стадии не сводится только к изменению валентного состояния частицы или только к переносу заряда через границу раздела электрод–электролит. Приобретение (или потеря) частицей электрона приводит одновременно к изменению ее физико-химического и энергетического состояния. Так, например, в ходе реакции
Н3О+ + е – = Надс + Н2О
приобретение электрона частицей Н3О+ означает не только изменение заряда от величины z1 = 1 до величины z2 = 0, но и превращение гидратированного протона в адсорбированный на электроде атом водорода, т.е. разрыв связей между ионом водорода и растворителем и создание связи между атомом водорода и металлом.
При осаждении металла из раствора его простой соли металлический ион из аквакомплекса переходит в состояние адатома (или адиона)
Mz+×aq + ze – = Мадс + Н2О
с последующим его вхождением в решетку металла.
Т.о., приобретение или потеря частицей заряда всегда сопровождаются перестройкой ее структуры и изменением ее природы. Чем глубже эти изменения, тем больше должна быть энергия активации и тем ниже скорость собственно электрохимической стадии, т.е. тем вероятнее, что именно она определяет скорость всего электродного процесса и обусловливает появление электрохимического перенапряжения.
Теория электрохимического перенапряжения была разработана применительно к процессу катодного выделения водорода, а затем распространена на другие электродные процессы. Первая попытка количественного оформления теории замедленного разряда была предпринята Эрдей-Грузом и Фольмером в 1930 г. Эрдей-Груз и Фольмер вывели формулу, связывающую потенциал электрода под током с плотностью тока. Выведенная ими формула является основным уравнением электрохимического перенапряжения и согласуется с эмпирическим уравнением для перенапряжения водорода. Однако теория замедленного разряда в ее первоначальном виде содержала ряд недостаточно обоснованных допущений и не могла удовлетворительно описать всю совокупность опытных данных. Наибольший вклад в теорию замедленного разряда был внесен А.Н.Фрумкиным (1933), который впервые учел влияние строения ДЭС на кинетику электрохимических процессов. Его идеи во многом определили основное направление развития электрохимической науки и ее современное состояние.
НАПРЯЖЕНИЕ РАЗЛОЖЕНИЯ.
Минимальная разность потенциалов, которую необходимо создать между электродами, чтобы электролиз начался, называется напряжением разложения электролита. При отсутствии перенапряжения на электродах напряжение разложения равно сумме равновесных потенциалов электродов, образующихся после начала электролиза (например, при электролизе НCl равно сумме равновесных потенциалов хлорного и водородного электродов). При наличии же перенапряжения хотя бы на одном электроде напряжение разложения больше суммы равновесных потенциалов.
Если при электролизе на электродах образуются твердые или жидкие растворы, и особенно при выделении газов, напряжение разложения зависит от формы и размеров электродов, характера их поверхности, условий удаления газов и многих других обстоятельств. Поэтому величина напряжения разложения не может служить однозначной характеристикой электролита при различных условиях.
Оказалось, что напряжения разложения при электролизе кислородсодержащих кислот и щелочей средних концентраций на платиновых электродах близки по своим значениям. По-видимому, при электролизе целого ряда веществ протекают одинаковые процессы как на катоде, так и на аноде. Действительно, в этих растворах на катоде выделяется водород, а на аноде – кислород. В растворах кислот разряжаются ионы гидроксония :
2Н3О+ + 2е = 2Н2О + Н2
В растворах щелочей также происходит разряд ионов гидроксония, а не ионов щелочного металла. Однако вследствие незначительной концентрации Н3О+ при большой силе тока водород в щелочи выделяется путем непосредственного разложения молекул воды, адсорбированных на электроде :
2Н2О + 2е = 2ОН– + Н2
В растворах щелочей и солей щелочных металлов присутствуют два сорта катионов (например, К+ и Н3О+). При изменении потенциала электрода в отрицательную сторону вначале достигается потенциал разряда ионов гидроксония, который в нейтральном растворе при Р = 1 атм равен всего – 0,4 В, и начинается процесс выделения водорода. Разряд же ионов калия (см. таблицу стандартных электродных потенциалов) может происходить лишь при высоких отрицательных потенциалах (при 
Выделение кислорода на аноде из щелочных растворов может быть следствием единственно возможной электродной реакции – разряда ионов гидроксила :
4ОН– – 4е = 2Н2О + О2
Ещё посмотрите лекцию «Эффективность здравоохранения» по этой теме.
При электролизе кислот, где концентрация ионов гидроксила очень мала, кислород выделяется в результате непосредственного разложения молекул воды на аноде :
6Н2О – 4е = 4Н3О+ + О2
Ранее предполагалось, что в растворах кислородсодержащих кислот или их солей разряжаются соответствующие анионы. Это предположение неправильно. Ионы ОН– обладают наименьшим потенциалом разряда (+1,23 В), а потому при электролизе указанных солей выделение О2 обусловлено разрядом ионов ОН–.
Т.о., при электролизе кислородсодержащих кислот, щелочей и соответствующих солей щелочных и щелочноземельных металлов на электродах протекает единственный процесс разложения воды, т.е. выделение кислорода и водорода. Роль остальных ионов сводится лишь к обеспечению достаточной для электролиза электропроводности. Следует отметить, что близость напряжения разложения при электролизе кислот и щелочей наблюдается только при использовании электродов из определенных металлов (Pt, Pd), на которых мало перенапряжение водорода.
В растворах солей металлов менее электроотрицательных, чем водород, на катоде может выделяться уже металл. При электролизе кислот, не содержащих кислорода, и их солей на аноде, как правило, разряжаются соответствующие анионы.
Интересно поведение соляной кислоты. В концентрированных растворах на аноде выделяется хлор, а в разбавленных – кислород, причем меняется величина напряжения разложения. С разбавлением кислоты уменьшается активность ионов хлора, и равновесный потенциал хлорного электрода делается более положительным, чем потенциал разряда ионов ОН–, поэтому и происходит изменение анодного процесса : существенно уменьшается разряд ионов хлора и происходит разряд ионов гидроксила или молекул воды и выделение кислорода.
Электролиз. Примеры расчета

Электролиз можно производить только постоянным током. При электролизе на отрицательном электроде (катоде) выделяется водород или металл, содержащийся в соли. Если положительный электрод (анод) выполнен из металла (обычно того же, что и в соли), то положительный электрод при электролизе растворяется. Если анод нерастворим (например, угольный), то содержание металла в электролите при электролизе уменьшается.
Количество вещества, выделяющегося при электролизе на катоде, пропорционально количеству электричества, которое протекло через электролит.
Количество вещества, выделенное одним кулоном электричества, называется электрохимическим эквивалентом A, поэтому G=A•Q; G=A•I•t,
где G – количество выделенного вещества; Q – количество электричества; I – электрический ток; t – время.
Каждый металл имеет свой электрохимический эквивалент A.
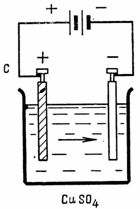
1. Сколько меди выделится из медного купороса (CuSO4) (рис. 1) током I=10 А за 30 мин. Электрохимический эквивалент меди A=0,329 мг/A•сек.
G = A•I•t = 0,329•10•30•60 = 5922 мг =5,922 г.
На предмете, подвешенном к катоду, выделится 5,9 г чистой меди.
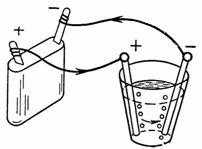
2. Допустимая плотность тока при электролитическом меднении •=0,4 А/дм2. Площадь катода, которая должна покрыться медью, S=2,5 дм2. Какой ток необходим для электролиза и сколько меди выделится на катоде за 1 ч (рис. 2 ).
I=••S =0,4-2,5=l A; G=A•Q=A•I•t=0,329•1•60•60=1184,4 мг.
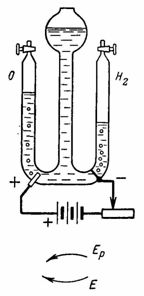
3. Окисленная вода (например, слабый раствор серной кислоты H2SO4) при электролизе разлагается на водород и кислород. Электроды могут быть угольные, оловянные, медные и т. д., но лучше всего из платины. Сколько кислорода выделится на аноде и сколько водорода выделится на катоде за 1/4 ч при токе 1,5 А. Количество электричества 1 А•сек выделяет 0,058 см3 кислорода и 0,116 см3 водорода (рис. 3 ).
На катоде выделится Gа=A•I•t=0,058•1,5•15•60=78,3 см3 кислорода.
На аноде выделится Gк=A•I•t=0,1162•1,5•15•60=156,8 см3 водорода.
Смесь водорода и кислорода в такой пропорции называется гремучим газом, который при поджигании взрывается с образованием воды.
4. Кислород и водород для лабораторных опытов получают при помощи электролиза воды (окисленной серной кислотой) (рис. 4 ). Платиновые электроды впаяны в стекло. Установим с помощью сопротивления ток I=0,5 А. (В качестве источника тока используется батарея из трех сухих элементов по 1,9 В.) Сколько водорода и кислорода выделится через 30 мин.
Рис. 4 . Рисунок к примеру 4
В правом сосуде выделится Gк=А•I•t=0,1162•0,5•30•60=104,58 см3 водорода.
В левом сосуде выделится Ga=A•l•t=0,058•0,5•30•60=52,2 см3 кислорода (газы выталкивают воду в средний сосуд).
5. Преобразовательная установка (двигатель-генератор) обеспечивает ток для получения электролитической (чистой) меди. За 8 ч необходимо получать 20 кг меди. Какой ток должен обеспечить генератор• Электрохимический эквивалент меди равен A=0,329 мг/А•сек.
Так как G=A•I•t, то I=G/(A•t)=20000000/(0,329•8•3600)=20000000/9475,2=2110,7 А.
6. Нужно отхромировать 200 фар, из которых на каждую требуется 3 г хрома. Какой ток необходим, чтобы эта работа была выполнена за 10 ч (электрохимический эквивалент хрома A=0,18 мг/А•сек).
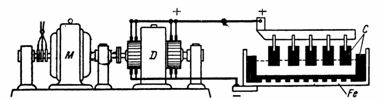
7. Алюминий получают путем электролиза раствора каолиновой глины и криолита в ваннах при рабочем напряжении ванны 7 В и токе 5000 А. Аноды изготовляются угольными, а ванна – стальной с угольными блоками (рис. 5 ).
Рис. 5 .Рисунок к примеру 5
Ванны для получения алюминия соединяются последовательно для увеличения рабочего напряжения (например, 40 ванн). Для получения 1 кг алюминия требуется примерно 0,7 кг угольных анодов и 25–30 кВт•ч электроэнергии. По приведенным данным определить мощность генератора, расход электроэнергии за 10 ч работы и вес полученного алюминия.
Мощность генератора при работе на 40 ванн P=U•I=40•7•5000=1400000 Вт =1400 кВт.
Электрическая энергия, расходуемая за 10 ч, A=P•t=1400 кВт 10 ч=14000 кВт•ч.
Количество полученного алюминия G=14000 : 25=560 кг.
Исходя из теоретического электрохимического эквивалента, количество полученного алюминия должно быть равно:
Gт=A•I•t=0,093•5000•40•10•3600=0,093•7200000000 мг=669,6 кг.
Коэффициент полезного действия электролитической установки равен: кпд=G/Gт =560/669,6=0,83=83%.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети:
Источник
Напряжение разложения



Теоретические основы промышленного электролиза.
Электроды присоединяются к внешнему источнику электрического тока следующим образом:
анод — к положительному полюсу;
катод — к отрицательному полюсу.
При наличии напряжения на электродах катионы электролита движутся к катоду, а анионы – к аноду.
Химическая сущность электролиза заключается в окислительно-восстановительных реакциях.
На аноде анионы отдаютэлектроны, т. е. окисляются.
На катоде катионы принимают электроны, т. е. восстанавливаются.
В результате этого на электродах разряжаются ионы с образованием газообразных, жидких или твёрдых электрически нейтральных веществ.
При этом идёт диссоциация новых молекул электролита, и восстанавливается равновесие, нарушенное при разряде ионов.
В зависимости от цели процесса электроды могут быть изготовлены из различных материалов: металлов или графита.
Металлические электроды могут быть растворимыми и нерастворимыми.
Растворимые электроды принимают участие в окислительно-восстановительных процессах, протекающих при электролизе, а нерастворимые – нет.
Если металлический анод растворим в электролите, то равновесие диссоциации восстанавливается путём перехода в раствор катионов металла анода.
В электролите обычно присутствует несколько видов ионов. В водных растворах электролитов присутствуют молекулы воды (слабый электролит) и катионы металлов или ионы водорода, а также анионы кислот и гидроксогруппы (результаты диссоциации сильных электролитов: солей, кислот и щелочей).
При электролизе водных растворов электролитов катионы движутся к катоду. На катоде конкурируют процессы восстановления ионов металлов и водорода из воды:
Mt n+ + nê = Me
2H2O + 2ê = H2 + 2OH —
Анионы при электролизе подходят к аноду. На аноде конкурируют процессы окисления анионов и кислорода из воды:
2Cl — — 2ê = Cl2
2H2O — 4ê = O2 + 4H +
На катоде в первую очередь восстанавливаются более сильные окислители.
На аноде в первую очередь окисляются более сильные восстановители.
Для теоретического предсказания схемы электролиза в общем случае нужно рассчитывать напряжение разложения.
В первую очередь идут процессы, требующие меньшего напряжения разложения.
Напряжение разложения (Uразл.) – минимальное напряжение (наименьшая разность потенциалов), которое необходимо приложить от внешнего источника для протекания процесса электролиза при данных температуре и концентрации раствора.
Напряжение разложения слагается из потенциала поляризации (∆Eполяр.) и перенапряжения на катоде и аноде:
Значения ηк и ηа для электродов, изготовленных из различных материалов, имеются в справочниках
Величина перенапряжения зависит от природы процесса и очень многих факторов (концентрации, температуры, материал электрода и т. д.).
Сначала мы с вами введём понятия потенциала поляризации и перенапряженя на аноде и катоде;а затем рассмотримрасчёт напряжения разложения на примере электролиза водного раствора хлорида
никеля (II).
В водном растворе хлорид никеля диссоциирует по схеме:
NiCl2 = Ni 2+ + 2Cl —
Положительно заряженные ионы никеля подходят к катоду, на котором происходит их восстановление:
Катод (-) Ni 2+ + 2ê = Ni
На аноде окисляются ионы хлора:
Анод (+) 2Cl — — 2ê = Cl2
Суммарный процесс при электролизе в ионно-молекулярной форме:
Ni 2+ + 2Cl — = Cl2 + Ni
Выделение никеля на катоде и хлора на аноде приводит к возникновению хлорно-никелевого гальванического элемента:
(-) Ni | Ni 2+ || Cl2 | Cl — (+)
Равновесие на электроде, покрытом никелем:
Ni 2+ + 2ê = Ni E 0 Ni 2+ |Ni = -0,25 В
Равновесие на хлорном электроде:
Если принять, что концентрации ионов никеля и хлора являются стандартными (1 моль/л), то при установлении равновесия на каждом из электродов возникнет скачёк потенциала, равный стандартному электродному потенциалу.
Никелевый электрод в образовавшемся гальваническом элементе будет восстановителем, хлорный электрод выступит в роли окислителя:
Ni 0 — 2e = Ni 2+
Cl2 + 2e = 2Cl —
Ni + Cl2 = Ni 2+ + 2Cl —
Суммарный процесс Ni + Cl2 = Ni 2+ + 2Cl — ,в случае гальванического элемента, характеризуется разностью потенциалов

∆E 0 = ∆E 0 окисл. — ∆E 0 восст. = 1,36 — (-0,25) = 1,61 В.
Разность потенциалов возникшего гальванического элемента и есть ∆E 0 поляр.
Источник
§ 114. Напряжение разложения
При прохождении через раствор электрического тока на электродах выделяются продукты электролиза. Эти продукты, присутствуя совместно с ионами, из которых они образовались, представляют собой окислительно-восстановительные пары. Например, при электролизе раствора CuCl2 у катода образуется пара Cu2+/Cu, а у анода CI2/2ci-. Точно так же при электролизе CuSO4 у катода
образуется пара Cu2+/Cu, а у анода 02 + 4Н+/2Н20; при электролизе серной кислоты возникают пары 2Н+/Н2 (у катода) и O2 + 4Н+/2Н20 (у анода) и т. д.
Каждая пара имеет определенный окислительно-восстановительный потенциал и представляет собой полуэлемент. Когда два полуэлемента соединяют проводником первого рода, образуется гальванический элемент, имеющий собственную электродвижущую •силу (э. д. с). Направление этой э. д. с. противоположно той внешней э.д. е., которую прилагают при электролизе. Действительно, например при электролизе 1 M раствора CuCl2 потенциал образующейся у катода пары Cu2+/Cu равен стандартному потенциалу ее, т. е. +0,34 в (поскольку концентрация Си2+-ионов равна 1 г-ион/л, а концентрация твердой фазы Cu постоянна), потенциал пары С12/2С1- равняется +1,36 в, когда раствор становится насыщенным относительно Cl2 При давлении его в 1 атм. Как известно, пара с меньшим потенциалом (Cu2+/Cu) отдает в цепь электроны. Следовательно, при работе возникающего в результате электролиза гальванического элемента на электроде происходит процесс Cu—2е->Си2+. При этом медь растворяется, окисляясь до Cu2+.
Как этот процесс, так и направление тока в цепи обратны тем, которые возникают под влиянием внешней э. д. с. при электролизе. Так как при электролизе катионы движутся и разряжаются на электроде, присоединенном к отрицательному полюсу внешнего источника тока (с определенной э.д.с), от которого электрод получает электроны, этот электрод называется катодом; второй электрод, на котором разряжаются анионы (окисляются, т. е. отдают ему электроны), носит название анода.
Итак, в’ результате выделения на электродах продуктов электролиза в системе возникает э. д. с, обратная внешней э. д. с. источника тока. Это явление называется электрохимической поляризацией, а возникающая обратная э.д. с. — электродвижущей силой поляризации. В существовании ее нетрудно убедиться, если, выключив во время электролиза источник тока, соединить проводником электроды с клеммами гальванометра. При этом стрелка гальванометра отклонится в сторону, противоположную той, в которую она отклонялась под влиянием внешней э.д.с. при электролизе.
Электрохимическая поляризация не зависит от плотности тока * и возникает, когда на электродах выделяются продукты электролиза, отличные от материала самого электрода. Ее можно заметно уменьшить, прибавляя так называемые деполяризаторы, т. вещества, разряжающиеся прежде, чем те ионы, которые разряжались бы в их отсутствие. Например, если на электроде выделяется кислород или хлор, в качестве деполяризатора употребляется
* Плотностью тока называется сила тока, приходящаяся на единицу поверхности электрода.
солянокислый гидроксиламин NH2OH-HCl, окисляющийся на аноде при менее положительном потенциале, чем Cl- или молекулы H2O. Если на электроде выделяется водород, то в качестве деполяризаторов применяют окислители, например HNO3, (NH4) 2S2Oa и т. п.
Причиной поляризации может являться не только возникновение на электродах новых окислительно-восстановительных пар, но и изменение концентраций ионов при электролизе. Например, при электролизе раствора CuSO4 с медными электродами на аноде растворяется, а на катоде медь осаждается. Следовательно, на
обоих электродах присутствует одна и та же пара Cu2+/Cu, потенциал которой связан с концентрацией Cu2+ уравнением Нернста:
Напряжение E = 0,34 + °’°58 Ig [Cu2+J
Внешняя з. д. с. В процессе электролиза, несмотря
„ на диффузию ионов в растворе из бо-
Рис. 60. Изменение силы тока TTJ г , г „
с увеличением напряжения при лее концентрированных областей в ме-электролизе. нее, эта концентрация у анода не-
сколько увеличивается, а у катода — уменьшается и в результате возникает э. д. с. поляризации (концентрационная поляризация).
Таким образом, чтобы электролиз мог происходить, необходимо приложить к электродам напряжение, превышающее э. д. с. поляризации. Опыт вполне подтверждает это заключение. Например, если подвергать электролизу раствор CdSO4, подкисленный серной кислотой, при напряжениях меньше 2,03 в, то хотя в первый момент электролиз и начинается, но сейчас же сила тока в цепи снова понижается почти до нуля, и дальнейшее выделение продуктов электролиза прекращается. Наоборот, при напряжениях больше 2,03 в электролиз идет непрерывно, причем сила тока в цепи быстро увеличивается с увеличением напряжения сверх указанной величины (рис. 60).
Наименьшее напряжение, которое необходимо приложить к электродам для того, чтобы вызвать непрерывный электролиз данного электролита, называется его напряжением разложения (Ер).
Оно должно быть больше, чем разность потенциалов между анодом и катодом, иначе говоря, возникающей э. д. с. гальванического элемента (т. е. больше величины электрохимической поляризации).
Величины напряжения разложения различных электролитов приведены в табл. 23.
Значения приведенных в табл. 23 величин зависят и от катиона и от аниона, входящих в состав электролита. Например, напряже-
ние разложения для сульфатов различных металлов имеет разные значения (влияние природы катиона). Точно так же различны напряжения разложения сульфатов и хлоридов одного и того же металла (влияние природы аниона). Исключением являются такие кислородные кислоты, как H2SO4, HNO3, HClO4, H3PO4, а также едкие щелочи (КОН, NaOH), имеющие, несмотря на различие состава, практически одну и ту же величину напряжения разложения, равную приблизительно 1,7 в. Это зависит от того, что при электролизе растворов указанных соединений на электродах выделяются одни и те же продукты: H2 (на катоде) и O2 (на аноде) *.
Таблица 23. Напряжение разложения 1 н. растворов некоторых электролитов
Источник
Разность равновесных потенциалов электродных реакций называется обратимым напряжением разложения электролита Uo- Последнее численно равно э. д. с. электрохимической цепи, в которой протекает реакция, обратная реакции при электролизе. Например, обратимое напряжение разложения воды равно э. д. с. водороднокислородной цепи, при отборе тока от которой идет синтез воды из водорода и кислорода (см. 178). При 298 К э. д. с. этой цепи, а следовательно, и Uo равны 1,23 В. Учитывая соответствие между э. д. с. и обратимым напряжением разложения, последнее можно определить по термодинамическим данным согласно (175.9). При электролизе воды происходит выделение водорода на катоде и кислорода на аноде, причем каждый процесс сопровождается свойственным ему перенапряжением, зависящим, в первую очередь, от материала электродов [c.515]
Вычислить практический расход электроэнергии на 1 т алюминия, если практическое напряжение разложения 4,5 В прп выходе по току 90%. [c.215]
Электролиз. Напряжение разложения [c.513]
Величины напряжения разложения различных электролитов приведены в табл. 23. [c.428]
Теоретическое напряжение разложения, рассчитанное для реакции (б), меньще, чем для прямого электролиза воды оно составляет 0,17 В, тогда как при прямом электролизе воды ит(25°)= 1,23 В. Расчетные затраты для комбинированной установки меньще, чем при электролизе воды. Суммарный КПД процесса должен составить 35—37%. В качестве источника энергии для комбинированной системы может быть использован ядерный газовый реактор, снабжающий отбросной теплотой термохимическую ступень процесса и электроэнергией — электрохимическую. [c.83]
Теоретическое напряжение разложения хлорида натрия [c.227]
| Таблица 23. Напряжение разложения 1 н. растворов некоторых электролнтов |  |
Разделение и последовательное определение меди и никеля в растворе основано на различии напряжений разложения солей. Так, медь, стандартный потенциал которой (в паре Си +/Си) равен +0,34 в, восстанавливается на катоде значительно легче, чем никель, стандартный потенциал которого (в паре N +/N1) отрицателен ( ° = —0,23 в). При напряжении 2 в медь полностью осаждается на катоде даже из сильнокислых растворов, осаждение никеля в этих условиях не происходит. Для полного выделения никеля из раствора, оставшегося после выделения меди, необходимо не только повысить напряжение до 3—4 в, но и сильно понизить концентрацию Н+-ионов в растворе путем создания аммиачной среды. При этом Ы1 +-ионы превращаются в комплексные катионы [Ы1(ЫНз)4] +, остающиеся в растворе, а Ее +-ионы и некоторые другие катионы (если они присутствуют в растворе), не способные к образованию аммиачных комплексов, осаждаются в виде соответствующих гидроокисей и могут быть отделены фильтрованием. [c.444]
Наименьшее напряжение, которое необходимо приложить к электродам для того, чтобы вызвать непрерывный электролиз данного электролита, называется его напряжением разложения ( р). [c.428]
Но поскольку э. д. с. поляризации численно равна напряжению разложения ( р) данного электролита, закон Ома будет выражаться формулой [c.436]
Что такое электрохимическая поляризация Концентрационная поляризация Что является причиной существования определенного напряжения разложения [c.456]
В стандартных условиях (25°С, 0,1 МПа) теоретическое напряжение разложения электролита (воды) в соответствии с уравнением (П.27) составляет [c.80]
Из приведенных выше соображений ясно, что минимальная величина напряжения разложения должна быть равн.з э.д.с. поляризации. [c.615]
Электродные потенциалы представляют собой индивидуальные характеристики электрохимических реакций и зависят от условий их протекания. Разность потенциалов фд и ф поляризованных электродов называется напряжением разложения электролита U. Величины Фа и ф , в свою очередь, равны (см. 182) [c.515]
Фактическое напряжение разложения [c.228]
За вычетом напряжения разложения и повышения напряжения от вспышек остальная часть напряжения приходится на падение его в электролите и контактах 4,8— 1,7 — 0,06 = 3,04 В. Из этого значения на внешние (негреющие) контакты и проводники приходится 12%, т. е. 3,04-0,12 = 0,36 В, на внутренние греющие контакты и проводники — 20%, т. е. 3,04-0,2 = 0,61 В. Остальная часть падения напряжения определяется потерями в электролите 3,04 — 0,36 — 0,61 = 2,07 В. [c.231]
Процесс электролиза начинается в том случае, если напряжение, приложенное к электролизеру, превысит на бесконечно малую величину А теоретическое напряжение разложения Т т, т. е. если будет обеспечено условие [c.331]
Выше уже говорилось, что напряжение разложения должно превышать э. д. с. поляризации, которая представляет собой разность потенциалов, возникающих на электродах окислительно-вос-становительных пар. Эти потенциалы вычисляют по уравнению Нернста. Например, при электролизе 1 М раствора С(1504, подкисленного до pH = О (т. е. до [Н+] =1), потенциал пары Сё +/Сс1 равен стандартному потенциалу н= °=—0,40 в. Точно так же и потенциал пары О2 + 4Н+/2Н20 при [Н+] = 1 равен стандартному потенциалу этой пары, т. е. — +1,23 в. Поэтому следовало бы ожидать, что напряжение разложения 1 М раствора С(1504 должно равняться э. д. с. элемента, образующегося из данных пар, т. е. р = — = 1,23 — (-0,40) = 1,63 8. [c.429]
Одингжовые значения напряжении разложения являются экспериментальным доказательством справедливости представлений о том, что здесь разряжаются именно молекулы воды, а не 80 -, N0 -, С10 — или Ка — и К -ионы, так как иначе величины напряжений разложения всех указанных кислот и ще-лоч( й были бы различными. [c.429]
В качестве примера вычислим по этой формуле напряжение разложения для 1 М раствора H2SO4. При электролизе его на катоде образуется пара 2Н+/Нз и на аноде — пара О2 + 4Н+/2Н2О. Следовательно, а = 1,23 в, а , ( = 0. Если электролиз проводится с гладкими платиновыми электродами, то ria = 0,40 в и Г) ( = —0,07 в отсюда [c.431]
Для выделения каждого металла на катоде требуется приложить э. д. с., превышающую напряжение разложения подвергаемой электролизу соли. Поэтому, если анализируемый раствор содержит соли разных металлов, а значения напряжения разложения их отличаются достаточно сильно (на 0,2—0,4 в или более), то соответствующие металлы можно выделять из раствора и количественно определять один за другим. Поясним сказанное примером. Допустим, что электролизу подвергают смесь растворов Ад2504 н dS04, концентрация каждого из них равна 0,1 М Для [c.432]
II. Как можно теоретически вычислить напряжение разложения Что такое перепапряжение [c.456]
Отношение напряжения разложения к общему напряжению на ванне называют коэффпцпентом полезного НСПОЛЬЗОВаПИЯ напряжения Kna.ui- [c.202]
Определить количество электричества, необходимое для выделения 1 водорода и 0,5 кислорода, получаемых при электролизе воды. Теоретическое напряжение разложения поды равно 1,23 В (при 18 С), а фактическое превышает его в 1,5—2 раза. Рассчитать <[зактический расход электрической энергии. [c.204]
Задача 14.4. Вычислить выход но энергии (в процентах) при электролизе глииозсма в крполпте при постоянном теоретическом напряжеини разложения, равном 1,7 В, и практическом напряжении разложения [c.212]
Минимальная разность потенциалов, которую необходимо создать между электродами, чтобы электролиз начался, называется напряжением разложения электролита. Очевидно, эта величина равна сумме потенциалов разряда ионов на электродах. При отсутствии перенапряжения (см. ниже) на электродах напряжение разложения равно сумме равновесных потегщиалов электродов, образующихся после начала электролиза (в выше разобранном примере — электролиз НС1, aq — равно сумме равновесных потенциалов хлорного и водородного электродов). При [c.614]
Величина напряжения разложения более или менее точно может быть определена для данного электролита определенной концентрации лишь в случае выделения на электродах чистых твердых веществ. Если при электролизе на электродах образуются гвердые или жидкие растворы и, особенно, при выделении газов, напряжение разложения зависит от формы и размеров эл( ктродов, характера их поверхности, условий удаления газов и многих других обстоятельств, подчас не учитываемых Поэтому величина напряжения разложения не может служи ь однозначной характеристикой для любого электролита при различных условиях, так же как и величины потенциалов разряда ионов. Величина э.д.с. электрохимической поляризании при электролизе отражает э.д.с., реально возникающую при приложении внешней разности потенциалов и противодействующую электролизу независимо от того, протекает электролиз или он подавлен э.д.с. электрохимической поляризации. В частном случае возникающая на электродах предельная поляризация может быть как раз лишь незначительно меньшей, чем приложенная разность потенциалов. Тогда эта разность равна сумме потенциалов разряда ионов (напряжению разложения). [c.615]
Однако во многих случаях для того, чтобы электролиз начался, необходимо приложить к электролитической ванне извне разность потенциалов, на конечную величину большую, чем разность равновесных потенциалов электродов, образующихся при лектролизе. Как было сказано выше, эта минимальная вели-, чина приложенной извне разности потенциалов называется напряжением разложения. Разность между напряжением разложения и суммой равновесных потенциалов на электродах называется перенапряжением. [c.618]
Общая химия (1984) — [
c.298
]
Теоретические основы аналитической химии 1987 (1987) — [
c.278
]
Краткий курс физической химии (1979) — [
c.135
]
Лабораторный практикум по теоретической электрохимии (1979) — [
c.111
]
Руководство по физической химии (1988) — [
c.326
]
Технология редких металлов в атомной технике (1974) — [
c.259
]
Практические работы по физической химии (1961) — [
c.238
]
Учебник физической химии (1952) — [
c.303
]
Курс химии Часть 1 (1972) — [
c.288
]
Практикум по теоретической электрохимии (1954) — [
c.133
]
Технический анализ Издание 2 (1958) — [
c.322
]
Курс теоретической электрохимии (1951) — [
c.267
]
Электродные процессы в органической химии (1961) — [
c.13
]
Количественный анализ (1963) — [
c.511
,
c.513
]
Общая химическая технология неорганических веществ 1964 (1964) — [
c.310
,
c.315
,
c.338
,
c.354
]
Общая химическая технология неорганических веществ 1965 (1965) — [
c.310
,
c.315
,
c.338
,
c.354
]
Объёмный анализ Том 1 (1950) — [
c.291
]
Основы аналитической химии Книга 2 (1961) — [
c.24
]
Производство хлора и каустической соды (1966) — [
c.59
]
Технология содопродуктов (1972) — [
c.271
]
Общая химия Издание 4 (1965) — [
c.189
]
Курс технологии минеральных веществ Издание 2 (1950) — [
c.125
]
Физическая химия Том 2 (1936) — [
c.414
]
Основы физической и коллоидной химии Издание 3 (1964) — [
c.248
]
Химические источники тока (1948) — [
c.74
]
Количественный анализ (0) — [
c.501
,
c.503
]
Практикум по физической химии (1950) — [
c.237
,
c.239
]
Учебник физической химии (0) — [
c.333
]
Количественный анализ (0) — [
c.195
]
Общая химическая технология Том 1 (1953) — [
c.553
,
c.560
,
c.572
]
Краткий курс физической химии Издание 3 (1963) — [
c.438
]
Курс физической химии Издание 3 (1975) — [
c.611
]
Практикум по физической химии Изд 4 (1975) — [
c.357
]