Насыщенный пар используется во многих областях промышленности, поэтому для работы различных устройств важно поддерживать состояние насыщения пара.
Рассмотрим, как определить насыщенный пар или нет. Также в статье даны способы определения насыщенности пара, формула и примеры расчета.
Содержание
- Данные для определения насыщенности
- Методы
- Как найти?
- Как рассчитать?
- Несколько примеров
- Где эти расчеты могут пригодиться на практике?
- Заключение
Данные для определения насыщенности
Насыщенный пар или нет, можно определить, зная условия его возникновения и зависимость от различных факторов:
- Этот тип пара образуется только в закрытых сосудах.
- Образуется только над поверхностью исходной жидкости или льдом.
- Имеет свойство конденсации.
- Насыщен влагой.
- Температура пара всегда равна температуре его жидкости.
- Плотность и давления такого пара не зависят от объема.
- Насыщенный пар имеет прямую зависимость от температуры и давления.
Насыщенный пар находится в термодинамическом равновесии с жидкостью из которой он образован. На это указывает равенство массы испарения и последующей конденсации.
Методы
Математический способ определения насыщенного пара используется при вычислении на основе имеющихся данных о его давлении, температуре, влажности и по иным параметрам.
Также есть метод определения на основе отдельных данных:
- Замер температуры пара. Указывает на состояние насыщенного пара при условии равенства температур газа и жидкости. Любое отклонение от равенства укажет на потерю динамического равновесия и уровня влажности.
- По давлению. Измеряется давление пара и сравнивается с табличной величиной при актуальной температуре.
- По степени конденсации. Рассчитывается температура конденсата и скорость его образования.
- По уровню влажности. Влажность насыщенного пара всегда равна 100%.
Также существует метод определения по точке кипения. Он основан на расчете скорости парообразования при актуальном давлении. Например, при давлении 101 кПа, точкой парообразования является температура 100 градусов.
Существуют также некоторые лабораторные методы определения:
- статический,
- динамический,
- кинетический.
Они также основаны на замерах температуры, давления, плотности, влажности и конденсации при определенных условиях и сравнении полученных данных с таблицей насыщенного пара по температуре и давлению.
Как найти?
Свойства насыщенного пара не позволяют приравнивать его к идеальному газу, поэтому для его расчета используется формула Менделеева-Клапейрона.
Как рассчитать?
Расчет выполнятся по формуле: pV=vRT.

- «p» — давление насыщенного пара (Па);
- «V» — его объем (м3);
- «v» — общее количество вещества (моль);
- «R» — газовая постоянная (8,31 м2);
- «T» — температура среды (К).
Данная формула помогает рассчитать не только параметры насыщенного пара, но и их изменения при изменении плотности, объема или давления.
Несколько примеров
Задача:
- В цилиндре находится насыщенный пар и вода при постоянной температуре.
- Поршень сдвигается, уменьшая свободный объем пространства.
- Выяснить, как повлияет уменьшение объема на общую массу жидкости.
Ответ: масса жидкости увеличится, по причине обратного фазового перехода пара в жидкость.
Согласно уравнению pV=m/u*Rt, при снижении общего объема пара не последует снижения его давления, а значит пар конденсируется обратно в воду, увеличив ее общую массу.
Задача:
- Температура насыщенного пара 100 градусов.
- Давление 101 кПа.
- Плотность неизвестна.
Решение: P=pu/Rt=105*18*10-3/8,31*373=0,5 кг/м3.
Ответ: насыщенный пар при температуре 100 градусов по Цельсию и при давлении 101 кПа имеет плотность 0,5 кг/м3. При решении данной задачи использовались табличные величины молярной массы, газовой постоянной и давлении при данной температуре.
Где эти расчеты могут пригодиться на практике?

- при проектировании бытовых систем вентиляции и кондиционирования;
- для эффективной работы отопительных систем;
- при проектировании и поддержании работы паровых турбинных установок.
На основе этих расчетов строятся «умные» датчики влажности, которые реагируют на количество молекул воды или иных веществ в воздухе. Свойства насыщенного пара также применяются при выпаривании летучих веществ с их очисткой за счет последующей конденсации их насыщенных паров.
Заключение
Свойства насыщенного пара не делают его идеальным газом, но позволяют использовать в быту и в промышленности. Этот пар является идеальным источником тепла, влажности и помогает разделять химические элементы за счет способности к конденсации.
Формула расчета по уравнению Менделеева-Клапейрона позволяет рассчитать основные параметры пара и определить степень его схожести с насыщенным.
Насыщенные и ненасыщенные пары.
Рассмотрим процессы, происходящие в закрытом сосуде:
- процесс испарения, скорость которого постепенно уменьшается
- конденсации, скорость которого постепенно возрастает
С течением времени в сосуде закрытом крышкой между жидкостью и её паром устанавливается состояние динамического (подвижного) равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, то есть когда скорости процессов испарения и конденсации одинаковы. Такую систему называютдвухфазной.
Пар, находящийся в динамическом равновесии со своей жидкостью, называютнасыщенным.
Название «насыщенный» подчеркивает, что в данном объеме при данной температуре не может находиться большее количество пара.
Ненасыщенный пар – это пар, не достигший динамического равновесия со своей жидкостью. При данной температуре давление ненасыщенного пара всегда меньше давления насыщенного пара. При наличии над поверхностью жидкости ненасыщенного пара процесс парообразования преобладает над процессом конденсации, и потому жидкости в сосуде с течением времени становится все меньше и меньше.
Рассмотрим некоторые свойства насыщенного пара:
1. Концентрация молекул насыщенного пара не зависит от его объёма при постоянной температуре. Если уменьшить объем насыщенного пара, то сначала концентрация его молекул увеличится и из газа в жидкость начнет переходить больше молекул до тех пор, пока опять на установится динамическое равновесие.
2. Давление насыщенного пара при постоянной температуре не зависит от его объёма.
p = n*k*T, т.к. n не зависит от V , то и р не зависит от V.
Независимое от объёма давление пара, при котором жидкость находится в равновесии со своим паром, называется давлением насыщенного пара. Это наибольшее давление, которое может иметь пар при данной температуре.
3. Давление насыщенного пара зависит от температуры. Чем выше будет температура жидкости, тем больше молекул будет испаряться, динамическое равновесие нарушится, но концентрация молекул пара будет расти до тех пор, пока равновесие не установится опять, а значит, больше станет и давление насыщенного пара. С увеличением температуры давление насыщенных паров возрастает.
В атмосферном воздухе всегда присутствуют пары воды, которая испаряется с поверхности морей, рек, океанов и т.п.
Воздух, содержащий водяной пар, называют влажным.
Влажность воздуха оказывает огромное влияние на многие процессы на Земле: на развитие флоры и фауны, на урожай сельхоз. культур, на продуктивность животноводства и т.д. Влажность воздуха имеет большое значение для здоровья людей, т.к. от неё зависит теплообмен организма человека с окружающей средой. При низкой влажности происходит быстрое испарение с поверхности и высыхание слизистой оболочки носа, гортани, что приводит к ухудшению состояния.
Значит, влажность воздуха надо уметь измерять. Для количественной оценки влажности воздуха используют понятия абсолютной и относительной влажности.
Абсолютная влажность – величина, показывающая, какая масса паров воды находится в 1 м³ воздуха. Она равна парциальному давлению пара при данной температуре.
Парциальное давление пара – это давление, которое оказывал бы водяной пар, находящийся в воздух , если бы все остальные газы отсутствовали.
Относительная влажность воздуха – это величина, показывающая, как далек пар от насыщения. Это отношение парциального давления p водяного пара, содержащегося в воздухе при данной температуре, к давлению насыщенного пара p0 при той же температуре, выраженное в процентах:
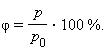
Если воздух не содержит паров воды, то его абсолютная и относительная влажность равны 0.
Если влажный воздух охлаждать, то находящийся в нем пар можно довести до насыщения, и далее он будет конденсироваться.
Примеры:
выпадение росы под утро,
запотевание холодного стекла, если на него подышать,
образование капли воды на холодной водопроводной трубе,
сырость в подвалах домов.
Точка росы – это температура, при которой водяной пар, содержащийся в воздухе, становится насыщенным.
Точка росы также характеризует влажность воздуха.
|
C° |
Точка россы при относительной влажности воздуха в % |
|||||||||||||
|
30% |
35% |
40% |
45% |
50% |
55% |
60% |
65% |
70% |
75% |
80% |
85% |
90% |
95% |
|
|
30 |
10,5 |
12,9 |
14,9 |
16,8 |
18,4 |
20 |
21,4 |
22,7 |
23,9 |
25,1 |
26,2 |
27,2 |
28,2 |
29,1 |
|
29 |
9,7 |
12 |
14 |
15,9 |
17,5 |
19 |
20,4 |
21,7 |
23 |
24,1 |
25,2 |
26,2 |
27,2 |
28,1 |
|
28 |
8,8 |
11,1 |
13,1 |
15 |
16,6 |
18,1 |
19,5 |
20,8 |
22 |
23,2 |
24,2 |
25,2 |
26,2 |
27,1 |
|
27 |
8 |
10,2 |
12,2 |
14,1 |
15,7 |
17,2 |
18,6 |
19,9 |
21,1 |
22,2 |
23,3 |
24,3 |
25,2 |
26,1 |
|
26 |
7,1 |
9,4 |
11,4 |
13,2 |
14,8 |
16,3 |
17,6 |
18,9 |
20,1 |
21,2 |
22,3 |
23,3 |
24,2 |
25,1 |
|
25 |
6,2 |
8,5 |
10,5 |
12,2 |
13,9 |
15,3 |
16,7 |
18 |
19,1 |
20,3 |
21,3 |
22,3 |
23,2 |
24,1 |
|
24 |
5,4 |
7,6 |
9,6 |
11,3 |
12,9 |
14,4 |
15,8 |
17 |
18,2 |
19,3 |
20,3 |
21,3 |
22,3 |
23,1 |
|
23 |
4,5 |
6,7 |
8,7 |
10,4 |
12 |
13,5 |
14,8 |
16,1 |
17,2 |
18,3 |
19,4 |
20,3 |
21,3 |
22,2 |
|
22 |
3,6 |
5,9 |
7,8 |
9,5 |
11,1 |
12,5 |
13,9 |
15,1 |
16,3 |
17,4 |
18,4 |
19,4 |
20,3 |
21,1 |
|
21 |
2,8 |
5 |
6,9 |
8,6 |
10,2 |
11,6 |
12,9 |
14,2 |
15,3 |
16,4 |
17,4 |
18,4 |
19,3 |
20,2 |
|
20 |
1,9 |
4,1 |
6 |
7,7 |
9,3 |
10,7 |
12 |
13,2 |
14,4 |
15,4 |
16,4 |
17,4 |
18,3 |
19,2 |
|
19 |
1 |
3,2 |
5,1 |
6,8 |
8,3 |
9,8 |
11,1 |
12,3 |
13,4 |
14,5 |
15,3 |
16,4 |
17,3 |
18,2 |
|
18 |
0,2 |
2,3 |
4,2 |
5,9 |
7,4 |
8,8 |
10,1 |
11,3 |
12,5 |
13,5 |
14,5 |
15,4 |
16,3 |
17,2 |
|
17 |
-0,6 |
1,4 |
3,3 |
5 |
6,5 |
7,9 |
9,2 |
10,4 |
11,5 |
12,5 |
13,5 |
14,5 |
15,3 |
16,2 |
|
16 |
-1,4 |
0,5 |
2,4 |
4,1 |
5,6 |
7 |
8,2 |
9,4 |
10,5 |
11,6 |
12,6 |
13,5 |
14,4 |
15,2 |
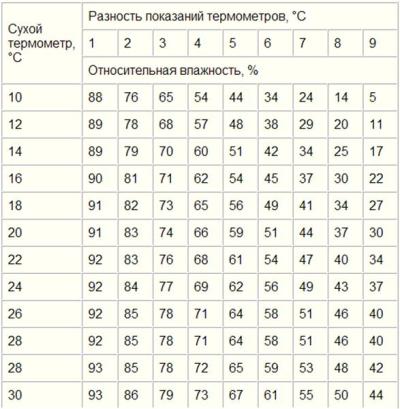
Для измерения влажности воздуха используют приборы гигрометры и психрометры.
1. Конденсационный гигрометр.
Состоит из укрепленной на подставке металлической круглой коробочки с отполированной плоской поверхностью. В коробочке сверху имеются два отверстия. Через одно из них в коробочку наливают эфир и вставляют термометр, а другое соединяют с резиновой грушей. Действие конденсационного гигрометра основано на определении точки росы.
Продувают воздух через эфир (с помощью резиновой груши), при этом эфир быстро испаряется и охлаждает коробочку. При определенной температуре на отполированной поверхности коробочки появляются капельки воды (роса). По термометру определяют эту температуру, это и будет точка росы. В специальной таблице по точке росы находят абсолютную влажность.
Чтобы найти относительную влажность, надо давление насыщенного пара при температуре точки росы разделить на давление насыщенного пара при температуре окружающего воздуха и умножить на 100%.
2. Волосной гигрометр.
Его работа основана на том, что обезжиренный человеческий волос при увеличении влажности воздуха удлиняется, а при уменьшении влажности укорачивается. Волос оборачивают вокруг легкого блока, прикрепив один конец к раме, а к другому подвешивают груз. При изменении длины волоса указатель (стрелка), прикрепленный к блоку, будет двигаться, перемещаясь по шкале. Шкалу градуируют по эталонному прибору.
3. Психрометр. (от греч «психриа» — холод).
Состоит из двух одинаковых термометров. Резервуар одного из них обернут марлей, опущенной в сосуд с водой. Вода смачивает резервуар термометра и при её испарении он охлаждается. По разности температур сухого и влажного термометров по психрометрической таблице определяют влажность воздуха.
Как читать таблицы водяного пара
Если вы едете по неизвестной местности, вам понадобится карта или навигатор, если вы летите на самолете, вам не обойтись без расписания полётов. Так и таблицы водяного пара необходимы всем пользователям в индустрии пара. В этой статье мы познакомимся с таблицами пара, рассмотрим их виды и немного поговорим о присутствующих в них элементах.
Таблицы насыщенного водяного пара
Таблицы насыщенного водяного пара — необходимый инструмент для любого инженера, работающего с паром. Обычно их используют для определения зависимости температуры насыщенного пара от парового давления или, наоборот, давления от температуры насыщенного пара. Кроме этих параметров, таблицы обычно включают и другие показатели, такие как удельная энтальпия (h) и удельный объём (v).
Данные таблиц насыщенного водяного пара всегда отображают информацию о конкретной точке насыщения известной как точка кипения. Это точка, в которой вода (жидкость) и пар (газ) могут сосуществовать при одинаковых температуре и давлении. Так как H2O может быть и в жидком, и в газообразном состоянии, нам будут необходимы две подборки данных: данные о насыщенной воде (жидкости), которые обычно обозначаются подстрочной буквой f, и данные о насыщенном паре (газе), которые обозначают подстрочной буквой g.
Пример таблицы насыщенного пара
Обозначения:
- P = Давление пара/воды
- T = Точка насыщения пара/воды (точка кипения)
- vf = Удельный объём насыщенной воды (жидкости)
- vg = Удельный объём насыщенного пара (газа)
- hf = Удельная энтальпия насыщенной воды (энергия, необходимая для подогрева воды от 0 °C до точки кипения)
- hfg = Скрытое тепло испарения (энергия, необходимая для трансформации насыщенной воды в насыщенный пар)
- hg = Удельная энтальпия насыщенного пара (энергия, необходимая для получения пара из воды с температурой 0 °C)
* Источник: 1999 таблицы пара Японского общества инженеров-механиков
При нагреве обычно используется скрытое тепло испарения (Hfg). Как видно из таблицы, это скрытое тепло испарения будет выше при более низком давлении. По мере увеличения парового давления скрытое тепло постепенно снижается и достигает 0 при суперкритическом давлении, например, 22.06 МПа.
Полезно знать
Два формата: на основе давления и температуры
Так как давление и температура насыщенного пара напрямую связаны друг с другом, таблицы пара обычно доступны в двух форматах: на основе давления и температуры. В обоих содержится одинаковая информация, но классифицирована она по-разному.
Таблица насыщенного водяного пара, основанная на давлении
| Давл. (изб.) | Темп. | Удельный объём | Удельная энтальпия | |||
|---|---|---|---|---|---|---|
| кПа изб. | °C | м3/кг | кДж/кг | |||
| P | T | Vf | Vg | Hf | Hfg | Hg |
| 0 | 99.97 | 0.0010434 | 1.673 | 419.0 | 2257 | 2676 |
| 20 | 105.10 | 0.0010475 | 1.414 | 440.6 | 2243 | 2684 |
| 50 | 111.61 | 0.0010529 | 1.150 | 468.2 | 2225 | 2694 |
| 100 | 120.42 | 0.0010607 | 0.8803 | 505.6 | 2201 | 2707 |
Таблица насыщенного водяного пара, основанная на температуре
| Темп. | Давл. (изб.) | Удельный объём | Удельная энтальпия | |||
|---|---|---|---|---|---|---|
| °C | кПа изб. | м3/кг | кДж/кг | |||
| T | P | Vf | Vg | Hf | Hfg | Hg |
| 100 | 0.093 | 0.0010435 | 1.672 | 419.1 | 2256 | 2676 |
| 110 | 42.051 | 0.0010516 | 1.209 | 461.4 | 2230 | 2691 |
| 120 | 97.340 | 0.0010603 | 0.8913 | 503.8 | 2202 | 2706 |
| 130 | 168.93 | 0.0010697 | 0.6681 | 546.4 | 2174 | 2720 |
| 140 | 260.18 | 0.0010798 | 0.5085 | 589.2 | 2144 | 2733 |
| 150 | 374.78 | 0.0010905 | 0.39250 | 632.3 | 2114 | 2746 |
Разные единицы измерения: избыточное и абсолютное давление
Таблицы насыщенного пара также используют два различных вида давления: абсолютное и манометрическое (избыточное).
- Абсолютное давление — это нулевая точка по отношению к абсолютному вакууму.
- Манометрическое давление — это нулевая точка по отношению к атмосферному давлению (101.3 кПа).
Таблица насыщенного пара с абсолютным давлением
| Давл. (абс.) | Темп. | Удельный объём | Удельная энтальпия | |||
|---|---|---|---|---|---|---|
| кПа | °C | м3/кг | кДж/кг | |||
| P | T | Vf | Vg | Hf | Hfg | Hg |
| 0 | — | — | — | — | — | — |
| 20 | 60.06 | 0.0010103 | 7.648 | 251.4 | 2358 | 2609 |
| 50 | 81.32 | 0.0010299 | 3.240 | 340.5 | 2305 | 2645 |
| 100 | 99.61 | 0.0010432 | 1.694 | 417.4 | 2258 | 2675 |
Таблица насыщенного пара с избыточным давлением
| Давл. (изб.) | Темп. | Удельный объём | Удельная энтальпия | |||
|---|---|---|---|---|---|---|
| кПа изб. | °C | м3/кг | кДж/кг | |||
| P | T | Vf | Vg | Hf | Hfg | Hg |
| 0 | 99.97 | 0.0010434 | 1.673 | 419.0 | 2257 | 2676 |
| 20 | 105.10 | 0.0010475 | 1.414 | 440.6 | 2243 | 2684 |
| 50 | 111.61 | 0.0010529 | 1.150 | 468.2 | 2225 | 2694 |
| 100 | 120.42 | 0.0010607 | 0.8803 | 505.6 | 2201 | 2707 |
Избыточное давление было придумано для простоты измерения давления по отношению к тому, которое мы обычно испытываем.
В таблицах пара, составленных на основе манометрического давления, атмосферное давление определяется как 0, а в таблицах с абсолютным давлением — 101.3 кПа. А для того чтобы отличать избыточное давление от абсолютного в конце добавляют «изб.», например, кПа изб. или фт/кв. дюйм изб..
Перевести показатели избыточного давления в показатели абсолютного
Для единиц СИ
Давление пара [кПа изб.] = Давление пара [кПа изб.] + 101.3 кПа
Важное замечание: Проблемы могут возникнуть в том случае, если перепутать абсолютное и манометрическое давление, именно поэтому надо быть особенно внимательными с единицами давления, указанными в таблице.
Сводная таблица
Избыточное давление
- Нулевая точка отсчёта при атмосферном давлении*
- Нулевое давление = Атмосферное давление
Абсолютное давление:
- Нулевая точка отсчёта при атмосферном давлении
- Нулевое давление = Абсолютный вакуум
*Атмосферное давление — 101.3 кПа
Таблицы перенасыщенного пара
Информацию о перенасыщенном паре нельзя получить из обычных таблиц насыщенного пара, для этого существуют специальные таблицы перенасыщенного пара. Происходит это потому, что температура перенасыщенного пара в отличии от температуры насыщенного может существенно меняться при одном и том же давлении.
В действительности, количество возможных комбинаций температуры и давления настолько велико, что даже теоретически не представляется возможным собрать их в одной таблице. В результате для перегретого пара используется общая сводная таблица данных о температуре и давлении.
Пример таблицы перенасыщенного пара
В приведенной выше таблице есть данные об удельном объёме (Vg), удельной энтальпии (Hg) и удельном тепле (Sg) при типичных значениях давления и температуры.
Насыщенный пар
-
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
-
Испарение и конденсация
-
Динамическое равновесие
-
Свойства насыщенного пара
-
Влажность воздуха
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
Если открытый стакан с водой оставить на долгое время, то в конце концов вода полностью улетучится. Точнее — испарится. Что такое испарение и почему оно происходит?
Испарение и конденсация
При данной температуре молекулы жидкости обладают разными скоростями. Скорости большинства молекул находятся вблизи некоторого среднего значения (характерного для этой температуры). Но попадаются молекулы, скорости которых значительно отличаются от средней как в меньшую, так и большую сторону.
На рис. 1 изображён примерный график распределения молекул жидкости по скоростям. Голубым фоном показано то самое большинство молекул, скорости которых группируются около среднего значения. Красный «хвост» графика — это небольшое число «быстрых» молекул, скорости которых существенно превышают среднюю скорость основной массы молекул жидкости.
Рис. 1. Распределение молекул по скоростям
Когда такая весьма быстрая молекула окажется на свободной поверхности жидкости (т.е. на границе раздела жидкости и воздуха), кинетической энергии этой молекулы может хватить на то, чтобы преодолеть силы притяжения остальных молекул и вылететь из жидкости. Данный процесс и есть испарение, а молекулы, покинувшие жидкость, образуют пар.
Итак, испарение — это процесс превращения жидкости в пар, происходящий на свободной поверхности жидкости (при особых условиях превращение жидкости в пар может происходить по всему объёму жидкости. Данный процесс вам хорошо известен — это кипение).
Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость.
Процесс перехода молекул пара в жидкость называется конденсацией. Конденсация пара — процесс, обратный испарению жидкости.
к оглавлению ▴
Динамическое равновесие
А что будет, если сосуд с жидкостью герметично закрыть? Плотность пара над поверхностью жидкости начнёт увеличиваться; частицы пара будут всё сильнее мешать другим молекулам жидкости вылетать наружу, и скорость испарения станет уменьшаться. Одновременно начнёт увеличиваться скорость конденсации, так как с возрастанием концентрации пара число молекул, возвращающихся в жидкость, будет становиться всё больше.
Наконец, в какой-то момент скорость конденсации окажется равна скорости испарения. Наступит динамическое равновесие между жидкостью и паром: за единицу времени из жидкости будет вылетать столько же молекул, сколько возвращается в неё из пара. Начиная с этого момента количество жидкости перестанет убывать, а количество пара — увеличиваться; пар достигнет «насыщения».
Насыщенный пар — это пар, который находится в состоянии динамического равновесия со своей жидкостью. Пар, не достигший состояния динамического равновесия с жидкостью, называется ненасыщенным.
Давление и плотность насыщенного пара обозначаются и
. Очевидно,
и
— это максимальные давление и плотность, которые может иметь пар при данной температуре. Иными словами, давление и плотность насыщенного пара всегда превышают давление и плотность ненасыщенного пара.
к оглавлению ▴
Свойства насыщенного пара
Оказывается, что состояние насыщенного пара (а ненасыщенного — тем более) можно приближённо описывать уравнением состояния идеального газа (уравнением Менделеева — Клапейрона). В частности, имеем приближённое соотношение между давлением насыщенного пара и его плотностью:
(1)
Это весьма удивительный факт, подтверждаемый экспериментом. Ведь по своим свойствам насыщенный пар существенно отличается от идеального газа. Перечислим важнейшие из этих отличий.
1. При неизменной температуре плотность насыщенного пара не зависит от его объёма.
Если, например, насыщенный пар изотермически сжимать, то его плотность в первый момент возрастёт, скорость конденсации превысит скорость испарения, и часть пара конденсируется в жидкость — до тех пор, пока вновь не наступит динамическое равновесие, в котором плотность пара вернётся к своему прежнему значению.
Аналогично, при изотермическом расширении насыщенного пара его плотность в первый момент уменьшится (пар станет ненасыщенным), скорость испарения превысит скорость конденсации, и жидкость будет дополнительно испаряться до тех пор, пока опять не установится динамическое равновесие — т.е. пока пар снова не станет насыщенным с прежним значением плотности.
2. Давление насыщенного пара не зависит от его объёма.
Это следует из того, что плотность насыщенного пара не зависит от объёма, а давление однозначно связано с плотностью уравнением (1).
Как видим, закон Бойля — Мариотта, справедливый для идеальных газов, для насыщенного пара не выполняется. Это и не удивительно — ведь он получен из уравнения Менделеева — Клапейрона в предположении, что масса газа остаётся постоянной.
3. При неизменном объёме плотность насыщенного пара растёт с повышением температуры и уменьшается с понижением температуры.
Действительно, при увеличении температуры возрастает скорость испарения жидкости.
Динамическое равновесие в первый момент нарушается, и происходит дополнительное испарение некоторой части жидкости. Пара будет прибавляться до тех пор, пока динамическое равновесие вновь не восстановится.
Точно так же при понижении температуры скорость испарения жидкости становится меньше, и часть пара конденсируется до тех пор, пока не восстановится динамическое равновесие — но уже с меньшим количеством пара.
Таким образом, при изохорном нагревании или охлаждении насыщенного пара его масса меняется, поэтому закон Шарля в данном случае не работает. Зависимость давления насыщенного пара от температуры уже не будет линейной функцией.
4. Давление насыщенного пара растёт с температурой быстрее, чем по линейному закону.
В самом деле, с увеличением температуры возрастает плотность насыщенного пара, а согласно уравнению (1) давление пропорционально произведению плотности на температуру.
Зависимость давления насыщенного пара от температуры является экспоненциальной (рис. 2). Она представлена участком 1–2 графика. Эту зависимость нельзя вывести из законов идеального газа.
Рис. 2. Зависимость давления пара от температуры
В точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3).
Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
к оглавлению ▴
Влажность воздуха
Воздух, содержащий водяной пар, называется влажным.Чем больше пара находится в воздухе, тем выше влажность воздуха.
Абсолютная влажность — это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха — это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
Из уравнения Менделеева-Клапейрона (1) следует, что отношение давлений пара равно отношению плотностей. Так как само уравнение (1), напомним, описывает насыщенный пар лишь приближённо, мы имеем приближённое соотношение:
Одним из приборов, измеряющих влажность воздуха, является психрометр. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
Спасибо за то, что пользуйтесь нашими публикациями.
Информация на странице «Насыщенный пар» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать необходимые и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
Жидкости имеют свойство испаряться. Если бы мы капнули на стол по капле воды, эфира и ртути (только не делайте этого в домашних условиях!), смогли бы наблюдать, как постепенно капли исчезают – испаряются. Одни жидкости испаряются быстрее, другие медленнее. Процесс испарения жидкости еще называется парообразованием. А обратный процесс превращения пара в жидкость – конденсацией.
Эти два процесса иллюстрируют фазовый переход – процесс перехода веществ из одного агрегатного состояния в другое:
- испарение (переход из жидкого в газообразное состояние);
- конденсация (переход из газообразного состояния в жидкое);
- десублимация (переход из газообразного состояния в твердое, минуя жидкую фазу);
- возгонка, она же сублимация (переход из твердого в газообразное состояние, минуя жидкое).
Сейчас, к слову, подходящий сезон, чтобы наблюдать процесс десублимации в природе: иней и изморозь на деревьях и предметах, морозные узоры на окнах – ее результат.
Как образуется насыщенный и ненасыщенный пар
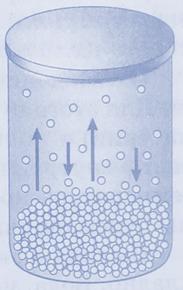
Но вернемся к парообразованию. Мы продолжим экспериментировать и нальем жидкость – воду, например, в открытый сосуд, а к нему подсоединим манометр. Невидимое глазу, в сосуде происходит испарение. Все молекулы жидкости находятся в непрерывном движении. Некоторые движутся так быстро, что их кинетическая энергия оказывается сильнее той, что связывает молекулы жидкости вместе.
Покинув жидкость, эти молекулы продолжают хаотически двигаться в пространстве, подавляющее их большинство рассеивается в нем – так образуется ненасыщенный пар. Лишь небольшая их часть возвращается обратно в жидкость.
Если закроем сосуд, молекул пара постепенно будет становиться все больше. И все больше их будет возвращаться в жидкость. При этом будет увеличиваться давление пара. Это зафиксирует подсоединенный к сосуду манометр.
Спустя какое-то время число молекул, вылетающих из жидкости и возвращающихся в нее, сравняется. Давление пара перестанет изменяться. В результате насыщения пара установится термодинамическое равновесие системы жидкость-пар. То есть испарение и конденсация будут равны.
Свойства насыщенного пара
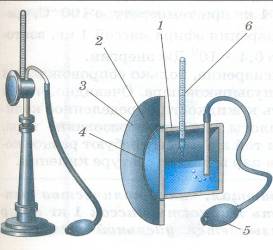
Чтобы их проиллюстрировать наглядно, используем еще один эксперимент. Призовите всю силу своего воображения, чтобы представить его. Итак, возьмем ртутный манометр, состоящий из двух колен – сообщающихся трубок. В оба налита ртуть, один конец открыт, второй запаян и над ртутью в нем находится еще некоторое количество эфира и его насыщенного пара. Если опускать и поднимать не запаянное колено, уровень ртути в запаянном будет также опускаться и подниматься.
При этом будет изменяться и количество (объем) насыщенного пара эфира. Разность уровней ртутных столбиков в обоих коленах манометра показывает давление насыщенного пара эфира. Оно будет сохраняться неизменным все время.
Отсюда вытекает свойство насыщенного пара – его давление не зависит от занимаемого им объема. Давление насыщенных паров различных жидкостей (воды и эфира, к примеру) разное при одинаковой температуре.
Однако температура насыщенного пара имеет значение. Чем выше температура, тем выше и давление. Давление насыщенного пара с увеличением температуры возрастает быстрее, чем это происходит с ненасыщенным паром. Температура и давление ненасыщенного пара связаны линейной зависимостью.
Можно провести еще один любопытный опыт. Взять пустую колбу без паров жидкости, закрыть ее и подсоединить манометр. Постепенно, по капле, подавать внутрь колбы жидкость. По мере поступления жидкости и ее испарения устанавливается давление насыщенного пара, наибольшее для данной жидкости при данной температуре.
Еще о температуре и насыщенном паре
Температура пара влияет и на скорость конденсации. Так же, как температура жидкости определяет скорость испарения – число молекул, которые вылетают с поверхности жидкости в единицу времени, другими словами.
У насыщенного пара его температура равна температуре жидкости. Чем выше температура насыщенного пара, тем выше его давление и плотность, ниже плотность жидкости. При достижении критической для вещества температуры плотность жидкости и пара одинаковая. Если температура пара выше критической для вещества температуры, физические различия между жидкостью и насыщенным паром стираются.
Определение давления насыщенного пара в смеси с другими газами
Мы сказали о неизменном при постоянной температуре давлении насыщенного пара. Мы определяли давление в «идеальных» условиях: когда в сосуде или колбе присутствуют жидкость и пар только одного вещества. Рассмотрим еще эксперимент, в котором молекулы вещества рассеяны в пространстве в смеси с другими газами.
Для этого возьмем два открытых стеклянных цилиндра и поместим в оба закрытые сосуды с эфиром. Как водится, подсоединим манометры. Один сосуд с эфиром раскрываем, после чего манометр фиксирует повышение давления. Разность между этим давлением и давлением в цилиндре с закрытым сосудом эфира и позволяет узнать давление насыщенного пара эфира.
О давлении и кипении
Испарение возможно не только с поверхности жидкости, но и в ее объеме – тогда его называют кипением. При повышении температуры жидкости образуются пузырьки пара. Когда давление насыщенного пара больше либо равно давлению газа в пузырьках, жидкость испаряется внутрь пузырьков. А те расширяются и поднимаются на поверхность.
Жидкости кипят при разных температурах. В обычных условиях вода закипает при 1000С. Но с изменением атмосферного давления меняется и температура кипения. Так, в горах, где воздух сильно разрежен и атмосферное давление ниже, по мере подъема в горы снижается и температура кипения воды.
Кстати, в герметично закрытом сосуде кипение невозможно вообще.
Еще один пример взаимосвязи давления пара и испарения демонстрирует такая характеристика содержания паров воды в воздухе, как относительная влажность воздуха. Она представляет собой отношение парциального давления паров воды к давлению насыщенного пара и определяется по формуле: φ = р/ро * 100%.
При понижении температуры воздуха концентрация водяных паров в нем повышается, т.е. они становятся более насыщенными. Эта температура называется точкой росы.
Подведем итоги
На несложных примерах мы разобрали суть процесса испарения и образующиеся в его результате ненасыщенный и насыщенный пар. Все эти явления вы ежедневно можете наблюдать вокруг себя: например, видеть высыхающие после дождя лужи на улицах или запотевшее от пара зеркало в ванной комнате. В ванной вы даже можете наблюдать, как сначала происходит парообразование, а потом конденсация скопившейся на зеркале влаги обратно в воду.
Вы также можете использовать эти знания, чтобы сделать свою жизнь более комфортной. Например, зимой во многих квартирах воздух очень сухой, и это плохо сказывается на самочувствии. Вы можете использовать современный прибор-увлажнитель, чтобы сделать его более влажным. Или по старинке поставить в комнате емкость с водой: постепенно испаряясь, вода насытит воздух своими парами.
Поделитесь ссылкой на эту статью со своими одноклассниками и друзьями. Сделать это совсем не сложно – специальные кнопки есть под текстом. А кто-нибудь даже скажет вам спасибо за полезную информацию.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.