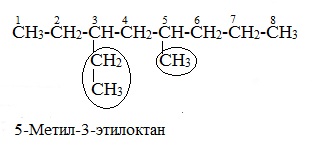
Номенклатура алканов
В молекулах органических веществ атомы углерода, соединённые посредством ковалентных связей, могут образовывать линейные, разветвлённые и циклические структуры. Этим объясняется многообразие органических соединений, число которых намного больше, чем число известных неорганических веществ.
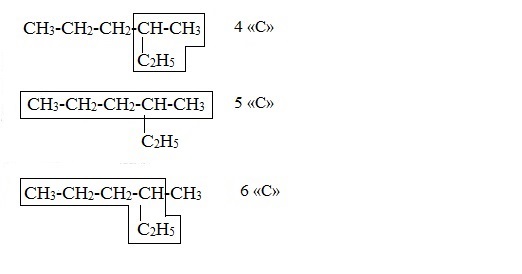
Многие органические вещества имеют одинаковый состав, но разное строение молекул. Вы уже знаете, что такие вещества называются изомерами. В случае алканов явление изомерии проявляется, начиная с четвёртого представителя гомологического ряда — бутана C4H10, для которого существует два изомера. Пентан C5H12 имеет три изомера: 
Для алканов с большим числом атомов углерода в молекуле число изомеров огромно. Например, возможно существование 36 797 588 изомерных алканов состава С25Н52, это почти сорок миллионов веществ! Возникает вопрос: как называть эти вещества? Для решения этой проблемы были разработаны правила составления названий органических соединений (номенклатура). В настоящее время наиболее широко используется номенклатура ИЮПАК (IUPAC — International Union of Pure and Applied Chemistry).
Рассмотрим основные принципы номенклатуры органических соединений на примере алканов.
Углеродная цепь в молекулах алканов может иметь линейное и разветвлённое строение. Сначала рассмотрим названия неразветвлённых (нормальных) алканов (табл. 9.1).
Таблица 9.1. Формулы и названия неразветвлённых алканов
|
Молекулярная формула |
Структурная формула |
Название |
|
СН4 |
СН4 |
метан |
|
С2Н6 |
|
этан |
|
С3Н8 |
|
пропан |
|
С4Н10 |
|
н-бутан |
|
С5Н12 |
|
н-пентан |
|
С6Н14 |
|
н-гексан |
|
С7Н16 |
|
н-гептан |
|
С8Н18 |
|
н-октан |
|
С9Н20 |
|
н-нонан |
|
С10Н22 |
|
н-декан |
Названия первых четырёх представителей гомологического ряда алканов — метана, этана, пропана, бутана — являются исторически сложившимися (тривиальными). Названия последующих алканов состоят из греческого числительного, обозначающего число атомов углерода в молекуле алкана, и суффикса —ан. Обратите внимание, что, начиная с бутана, в начале названия ставят букву «н». Это объясняется тем, что у бутана и последующих алканов имеются изомеры. Буква «н» в начале названия обозначает углеводород с неразветвлённой (нормальной) углеродной цепью.
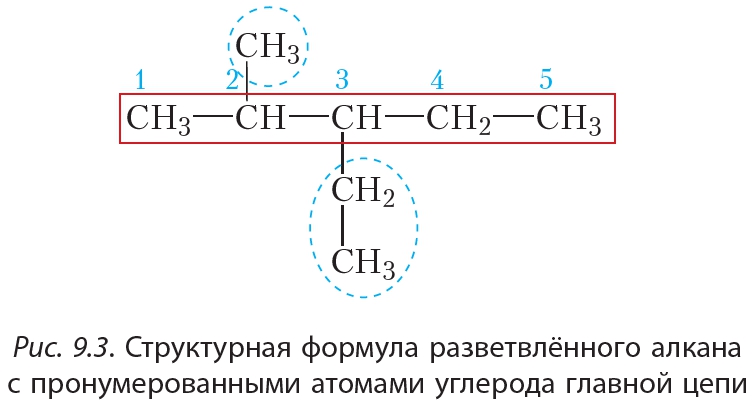
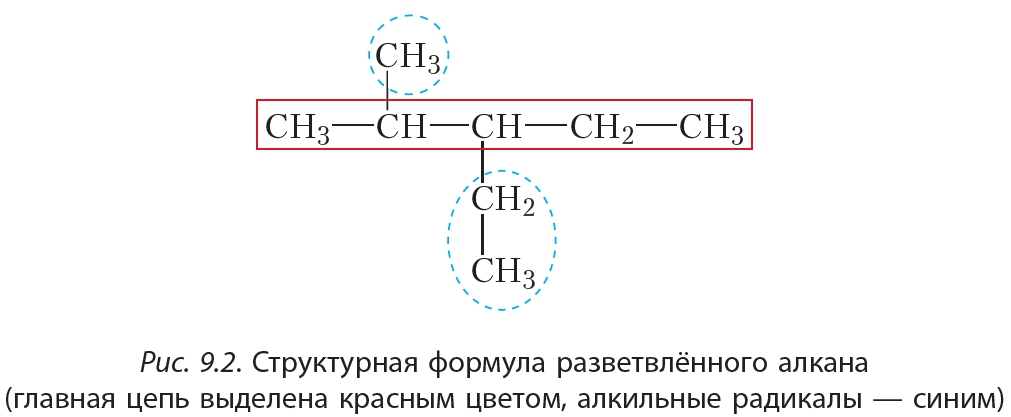
Составить название разветвлённого алкана несколько сложнее. Будем руководствоваться очевидным принципом: если объект невозможно назвать целиком, разделим его на части и будем называть по частям. При этом логично представить молекулу разветвлённого строения как подобие дерева, имеющего ствол, к которому в определённых местах прикреплены веточки (рис. 9.2). В роли ствола — выступает самая длинная углеродная цепь, такую цепь называют главной цепью. «Веточки», соединённые со «стволом», представляют собой группы атомов ,
и т. д. Такие группы называются алкильными радикалами, или алкильными группами.
и
). Поэтому алкильные радикалы называют заместителями. Название алкильного радикала составляют аналогично названию алкана, заменяя суффикс —ан на -ил (табл. 9.2).
Таблица 9.2. Формулы и названия алкильных радикалов
|
Молекулярная формула |
Структурная формула |
Название |
|
|
|
метил |
|
|
|
этил |
|
|
|
пропил |
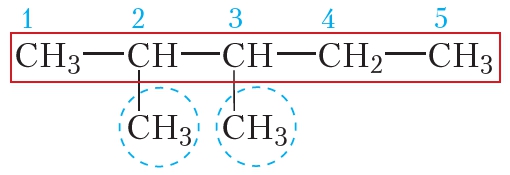
Перед построением названия атомы углерода в главной цепи нумеруют, начиная с того конца, к которому ближе разветвление:
В названии алкильные заместители перечисляют в алфавитном порядке, указывая цифрами положение каждого заместителя в главной цепи. В соответствии с приведёнными правилами название данного алкана 2-метил3-этилпентан. Рассмотрим подробнее принципы построения названий алканов на конкретных примерах.
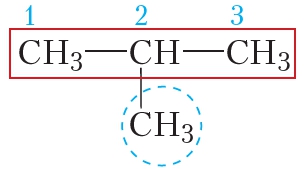
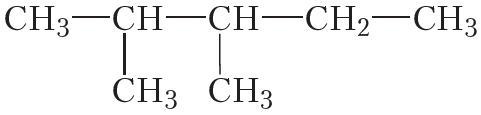
Пример 1. Назовём простейший алкан разветвлённого строения:
Главная цепь данной молекулы состоит из трёх атомов углерода. Алкан с таким числом атомов углерода называется пропан. К этой цепи в положении 2 присоединена метильная группа .
Название вещества 2-метилпропан.
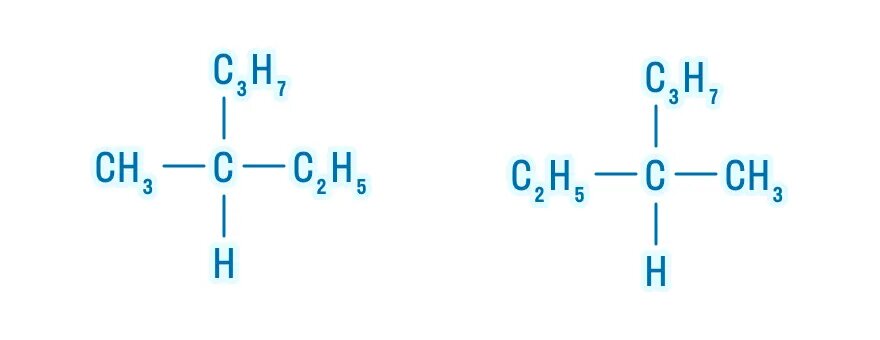
Пример 2. Cоставим название одного из изомеров пентана:
Находим в структурной формуле самую длинную углеродную цепь. Атомы углерода этой цепи нумеруем, начиная с того конца, к которому ближе разветвление:
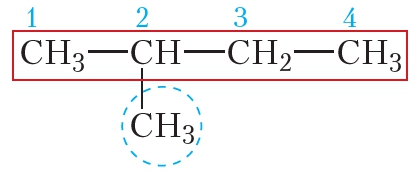
. Следовательно, углеводород будет называться 2-метилбутан.
Пример 3. Составим название одного из изомеров гептана:
Главная цепь содержит пять атомов углерода. Алкан с пятью атомами углерода — пентан.
Данный пример интересен тем, что к главной цепи присоединены две метильные группы, они связаны со вторым и третьим атомами углерода. Отметим, что при наличии в молекуле нескольких одинаковых алкильных радикалов, их число обозначается дополнительной приставкой, например: диэтил-, трипропил-, пентаметили т. д. Поэтому в названии рассматриваемого алкана, перед названием углеводородного радикала (метил-) необходимо поставить приставку ди-. Название соединения 2,3-диметилпентан.
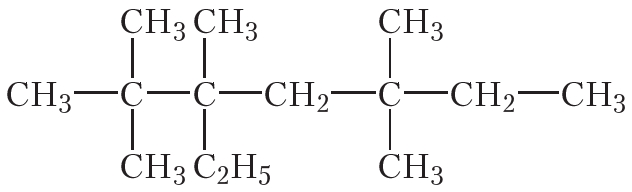
Пример 4. Решим обратную задачу — напишем структурную формулу алкана по его названию. Название алкана: 2,2,3,5,5-пентаметил-3-этилгептан.
Из названия видно, что главная цепь состоит из семи атомов углерода (гептан), к которой в положениях 2, 3 и 5 присоединены пять метильных групп и в положении 3 — одна этильная группа.
Изображая цепь из семи атомов углерода и присоединяя к ней в соответствующих положениях перечисленные группы, получаем формулу вещества:
Как видно, принципы номенклатуры ИЮПАК позволяют дать названия алканам достаточно сложного строения и написать формулу вещества по его названию.
Для построения названий органических веществ используют номенклатуру ИЮПАК.
При построении названия разветвлённый алкан рассматривают как продукт замещения атомов водорода в неразветвлённом алкане на алкильные радикалы.
Название алкана состоит из названия главной цепи и названий заместителей с указанием их положения.
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Гомологический ряд алканов
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Все алканы легче воды, не растворимы в воде и не смешиваются с ней.
Строение алканов
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
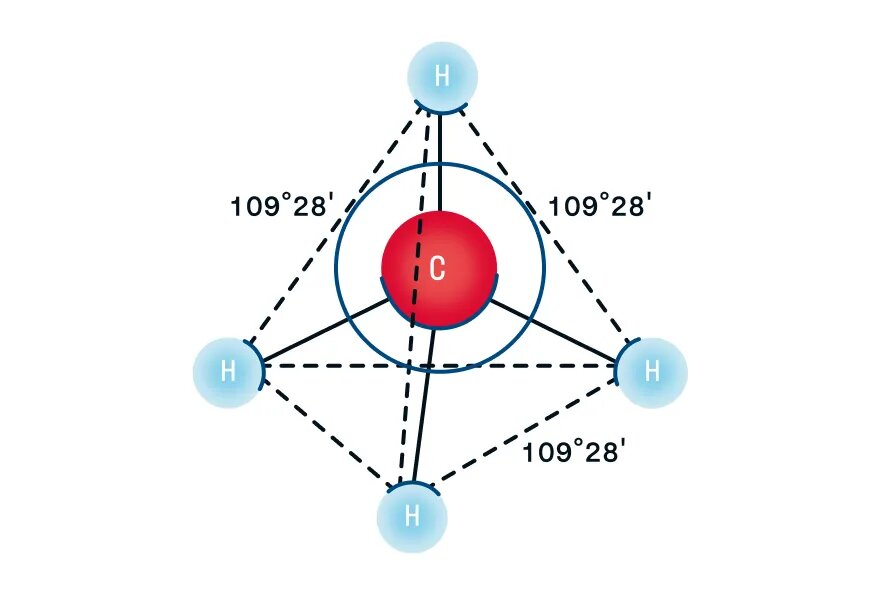
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Наример, пространственное строение н-бутана — зигзагообразное
Изомерия алканов
Структурная изомерия
Для алканов характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан
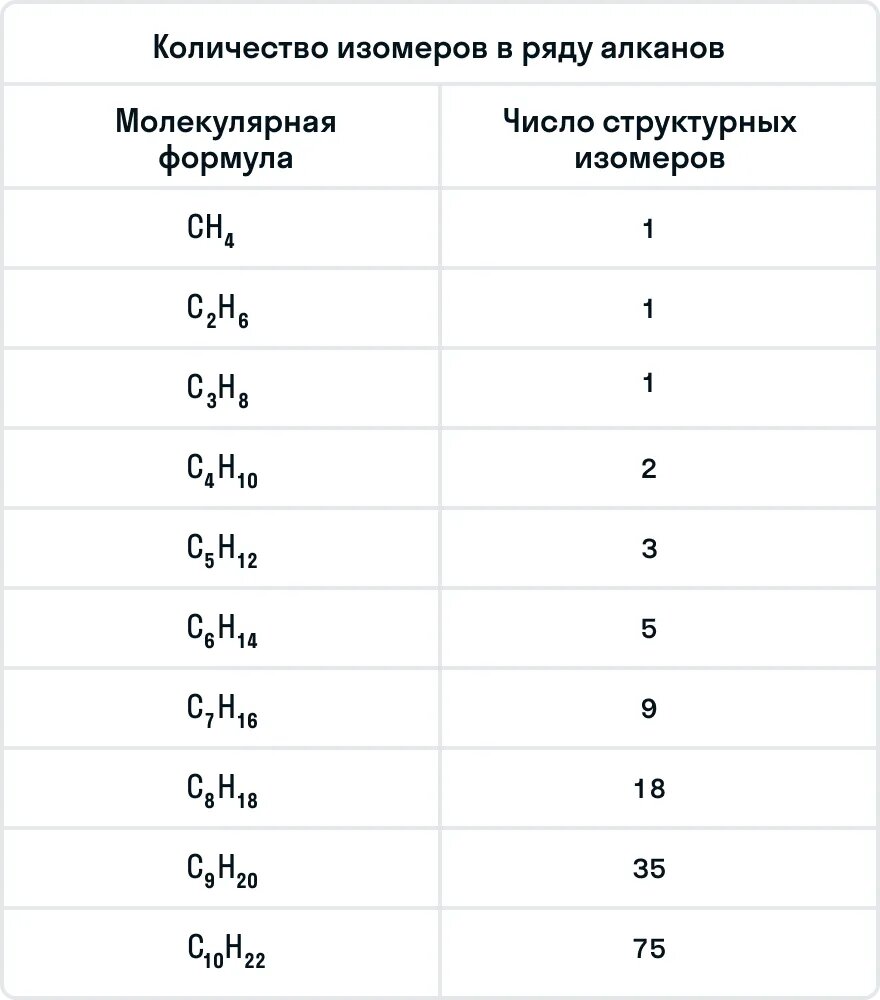
С увеличением числа атомов углерода в молекуле увеличивается количество изомеров, соответствующих данной формуле. У метана CH4, этана C2H6 и пропана C3H8 структурных изомеров нет.
Количество изомеров в ряду алканов:
| Молекулярная формула | Число структурных изомеров |
| C4H10 | 2 |
| C5H12 | 3 |
| C6H14 | 5 |
| C7H16 | 9 |
| C8H18 | 18 |
| C9H20 | 35 |
| C10H22 | 75 |
Оптическая изомерия
Если атом углерода в молекуле связан с четырьмя различными заместителями (атомами или атомными группами), например:
то возможно существование двух соединений с одинаковой структурой, но различным пространственным строением.Молекулы таких соединений относятся друг к другу, как зеркальные изображение и предмет. При этом никаким вращением нельзя получить одну молекулу из другой.
Номенклатура алканов
В названиях алканов используется суффикс -АН.
Для простейших алканов (метан, этан, пропан, бутан и изобутан) используют тривиальные названия. Начиная с пятиатомного углероводорода, в названии неразветвленных (нормальных) алканов используют корень, который показывает число атомов углерода в молекуле, и добавляют соответствующий суффикс (для алканов – ан, для алкенов – ен, и т.д.).
Название разветвленных алканов строится по следующим правилам:
1. Выбирают главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями. При этом главная цепь должна быть самой длинной. Например, в молекуле на рисунке главной является цепь, отмеченная на рисунке а:
Главная цепь должна быть самой разветвленной.
Например, в молекуле, изображенной на рисунках а и б, выделены цепи с одинаковым числом атомов углерода. Но главной будет цепь, изображенная на рисунке а, т.к. от нее отходит 2 заместителя, а от цепи на рисунке б – только один:
2. Нумеруют атомы углерода в главной цепи так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Например, 2-метилпропан:
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 2,2-диметилпропан или 2,2,3-триметилпентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 2,2-диметил-3-этилпентан.
5. Называют главную углеродную цепь, т.е. соответствующий нормальный алкан.
Например, название молекулы на рисунке:
2,2,4-триметил-4-этилгексан
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
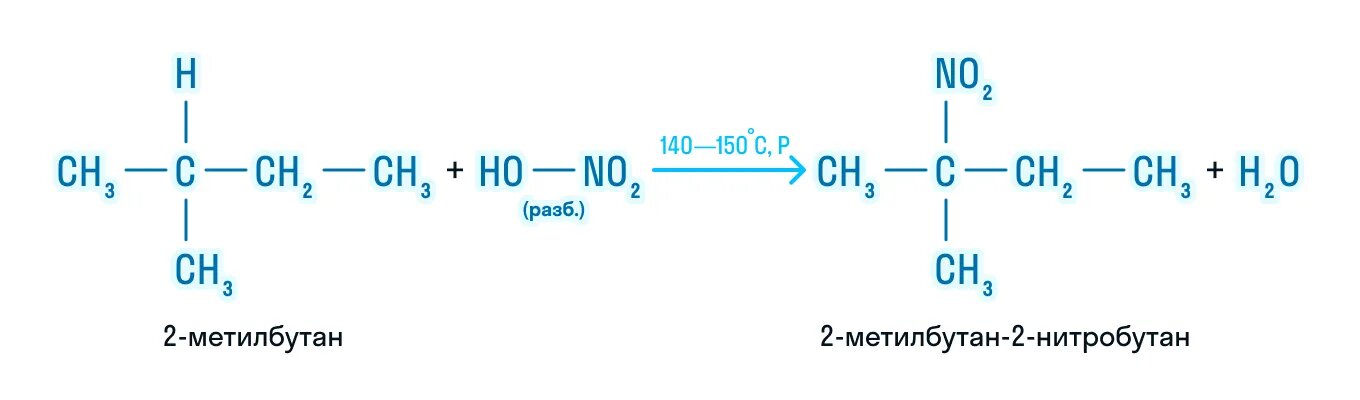
1.2. Нитрование алканов
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения
2.1. Дегидрирование и дегидроциклизация
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
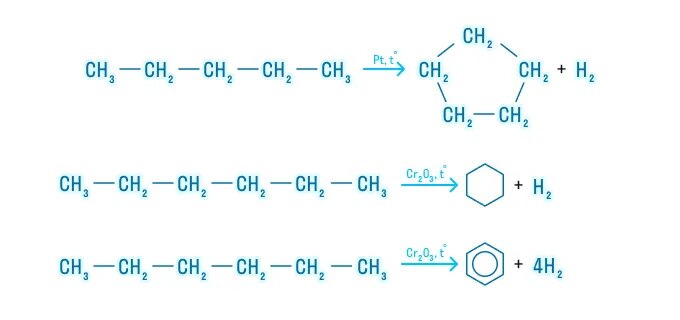
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
2.2. Пиролиз (дегидрирование) метана
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Получение алканов
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Хлорэтан взаимодействует с натрием с образованием бутана:
Реакция больше подходит для получения симметричных алканов.
При проведении синтеза со смесью разных галогеналканов образуется смесь разных алканов.
2. Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
В водном растворе ацетат натрия практически полностью диссоциирует:
CH3COONa → CH3COO– + Na+
При этом на катод притягиваются катионы натрия Na+ и молекулы воды H2O.
Разряжаться на катоде будут молекулы воды:
Kатод(-): 2H2O + 2e = H2 + 2OH–
На аноде окисляются ацетат-ионы, а именно, атом углерода карбоксильной группы.
При этом от карбоксильной группы отрывается углекислый газ и остаются метильные радикалы, которые образуют газообразный этан:
Aнод(+): 2CH3COO– – 2e = 2CO2 + CH3–CH3
Суммарное уравнение электролиза водного раствора ацетата натрия:
2CH3COONa + 2H2O = H2 + 2NaOH + 2CO2 + CH3–CH3
3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия:
4. Гидрирование алкенов, алкинов, циклоалканов, алкадиенов
При гидрировании этилена образуется этан:
При полном гидрировании ацетилена также образуется этан:
При гидрировании циклопропана образуется пропан:
5. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (2n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
6. Получение алканов в промышленности
В промышленности алканы получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
Рассмотрим правила составления названий алканов и их производных согласно международной номенклатуре ИЮПАК.
Вспомним, что для четырёх первых алканов используются тривиальные названия:
CH4
— метан,
C2H6
— этан,
C3H8
— пропан,
C4H10
— бутан.
Названия следующих гомологов образуются от греческих числительных, к которым добавляется суффикс «-ан»:
C5H12
— пентан,
C6H14
— гексан,
C7H16
— гептан,
C8H18
— октан,
C9H20
— нонан,
C10H22
— декан,
C14H30
— тетрадекан и т. д.
В названиях радикалов суффикс «-ан» заменяется на «-ил»:
CH3
— метил,
C2H5
— этил.
По правилам международной номенклатуры ИЮПАК, алканы с разветвлённой цепью атомов углерода рассматриваются как производные неразветвлённых углеводородов, в молекулах которых есть боковые радикалы.
Чтобы назвать такие вещества, выбирают самую длинную цепь углеродных атомов.
Атомы нумеруют, начиная с того конца, к которому ближе расположено боковое ответвление.
Сначала цифрой указывают положение радикала, а затем его название. Если одинаковых радикалов несколько, то добавляют приставку: «ди-» (два), «три-» (три), «тетра-» (четыре) и т. д. Затем называют главную цепь.
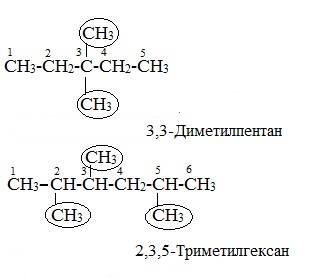
Пример (1). Назовём алкан такого строения.
Самая длинная цепь в этой молекуле содержит шесть атомов углерода. Нумерацию начинаем слева, так как со вторым атомом соединены два радикала. В молекуле три радикала
CH3
.
Указываем цифрами через запятую положение каждого радикала ((2),(2),(4)), ставим дефис (—), указываем число и название радикалов (триметил) и добавляем название главной цепи (гексан): (2),(2),(4)-триметилгексан.
Если в молекуле содержатся разные радикалы, то их называют в алфавитном порядке.
Пример (2). Рассмотрим это правило на примере алкана следующего строения.
В этой молекуле три радикала
CH3
(метил) и один
C2H5
(этил). Название алкана: (2),(2),(4)-триметил-(4)-этилгексан.
В реакциях алканов с разными веществами образуются их производные, содержащие заместители (атомы галогенов, нитрогруппы и т. д.). Такие соединения называются по общим правилам.
Пример (3). Назовём производное алкана, в молекуле которого есть атомы хлора и брома, а также радикал метил.
Выбираем и нумеруем самую длинную цепь. Записываем «адрес» и название каждого заместителя в алфавитном порядке: (3)-бром-(2)-метил-(1)-хлорбутан.
Алканы — это предельные углеводороды, в строении которых имеются только одинарные или σ-связи.
Этот класс относится к алифатическим соединениям, так как не имеет ароматических связей. К тому же алканы — предельные углеводороды, то есть они содержат максимально возможное число атомов водорода. Поэтому общая формула алканов — CnH2n+2.
Строение алканов
Основные химические связи у алканов — это ковалентная неполярная связь между атомами углерода (С—С) и ковалентная полярная связь между атомами углерода и водорода (С—Н).
Так как алканы — это предельный класс, делаем вывод, что все связи между атомами являются одинарными, то есть σ-связями.
Разберемся с типом гибридизации атомов углерода в алканах, но сначала вспомним, что такое гибридизация. Упрощенное определение гибридизации звучит так: это смешение различных орбиталей в многоатомной молекуле для выравнивания формы и энергии, которое приводит к изменению формы орбитали. Гибридизация атомов углерода в алканах — sp3. Рассмотрим, как она образуется.
При образовании связи между углеродами происходит смешение их орбиталей — вот так:
В то время как образование связи между углеродом и водородом происходит следующим образом:
Рассмотрим пространственное строение алканов на примере метана — первого представителя гомологического ряда алканов. При наличии четырех атомов водорода и одного атома углерода в молекуле образуются четыре гибридизованные орбитали, которые взаимно отталкиваются друг от друга, но не произвольно, а под определенным углом. Максимальный угол взаимного отталкивания — это валентный угол, для алканов он равен 109°28′. Таким образом, молекула метана в пространстве выглядит как тетраэдр:
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Узнай, какие профессии будущего тебе подойдут
Пройди тест — и мы покажем, кем ты можешь стать, а ещё пришлём подробный гайд, как реализовать себя уже сейчас
Номенклатура алканов
Познакомьтесь с номенклатурой гомологического ряда алканов (ее необходимо выучить):
Названия первых четырех представителей этого ряда сложились исторически. Названия остальных алканов образованы от греческих числительных, которые обозначают количество атомов углерода, с помощью суффикса -ан-.
Важно помнить, что бутан и следующие за ним алканы могут иметь изомеры. Ниже в таблице указано количество изомеров у каждого представителя алканов:
Помимо структурной изомерии, для алканов характерна изомерия оптическая. Но для ее реализации нужно одно условие — наличие хирального атома углерода, то есть атома с четырьмя различными заместителями.
Молекулы таких соединений относятся друг к другу как предмет и его зеркальное отражение. Как бы мы ни вращали эти молекулы, нельзя получить из одной другую.
Физические свойства алканов
Свойства этих соединений меняются по мере продвижения по гомологическому ряду:
-
первые четыре представителя алканов являются газами;
-
алканы, в составе молекулы которых от 5 до 15 атомов углерода, являются жидкостями;
-
алканы, в составе молекулы которых от 16 атомов углерода, — твердые вещества.
С увеличением количества атомов углерода в структуре молекулы и с ее формой в пространстве связана одна особенность: у линейных молекул, в отличие от разветвленных, температура кипения и плавления выше. В таблице собрали справочные данные о температуре плавления и составе алканов.
Все алканы бесцветны, легче воды и нерастворимы в ней, однако хорошо растворяются в органических растворителях. Жидкие алканы, такие как пентан и гексан, сами широко используются как растворители.
Химические свойства алканов
Для алканов характерны реакции замещения. Для всех реакций замещения алканов нужно соблюдать правило: сначала замещается водород у третичного атома углерода, затем — у вторичного, в последнюю очередь — у первичного атома углерода.
Рассмотрим все возможные реакции, характерные для алканов.
Реакция нитрования (реакция Коновалова)
Галогенирование
.
Реакция может продолжаться до полного замещения атомов водорода на хлор.
Дегидрирование (отщепление водорода)
Катализаторы для дегидрирования: Ni, Pt, Pd, Cr2O3, Fe2O3, ZnO и другие.
Реакции разложения
-
Крекинг:
C8H18 → C4H10 + C4H8.
-
Пиролиз метана:
— при медленном и длительном нагревании;
-
— при очень быстром нагревании.
Реакция окисления (горение)
Все алканы, кроме метана, горят с образованием углекислого газа и воды. Метан горит с образованием угля и воды.
Алканы не окисляются сильными окислителями, такими как перманганаты, дихроматы и хроматы.
Вопросы для самопроверки
-
Выберите алкан с наибольшей молярной массой.
-
Пентан
-
Бутан
-
Октан
-
Гексан
-
Какая гибридизация у атомов углерода в предельных углеводородах?
-
sp3
-
sp2
-
sp
-
Гибридизации нет
-
Какие виды изомерии характерны для алканов?
-
Оптическая и пространственная
-
Цис-транс-изомерия
-
Углеродного скелета и геометрическая
-
Углеродного скелета и оптическая
-
Вспомните общую формулу алканов.
-
CnH2n
-
CnH2n−2
-
CnH2n+2
-
CnH2n−6
-
Какой тип реакций характерен для алканов?
-
Присоединение
-
Замещение
-
Присоединение и замещение
-
Любые типы реакций
-
Какая именная реакция удвоит углеродный скелет у алканов?
-
Реакция Коновалова
-
Реакция Вюрца — Фиттинга
-
Реакция Вюрца
-
Реакция Зинина
Подготовиться к ЕГЭ на онлайн-курсах по химии, пожалуй, лучший вариант. Можно заниматься дома и не тратить время на дорогу — нужен лишь компьютер и стабильный интернет. Преподаватели онлайн-школы Skysmart помогут не только упорядочить знания, но и подготовиться к экзамену психологически. Пройти вводное тестирование и получить рекомендации по самостоятельному обучению можно бесплатно!
Ответы на вопросы
-
c
-
a
-
d
-
c
-
b
-
c
В настоящее время общепринятой является систематическая номенклатура ИЮПАК.
Первые четыре углеводорода носят исторически сложившиеся названия: метан, этан, пpопан, бутан, изобутан.
Начиная с пятого гомолога названия алканов состоят из корня — греческого числительного и суффикса -ан: пентан, гексан, гептан, октан, нонан, декан и т.д.
Для применения номенклатуры ИЮПАК необходимо знать названия и строение определенных фрагментов молекул – органических радикалов.
Согласно международной номенклатуре изомеры с разветвленной цепью углеродных атомов следует рассматривать как производные алкана с самой длинной неразветвленной цепью.
Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)
1.Найти самую длинную (главную) неразветвленную цепь углеродных атомов.
2. Пронумеровать атомы углерода главной цепи. Номер атома углерода, у которого находится заместитель (алкильный радикал), должен быть наименьшим.
3. Указать положение заместителя (номер атома углерода, у которого находится алкильный радикал).
4. Назвать алкильный радикал в соответствии с его положением в цепи.
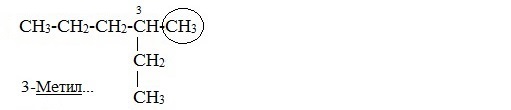
5. Назвать алкан, соответствующий главной цепи.
Если заместителем является галоген (фтор, хлор, бром, йод), то все номенклатурные правила сохраняются.
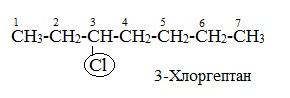
В молекуле с несколькими одинаковыми заместителями нужно указывать положение каждого заместителя через запятую (2,2-). После номера через дефис указывают количество заместителей (ди — два, три — три, тетра — четыре, пента — пять) и название заместителя (метил, этил, пропил). Далее без пробелов и дефисов название главной цепи.
Разные заместители называются в алфавитном порядке.
Номенклатура алканов
Алканы (предельные углеводороды)