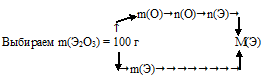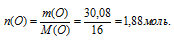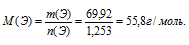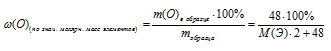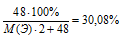Задача. Найти неизвестный элемент ядерной реакции. Пример реакции: , остальные реакции будут разобраны в тексте задачи (ибо лень делать страницу для каждой реакции).
Дано:
Реакция
Найти:
Элемент — ?
Решение
Думаем: все вопросы нахождения неизвестного элемента ядерной реакции касаются закона сохранения нуклонного и протонного заряда:
(1)
(2)
Также есть набор элементов, которые могут не записываться без протонного и нуклонного заряда.
Решаем: рассматривая реакцию , исходя из (1) и (2) можем вывести два соотношения.
(3)
(4)
Считаем: исходя из (3) и (4), получаем:
;
Тогда: — этот элемент является нейтроном.
Ответ: (нейтрон)
Задача 2. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — дейтерий — «тяжёлый» водород с 1 протоном (всё же водород) и 1 нейтрон. Тогда форма записи:
.
— нейтрон — элемент с 0 протонов и 1 нейтроном, т.е.
. Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
(5)
(6)
Считаем: исходя из (5) и (6), получаем:
;
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — фтор (
)
Ответ: (фтор).
Задача 3. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — гамма-квант или фотон света без нейтронов и протонов. Тогда форма записи:
.
— протон — элемент с 1 протоном и 0 нейтронов, тогда форма записи:
.
— нейтрон — элемент с 0 протонов и 1 нейтроном, т.е.
. Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
(7)
(8)
Считаем: исходя из (7) и (8), получаем:
;
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — калий (
)
Ответ: (калий).
Задача 4. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — альфа частица или ядро гелия с 2 протонами и 2 нейтронами. Тогда форма записи:
.
— нейтрон — элемент с 0 протонов и 1 нейтроном, т.е.
. Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
(9)
(10)
Считаем: исходя из (9) и (10), получаем:
;
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — бериллий (
).
— используя таблицу Менделеева, заключаем, что этот элемент — углерод (
)
Ответ: (бериллий),
(углерод).
Задача 5. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — свинец, из таблицы Менделеева находим количество протонов — 94. Тогда форма записи:
.
— кюрий, из таблицы Менделеева находим количество протонов — 96.
— нейтрон — элемент с 0 протонов и 1 нейтроном, т.е.
. Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
(11)
(12)
Считаем: исходя из (11) и (12), получаем:
;
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — Гелий (или альфа-частица) (
).
Ответ: (гелий).
Найдите неизвестный элемент ядерной реакции
Задача. Найти неизвестный элемент ядерной реакции. Пример реакции: , остальные реакции будут разобраны в тексте задачи (ибо лень делать страницу для каждой реакции).
Найти:
Элемент — ?
Решение
Думаем: все вопросы нахождения неизвестного элемента ядерной реакции касаются закона сохранения нуклонного и протонного заряда:
- — количество нуклонов (протонов+нейтронов) в соответствующих атомах,
- — количество протонов в соответствующих атомах.
Также есть набор элементов, которые могут не записываться без протонного и нуклонного заряда.
Решаем: рассматривая реакцию , исходя из (1) и (2) можем вывести два соотношения.
Считаем: исходя из (3) и (4), получаем:
Тогда: — этот элемент является нейтроном.
Ответ: (нейтрон)
Задача 2. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — дейтерий — «тяжёлый» водород с 1 протоном (всё же водород) и 1 нейтрон. Тогда форма записи: . — нейтрон — элемент с 0 протонов и 1 нейтроном, т.е. . Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
Считаем: исходя из (5) и (6), получаем:
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — фтор ( )
Ответ: (фтор).
Задача 3. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — гамма-квант или фотон света без нейтронов и протонов. Тогда форма записи: . — протон — элемент с 1 протоном и 0 нейтронов, тогда форма записи: . — нейтрон — элемент с 0 протонов и 1 нейтроном, т.е. . Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
Считаем: исходя из (7) и (8), получаем:
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — калий ( )
Ответ: (калий).
Задача 4. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — альфа частица или ядро гелия с 2 протонами и 2 нейтронами. Тогда форма записи: . — нейтрон — элемент с 0 протонов и 1 нейтроном, т.е. . Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
Считаем: исходя из (9) и (10), получаем:
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — бериллий ( ). — используя таблицу Менделеева, заключаем, что этот элемент — углерод ( )
Ответ: (бериллий), (углерод).
Задача 5. Реакция .
Решаем: в этой задаче дополнительно необходимо «узнать» элементы. В нашей задаче — свинец, из таблицы Менделеева находим количество протонов — 94. Тогда форма записи: . — кюрий, из таблицы Менделеева находим количество протонов — 96. — нейтрон — элемент с 0 протонов и 1 нейтроном, т.е. . Тогда:
Решаем: исходя из (1) и (2) можем вывести два соотношения.
Считаем: исходя из (11) и (12), получаем:
Тогда: — используя таблицу Менделеева, заключаем, что этот элемент — Гелий (или альфа-частица) ( ).
Примеры ядерных реакций: особенности, решение и формулы
На протяжении долгого времени человека не оставляли мечты о взаимопревращении элементов – точнее, о превращении различных металлов в один. После осознания бесплодности этих попыток утвердилась точка зрения о незыблемости химических элементов. И только открытие структуры ядра в начале XX века показало, что превращение элементов один в другой возможно – но не химическими методами, то есть воздействием на внешние электронные оболочки атомов, а путем вмешательства в структуру атомного ядра. Такого рода явления (и некоторые другие) относятся к ядерным реакциям, примеры которых будут рассмотрены ниже. Но прежде необходимо вспомнить о некоторых основных понятиях, которые потребуются в ходе этого рассмотрения.
Общее понятие о ядерных реакциях
Существуют явления, в которых ядро атома того или иного элемента вступает во взаимодействие с другим ядром или какой-либо элементарной частицей, то есть обменивается с ними энергией и импульсом. Подобные процессы и называются ядерными реакциями. Результатом их может стать изменение состава ядра или образование новых ядер с испусканием определенных частиц. При этом возможны такие варианты, как:
- превращение одного химического элемента в другой;
- деление ядра;
- синтез, то есть слияние ядер, при котором образуется ядро более тяжелого элемента.
Начальная фаза реакции, определяемая типом и состоянием вступающих в нее частиц, называется входным каналом. Выходные каналы – это возможные пути, по которым реакция будет протекать.
Правила записи ядерных реакций
В примерах, приведенных ниже, демонстрируются способы, с помощью которых принято описывать реакции с участием ядер и элементарных частиц.
Первый способ – тот же, что применяется в химии: в левой части ставятся исходные частицы, в правой – продукты реакции. Например, взаимодействие ядра бериллия-9 с налетающей альфа-частицей (так называемая реакция открытия нейтрона) записывается следующим образом:
Верхние индексы обозначают количество нуклонов, то есть массовые числа ядер, нижние – количество протонов, то есть атомные номера. Суммы тех и других в левой и правой части должны совпадать.
Сокращенный способ написания уравнений ядерных реакций, часто применяющийся в физике, выглядит так:
Общий вид такой записи: A (a, b1b2…) B. Здесь A – ядро-мишень; a – налетающая частица или ядро; b1, b2 и так далее – легкие продукты реакции; B – конечное ядро.
Энергетика ядерных реакций
В ядерных превращениях выполняется закон сохранения энергии (наряду с другими законами сохранения). При этом кинетическая энергия частиц во входном и выходном канале реакции могут различаться за счет изменения энергии покоя. Так как последняя эквивалентна массе частиц, до и после реакции массы также будут неодинаковы. Но полная энергия системы всегда сохраняется.
Разность энергии покоя вступающих в реакцию и выходящих из нее частиц называется энергетическим выходом и выражается в изменении их кинетической энергии.
В процессах с участием ядер задействуются три вида фундаментальных взаимодействий – электромагнитное, слабое и сильное. Благодаря последнему ядро обладает такой важнейшей особенностью, как высокая энергия связи между составляющими его частицами. Она существенно выше, чем, например, между ядром и атомными электронами или между атомами в молекулах. Об этом свидетельствует заметный дефект массы – разница между суммой масс нуклонов и массой ядра, которая всегда меньше на величину, пропорциональную энергии связи: Δm = Eсв/c 2 . Расчет дефекта массы производится по простой формуле Δm = Zmp + Amn – Мя, где Z – заряд ядра, A – массовое число, mp – масса протона (1,00728 а.е.м.), mn – масса нейтрона (1,00866 а.е.м.), Mя – масса ядра.
При описании ядерных реакций используется понятие удельной энергии связи (то есть в расчете на один нуклон: Δmc 2 /A).
Энергия связи и стабильность ядер
Наибольшей устойчивостью, то есть наивысшей удельной энергией связи, отличаются ядра с массовым числом от 50 до 90, например, железо. Такой «пик стабильности» обусловлен нецентральным характером ядерных сил. Поскольку каждый нуклон взаимодействует только с соседями, на поверхности ядра он связан слабее, нежели внутри. Чем меньше в ядре взаимодействующих нуклонов, тем меньше и энергия связи, поэтому легкие ядра менее стабильны. В свою очередь, с ростом количества частиц в ядре возрастают кулоновские силы отталкивания между протонами, так что энергия связи тяжелых ядер тоже уменьшается.
Таким образом, для легких ядер наиболее вероятными, то есть энергетически выгодными, являются реакции слияния с формированием устойчивого ядра средней массы, для тяжелых же – напротив, процессы распада и деления (нередко многоступенчатые), в результате которых также образуются более стабильные продукты. Этим реакциям свойственен положительный и часто очень высокий энергетический выход, сопровождающий увеличение энергии связи.
Ниже мы рассмотрим некоторые примеры ядерных реакций.
Реакции распада
Ядра могут претерпевать спонтанное изменение состава и структуры, при которых происходит испускание каких-либо элементарных частиц или фрагментов ядра, таких как альфа-частицы или более тяжелые кластеры.
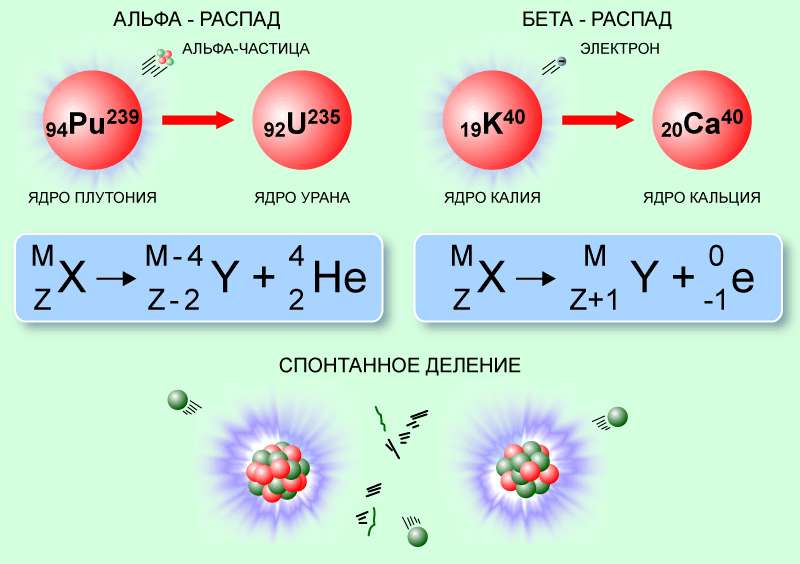
Так, при альфа-распаде, возможном благодаря квантовому туннелированию, альфа-частица преодолевает потенциальный барьер ядерных сил и покидает материнское ядро, которое, соответственно, уменьшает атомный номер на 2, а массовое число – на 4. Например, ядро радия-226, испуская альфа-частицу, превращается в радон-222:
Энергия распада ядра радия-226 составляет около 4,87 МэВ.
Бета-распад, обусловленный слабым взаимодействием, происходит без изменения количества нуклонов (массового числа), но с увеличением или уменьшением заряда ядра на 1, при испускании антинейтрино или нейтрино, а также электрона или позитрона. Примером ядерной реакции данного типа является бета-плюс-распад фтора-18. Здесь один из протонов ядра превращается в нейтрон, излучаются позитрон и нейтрино, а фтор превращается в кислород-18:
Энергия бета-распада фтора-18 – около 0,63 МэВ.
Деление ядер
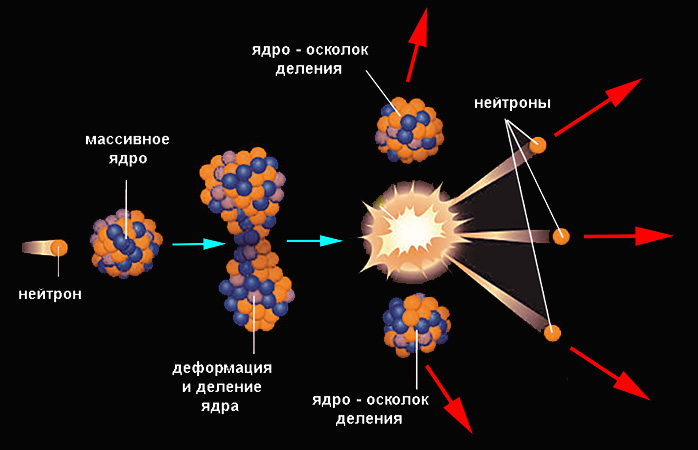
Гораздо больший энергетический выход имеют реакции деления. Так называется процесс, при котором ядро самопроизвольно или вынужденно распадается на близкие по массе осколки (как правило, два, редко – три) и некоторые более легкие продукты. Ядро делится, если его потенциальная энергия превысит исходное значение на некоторую величину, называемую барьером деления. Однако вероятность спонтанного процесса даже для тяжелых ядер невелика.
Она существенно возрастает при получении ядром соответствующей энергии извне (при попадании в него частицы). Наиболее легко проникает в ядро нейтрон, поскольку он не подвержен силам электростатического отталкивания. Попадание нейтрона приводит к повышению внутренней энергии ядра, оно деформируется с образованием перетяжки и делится. Осколки разлетаются под действием кулоновских сил. Пример ядерной реакции деления демонстрирует уран-235, поглотивший нейтрон:
Расщепление на барий-144 и криптон-89 – лишь один из возможных вариантов деления урана-235. Эту реакцию можно записать в виде 235 92U + 1 0n → 236 92U* → 144 56Ba + 89 36Kr + 3 1 0n, где 236 92U* – сильно возбужденное составное ядро с высокой потенциальной энергией. Избыток ее наряду с разностью энергий связи материнского и дочерних ядер выделяется главным образом (около 80%) в форме кинетической энергии продуктов реакции, а также частично в форме потенциальной энергии осколков деления. Общая энергия деления массивного ядра – примерно 200 МэВ. В пересчете на 1 грамм урана-235 (при условии, что прореагировали все ядра) это составляет 8,2 ∙ 10 4 мегаджоулей.
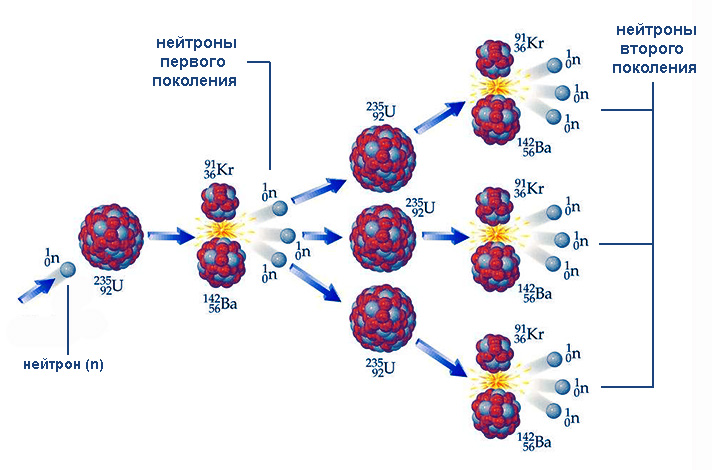
Цепные реакции
Деление урана-235, а также таких ядер, как уран-233 и плутоний-239, характеризуется одной важной особенностью – наличием среди продуктов реакции свободных нейтронов. Эти частицы, проникая в другие ядра, в свою очередь, способны инициировать их деление опять-таки с вылетом новых нейтронов и так далее. Подобный процесс именуется цепной ядерной реакцией.
Течение цепной реакции зависит от того, как соотносится число вылетающих нейтронов очередного поколения с количеством их в предыдущем поколении. Это отношение k = Ni/Ni–1 (здесь N – количество частиц, i – порядковый номер поколения) носит название коэффициента размножения нейтронов. При k 1 число нейтронов, а значит, и делящихся ядер, возрастает лавинообразно. Пример цепной ядерной реакции такого типа – взрыв атомной бомбы. При k = 1 процесс протекает стационарно, примером чему служит реакция, управляемая при помощи поглощающих нейтроны стержней, в ядерных реакторах.
Ядерный синтез
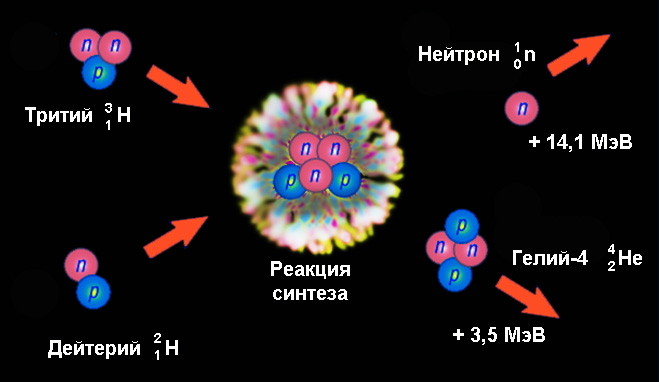
Наибольшее энерговыделение (в расчете на один нуклон) происходит при слиянии легких ядер – так называемых реакциях синтеза. Чтобы вступить в реакцию, положительно заряженные ядра должны преодолеть кулоновский барьер и сблизиться на расстояние сильного взаимодействия, не превышающее размеров самого ядра. Поэтому они должны обладать чрезвычайно большой кинетической энергией, что означает высокие температуры (десятки миллионов градусов и выше). По этой причине реакции синтеза еще называют термоядерными.
Пример ядерной реакции синтеза – образование гелия-4 с вылетом нейтрона при слиянии ядер дейтерия и трития:
Здесь высвобождается энергия 17,6 МэВ, что в расчете на один нуклон более чем в 3 раза превышает энергию деления урана. Из них 14,1 МэВ приходится на кинетическую энергию нейтрона и 3,5 МэВ – ядра гелия-4. Такая существенная величина создается за счет огромной разницы в энергиях связи ядер дейтерия (2,2246 МэВ) и трития (8,4819 МэВ) с одной стороны, и гелия-4 (28,2956 МэВ) – с другой.
В реакциях деления ядра высвобождается энергия электрического отталкивания, в то время как при синтезе энерговыделение происходит за счет сильного взаимодействия – самого мощного в природе. Это и определяет столь значительный энергетический выход данного типа ядерных реакций.
Примеры решения задач
Рассмотрим реакцию деления 235 92U + 1 0n → 140 54Xe + 94 38Sr + 2 1 0n. Каков ее энергетический выход? В общем виде формула для его расчета, отражающая разность энергий покоя частиц до и после реакции, выглядит следующим образом:
Вместо умножения на квадрат скорости света можно умножить разность масс на коэффициент 931,5 и получить значение энергии в мегаэлектронвольтах. Подставив в формулу соответствующие значения атомных масс, получим:
Q = (235,04393 + 1,00866 – 139,92164 – 93,91536 — 2∙1,00866) ∙ 931,5 ≈ 184,7 МэВ.
Еще один пример – на реакцию синтеза. Это один из этапов протон-протонного цикла – главного источника солнечной энергии.
Применим ту же формулу:
Q = (2 ∙ 3,01603 – 4,00260 — 2 ∙ 1,00728) ∙ 931,5 ≈ 13,9 МэВ.
Основная доля этой энергии – 12,8 МэВ – приходится в данном случае на гамма-фотон.
Мы рассмотрели только простейшие примеры ядерных реакций. Физика этих процессов чрезвычайно сложна, они отличаются огромным разнообразием. Исследование и применение ядерных реакций имеет большое значение как в практической области (энергетика), так и в фундаментальной науке.
Ядерные реакции. Выделение и поглощение энергии при ядерных реакциях. Термоядерные реакции синтеза лёгких ядер
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На этом уроке мы узнаем, что такое ядерные реакции, рассмотрим законы сохранения при ядерных реакциях, выясним причину изменения суммарной массы ядер, а также научимся вычислять энергетический выход таких реакций. В конце урока узнаем, какой колоссальный выход энергии получается при термоядерных реакциях.
источники:
http://fb.ru/article/416252/primeryi-yadernyih-reaktsiy-osobennosti-reshenie-i-formulyi
http://interneturok.ru/lesson/physics/11-klass/fizika-atomnogo-jadra/yadernye-reaktsii-vydelenie-i-pogloschenie-energii-pri-yadernyh-reaktsiyah-termoyadernye-reaktsii-sinteza-lyogkih-yader
9 кл. Физика. Решение задач по теме: «Ядерные реакции».
Цель уроков: научиться решать задачи по теме: «Ядерные реакции».
-
Повтори блок 11.
2. Внимательно изучи задачи-шаблоны и запиши решения в рабочую тетрадь.
Задача-шаблон 1. Определить состав ядра атома алюминия 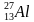
Решение:
В ядро входят только протоны и нейтроны (электроны в состав ядра не входят, они входят только в состав атома), поэтому протонов p = 13 (зарядовое число Z, нижнее число элемента), нейтронов – n = A – Z (А – массовое число, верхнее число элемента), т.е. n = 27 – 13 = 14.
Ответ: p = 13, n = 14.
Задача-шаблон 2. Найти неизвестный элемент X в следующей ядерной реакции:
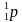

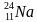
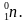
Решение:
В любой ядерной реакции соблюдаются законы сохранения массового и зарядового чисел, т.е. сумма верхних чисел слева должна быть равна сумме верхних чисел справа. Аналогично и для нижних чисел. Тогда вычислит атомную массу неизвестного числа X, для этого сложим атомные массы элементов справа и отнимем атомную массу известного элемента слева: 24 + 0 – 1 = 23 – это атомная масса неизвестного элемента. Так же вычислим зарядовое число неизвестного элемента: 11 + 1 – 1 = 11. Тогда 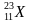
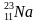
Коротко решение можно записать так:
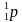

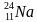
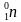
А = 24 + 0 – 1 = 23;
Z = 11 + 1 – 1 = 11 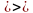
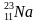
Ответ: изотоп натрия 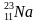
3. Реши задачи в рабочей тетради.
Задача 1. Определи состав ядер атомов серебра 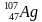
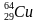
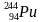
Задача 2. Чем отличаются ядра изотопов хлора: 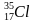
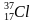
Задача 3. При захвате нейтрона ядром атома магния 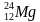
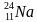
Задача 4. Ядро изотопа урана 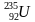
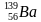
4. ДЗ: Реши задачи.
1) Найди неизвестный элемент в следующих ядерных реакциях:
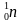

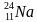
;
+

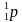
2) Ядро изотопа урана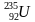
. Запиши соответствующую ядерную реакцию. Выясни, ядром какого изотопа является второй осколок?
Способы определения молекулярной формулы оксида и элемента металла, образующего данный оксид
Задача 115.
Некоторый элемент образует оксид вида Э2О3, где Э — неизвестный элемент. Массовая доля кислорода в нем составляет 30,08% . Определите элемент и формулу оксида.
Дано: формула оксида: Э2О3; массовая доля кислорода в оксиде:
Найти: элемент и формулу оксида.
Решение:
Для выявления неизвестного элемента необходимо определить его молярную массу, по которой, пользуясь Периодической системой Д.И.Менделеева, возможно найти неизвестный элемент.
I способ (последовательно-разветвленный алгоритм).
Схематично этот алгоритм можно изобразить так:
1) Произвольно выбираем некоторую массу образца. Наиболее удобная масса — 100 г, т.к. в условии фигурирует массовая доля. Тогда в 100 г Э2О3 содержится 30,08 г кислорода.
2) По разности находим массу неизвестного элемента:
m(Э) = 100 – m(О) = 100 – 30,08 = 69,92 г содержится в выбранном образце Э2О3.
3) Находим количество вещества атомарного кислорода:
4) По известной общей формуле Э2О3 вычисляем количество вещества атомов неизвестного элемента. На каждые 3 моль атомов кислорода приходится 2 моль атомов неизвестного элемента.
Составим пропорцию:
3 моль атомов кислорода приходится на 2 моль атомов Э
1,88 моль атомов кислорода приходится на х моль атомов Э.
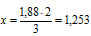
5) Теперь находим молярную массу атомов неизвестного элемента:
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
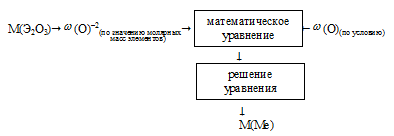
II способ (встречный алгоритм).
Схематично алгоритм можно изобразить таким образом:
Применим предложенный алгоритм.
1) Записываем выражение для молярной массы Э2О3:
М(Э2О3) = М(Э) . 2 + М(О) . 3 = (М(Э) . 2 + 48) г/моль.
2) Выбираем массу образца Э2О3, соответствующую 1 моль вещества. Она составит m(Э2О3) = (M(Э) . 2 + 48) г. Масса кислорода в этом образце будет 48 г.
3) Записываем выражение для массовой доли кислорода в выбранном образце:
4) Приравниваем полученное выражение к значению массовой доли кислорода из условия:
Получили одно уравнение с одним неизвестным М(Э). Решаем его и получаем М(Э) = 55,8 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
Ответ: искомый элемент — железо, формула Fе2О3.
Дихромат аммония аммония мне кажется будет..
Сейчас попробую рассчет привести
Кол-во моль одинаковопоэтому прировняем
10.08 148 + 2х = 6.08 48 +2х
находим х=52.25 — это хром
Красным — это молярная масса
Изменено 10 Июля, 2012 в 11:10 пользователем MacinTosh94