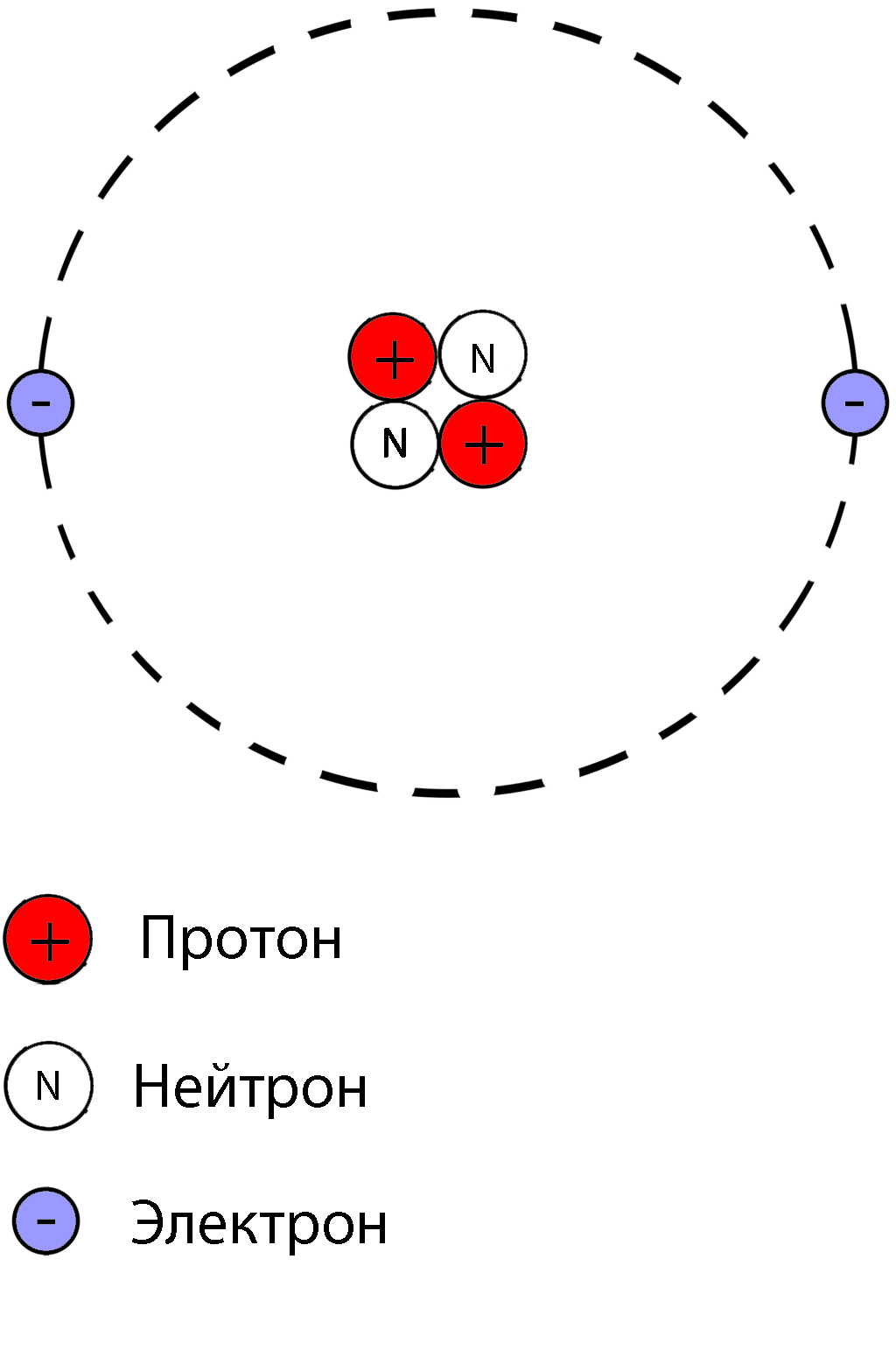
Нахождение числа нейтронов, протонов и электронов в атоме .
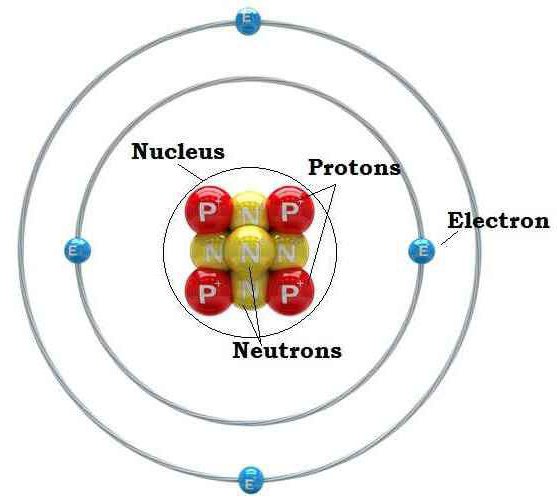
Атом состоит из ядра и вращающихся вокруг ядра электронов.
Ядро состоит из протонов и нейтронов
Протон- положительно заряженная частица
масса протона равна единице, заряд протона равен единице
Нейтрон-нейтральная частица
масса нейтрона равна единице, заряд нейтрона равен нулю
Электрон- отрицательно заряженная частица
Заряд электрона равен -1, а масса электрона равна нулю
Порядковый номер элемента в таблице Менделеева указывает на число электронов в атоме
Количество протонов в атоме равно количеству электронов , так как атом электрически нейтрален
Масса атома складывается из числа протонов и числа нейтронов, масса электрона не учитывается
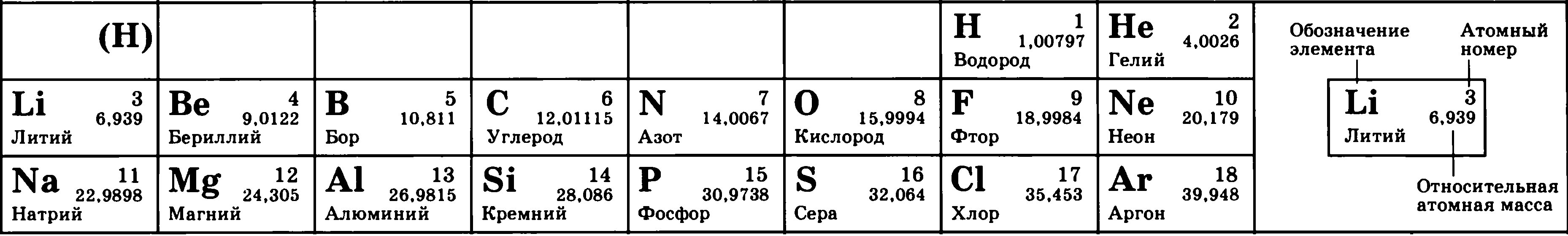
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов
в атоме водорода
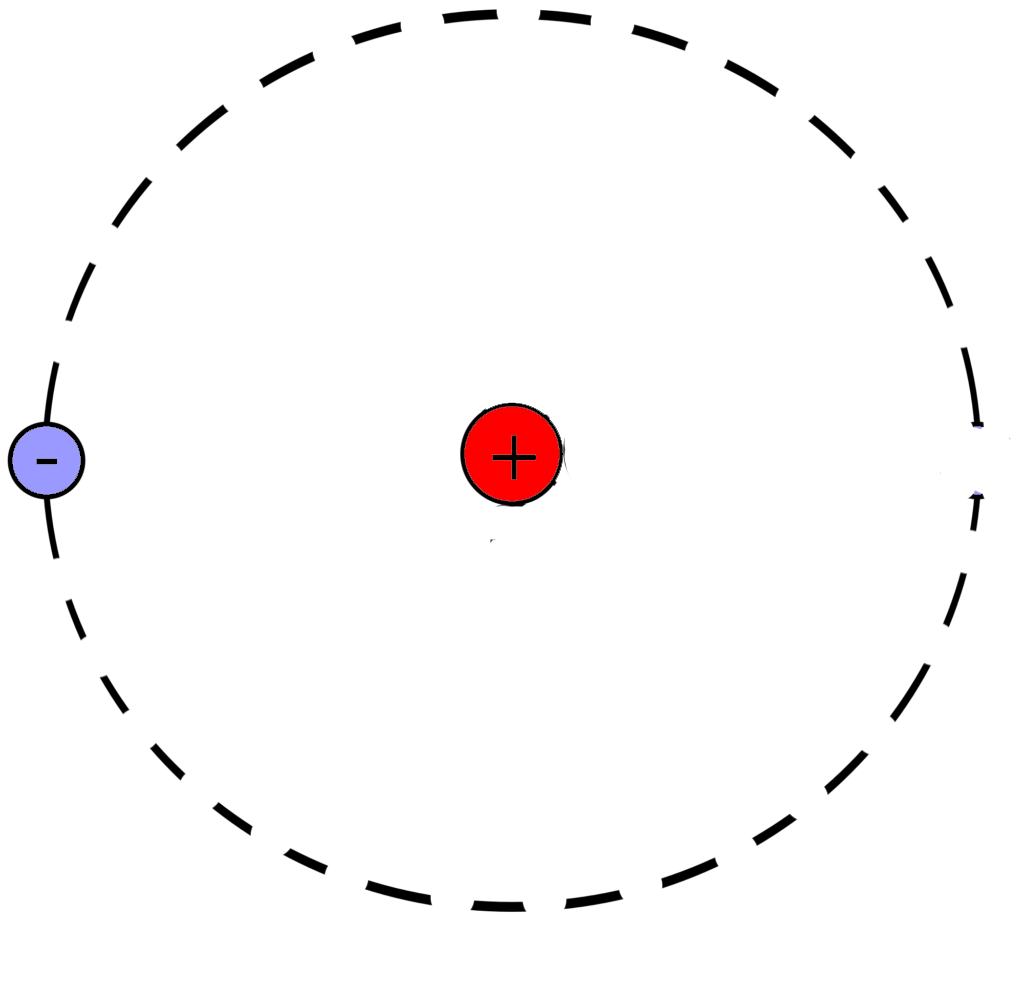
После чего начертим модель атома водорода
Порядковый номер атома водорода равен единице, значит атом имеет:
1 электрон
1 протон
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома водорода равна единице
Количество нейтронов=1-1=0
В атоме водорода нет нейтронов
Модель атома водорода:
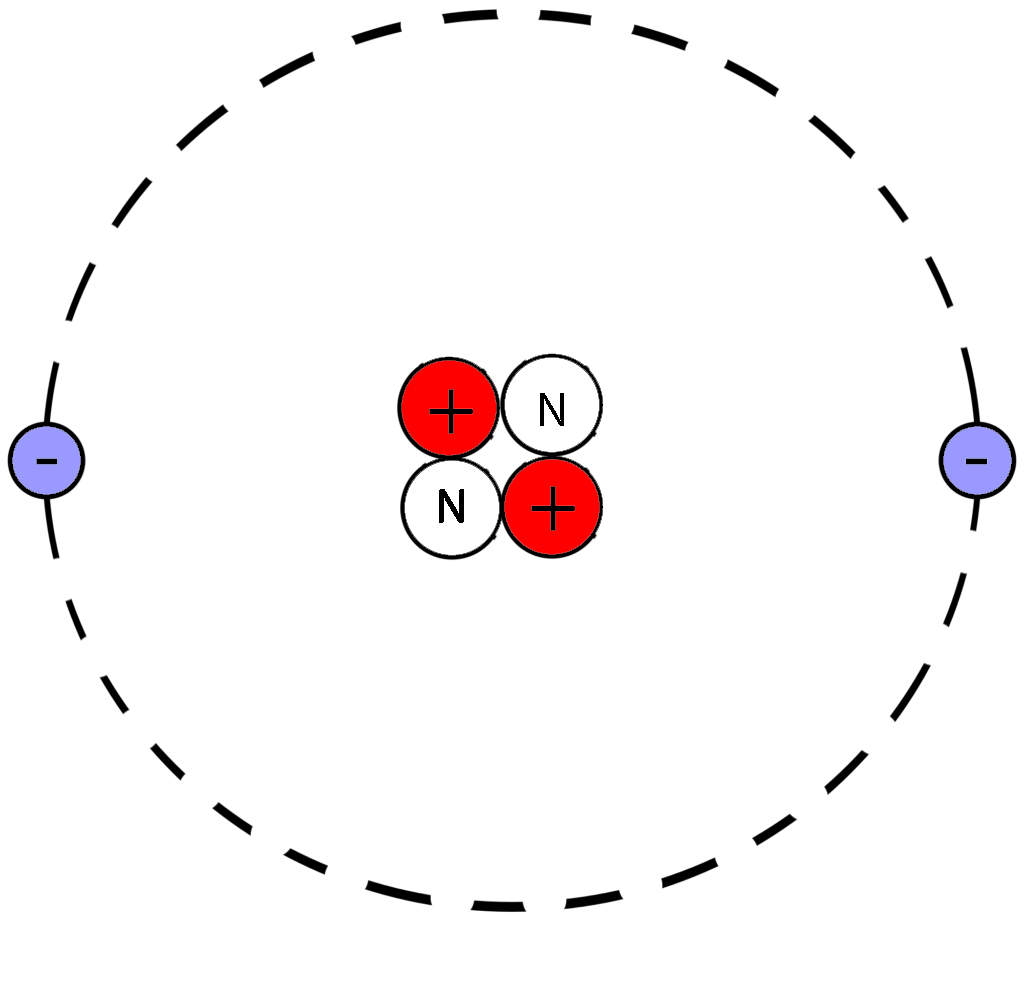
Рассмотрим фрагмент таблицы Менделеева и найдем количество протонов, нейтронов и электронов
в атоме гелия
После чего начертим модель атома гелия
Порядковый номер атома гелия равен 2, значит атом имеет:
2 электрона
2 протона
Для нахождения количества нейтронов нужно из массы вычесть число протонов
Масса атома гелия равна 4
Количество нейтронов=4-2=2
В атоме гелия 2 нейтрона
Модель атома гелия:
Задача 1.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме лития
Массу атома округлить до 7.
Показать ответ
Показать решение
Видеорешение
Задача 2.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме углерода.
Показать ответ
Показать решение
Видеорешение
Задача 3.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме азота.
Показать ответ
Показать решение
Видеорешение
Задача 4.
С помощью фрагмента таблицы Менделеева найти количество протонов, нейтронов и электронов в атоме кислорода.
Атомную массу округлить до 16.
Показать ответ
Показать решение
Видеорешение
Как мы видим в таблице Менделеева выше стоит порядковый номер, то есть заряд, который равен числу протонов
и электронов , а под ним расположена атомная масса.
Из каких-то непонятных соображений в ядерных реакциях или просто в одиночном обозначении элемента
сверху стоит масса, а снизу заряд(номер).
То есть все наоборот
( _{6}^{12}textrm{C} ;;;;;;;;; ) (12) это масса, (6) это заряд (номер)
( _{Z}^{M}textrm{C} ;;;;;;;;; ) (M) это масса, (Z) это заряд (номер)
Задача 5.
Найти количество протонов, нейтронов и электронов в атоме фтора
( _{9}^{19}textrm{F} )
Показать ответ
Показать решение
Видеорешение
Задача 6.
Найти количество протонов, нейтронов и электронов в атоме алюминия
( _{13}^{27}textrm{Al} )
Показать ответ
Показать решение
Видеорешение
Изотопы это атомы одного и того же химического элемента, они имеют одинаковый заряд,
но разное количество нейтронов
Изотопы кислорода:
( _{8}^{16}textrm{O} , ;;;; _{8}^{17}textrm{O} , ;;;; _{8}^{18}textrm{O} )
Как определить число нейтронов
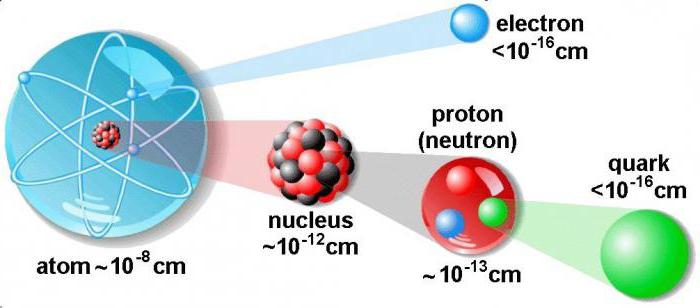
Атом химического элемента состоит из атомного ядра и электронов. В состав атомного ядра входят два типа частиц — протоны и нейтроны. Почти вся масса атома сосредоточена в ядре, так как протоны и нейтроны намного тяжелее электронов.

Вам понадобится
- атомный номер элемента, изотопы
Инструкция
В отличие от протонов, нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Поэтому, зная атомный номер элемента, нельзя однозначно сказать, сколько нейтронов содержится в его ядре. К примеру в ядре атома углерода всегда содержится 6 протонов, однако протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с разным количеством нейтронов в ядре называются изотопами этого элемента. Изотопы могут быть как природными, так и полученными искусственно.
Атомные ядра обозначаются буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A — это массовое число атома, A = Z+N, где Z — заряд ядра (число протонов),а N — число нейтронов. Нижнее число — это Z — заряд ядра. Такая запись дает информацию о количестве нейтронов в ядре. Очевидно, оно равно N = A-Z.
У разных изотопов одного химического элемента число A меняется, что отражено в записи этого изотопа. Определенные изотопы имеют свои оригинальные названия. Например, обычное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2), а изотоп тритий — два нейтрона (A = 3).
Зависимость числа нейтронов от числа протонов отражена на N-Z диаграмме атомных ядер. Устойчивость ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов наиболее устойчивы при N/Z = 1, то есть при равенстве количества нейтронов и протонов. С ростом массового числа область устойчивости сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для наиболее тяжелых ядер.
Видео по теме
Источники:
- Строение атомного ядра
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Загрузить PDF
Загрузить PDF
В атомах одного и того же элемента число протонов неизменно, в то время как число нейтронов может меняться. Зная, сколько нейтронов содержится в конкретном атоме, вы сможете определить, является ли он обычным атомом или изотопом, который будет иметь меньшее или большее количество нейтронов.[1]
Определить количество нейтронов в атоме — довольно просто. Все, что вам нужно сделать для расчета количества нейтронов в атоме или изотопе, — это следовать нашим инструкциям и держать под рукой периодическую таблицу.
-
1
Найдите элемент в периодической таблице. Для примера мы будем рассматривать осмий (Os), который находится в шестом периоде (шестой ряд сверху).
-
2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер — это количество протонов в одном атоме этого элемента. Для осмия это число 76, то есть в одном атоме осмия содержится 76 протонов.
- Число протонов неизменно, именно оно и делает элемент элементом.
-
3
Найдите атомную массу элемента. Это число обычно находится под символом элемента. Обратите внимание, что в варианте периодической системы в нашем примере атомная масса не приведена (это не всегда так; во многих вариантах периодической системы атомная масса указана). Атомная масса осмия — 190,23.
-
4
Округлите атомную массу до ближайшего целого числа. В нашем примере 190,23 округляется до 190.
- Атомная масса — среднее число изотопов конкретного элемента, обычно она не выражается целым числом.
-
5
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. Цифры после десятичной запятой относятся к очень малой массе электронов в атоме. В нашем примере: 190 (атомный вес) — 76 (число протонов) = 114 (число нейтронов).
-
6
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
-
N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
Реклама
-
N = M – n
-
1
Найдите элемент в периодической таблице. В качестве примера мы будем рассматривать изотоп углерода 14С. Поскольку неизотопный углерод 14С есть просто углерод С, найдите углерод в периодической таблице (второй период или второй ряд сверху).
-
2
Найдите атомный номер элемента. Это, как правило, наиболее заметное число в ячейке элемента и обычно находится над его символом (в варианте периодической системы, которую мы используем в нашем примере, других номеров и нет). Атомный номер – это количество протонов в одном атоме этого элемента. Углерод находится под номером 6, то есть один атом углерода имеет шесть протонов.
-
3
Найдите атомную массу. В случае изотопов делать это очень просто, так как они названы в соответствии с их атомной массой. В нашем случае у углерода 14С атомная масса равна 14. Теперь мы знаем атомную массу изотопа; последующий процесс расчета такой же, как и для определения числа нейтронов в атомах (не изотопах).
-
4
Вычтите атомный номер из атомной массы. Поскольку абсолютная часть атомной массы приходится на протоны и нейтроны, вычитание числа протонов (то есть атомного номера, который равен числу протонов) из атомной массы дает число нейтронов в атоме. В нашем примере: 14 (атомная масса) — 6 (число протонов) = 8 (число нейтронов).
-
5
Запомните формулу. Чтобы найти число нейтронов в будущем, просто используйте эту формулу:
-
N = M – n
- N = количество нейтронов
- M = атомная масса
- n = атомный номер
Реклама
-
N = M – n
Советы
- Протоны и нейтроны составляют практически абсолютную массу элементов, в то время как электроны и прочие частицы составляют крайне незначительную массу (эта масса стремится к нулю). Так как один протон имеет примерно ту же массу, что и один нейтрон, а атомное число представляет собой число протонов, то можно просто вычесть число протонов от общей массы.
- Осмий — металл в твердом состоянии при комнатной температуре, получил свое название от греческого слова «osme» — запах.
- Если вы не уверены, что значит какое-то число в периодической таблице, запомните: таблица, как правило, строится вокруг атомного номера (то есть числа протонов), который начинается с 1 (водород) и растет на одну единицу слева направо, заканчиваясь на 118 (Оганесон). Это потому, что число протонов в атоме определяет сам элемент и такое число — наиболее легкий способ систематизации элементов (например, атом с 2 протонами — всегда гелий, так же, как и атом с 79 протонами — всегда золото).
Реклама
Об этой статье
Эту страницу просматривали 193 556 раз.
Была ли эта статья полезной?
В природе подавляющее большинство атомов водорода не имеют нейтронов; эти атомы состоят только из одного электрона и одного протона и являются самыми легкими из возможных атомов. Тем не менее, редкие изотопы водорода, называемые дейтерием и тритием, имеют нейтроны. Дейтерий имеет один нейтрон, а тритий, нестабильный и не встречающийся в природе, имеет два.
TL; DR (слишком долго; не читал)
Большинство атомов водорода не имеют нейтронов. Однако редкие изотопы водорода, называемые дейтерием и тритием, имеют один и два нейтрона каждый, соответственно.
Элементы и изотопы
Большинство элементов в периодической таблице имеют несколько изотопов — «двоюродных братьев» элемента, которые имеют одинаковое количество протонов, но различное количество нейтронов. Изотопы выглядят очень похожими друг на друга и имеют сходные химические свойства. Например, наряду с обильным изотопом углерода-12, вы можете найти крошечные количества радиоактивного углерода-14 практически во всех живых существах. Однако, поскольку нейтроны имеют массу, вес изотопов несколько отличается. Ученые могут обнаружить разницу, используя масс-спектрометр и другое специализированное оборудование.
Использует для водорода
Водород — самый распространенный элемент во вселенной. На Земле вы редко найдете водород сам по себе; гораздо чаще он сочетается с кислородом, углеродом и другими элементами в химических соединениях. Вода, например, представляет собой водород, соединенный с кислородом. Водород играет важную роль в углеводородах, таких как масла, сахара, спирты и другие органические вещества. Водород также служит «зеленым» источником энергии; когда сгорел в воздухе; он выделяет тепло и чистую воду без выделения CO 2 или других вредных выбросов.
Использует для дейтерия
Хотя дейтерий, также известный как «тяжелый водород», встречается в природе, он менее распространен, и на его долю приходится один из каждых 6420 атомов водорода. Как и водород, он соединяется с кислородом, образуя «тяжелую воду», вещество, которое выглядит и ведет себя так же, как обычная вода, но немного тяжелее и имеет более высокую температуру замерзания, 3, 8 градуса Цельсия (38, 4 градуса по Фаренгейту), по сравнению с 0 градусами. По Цельсию (32 градуса по Фаренгейту). Дополнительные нейтроны делают тяжелую воду полезной для радиационной защиты и других применений в научных исследованиях. Будучи редкой, тяжелая вода также намного дороже, чем обычный вид. Его дополнительный вес делает его несколько странным по сравнению с водой. При нормальных концентрациях не о чем беспокоиться; однако, количества свыше 25 процентов повредят кровь, нервы и печень, и очень высокие концентрации могут быть смертельными.
Использует для трития
Два дополнительных нейтрона, найденные в тритии, делают его радиоактивным, распадающимся с периодом полураспада 12, 28 лет. Без естественной поставки трития его необходимо производить в ядерных реакторах. Хотя его излучение несколько опасно, в небольших количествах и при бережном обращении и хранении тритий может быть полезным. Знаки «выхода», сделанные с тритием, производят мягкое свечение, которое остается видимым в течение 20 лет; потому что им не нужно электричество, они обеспечивают безопасное освещение во время отключения электричества и других чрезвычайных ситуаций. Тритий используется в исследованиях, например, для отслеживания потока воды; это также играет роль в некотором ядерном оружии.
Поговорим о том, как найти протоны, нейтроны и электроны. В атоме существует три вида элементарных частиц, причем у каждой есть свой элементарный заряд, масса.
Строение ядра
Для того чтобы понять, как найти протоны, нейтроны и электроны, представим особенности строения ядра. Оно является основной частью атома. Внутри ядра располагаются протоны и нейтроны, именуемые нуклонами. Внутри ядра эти частицы могут переходить друг в друга.
Например, чтобы найти протоны, нейтроны и электроны в атоме водорода, необходимо знать его порядковый номер. Если учесть, что именно этот элемент возглавляет периодическую систему, то в его ядре содержится один протон.
Диаметр атомного ядра составляет десятитысячную долю всего размера атома. В нем сосредоточена основная масса всего атома. По массе ядро превышает в тысячи раз сумму всех электронов, имеющихся в атоме.
Характеристика частиц
Рассмотрим, как найти протоны, нейтроны и электроны в атоме, и узнаем об их особенностях. Протон — это элементарная частица, которая соответствует ядру атома водорода. Его масса превышает электрон в 1836 раз. Для определения единицы электричества, проходящего через проводник с заданным поперечным сечением, используют электрический заряд.
У каждого атома в ядре располагается определенное количество протонов. Оно является постоянной величиной, характеризует химические и физические свойства данного элемента.
Как найти протоны, нейтроны и электроны в атоме углерода? Порядковый номер данного химического элемента 6, следовательно, в ядре содержится шесть протонов. Согласно планетарной модели строения атома, вокруг ядра по орбитам движется шесть электронов. Для определения количество нейтронов из значения относительной атомной массы углерода (12) вычитаем количество протонов (6), получаем шесть нейтронов.
Для атома железа число протонов соответствует 26, то есть этот элемент имеет 26-й порядковый номер в таблице Менделеева.
Нейтрон является электрически нейтральной частицей, нестабильной в свободном состоянии. Нейтрон способен самопроизвольно превращаться в положительно заряженный протон, испуская при этом антинейтрино и электрон. Средний период его полураспада составляет 12 минут. Массовое число — это суммарное значение количества протонов и нейтронов внутри ядра атома. Попробуем выяснить, как найти протоны, нейтроны и электроны в ионе? Если атом во время химического взаимодействия с другим элементом приобретает положительную степень окисления, то число протонов и нейтронов в нем не изменяется, меньше становится только электронов.
Заключение
Существовало несколько теорий, касающихся строения атома, но ни одна из них не была жизнеспособной. До версии, созданной Резерфордом, не было детального пояснения о расположении внутри ядра протонов и нейтронов, а также о вращении по круговым орбитам электронов. После появления теории планетарного строения атома у исследователей появилась возможность не только определять количество элементарных частиц в атоме, но и предсказывать физические и химические свойства конкретного химического элемента.