Йод, свойства атома, химические и физические свойства.
I 53 Йод
126,90447(3) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5
Йод — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 53. Расположен в 17-й группе (по старой классификации — главной подгруппе седьмой группы), пятом периоде периодической системы.
Атом и молекула йода. Формула йода. Строение атома йода
Изотопы и модификации йода
Свойства йода (таблица): температура, плотность, давление и пр.
Физические свойства йода
Химические свойства йода. Взаимодействие йода. Химические реакции с йодом
Получение йода
Применение йода
Таблица химических элементов Д.И. Менделеева
Атом и молекула йода. Формула йода. Строение атома йода:
Йод (лат. Iodum, от греч. ἰώδης — «фиалковый (фиолетовый)») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением I и атомным номером 53. Расположен в 17-й группе (по старой классификации – главной подгруппе седьмой группы), пятом периоде периодической системы.
Йод – неметалл. Относится к группе галогенов.
Йод обозначается символом I.
Как простое вещество йод при нормальных условиях представляет собой кристаллы чёрно-серого цвета с фиолетовым металлическим блеском. Йод легко образует фиолетовые пары, обладающие резким запахом.
Молекула йода двухатомна.
Химическая формула йода I2.
Электронная конфигурация атома йода 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5. Потенциал ионизации (первый электрон) атома йода равен 1008,39 кДж/моль (10,451260(25) эВ).
Строение атома йода. Атом йода состоит из положительно заряженного ядра (+53), вокруг которого по пяти оболочкам движутся 53 электрона. При этом 46 электронов находятся на внутреннем уровне, а 6 электронов – на внешнем. Поскольку йод расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома йода на 5s-орбитали находятся два спаренных электрона, на 5p-орбитали – четыре спаренных и один неспаренный электрон. В свою очередь ядро атома йода состоит из 53 протонов и 74 нейтронов. Йод относится к элементам p-семейства.
Радиус атома йода (вычисленный) составляет 115 пм.
Атомная масса атома йода составляет 126,90447(3) а. е. м.
Йод – химически активный неметалл.
Изотопы и модификации йода:
Свойства йода (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Йод |
| 102 | Прежнее название | |
| 103 | Латинское название | Iodum |
| 104 | Английское название | Iodine |
| 105 | Символ | I |
| 106 | Атомный номер (номер в таблице) | 53 |
| 107 | Тип | Неметалл |
| 108 | Группа | Галоген |
| 109 | Открыт | Бернар Куртуа, Франция, 1811 г. |
| 110 | Год открытия | 1811 г. |
| 111 | Внешний вид и пр. | Кристаллы чёрно-серого цвета с фиолетовым металлическим блеском. Легко образует фиолетовые пары, обладающие резким запахом |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,000049 % |
| 120 | Содержание в морях и океанах (по массе) | 6,0·10-6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10-7 % |
| 122 | Содержание в Солнце (по массе) | |
| 123 | Содержание в метеоритах (по массе) | 0,000025 % |
| 124 | Содержание в организме человека (по массе) | 0,00002 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 126,90447(3) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O7 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 115 пм |
| 205 | Эмпирический радиус атома* | 140 пм |
| 206 | Ковалентный радиус* | 139 пм |
| 207 | Радиус иона (кристаллический) | I–
206 (6) пм, I 5+ 109 (6) пм, I 7+ 67 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 198 пм |
| 209 | Электроны, Протоны, Нейтроны | 53 электрона, 53 протона, 74 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 17-ая группа (по старой классификации – главная подгруппа 7-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, 0, +1, +2, +3, +4, +5, +6, +7 |
| 302 | Валентность | I, III, V, VII |
| 303 | Электроотрицательность | 2,66 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1008,39 кДж/моль (10,451260(25) эВ) |
| 305 | Электродный потенциал | I2 + 2e– → 2I–, Eo = +0,536,
I3– + 2e– → 3I–, Eo = +0,545 |
| 306 | Энергия сродства атома к электрону | 295,1531(4) кДж/моль (3,0590465(37) эВ) – йод 127I,
295,154(4) кДж/моль (3,059052(38) эВ) – йод 128I |
| 400 | Физические свойства | |
| 401 | Плотность* | 4,933 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело)
4,866 г/см3 (при 60 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | 113,7 °C (386,85 K, 236,66 °F) |
| 403 | Температура кипения* | 184,3 °C (457,4 K, 363,7 °F) |
| 404 | Температура сублимации* | При нагревании при атмосферном давлении |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл) | 15,52 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 41,57 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 54,44 Дж/(K·моль) |
| 411 | Молярный объём | 25,689 см³/моль |
| 412 | Теплопроводность | 0,449 Вт/(м·К) (при стандартных условиях),
0,45 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Орторомбическая
|
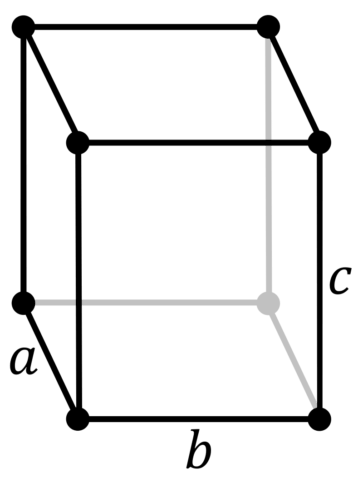
| 513 | Параметры решётки | a = 7,18 Å, b = 4,71 Å, c = 9,81 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | Cmca |
| 517 | Номер пространственной группы симметрии | 64 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7553-56-2 |
Примечание:
205* Эмпирический радиус атома йода согласно [3] составляет 136 пм.
206* Ковалентный радиус йода согласно [1] и [3] составляет 139±3 пм и 133 пм соответственно.
401* Плотность йода согласно [3] и [4] составляет 4,93 г/см3 (при 25 °C и иных стандартных условиях, состояние вещества – твердое тело) и 4,94 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления йода согласно [3] и [4] составляет 113,5 °С (386,65 K, 236,3 °F) и 114 °С (387,15 K, 237,2 °F) соответственно. Жидкий йод согласно [3] можно получить, нагревая его под давлением.
403* Температура кипения йода согласно [3] и [4] составляет 184,35 °C (457,5 K, 363,83 °F) и 185,5 °С (458,65 K, 365,9 °F) соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) йода согласно [3] составляет 41,95 кДж/моль.
Физические свойства йода:
Химические свойства йода. Взаимодействие йода. Химические реакции с йодом:
Получение йода:
Применение йода:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Iodine
- https://de.wikipedia.org/wiki/Iod
- https://ru.wikipedia.org/wiki/Иод
- http://chemister.ru/Database/properties.php?dbid=1&id=263
- https://chemicalstudy.ru/yod-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
йод атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле йода йод
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности
4 458
Характеристика иода
Положение в ПСХЭ
Иод (I) располагается в 5 периоде, в VII группе, главной подгруппе, имеет порядковый номер 53.
Атомные числа
A (массовое число) = 127
P (число протонов) = 53
N (число нейтронов) = A — Z = 127 — 53 = 74
ē (число электронов) = 53
Электронное строение атома
I
+53
2
8
18
18
7
53I 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5
Валентные электроны
| 53I | ↑↓ | ↑↓ | ↑↓ | ↑ | ||||||||
| 5s | 5p | 5d |
| 53I* | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | |||||||
| 5s | 5p | 5d |
| 53I** | ↑↓ | ↑ | ↑ | ↑ | ↑ | ↑ | ||||||
| 5s | 5p | 5d |
| 53I*** | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | ↑ | |||||
| 5s | 5p | 5d |
Степени окисления
минимальная: -1
максимальная: +7
Свойства простого вещества
Иод – p-элемент, неметалл.
Высший оксид
I2O7 – оксид иода (VII).
Проявляет кислотные свойства:
I2O7 + 2NaOH ⟶ 2NaIO4 + H2O
Высший гидроксид
HIO4 – иодная кислота.
Проявляет кислотные свойства:
HIO4 + NaOH ⟶ NaIO4 + H2O
Водородное соединение
HI
Предмет: Химия,
автор: pin777
Химия! Очень срочно!
Рассчитайте число протонов, электронов и нейтронов для следующих атомов: йод, сера, берилий.
Ответы
Автор ответа: tolibaevazumrad
1
Ответ:
йод: 53 протонов,
53 электронов
74 нейтронов.
сера: 16 протонов,
16 электронов,
16 нейтронов.
берилий: 4 протонов,
4 электронов,
5 нейтронов.
Объяснение:
для того что бы найти нейтроны надо массу отнимать от потрядкогого номера. а протоны равны с порядковый номером а электрон протоном
Интересные вопросы
Предмет: Биология,
автор: kuznecovtimofey2006
Предмет: Алгебра,
автор: andrianasevcik
Предмет: Алгебра,
автор: mashasnyrova
История открытия
Йод был открыт в 1811 году французским химиком Бернаром Куртуа (1777—1838). Одна из первых его работ в начале 1800-х годов состояла в том, чтобы помочь своему отцу в изготовлении соединений натрия и калия (нитрат калия, KNO3) из морских водорослей.
Куртуа и его отец собирали водоросли на побережьях Нормандии и Бретани во Франции. Затем они жгли их и смачивали пепел водорослей в воде, чтобы растворить соединения натрия и калия. Однажды в 1811 году Бернар добавил серную кислоту и увидел фиолетовые пары, которые конденсировались, образуя кристаллы с металлическим блеском. Куртуа догадался, что это был новый элемент, который он назвал в честь его цвета (на греческом языке слово «иодес» означает «фиолетовый»).
Куртуа дал небольшое количество этого вещества Шарлю-Бернару Десормесу и Николя Клеману, которые провели систематическое расследование. В ноябре 1813 года они выставили йод в Императорском институте в Париже. То, что это действительно новый элемент, было доказано Джозефом Гей-Люссаком и подтверждено Хамфри Дэви, который отправил отчёт в Королевское учреждение в Лондоне, где ошибочно предположили, что он был первооткрывателем, и это убеждение сохранялось более 50 лет.
Основная информация
Йод является важным элементом, необходимым для жизни. Он наиболее известен своей ролью в выработке гормонов щитовидной железы у людей, а также у всех позвоночных. Дефицит йода может привести к серьёзным проблемам со здоровьем, включая зоб (увеличение щитовидной железы), умственную отсталость и кретинизм.
В качестве чистого элемента он представляет собой блестящий пурпурно-чёрный неметалл, твёрдый при стандартных условиях. Он легко переходит из твёрдого в газообразное состояние, минуя жидкую форму, и выделяет пурпурный пар. Хотя это технически неметалл, он обладает некоторыми металлическими качествами. Основными характеристиками элемента являются:
- Название: Йод.
- Символ: I.
- Атомный номер: 53.
- Атомная масса: 126,90447 а. е. м.
- Температура плавления: 113,5 °C.
- Температура кипения: 184,0 °C.
- Электронная формула йода (Электронная конфигурация): 1s22s22p63s23p63d104s24p64d105s25p5.
- Строение атома: количество протонов — 53, электронов — 53, нейтронов — 74.
- Валентность переменная: -1, +1, (+3), (+4), +5, +7.
- Классификация: галоген.
- Кристаллическая структура: ромбическая.
- Плотность при 20°C: 4,93 г / см3.
- Цвет: чёрно-серый.
Физические свойства
Йод является одним из самых ярких и красивых элементов. Как твёрдое вещество, это тяжёлый, серовато-черный, металлический материал. Среди его основных физических свойств можно выделить:
- При нагревании не плавится. Вместо этого он испаряется. Сублимация — это процесс, при котором твёрдое вещество превращается непосредственно в газ без предварительного плавления. Образующийся пар йода имеет фиолетовый цвет и резкий запах. Если в эти пары помещается холодный объект, йод снова превращается в твёрдое вещество. Образует привлекательные, нежные металлические кристаллы.
- Растворяется в воде лишь незначительно. Но он растворяется во многих других жидкостях, образуя характерные пурпурные растворы.
- При нагревании в надлежащих условиях его можно заставить испаряться при 113,5°C и закипеть при 184 °C. Плотность элемента составляет 4,93 грамма на кубический сантиметр.
- Имеет умеренное давление паров при комнатной температуре, и в открытом сосуде медленно сгущается до глубоких фиолетовых паров, которые раздражают глаза, нос и горло (высококонцентрированный йод является ядовитым и может нанести серьёзный ущерб коже и тканям.) По этой причине йод лучше всего взвешивать в закупоренной бутылке. Для приготовления водного раствора флакон может содержать раствор йодида калия, что значительно снижает давление паров йода.
Химические свойства
Как и другие галогены, йод является активным элементом. Однако он менее активен, чем три галогена, стоящие над ним в периодической таблице. Основные химические свойства йода:
- Его наиболее распространёнными соединениями являются щелочные металлы, натрий и калий. Но он также образует соединения с другими элементами, в том числе с галогенами. Некоторыми примерами являются монобромид йода (IBr), монохлорид йода (ICl) и пентафторид йода (IF 5).
- Молекулярная решётка йода содержит дискретные двухатомные молекулы, которые также присутствуют в расплавленном и газообразном состояниях. Выше 700 °C диссоциация на атомы йода становится заметной.
- Молекула элемента может действовать, как кислота Льюиса в том смысле, что она сочетается с различными основаниями Льюиса. Взаимодействие, однако, слабое, и лишь немногие твёрдые комплексные соединения были выделены. Они легко обнаруживаются в растворе и называются комплексами с переносом заряда. Например, йод слабо растворяется в воде и даёт желтовато-коричневый раствор. Коричневые растворы также образуются со спиртом, эфиром, кетонами и другими соединениями, действующими, как основания Льюиса через атом кислорода.
- Даёт красный раствор в бензоле, который рассматривается, как результат другого типа комплекса с переносом заряда. В инертных растворителях, таких как четырёххлористый углерод или сероуглерод, получаются растворы фиолетового цвета, которые содержат несогласованные молекулы йода.
- Реагирует также с йодид-ионами, поскольку последние могут действовать, как основания Льюиса, и по этой причине растворимость элемента в воде значительно повышается в присутствии йодида. При добавлении йодида цезия кристаллический трийодид цезия может быть выделен из красновато-коричневого водного раствора.
- Образует синий комплекс с крахмалом, и этот цветовой тест используется для обнаружения небольших количеств йода.
- Это более слабый окислитель, чем бром, хлор или фтор.
- Легко соединяется с большинством металлов и некоторыми неметаллами с образованием йодидов. Например, серебро и алюминий легко превращаются в их соответствующие йодиды, а белый фосфор легко объединяется с йодом.
- Водный раствор йодистого водорода (HI), известный как йодистоводородная кислота, является сильной кислотой, которая используется для приготовления йодидов путём реакции с металлами или их оксидами, гидроксидами и карбонатами.
- Проявляет степень окисления +5 в умеренно сильной йодной кислоте (HIO 3), которая может быть легко обезвожена с образованием белого твёрдого пентоксида йода (I 2 O 5).
Наличие в природе
Йода не очень много в земной коре. По оценкам, его количество составляет от 0,3 до 0,5 частей на миллион. Он находится в нижней трети элементов, с точки зрения изобилия. Но, тем не менее, он более распространён, чем кадмий, серебро, ртуть и золото. Его содержание в морской воде ещё меньше — около 0,0003 частей на миллион.
Этот элемент, как правило, концентрируется в земной коре лишь в нескольких местах, когда-то покрытых океанами. За миллионы лет океаны испарились и оставили химические соединения, которые были растворены в них и сегодня существуют под землёй, как соляные копи.
Существует возможность собирать этот элемент из морской воды, солоноватой воды, рассола или морских водорослей. Морская вода имеет разные названия, в зависимости от количества растворенных в ней твёрдых веществ. Водоросли являются популярным источником йода, так как поглощают элементы из морской воды. Со временем они начинают иметь гораздо более высокую концентрацию йода, чем морская вода. Морскую водоросль собирают, сушат и сжигают для сбора вещества. Процесс мало чем отличается от того, который использовал Куртуа в 1811 году.
Изотопы элемента
Известен только один природный изотоп элемента — йод-127. Изотопы — это две или более формы элемента. Они отличаются друг от друга по их массовому числу. Число, написанное справа от названия элемента, является массовым числом. Оно представляет количество протонов плюс нейтронов в ядре атома элемента. Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться. Каждая вариация является изотопом.
Примерно 30 радиоактивных изотопов йода были изготовлены искусственно. Это такие изотопы, которые распадаются на части и выделяют некоторую форму радиации. Они образуются, когда очень маленькие частицы обжигают атомы. Эти частицы прилипают к атомам и делают их радиоактивными.
Применение изотопов
Ряд изотопов йода имеет коммерческое использование. В медицинских целях они вводятся в организм пациента через рот, а затем проходят через тело в кровотоке. Когда они путешествуют, то излучают радиацию. Это излучение обнаруживается с помощью рентгеновской плёнки. Медицинский специалист может сказать, насколько хорошо организм функционирует, наблюдая диаграмму направленности. Изотопы йода используются и в следующих целях:
- Йод-123 — в исследованиях мозга, почек и щитовидной железы.
- Йод-125 — для исследования поджелудочной железы, кровотока, печени, поглощения минеральных веществ в костях и потери белков в организме.
- А йод-131 — при исследованиях печени, почек, кровотока, лёгких, мозга, поджелудочной железы.
Наиболее распространённым изотопом является йод-131. При попадании в организм он имеет тенденцию поступать непосредственно в щитовидную железу, а затем используется для выработки гормонов щитовидной железы.
Получение и нахождение
Этот элемент коммерчески производится из йодсодержащих рассолов. Природные рассолы или рассолы, извлечённые из нефтяных скважин, содержащие до 150 мг на литр (0,02 унции на галлон), обнаружены в Яве, Калифорнии и северной Италии. В число ведущих мировых производителей входят Чили, Япония, Китай, Россия и Азербайджан.
Примеси, такие как глина, песок и масло, удаляются фильтрацией, а раствор пропускается через поток диоксида серы, а затем через несколько контейнеров, в которых содержатся пучки медной проволоки. Образующийся йодид меди удаляют фильтрацией, промывают водой, сушат и тонко измельчают. Продукт нагревают с карбонатом калия, получая йодид калия, который затем окисляют до свободного элемента дихроматом и серной кислотой.
Использование и применение
Около 2/3 всего йода и его соединений используется в системах санитарии или в производстве различных антисептиков и лекарств. Вещество также используется для изготовления красителей, фотоплёнки и специального мыла. Он применяется в некоторых отраслях промышленности в качестве катализатора — вещества, используемого для ускорения или замедления химической реакции. Он не претерпевает никаких изменений во время реакции.
Элемент может оказывать как благоприятное, так и неблагоприятное воздействие на живые организмы. Он имеет тенденцию убивать бактерии и другие болезнетворные организмы. Это свойство вещества вызывает его использование в системах санитарии и в качестве антисептика — химического вещества, останавливающего рост микробов.
Настойка йода всегда была одним из самых популярных антисептических препаратов Её наносили на порезы и раны, чтобы предотвратить заражение. Сегодня она часто заменяется другими антисептиками.
Одной из причин того, что сегодня настойка используется реже, является то, что она также может вызвать проблемы. В более высоких дозах йод может раздражать или сжигать кожу. Он также может быть довольно ядовитым, если принимать его внутрь, поэтому важно использовать его согласно инструкции.
Другими важными областями применения йода являются:
- Поскольку он преобразуется в тироксин в щитовидной железе, небольшое его количество имеет важное значение для организма, который содержит в среднем 14 мг (0,00049 унции) элемента. Тироксин — это гормон, необходимый для поддержания нормального обмена веществ во всех клетках организма. Он способен возбудить нервную систему, в особенности кору головного мозга и промежуточный мозг. Во многих местах питьевая вода содержит достаточно йода для этой цели.
- Элемент и его соединения широко используются в аналитической химии. Многие процедуры основаны на выделении или поглощении йода и его последующем титровании с тиосульфатом натрия (йодометрия). Ненасыщенность жиров (то есть количество двойных или тройных связей между атомами углерода) определяется добавлением свободного йода (йодного числа).
- Используется в фотографии, как йодид серебра и йодид калия.
- Йодид серебра также применяется для посадки облаков, чтобы вызвать дождь.
- Используется в производстве красителей.
Биологическая роль
Йод является важным элементом для людей, которым требуется суточное его потребление в количестве около 0,1 мг. Максимальная безопасная для здоровья доза единовременного потребления — 0.5 г (500 мкг). Тело человека содержит до 20 миллиграмм этого элемента, главным образом в щитовидной железе, которая помогает регулировать рост и температуру тела.
Обычно люди получают достаточно йода из пищи, которую они едят. Дефицит же этого микроэлемента может вызвать опухоль щитовидной железы (известный, как зоб). Зоб вызывает большой комок в шее, поскольку щитовидная железа выходит из-под контроля. (Он может вырасти до размера виноградного плода.) Зоб пытается производить гормоны щитовидной железы, но он не получает достаточного количества йода из рациона человека, поэтому продолжает расширяться, пытаясь сделать свою работу.
Недостаток йода может вызвать и другие проблемы. Например, гормоны щитовидной железы необходимы для нормального развития мозга у нерожденного ребёнка и продолжения этого развития после рождения. Люди, которые не включают в свой рацион достаточного количества микроэлемента, не развиваются нормально.
Сегодня эксперты говорят, что низкий уровень йода является основной причиной умственной отсталости, глухоты, мутизма (неспособности говорить) и паралича. К менее серьёзным проблемам относятся сонливость, неуклюжесть и неспособность к обучению.
Количество йода в организме человека очень мало. Для определения его количества вес человека делится на 2 500 000. Полученное число и есть вес элемента в организме. Для нормальных людей эта сумма примерно равна размеру головки булавки, но эта крошечная точка может иметь большое значение для здоровья.
Низкий уровень микроэлемента может быть легко исправлен. Сегодня в большинстве развитых стран компании, производящие поваренную соль, добавляют небольшое количество йодида калия (KI) в соль, которая обозначается «йодированная соль». Люди, которые её используют, получают необходимое количество для нормальной работы щитовидной железы.
Но те, кто живет в развивающихся странах, могут не получать йодированной соли. Всемирная организация здравоохранения (ВОЗ) пытается найти способы обеспечения микроэлементом этих людей. По оценкам ВОЗ, 1,5 млрд человек живут в районах с низким уровнем йода. До 20 млн из этих людей могут иметь психические расстройства из-за его недостатка. ВОЗ начала программу по обеспечению будущего поколения в таких регионах этим микроэлементом, необходимым для нормального развития и функционирования.
йод
Что имеет 53 электрона и 74 нейтрона?
йод Атомный номер йода (53) говорит нам о том, что нейтральный атом йода содержит 53 протона в ядре и 53 электрона вне ядра. Поскольку сумма количества протонов и нейтронов равна массовому числу 127, количество нейтронов равно 74 (127 – 53 = 74).
Смотрите также, на каком континенте находится Дания.
Какой атом имеет 53 протона, 53 электрона и 72 нейтрона?
Йод 125 Йод 125 является единственным другим радиоизотопом йода, используемым в лучевой терапии. Йод 125 (I-125) — изотоп йода, ядро которого состоит из 53 протонов и 72 нейтронов. Это радиоизотоп, разрушающий электроны, в составе Tellure 125 (Te-125) с периодом полураспада 59,4 дня.
Какой изотоп имеет 53 протона и 73 нейтрона?
Например: йод имеет атомную массу 126 и атомный номер 53. Таким образом, имеется 53 протона и 73 нейтрона (126 – 53 = 73).
Какой элемент имеет 74 протона?
Вольфрам Вольфрам представляет собой химический элемент с символом W и атомным номером 74. Классифицируемый как переходный металл, вольфрам представляет собой твердое вещество при комнатной температуре.
Что имеет 74 протона и электрона?
вольфрам
Как описано выше, каждый атом вольфрама состоит из 74 протонов и 74 электронов в своем химическом составе. Протоны атома находятся в ядре атома. 22 января 2020 г.
Какой элемент имеет 53 протона и 70 нейтронов?
Изотопы йода
| Изотоп: | Содержание ядра: |
|---|---|
| Йод-123 | 53 протона, 70 нейтронов |
| Йод-124 | 53 протона, 71 нейтрон |
| Йод-125 | 53 протона, 72 нейтрона |
| Йод-128 | 53 протона, 75 нейтронов |
Как написать изотоп йода с 74 нейтронами?
Следовательно, изотопный символ изотопа йода с 74 нейтронами равен 12753I 53 127 I .
Сколько протонов содержит ион с 74 электронами и зарядом +4?
Каков его заряд? Pt имеет атомный номер 78, поэтому 78 протонов. С 74 электронами он потерял 4 электрона и должен иметь заряд +4.
Что такое периодическая таблица MN?
марганец (Mn), химический элемент, один из серебристо-белых, твердых, хрупких металлов группы 7 (VIIb) периодической таблицы. Он был признан элементом в 1774 году шведским химиком Карлом Вильгельмом Шееле во время работы с минералом пиролюзитом и в том же году был выделен его коллегой Йоханом Готлибом Ганом.
Какой элемент имеет атомный номер 53?
йод
Это химик UCL Андреа Селла рассказала историю о йоде, элементе номер 53.
Смотрите также, как образуются купольные горы
Что имеет 78 нейтронов и 53 электрона?
Йод Йод имеет 53 протона и 53 электрона (поскольку он не имеет заряда, количество протонов равно количеству электронов). Йод-131 имеет 131 протон и нейтрон. Йод-131 имеет 131 минус 53 протона = 78 нейтронов.
Какой йод имеет 76 нейтронов?
Йод-129
| Общий | |
|---|---|
| Имена | йод-129, И-129 |
| Протоны | 53 |
| Нейтроны | 76 |
| Нуклидные данные |
Что такое 74 в периодической таблице?
Вольфрам Вольфрам – Информация об элементе, свойства и использование | Периодическая таблица.
Что имеет атомный номер 74?
Вольфрам Вольфрам или вольфрам, представляет собой химический элемент с символом W и атомным номером 74.
Сколько стоит вольфрам?
Вольфрам — это редкий металл, который имеет самую высокую температуру плавления и кипения из всех известных элементов. В 2020 году средняя цена вольфрама составила около 270 долларов США за метрическую тонну триоксида вольфрама.
Сколько протонов в атоме с числом 74?
Атомный номер вольфрама равен 74, поэтому атом вольфрама имеет 74 протона. Массовое число = количество протонов + количество нейтронов = 184.
Сколько нейтронов в #74?
Резюме
| Элемент | Вольфрам |
|---|---|
| Количество протонов | 74 |
| Количество нейтронов (типичные изотопы) | 182-184, 186 |
| Количество электронов | 74 |
| Электронная конфигурация | [Хе] 4f14 5d4 6s2 |
Каков атомный символ для атома с 74 протонами, 110 нейтронами и 74 электронами?
Вольфрам Он имеет символ W. Вольфрам назван от шведского названия минерала, вольфрамата, который содержится в «шеелите», что означает тяжелый камень. Это редкий металл, содержащийся в таких минералах, как вольфрамит.
Кто такая современная таблица Менделеева?
Периодическая таблица Менделеева. Менделеев, впервые опубликовавшего свою периодическую таблицу в 1869 г. (рис. 3.2.1), обычно приписывают происхождение современной периодической таблицы.
Как найти атомный номер?
Что такое изотопный символ?
Каково массовое число атома йода с 74 нейтронами?
Например, типичный атом йода имеет атомную массу 126,904 — 53 протона и 74 нейтрона. Его изотопом будет йод-131 с 53 протонами и 78 нейтронами. Этот изотоп имеет массовое число 131.
Как найти изотопный символ элемента?
Чтобы написать символ изотопа, поместите атомный номер в качестве нижнего индекса и массовое число (протоны плюс нейтроны) в качестве верхнего индекса слева от атомного символа.
Как найти протоны, нейтроны и электроны?
Чтобы рассчитать количество субатомных частиц в атоме, используйте его атомный номер и массовое число: количество протонов = атомный номер. количество электронов = атомный номер.
Какой правильный символ иона для иона с 53 протонами и 54 электронами?
(йодид) I– (йодид) ионы имеют 53 протона и 54 электрона.
Смотрите также, что цветы отрастают снова, даже если на них наступили.
Какой элемент имеет массовое число 127 и 53 протона?
йод Наиболее распространенная стабильная форма йод имеет атомный номер 53 (протоны) и атомный вес 127 (53 протона плюс 74 нейтрона). Поскольку его ядро имеет «правильное» количество нейтронов, оно стабильно и не радиоактивно.
Как найти протоны и электроны в ионе?
Номер протона – это атомный номер элемента, а номер электрона это атомный номер минус заряд. Отрицательно заряженный ион или анион имеет больше электронов, чем протонов. Опять же, количество протонов — это атомный номер. Количество электронов — это атомный номер, добавленный к заряду.
Какой период мн?
4 Блок фактов
| Группа | 7 | 1246°С, 2275°F, 1519 К |
|---|---|---|
| Период | 4 | 2061°С, 3742°F, 2334 К |
| Блокировать | г | 7.3 |
| Атомный номер | 25 | 54.938 |
| Состояние при 20°C | Твердый | 55Мн |
Как называется элемент MN?
Марганец Марганец | Mn (элемент) — PubChem.
Что такое атомный радиус Mn?
Атомный номер: 25. Атомный радиус: 197 часов (Ван-дер-Ваальс)
Что такое 86-й элемент?
Радон – Информация об элементе, свойства и использование | Периодическая таблица.
Какой символ у магния?
мг
Что такое символ бария?
Ба