Загрузить PDF
Загрузить PDF
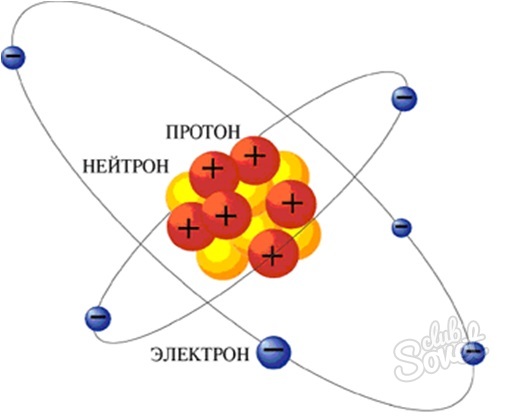
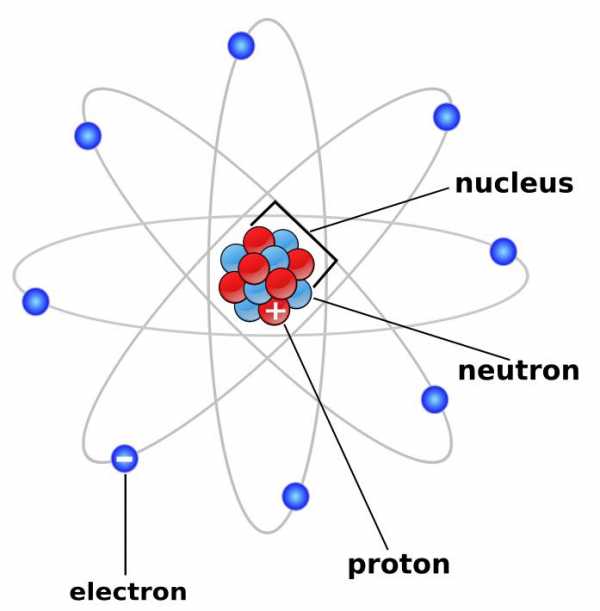
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 955 472 раза.
Была ли эта статья полезной?
Download Article
Download Article
Although all atoms of the same element contain the same number of protons, their number of neutrons can vary. Knowing how many neutrons are in a particular atom can help you determine if it’s a regular atom of that element or an isotope, which will have either extra or fewer neutrons.[1]
Determining the number of neutrons in an atom is fairly simple and doesn’t even require any experimentation. To calculate the number of neutrons in a regular atom or an isotope, all you need to do is follow these instructions with a periodic table in hand.
-
1
Locate the element on the periodic table. For this example, we’ll look at osmium (Os), which is in the sixth row down.[2]
-
2
Find the element’s atomic number. This tends to be the most visible number pertaining to a given element and usually sits above the element symbol, either in the middle of the box or in the upper left corner. (On the chart we’re using, in fact, no other numbers are listed.) The atomic number is the number of protons in a single atom of that element.[3]
Os is number 76, meaning one atom of osmium has 76 protons.- The proton number never changes in an element; it’s basically what makes that element that element.[4]
Advertisement
- The proton number never changes in an element; it’s basically what makes that element that element.[4]
-
3
Find the element’s atomic weight. This number is usually found beneath the atomic symbol. Note that the chart in this example is based solely on atomic number and doesn’t list the atomic weight. This won’t always usually be the case. Osmium has an atomic weight of 190.23.[5]
-
4
Round off the atomic weight to the nearest whole number to find the atomic mass.[6]
In our example, 190.23 would be rounded to 190, resulting in an atomic mass of 190 for osmium.- The atomic weight is an average of the isotopes of the element, so that’s why it’s not usually a whole number.[7]
- The atomic weight is an average of the isotopes of the element, so that’s why it’s not usually a whole number.[7]
-
5
Subtract the atomic number from the atomic mass. Since the vast majority of an atom’s mass is made up of its protons and neutrons, subtracting the number of protons (i.e. the atomic number) from the atomic mass will give you the calculated number of neutrons in the atom. The numbers after the decimal point represent the usually very small mass of the electrons in the atom. In our example, this is: 190 (atomic weight) – 76 (number of protons) = 114 (number of neutrons).[8]
-
6
Remember the formula. To find the number of neutrons in the future, simply use this formula:[9]
-
N = M – n
- N = number of Neutrons
- M = atomic Mass
- n = atomic number
-
N = M – n
Advertisement
-
1
Locate the element on the periodic table. As an example, we’ll look at the carbon-14 isotope. Since the non-isotopic form of carbon-14 is simply carbon (C), find carbon on the periodic table (in the second row down).[10]
-
2
Find the element’s atomic number. This tends to be the most visible number pertaining to a given element and usually sits above the element symbol. (On our example chart, in fact, no other numbers are listed.) The atomic number is the number of protons in a single atom of that element.[11]
C is number 6, meaning one atom of carbon has 6 protons. -
3
Find the atomic mass. This is incredibly easy with isotopes, as they are named according to their atomic mass. Carbon-14, for example, has an atomic mass of 14. Once you find the atomic mass of the isotope, the process is the same as it is for finding the number of neutrons in a regular atom.[12]
-
4
Subtract the atomic number from the atomic mass. Since the vast majority of an atom’s mass is found its protons and neutrons, subtracting the number of protons (i.e. the atomic number) from the atomic mass will give you the calculated number of neutrons in the atom. In our example, this is: 14 (atomic mass) – 6 (number of protons) = 8 (number of neutrons).
-
5
Remember the formula. To find the number of neutrons in the future, simply use this formula:[13]
-
N = M – n
- N = number of Neutrons
- M = atomic Mass
- n = atomic number
-
N = M – n
Advertisement
Add New Question
-
Question
How do you find the number of electrons, neutrons and protons?
Bess Ruff is a Geography PhD student at Florida State University. She received her MA in Environmental Science and Management from the University of California, Santa Barbara in 2016. She has conducted survey work for marine spatial planning projects in the Caribbean and provided research support as a graduate fellow for the Sustainable Fisheries Group.
Environmental Scientist
Expert Answer
Support wikiHow by
unlocking this expert answer.Fortunately, there’s a WikiHow article that can help you! It’s called Find the Number of Protons, Neutrons, and Electrons. While the answer section here doesn’t allow links, you can search for it in the search box at the top of the page using this title.
-
Question
How many neutrons are in oxygen?
Atomic mass minus the atomic number. Atomic mass of Oxygen is 16, and the atomic number is 8. 16 — 8 = 8.
-
Question
Where can I locate the atomic mass in a modern periodic table?
The modern periodic table has the atomic number on the top of each element’s symbol and the atomic mass right below the symbol.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Protons and neutrons make up almost all of the weight of the elements, whereas electrons and miscellaneous particles represent negligible mass (approaching zero mass). Since one proton has approximately the same weight as one neutron, and the atomic number represents the number of protons, we can simply subtract the number of protons from the total mass.[14]
-
If you’re ever unsure which number is which in a periodic table, just remember that the table is usually designed around the atomic number (i.e. number of protons), which starts at 1 (hydrogen) and ascends one unit at a time from left to right, ending at 118 (oganesson). This is because the number of protons in an atom determines what that atom is, making it the easiest elemental trait to organize by. (Ex. an atom with 2 protons is always helium, just as an atom with 79 protons is always gold.)
Advertisement
References
About This Article
Article SummaryX
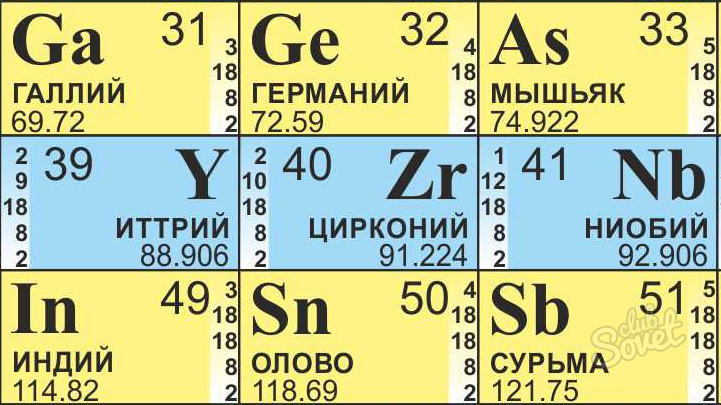
To find the number of neutrons in an atom, you just need a periodic table that lists the atomic number as well as the atomic weight of each element. First, locate the elemental symbol for your atom on the periodic table. Then, find the atomic number for the element. It’s usually located somewhere above the element symbol. This number represents the number of protons in the atom. For instance, the atomic number of niobium (Nb) is 41, meaning that a niobium atom has 41 protons. Next, find the atomic weight of the element, which is usually underneath the element symbol. Round up the atomic weight to the nearest whole number. Niobium has an atomic weight of 92.906, so you would round it up to 93. Finally, subtract the number of protons from the rounded up atomic weight to find the number of neutrons in the atom. In the case of niobium, 93 minus 41 is 52, which means that a niobium atom has 52 neutrons. To find out how to calculate the number of neutrons in an isotope, read on!
Did this summary help you?
Thanks to all authors for creating a page that has been read 1,161,083 times.
Reader Success Stories
-
«I didn’t know what atomic mass was, and I didn’t know that we had to round it off. So it really helped.…» more
Did this article help you?
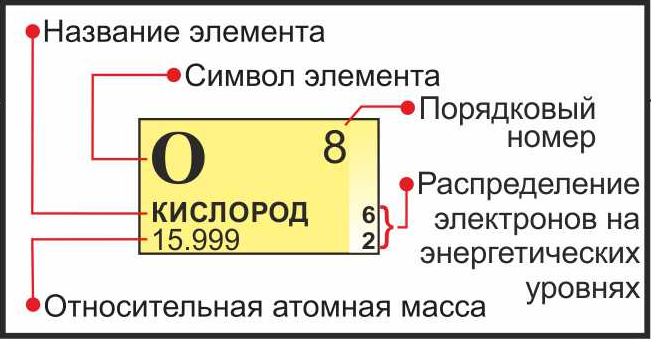
Химический элемент
Химический элемент — совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов
в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.
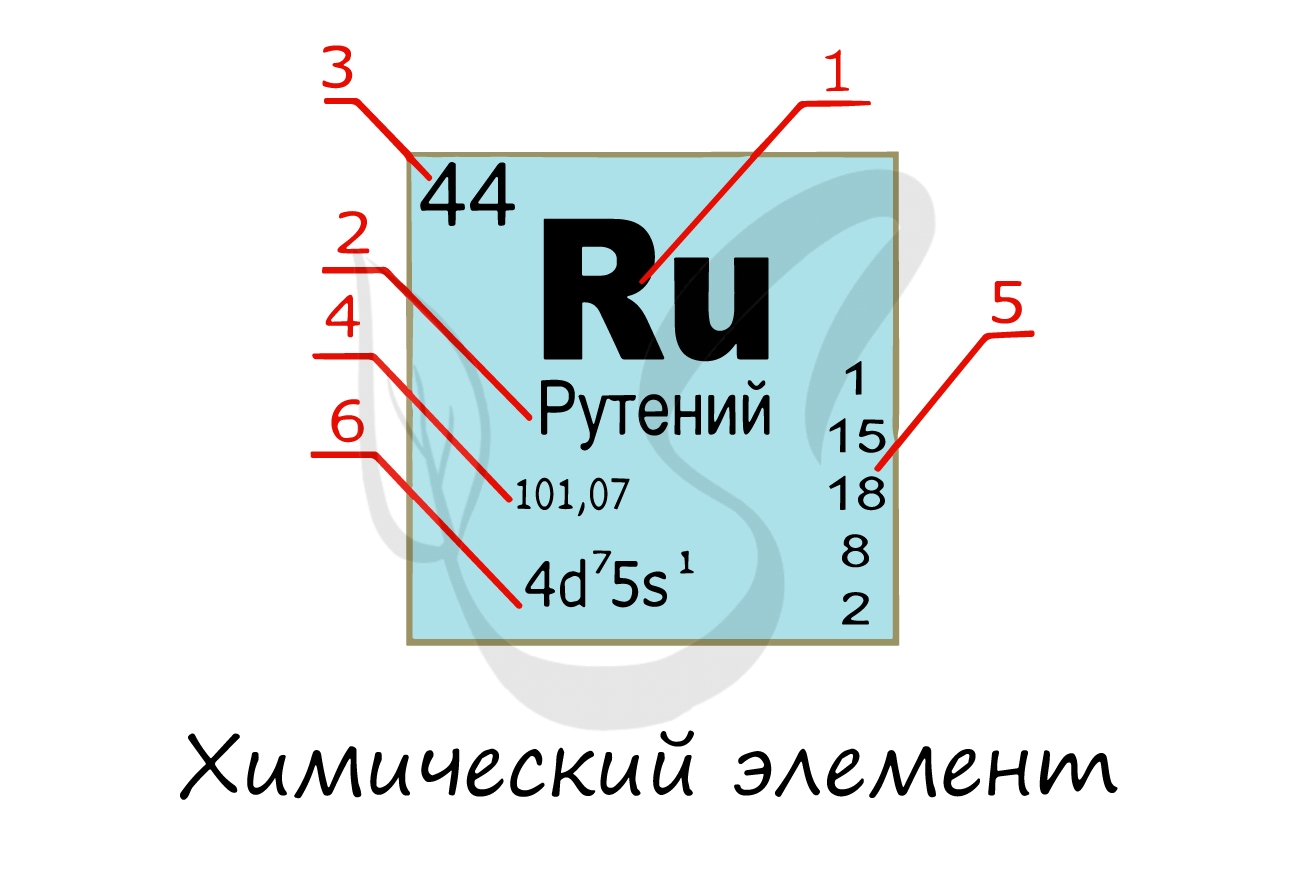
Изучая подобную карточку химического элемента, можно узнать о нем многое:
- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего
уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную
конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов
равно числу электронов.
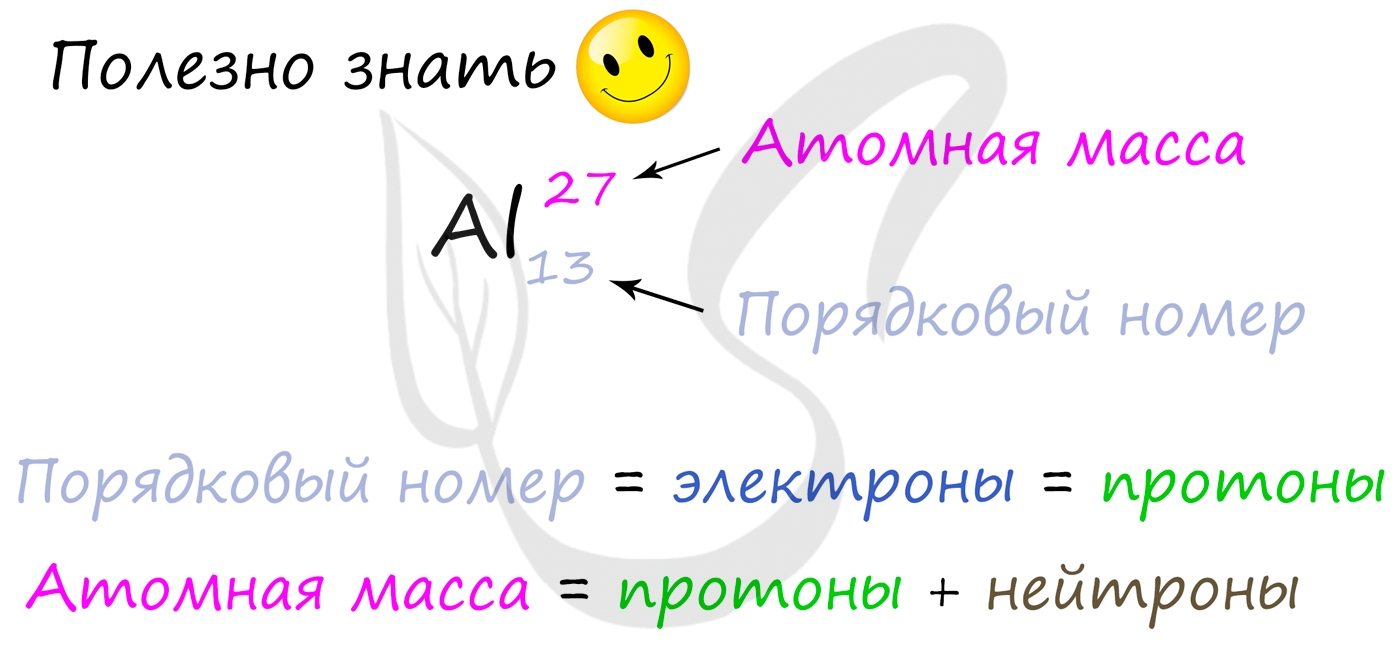
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
27 — 13 = 14
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия,
кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
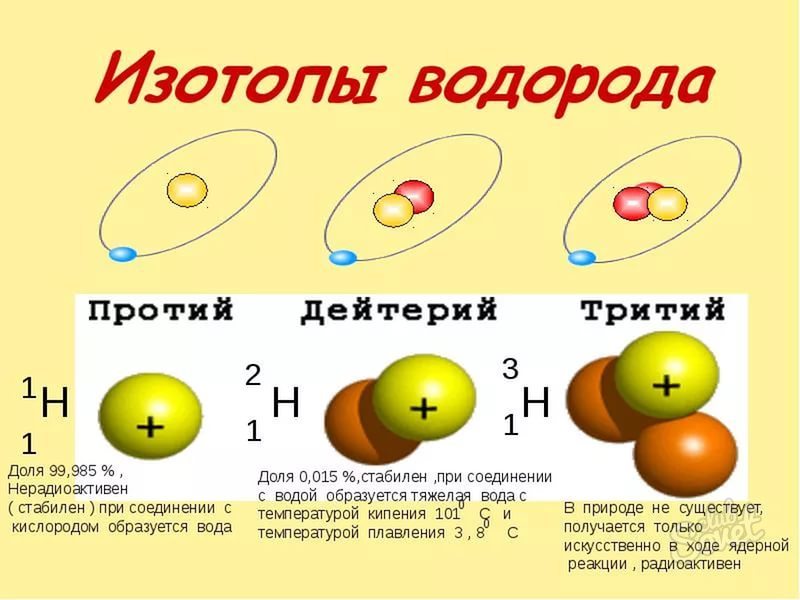
Изотопы (греч. isos — одинаковый + topos — место) — общее название разновидностей одного и того же химического элемента,
имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы — это самые распространенные
на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
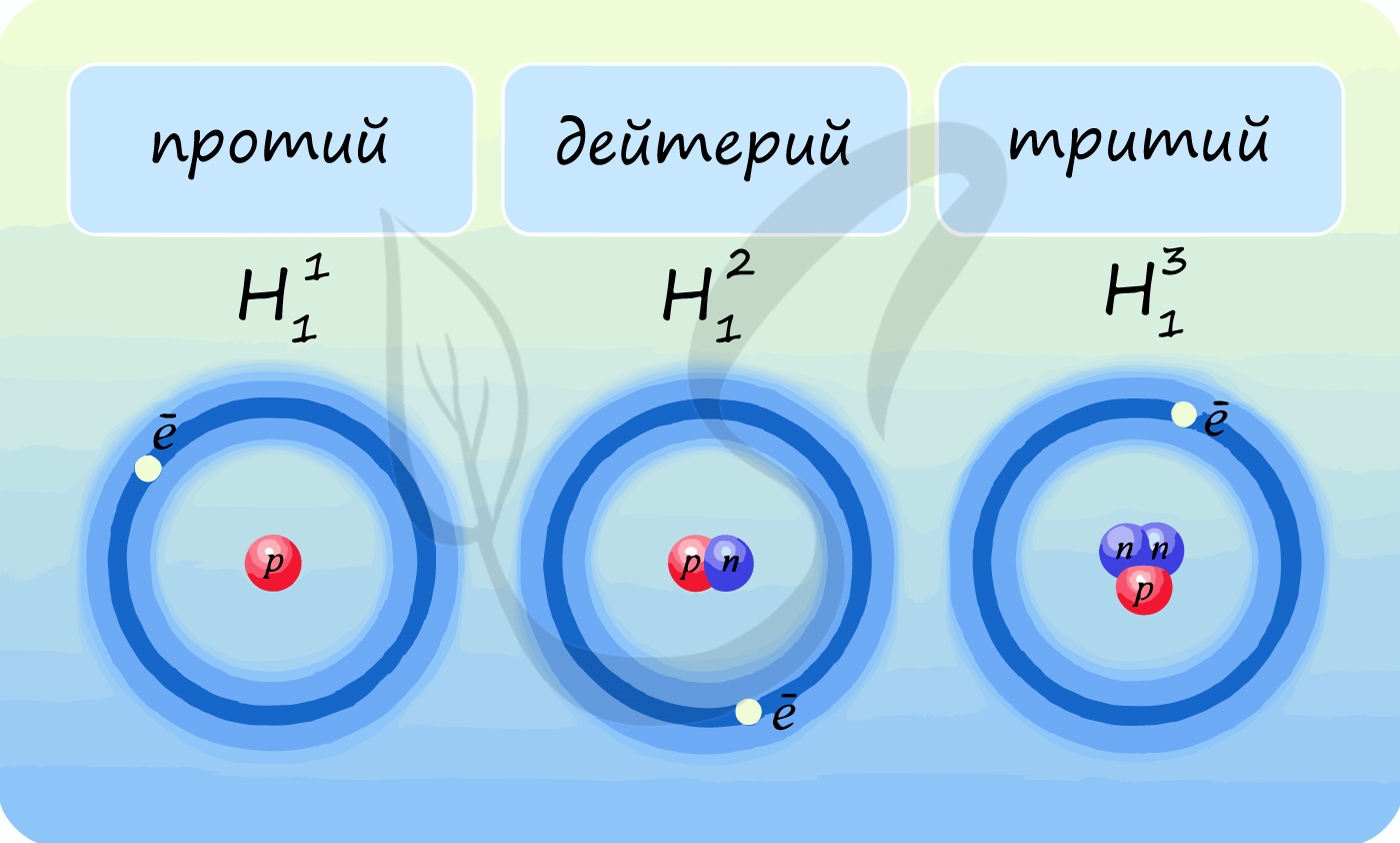
В таблице Д.И. Менделеева представлен самый распространенный из трех — протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У
дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы — атомы одного и того же химического элемента, различающиеся числом нейтронов.
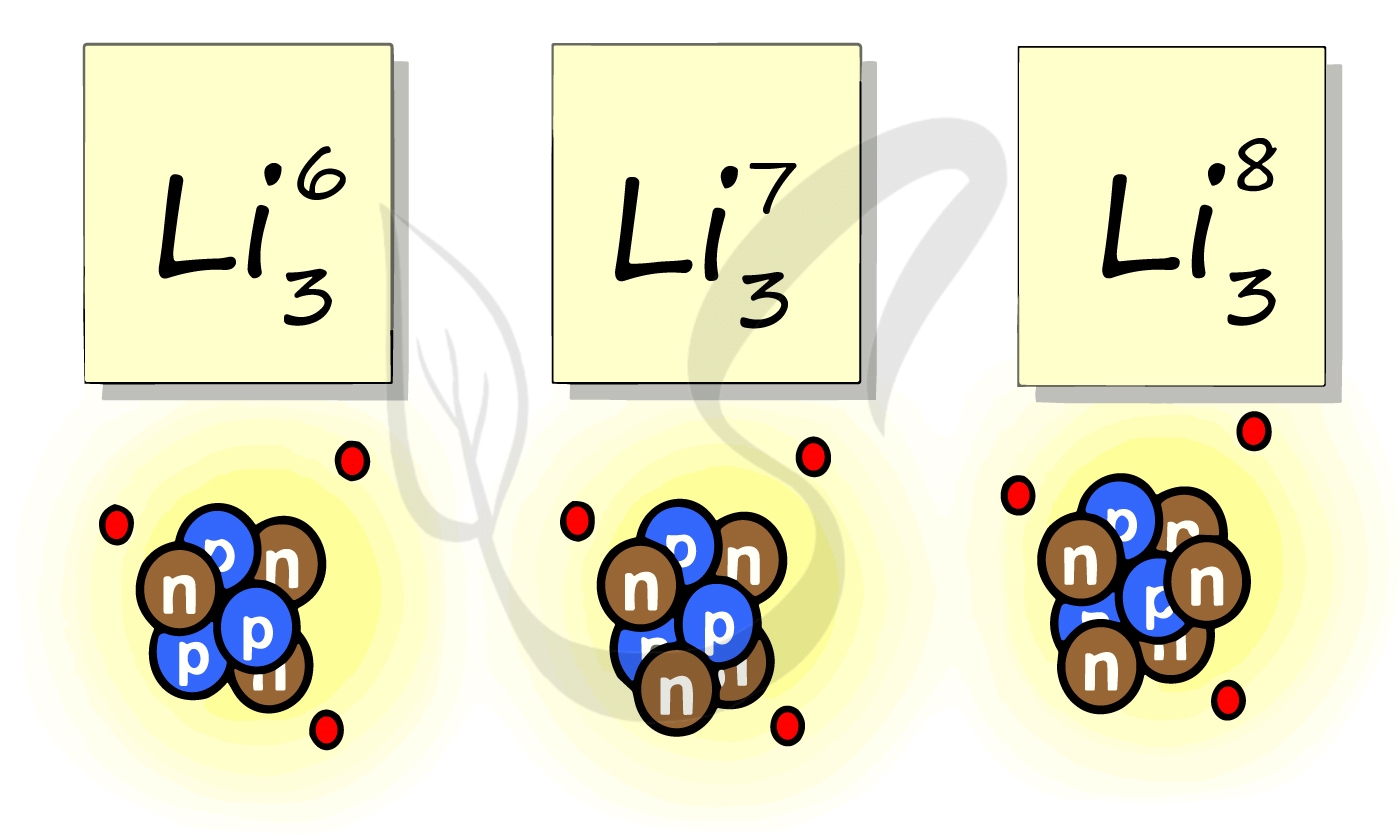
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который
включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Как найти нейтроны
Под запросом “Как найти нейтроны” понимается метод поиска числа нейтронов в атоме. Нейтрон – это тяжелая частица, которая не имеет электрического заряда и вместе с протоном составляет атомное ядро элемента. Число нейтронов в атоме определяется с помощью таблицы Менделеева.
1
Как найти нейтроны – ищем число нейтронов в атомах
- Берем таблицу Менделеева и находим нужный элемент.
- Как вы знаете, химические элементы расположены не случайным образом. Порядковый номер элемента соответствует числу протонов, находящихся в одном атоме элемента – атомному номеру. Вот он нам и нужен. Это самое крупное число в ячейке, его нетрудно обнаружить, так как элементы следуют друг за другом практически по порядку (по возрастанию).
- Запоминаем атомный номер.
- Находим массу атома. Это значение также располагается в ячейке элемента периодической системы, чье количество нейтронов мы ищем. Как правило, масса записана более мелким шрифтом, чем номер атома, в виде десятичной дроби. У более сложных элементов заключена в квадратные скобки.
- Для расчетов атомную массу округляем до целого числа.
- Так как ядро атома состоит из нейтронов и протонов, то путем вычитания из массы атома протонов (атомного номера), мы получим величину содержания нейтронов в атоме данного элемента.
2
Как найти нейтроны – пример
- Например, нам нужно найти, сколько нейтронов находится в атоме Циркония.
- Будем использовать формулу: N = M – n, где:
М – атомная масса, n – атомный номер (число протонов), N – число нейтронов.
- Находим Цирконий в таблице Менделеева, для химических расчетов она всегда должна быть под рукой.
- Его атомная масса равна 91,22, округляем до 91.
- Атомный номер равен 40.
- Получаем, что в атоме Циркония находится 51 (N = 91 – 40) нейтрон.
3
Как найти нейтроны – находим сколько нейтронов у изотопов
- Изотопы – это разновидности одного и того же элемента, но имеющие различную массу атомов. Но атомный номер, который мы научились искать выше, у них совпадает.
- Нужно знать, что все изотопы определенного элемента помещаются в одну ячейку в таблице Менделеева.
- Раз атомный номер у изотопов одного и того же элемента совпадает, значит нам нужно лишь найти атомную массу для расчета величины нейтронов.
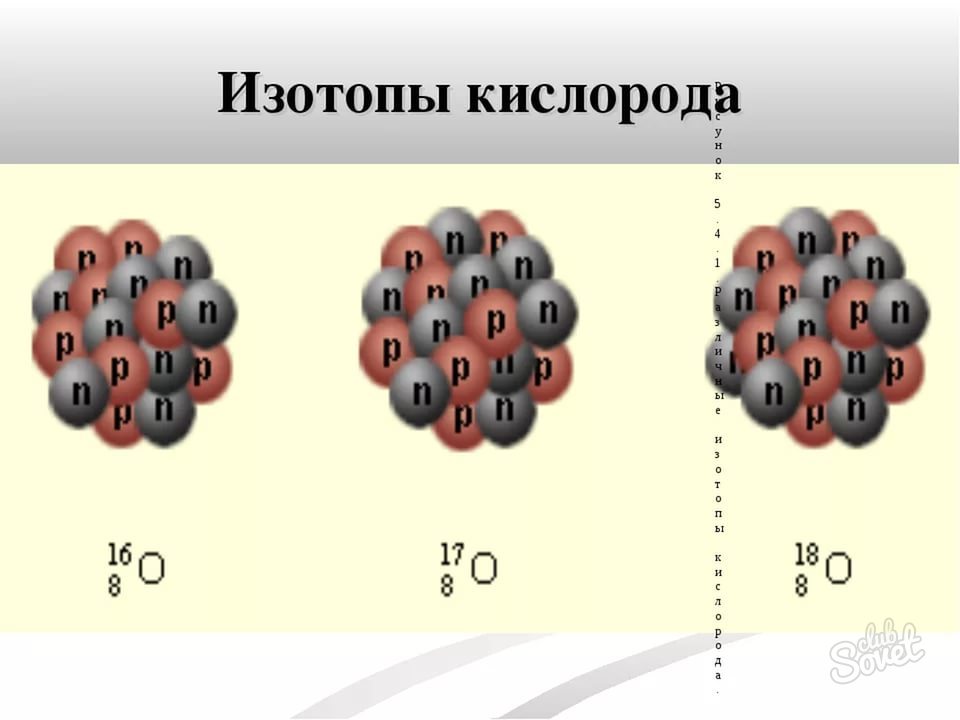
- Атомную массу изотопа найти очень просто – она заключена в самом названии изотопа. Например, О-16, О-17, О-18 – изотопы кислорода с атомной массой 16, 17 и 18 соответственно. Иногда атомную массу записывают как верхний индекс слева от символа хим. элемента.
- Таким образом, нам известны все составляющие для формулы. Нам не составит труда вычислить, какое количество нейтронов находится в изотопе.
4
Как найти нейтроны – пример, изотоп О-17
- Атомный номер всех изотопов кислорода, как и самого элемента равен 8.
- Атомная масса указана в названии изотопа – она равна 17.
- Вычисляем по формуле N = M – n, что количество нейтронов в атоме изотопа О-17 равно 9 (17 – 8).
Теперь вы знаете, как рассчитать число нейтронов в атоме любого элемента и изотопа. Конечно, для расчетов вам всегда понадобится иметь под рукой периодическую таблицу Менделеева.
Как определить протоны и нейтроны по таблице. Как найти нейтроны
Под запросом «Как найти нейтроны» понимается метод поиска числа нейтронов в атоме. Нейтрон — это тяжелая частица, которая не имеет электрического заряда и вместе с протоном составляет атомное ядро элемента. Число нейтронов в атоме определяется с помощью таблицы Менделеева.
Как найти нейтроны — ищем число нейтронов в атомах
- Берем таблицу Менделеева и находим нужный элемент.
- Как вы знаете, химические элементы расположены не случайным образом. Порядковый номер элемента соответствует числу протонов, находящихся в одном атоме элемента — атомному номеру. Вот он нам и нужен. Это самое крупное число в ячейке, его нетрудно обнаружить, так как элементы следуют друг за другом практически по порядку (по возрастанию).
- Запоминаем атомный номер.
- Находим массу атома. Это значение также располагается в ячейке элемента периодической системы, чье количество нейтронов мы ищем. Как правило, масса записана более мелким шрифтом, чем номер атома, в виде десятичной дроби. У более сложных элементов заключена в квадратные скобки.
- Для расчетов атомную массу округляем до целого числа.
- Так как ядро атома состоит из нейтронов и протонов, то путем вычитания из массы атома протонов (атомного номера), мы получим величину содержания нейтронов в атоме данного элемента.
Как найти нейтроны — пример
- Например, нам нужно найти, сколько нейтронов находится в атоме Циркония.
- Будем использовать формулу: N = M — n, где:
М — атомная масса, n — атомный номер (число протонов), N — число нейтронов.
- Находим Цирконий в таблице Менделеева, для химических расчетов она всегда должна быть под рукой.
- Его атомная масса равна 91,22, округляем до 91.
- Атомный номер равен 40.
- Получаем, что в атоме Циркония находится 51 (N = 91 — 40) нейтрон.
Как найти нейтроны — находим сколько нейтронов у изотопов
- Изотопы — это разновидности одного и того же элемента, но имеющие различную массу атомов. Но атомный номер, который мы научились искать выше, у них совпадает.
- Нужно знать, что все изотопы определенного элемента помещаются в одну ячейку в таблице Менделеева.
- Раз атомный номер у изотопов одного и того же элемента совпадает, значит нам нужно лишь найти атомную массу для расчета величины нейтронов.
- Атомную массу изотопа найти очень просто — она заключена в самом названии изотопа. Например, О-16, О-17, О-18 — изотопы кислорода с атомной массой 16, 17 и 18 соответственно. Иногда атомную массу записывают как верхний индекс слева от символа хим. элемента.
- Таким образом, нам известны все составляющие для формулы. Нам не составит труда вычислить, какое количество нейтронов находится в изотопе.
Как найти нейтроны — пример, изотоп О-17
- Атомный номер всех изотопов кислорода, как и самого элемента равен 8.
- Атомная масса указана в названии изотопа — она равна 17.
- Вычисляем по формул
crazylike.ru
Как определить протон, нейтрон, электрон 🚩 количество протонов нейтронов электронов 🚩 Естественные науки
Опыты великого ученого, «отца» современной ядерной физики, помогли создать планетарную модель атома. Согласно ей, атом представляет собой ядро, вокруг которого по орбитам вращаются электроны. Датский физик Нильс Бор немного доработал эту модель в рамках квантовых представлений. Получается, что электрон — одна из частиц, входящих в состав атома.
Эта частица была открыта Дж.Дж. Томсоном (лордом Кельвином) в 1897 году в опытах с катодными лучами. Великий ученый обнаружил, что при прохождении электрического тока через емкость с газом в нем образуются отрицательно заряженные частицы, впоследствии названные электронами.
Электрон — самая маленькая частица, имеющая отрицательный заряд. Это делает его стабильным (время жизни порядка иотта лет). Его состояние описывается несколькими квантовыми числами Электрон обладает собственным механическим моментом — спином, который может принимать значения +1/2 и -1/2 (спиновое квантовое число). Наличие спина было подтверждено в опытах Уленбека и Гаудсмита.
Эта частица подчиняются принципу Паули, согласно которому два электрона не могут иметь одни и те же квантовые числа в одно и то же время, то есть не могут одновременно находиться в одинаковых квантовых состояниях. По этому принципу заполняются электронные орбитали атомов.
Ядро, согласно принятой планетарной модели, состоит из протонов и нейтронов. Эти частицы имеют почти одинаковую массу, но у протона положительный заряд, нейтрон же его вообще не имеет.
Протон был открыт Эрнестом Резерфордом в результате его опытов с альфа-частицами, которыми он бомбардировал атомы золота. Была подсчитана масса протона. Она оказалась почти в 2000 раз больше массы электрона. Протон — самая стабильная частица во Вселенной. Ученые считают, что время ее жизни приближается к бесконечности.
Гипотеза о существовании нейтрона была высказана еще Резерфордом, но экспериментально подтвердить ее он не смог. Это было сделано Дж. Чедвиком в 1932 году. Нейтрон «живет» около 900 секунд. Через это время нейтрон распадется на протон, электрон и электронное нейтрино. Он способен вызывать ядерные реакции, так как легко может проникнуть в ядро, минуя действие сил электростатического взаимодействия, и вызвать его деление.
И протон, и нейтрон не являются целостными частицами. Согласно современным представлениям, они состоят из групп кварков, которые связывают их в ядре. Именно кварки осуществляют сильное и ядерное взаимодействие между составляющими ядра.
www.kakprosto.ru
Как определить количество протонов и нейтронов
Атом всякого химического элемента состоит из ядерного ядра и, обращающихся вокруг него, электронов. А из чего состоит ядерное ядро? В 1932 году было установлено, что ядерное ядро состоит из протонов и нейтронов .
Вам понадобится
- – периодическая таблица химических элементов Д.И. Менделеева.
Инструкция
1. Протон представляет собой одобрительно заряженную частицу с массой превышающей в 1836 раз массу электрона. Электрический заряд протона совпадает по модулю с зарядом электрона, а значит, заряд протона равен 1,6*10 ^ (-19) Кулон. Ядра различных атомов содержат различное число протонов . К примеру, в ядре атома водорода только один протон, а в ядре атома золота – семьдесят девять. Число протонов в ядре совпадает с порядковым номером данного элемента в таблице Д.И. Менделеева. Следственно для того, дабы определить число протонов в ядре химического элемента, надобно взять таблицу Менделеева, обнаружить в ней необходимый элемент. Указанное вверху целое число является порядковым номером элемента – это и есть число протонов в ядре. Пример1. Пускай необходимо определить число протонов в ядре атома полония. Обнаружьте в таблице Менделеева химический элемент полоний, он размещен под номером 84, значит в его ядре находится 84 протона.
2. Увлекательно, что число протонов в ядре совпадает с числом электронов, движущихся вокруг ядра. То есть число электронов в атоме элемента определяется так же, как и число протонов – порядковым номером элемента. Пример 2. Если порядковый номер полония – 84, то в нем 84 протона (в ядре) и столько же – 84 электронов.
3. Нейтрон представляет собой незаряженную частицу с массой, которая огромнее массы электрона в 1839 раз. Помимо порядкового номера, в периодической таблице химических элементов для всего вещества указано еще одно число, которое, если его округлить, показывает всеобщее число частиц (протонов и нейтронов ) в ядерном ядре. Это число именуется массовым числом. Для определения числа нейтронов в ядре необходимо вычесть из массового числа число протонов . Пример 3. Число протонов в атоме полония – 84. Его массовое число равно 210, значит, для определения числа нейтронов обнаружьте разность массового числа и порядкового номера: 210 – 84 = 126.
Атом химического элемента состоит из ядерного ядра и электронов. В состав ядерного ядра входят два типа частиц – протоны и нейтроны. Примерно каждая масса атома сфокусирована в ядре, потому что протоны и нейтроны гораздо тяжелее электронов.
Вам понадобится
- атомный номер элемента, изотопы
Инструкция
1. В различие от протонов, нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Следственно, зная ядерный номер элемента, невозможно однозначно сказать, сколько нейтронов содержится в его ядре. К примеру в ядре атома углерода неизменно содержится 6 протонов, впрочем протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с различным числом нейтронов в ядре именуются изотопами этого элемента. Изотопы могут быть как природными, так и полученными неестественно.
2. Ядерные ядра обозначаются буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A – это массовое число атома, A = Z+N, где Z – заряд ядра (число протонов),а N – число нейтронов . Нижнее число – это Z – заряд ядра. Такая запись дает информацию о числе нейтронов в ядре. Видимо, оно равно N = A-Z.
3. У различных изотопов одного химического элемента число A меняется, что отражено в записи этого изотопа. Определенные изотопы имеют свои подлинные наименования. Скажем, обыкновенное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2), а изотоп тритий – два нейтрона (A = 3).
4. Связанность числа нейтронов от числа протонов отражена на N-Z диаграмме ядерных ядер. Стабильность ядер зависит от отношения числа
нейтронов и числа протонов. Ядра легких нуклидов особенно устойчивы при N/Z = 1, то есть при равенстве числа нейтронов и протонов. С ростом массового числа область стабильности сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для особенно тяжелых ядер.
Видео по теме
Атом химического элемента состоит из ядерного ядра и электронной оболочки. В состав ядерного ядра входят два типа частиц – протоны и нейтроны. Примерно каждая масса атома сконцентрирована в ядре, так как протоны и нейтроны гораздо тяжелее электронов.
Вам понадобится
- атомный номер элемента, N-Z диаграмма.
Инструкция
1. Нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Это и представляет основную трудность при определении числа
нейтронов – ядерный номер элемента либо его электронная оболочка не дают однозначного результата на данный вопрос. Скажем, в ядре атома углерода неизменно содержится 6 протонов, впрочем протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с различным числом нейтронов в ядре именуются изотопами этого элемента. Изотопы могут быть природными, а могут быть и получены неестественно.
2. Ядра атомов обозначают буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A – это массовое число атома. A = Z+N, где Z – заряд ядра (число протонов), а N – число нейтронов. Нижнее число – это Z – заряд ядра. Такая запись дает информацию о числе нейтронов в ядре. Видимо, что оно равно N = A-Z.
3. У различных изотопов одного химического элемента число A меняется, что дозволено увидеть в записи этого изотопа. Определенные изотопы имеют свои подлинные наименования. Скажем, обыкновенное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2, цифра 2 сверху, 1 снизу), а изотоп тритий – два нейтрона (A = 3, цифра 3 сверху, 1 снизу).
4. Связанность числа нейтронов от числа протонов отражена на так называемой N-Z диаграмме ядерных ядер. Стабильность ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов особенно устойчивы при N/Z = 1, то есть при равенстве числа нейтронов и протонов. С ростом массового числа область стабильности сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для особенно тяжелых ядер.
Видео по теме
Дабы обнаружить число протонов
в атоме, определите его место в таблице Менделеева. Обнаружьте его порядковый номер в периодической таблице. Он будет равен числу протонов в ядерном ядре. Если изучается изотоп, посмотрите на пару чисел, описывающие его свойства, нижнее число будет равно числу протонов. В том случае, если знаменит заряд ядерного ядра, дозволено узнать число протонов, поделив его значение на заряд одного протона.
Вам понадобится
- Для того дабы обнаружить число протонов, узнайте значение заряда протона либо электрона, возьмите таблицу изотопов, периодическую таблицу Менделеева.
Инструкция
1. Определение числа протонов вестимого атома.В том случае, когда знаменито, какой атом изучается, обнаружьте его расположение в периодической таблице. Определите его номер в этой таблице, обнаружив ячейку соответствующего элемента. В данной ячейке обнаружьте порядковый номер элемента, тот, что соответствует постигаемому атому. Данный порядковый номер и будет соответствовать числу протонов в ядерном ядре.
2. Как обнаружить протоны в изотопе.Многие атомы имеют изотопы, отличающиеся массами ядер. Именно следственно только лишь массы ядра неудовлетворительно для однозначного определения ядерного ядра. При изложении изотопа перед записью его химического обозначения неизменно записывается пара чисел. Верхнее число показывает массу атома в ядерных единицах массы, а нижнее обозначает заряд ядра. Вся единица заряда ядра в такой записи соответствует одному протону. Таким образом, число протонов равно нижнему числу в записи данного изотопа.
3. Как обнаружить протоны, зная заряд ядра.Зачастую свойства атома характеризуется зарядом его ядра. Для того дабы определить число протонов в нем, нужно перевести его в кулоны (если он подан в кратных единицах). После этого поделите заряд ядра на модуль заряда электрона. Это связано с тем, что от того что атом электрически нейтрален, то число протонов в нем равно числу электронов. Причем заряды их равны по модулю и противоположны по знаку (протон имеет правильный заряд, электрон – негативный). Следственно заряд ядра атома поделите на число 1,6022•10^(-19) кулон. В итоге получится число протонов. От того что способы измерения заряда атома неудовлетворительно точны, в том случае, если при делении получилось дробное число, округлите его до целого.
Видео по теме
Атомы состоят из субатомных частиц — протонов, нейтронов и электронов. Протоны представляют собой позитивно заряженные частицы, которые находятся в центре атома, в его ядре. Вычислить число протонов изотопа дозволено по ядерному номеру соответствующего химического элемента.
Модель атома
Для изложения свойств атома и его конструкции применяется модель, знаменитая под наименованием «Модель атома по Бору». В соответствии с ней конструкция атома напоминает ясную систему — весомый центр (ядро) находится в центре, а больше легкие частицы движутся по орбите вокруг него. Нейтроны и протоны образуют позитивно заряженное ядро, а негативно заряженные электроны движутся вокруг центра, притягиваясь к нему электростатическими силами.Элементом называют вещество, состоящее из атомов одного типа, он определяется числом протонов в всем из них. Элементу присваивают свое имя и символ, скажем, водород (H) либо кислород (О). Химические свойства элемента зависят от числа электронов и, соответственно, числа протонов, содержащихся в атомах. Химические колляции атома не зависят от числа нейтронов, потому что нейтроны не имеют электрического заряда. Впрочем их число влияет на устойчивость ядра, изменяя всеобщую массу атома.
Изотопы и число протонов
Изотопами называют атомы отдельных элементов с разным числом нейтронов. Данные атомы химически одинаковым, впрочем владеют различной массой, также они отличаются своей способностью испускать излучение.Ядерный номер (Z) — это порядковый номер химического элемента в периодической системе Менделеева, он определяется числом протонов в ядре. Всякий атом характеризуется ядерным номером и массовым числом (А), которое равно суммарному числу протонов и нейтронов в ядре. Элемент может иметь атомы с разным числом нейтронов, но число протонов остается постоянным и равно числу электронов нейтрального атома. Для того, дабы определить, сколько протонов содержится в ядре изотопа, довольно посмотреть на его ядерный номер. Число протонов равно номеру соответствующего химического элемента в периодической таблице Менделеева.
Примеры
В качестве примера дозволено разглядеть изотопы водорода. В природе особенно распространены атомы водорода с одним протоном и без нейтронов. В то же время существуют изотопы водорода с одним либо двумя нейтронами, они имеют соответствующие наименования. Впрочем у них у всех один протон, что соответствует порядковому номеру водорода в периодической таблице. Изотоп водорода с одним нейтроном и массовым числом 2 называют дейтерием либо тяжелым водородом, он стабилен. Тритий, изотоп водорода с массовым числом 3 и двумя нейтронами, радиоактивен. Его изредка называют сверхтяжелым водородом, а ядро трития — тритоном.
Полоний — радиоактивный химический элемент VI группы периодической системы Менделеева, он относится к халькогенам. Полоний представляет собой мягкий серебристо-белый металл. Стабильных изотопов у данного элемента нет, но вестимо 27 радиоактивных.
Инструкция
1. Полоний был одним из первых открытых радиоактивных элементов, его нашли Пьер Кюри и Мария Склодовская-Кюри в 1898 году. Свое наименование он получил в честь Польши — родины Марии Склодовской-Кюри. Впервой полоний был выделен из урановой смоляной руды.
2. Полоний — редкий элемент, знамениты две его кристаллические модификации: низкотемпературная форма с кубическая решеткой, при температуре выше 36°С устойчива форма с ромбоэдрической решеткой.
3. Полоний присутствует в маленьких числах в морской воде, его могут накапливать разные морские организмы. Данный элемент попадает в тело человека совместно с пищей, позже чего равномерно распределяется по отдельным органам.
4. В высоких концентрациях полоний исключительно токсичен, для работы с ним применяют особые боксы. Токсичность полония была исследована в навыках на звериных, он вызывал метаморфозы состава периферической крови и уменьшал длительность жизни. У звериных прогрессировали опухоли разных органов. Биологическое влияние полония в мелких концентрациях неудовлетворительно изучено.
5. По своим химическим свойствам полоний близок к теллуру, в соединениях данный элемент проявляет степени окисления -2, +2, +4 и +6. Полоний окисляется на воздухе, он реагирует с растворами кислот с образованием ионов. При взаимодействии с водородом данный элемент дает летучий гидрид.
6. Нагревая металлы с парами полония при температуре 400-1000°С, получают полониды. Диоксид полония может существовать в 2-х кристаллических модификациях: при температуре ниже 54°С стабильна желтая форма с гранецентрированной кубической решеткой, при нагревании диоксид переходит в красную форму с тетрагональной решеткой. Монооксид полония представляет собой твердое вещество черного цвета, он образуется при беспричинном разложении селенита либо сульфита полония.
7. В граммовых числах полоний получают при помощи облучения металлического висмута нейтронами, процесс проходит в ядерных реакторах. В микроскопичных числах он может быть выделен из отходов переработки урановых руд. Его получают экстракцией, электроосаждением, возгонкой и ионным обменом. Полоний также образуется при облучении висмута протонами в циклотроне.
8. Полоний применяют в качестве источника энергии в ядерных батареях космических агрегатов, а также в переносных устройствах. Его используют для изготовления ампульных источников нейтронов.
Видео по теме
jprosto.ru
Как определить число электронов в атоме
6 октября 2011
Автор КакПросто!
Атом состоит из чрезвычайно плотного ядра, окруженного электронным «облаком». Ядро ничтожно мало по сравнению с внешними размерами облака, и состоит из протонов и нейтронов. Атом в обычном состоянии нейтрален, а электроны несут отрицательный заряд. Но атом может также перетянуть чужие электроны, или отдать свои. В таком случае он уже будет являться отрицательно заряженным или положительно заряженным ионом. Как определить, сколько электронов содержится в атоме?
Статьи по теме:
Инструкция
Прежде всего, вам на помощь придет Таблица Менделеева. Заглянув в нее, вы увидите, что каждый химический элемент имеет не только свое строго определенное место, но и индивидуальный порядковый номер. Например, у водорода он равен единице, у углерода – 6, у золота – 79 и так далее. Именно порядковый номер характеризует количество протонов в ядре, то есть положительный заряд ядра атома. Поскольку атом в обычном состоянии нейтрален, положительный заряд должен быть уравновешен отрицательным зарядом. Следовательно, у водорода – один электрон, углерода – шесть электронов, у золота – семьдесят девять электронов.
Ну а как определить количество электронов в атоме, если атом, в свою очередь, входит в состав какой-либо более сложной молекулы? Например, каково количество электронов в атомах натрия и хлора, если они образуют молекулу всем вам хорошо известной обычной поваренной соли?
И тут нет ничего сложного. Начните с того, что напишите формулу этого вещества, она будет иметь следующий вид: NaCl. Из формулы вы увидите, что молекула поваренной соли состоит из двух элементов, а именно: щелочного металла натрия и газа-галогена хлора. Но это уже не нейтральные атомы натрия и хлора, а их ионы. Хлор, образуя ионную связь с натрием, тем самым «перетянул» к себе один из его электронов, а натрий, соответственно, его «отдал».
Снова посмотрите в Таблицу Менделеева. Вы увидите, что натрий имеет порядковый номер 11, хлор – 17. Следовательно, теперь у иона натрия будет 10 электронов, у иона хлора – 18.
Действуя по такому же алгоритму, легко можно определить количество электронов у любого химического элемента, будь то в виде нейтрального атома или иона.
Полезный совет
Протоны – это положительно заряженные частицы, нейтроны же не несут какого-либо заряда.
Совет полезен?
Статьи по теме:
Не получили ответ на свой вопрос?
Спросите нашего эксперта:
www.kakprosto.ru
Как найти число протонов и нейтронов
Протоны и нейтроны, содержащиеся в ядерном ядре, называют нуклонами. От того что фактически каждая масса атома сконцентрирована в его ядре, то массовое число атома обозначает число нуклонов в ядре. С поддержкой периодической таблицы химических элементов Менделеева дозволено обнаружить число протонов и нейтронов. Для этого также дозволено применять другие методологии.
Вам понадобится
- — периодическая таблица химических элементов Менделеева;
- — заряд протона;
- — обозначения химических элементов.
Инструкция
1. Всякому атому вещества соответствует элемент периодической таблицы Менделеева. Обнаружьте такой элемент для атома, число протонов и нейтронов в ядре которого надобно обнаружить. Определите ядерную массу этого элемента. Она находится в нижней части ячейки, где размещен химический элемент. Если массовое число представлено дробным значением, округлите его до целых. Это число будет равно числу нуклонов в атоме. Скажем, определите ядерную массу магния. Обнаружьте данный элемент в периодической таблице, он имеет обозначение Mg. Его массовое число равно 24,305. Округлите его до целого и получите 24. Это значит, что число протонов и нейтронов (нуклонов) в ядре атома этого элемента равно 24.
2. Определите число протонов в ядре атома. Для этого обнаружьте его в периодической таблице химических элементов. В верхней части ячейки элемента подмечен его порядковый номер по счету в таблице. Это и есть число протонов в ядре атома исследуемого элемента. Скажем, порядковый номер магния (Mg) равен 12. Это значит, что в его ядре содержится 12 протонов.
3. Изредка вестим только заряд ядра в Кулонах, тогда, для того дабы обнаружить число протонов, поделите это число на заряд одного протона, тот, что равен 1,6022•10^-19 Кулона. Скажем, если знаменито, что заряд ядра составляет 35,2•10^-19 Кулона, то поделив его на 1,6022•10^-19 получите число , примерно равное 22. Это значит, что в ядре данного атома находится 2 протона.
4. Позже определения числа протонов обнаружьте число нейтронов в ядре. Для этого от относительной ядерной массы ядра, обнаруженной при помощи периодической таблицы химических элементов, отнимите число протонов, содержащихся в ядре. От того что помимо нейтронов других тяжелых частиц в ядре атома не содержится, это и будет число нейтронов. Скажем, если необходимо обнаружить число протонов и нейтронов в ядре фосфора (Р), обнаружьте его в периодической таблице, определите массовое число и порядковый номер элемента. Массовое число фосфора равно 30,97376?31, а порядковый номер 15. Это значит, что в ядре атома этого химического элемента содержится 15 протонов и 31-15=16 нейтронов.
Атом химического элемента состоит из ядерного ядра и электронов. В состав ядерного ядра входят два типа частиц – протоны и нейтроны. Примерно каждая масса атома сконцентрирована в ядре, потому что протоны и нейтроны гораздо тяжелее электронов.
Вам понадобится
- атомный номер элемента, изотопы
Инструкция
1. В различие от протонов, нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Следственно, зная ядерный номер элемента, невозможно однозначно сказать, сколько нейтронов содержится в его ядре. К примеру в ядре атома углерода неизменно содержится 6 протонов, впрочем протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с различным числом нейтронов в ядре именуются изотопами этого элемента. Изотопы могут быть как природными, так и полученными неестественно.
2. Ядерные ядра обозначаются буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A – это массовое число атома, A = Z+N, где Z – заряд ядра (число протонов),а N – число нейтронов . Нижнее число – это Z – заряд ядра. Такая запись дает информацию о числе нейтронов в ядре. Видимо, оно равно N = A-Z.
3. У различных изотопов одного химического элемента число A меняется, что отражено в записи этого изотопа. Определенные изотопы имеют свои подлинные наименования. Скажем, обыкновенное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2), а изотоп тритий – два нейтрона (A = 3).
4. Связанность числа нейтронов от числа протонов отражена на N-Z диаграмме ядерных ядер. Стабильность ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов особенно устойчивы при N/Z = 1, то есть при равенстве числа нейтронов и протонов. С ростом массового числа область стабильности сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для особенно тяжелых ядер.
Видео по теме
Атом химического элемента состоит из ядерного ядра и электронной оболочки. В состав ядерного ядра входят два типа частиц – протоны и нейтроны. Примерно каждая масса атома сконцентрирована в ядре, так как протоны и нейтроны гораздо тяжелее электронов.
Вам понадобится
- атомный номер элемента, N-Z диаграмма.
Инструкция
1. Нейтроны не имеют электрического заряда, то есть их электрический заряд равен нулю. Это и представляет основную трудность при определении числа нейтронов – ядерный номер элемента либо его электронная оболочка не дают однозначного результата на данный вопрос. Скажем, в ядре атома углерода неизменно содержится 6 протонов, впрочем протонов в нем может быть 6 и 7. Разновидности ядер химического элемента с различным числом нейтронов в ядре именуются изотопами этого элемента. Изотопы могут быть природными, а могут быть и получены неестественно.
2. Ядра атомов обозначают буквенным символом химического элемента из таблицы Менделеева. Справа от символа вверху и внизу стоят два числа. Верхнее число A – это массовое число атома. A = Z+N, где Z – заряд ядра (число протонов), а N – число нейтронов. Нижнее число – это Z – заряд ядра. Такая запись дает информацию о числе нейтронов в ядре. Видимо, что оно равно N = A-Z.
3. У различных изотопов одного химического элемента число A меняется, что дозволено увидеть в записи этого изотопа. Определенные изотопы имеют свои подлинные наименования. Скажем, обыкновенное ядро водорода не имеет нейтронов и имеет один протон. Изотоп водорода дейтерий имеет один нейтрон (A = 2, цифра 2 сверху, 1 снизу), а изотоп тритий – два нейтрона (A = 3, цифра 3 сверху, 1 снизу).
4. Связанность числа нейтронов от числа протонов отражена на так называемой N-Z диаграмме ядерных ядер. Стабильность ядер зависит от отношения числа нейтронов и числа протонов. Ядра легких нуклидов особенно устойчивы при N/Z = 1, то есть при равенстве числа нейтронов и протонов. С ростом массового числа область стабильности сдвигается к величинам N/Z>1, достигая величины N/Z ~ 1,5 для особенно тяжелых ядер.
Видео по теме
Дабы обнаружить число протонов в атоме, определите его место в таблице Менделеева. Обнаружьте его порядковый номер в периодической таблице. Он будет равен числу протонов в ядерном ядре. Если изучается изотоп, посмотрите на пару чисел, описывающие его свойства, нижнее число будет равно числу протонов. В том случае, если знаменит заряд ядерного ядра, дозволено узнать число протонов, поделив его значение на заряд одного протона.
Вам понадобится
- Для того дабы обнаружить число протонов, узнайте значение заряда протона либо электрона, возьмите таблицу изотопов, периодическую таблицу Менделеева.
Инструкция
1. Определение числа протонов знаменитого атома.В том случае, когда знаменито, какой атом изучается, обнаружьте его расположение в периодической таблице. Определите его номер в этой таблице, обнаружив ячейку соответствующего элемента. В данной ячейке обнаружьте порядковый номер элемента, тот, что соответствует постигаемому атому. Данный порядковый номер и будет соответствовать числу протонов в ядерном ядре.
2. Как обнаружить протоны в изотопе.Многие атомы имеют изотопы, отличающиеся массами ядер. Именно следственно только лишь массы ядра неудовлетворительно для однозначного определения ядерного ядра. При изложении изотопа перед записью его химического обозначения неизменно записывается пара чисел. Верхнее число показывает массу атома в ядерных единицах массы, а нижнее обозначает заряд ядра. Вся единица заряда ядра в такой записи соответствует одному протону. Таким образом, число протонов равно нижнему числу в записи данного изотопа.
3. Как обнаружить протоны, зная заряд ядра.Зачастую свойства атома характеризуется зарядом его ядра. Для того дабы определить число протонов в нем, нужно перевести его в кулоны (если он подан в кратных единицах). После этого поделите заряд ядра на модуль заряда электрона. Это связано с тем, что от того что атом электрически нейтрален, то число протонов в нем равно числу электронов. Причем заряды их равны по модулю и противоположны по знаку (протон имеет правильный заряд, электрон – негативный). Следственно заряд ядра атома поделите на число 1,6022•10^(-19) кулон. В итоге получится число протонов. От того что способы измерения заряда атома неудовлетворительно точны, в том случае, если при делении получилось дробное число, округлите его до целого.
Видео по теме
Атомы состоят из субатомных частиц — протонов, нейтронов и электронов. Протоны представляют собой правильно заряженные частицы, которые находятся в центре атома, в его ядре. Вычислить число протонов изотопа дозволено по ядерному номеру соответствующего химического элемента.
Модель атома
Для изложения свойств атома и его конструкции применяется модель, вестимая под наименованием «Модель атома по Бору». В соответствии с ней конструкция атома напоминает ясную систему — весомый центр (ядро) находится в центре, а больше легкие частицы движутся по орбите вокруг него. Нейтроны и протоны образуют позитивно заряженное ядро, а негативно заряженные электроны движутся вокруг центра, притягиваясь к нему электростатическими силами.Элементом называют вещество, состоящее из атомов одного типа, он определяется числом протонов в всем из них. Элементу присваивают свое имя и символ, скажем, водород (H) либо кислород (О). Химические свойства элемента зависят от числа электронов и, соответственно, числа протонов, содержащихся в атомах. Химические колляции атома не зависят от числа нейтронов, потому что нейтроны не имеют электрического заряда. Впрочем их число влияет на устойчивость ядра, изменяя всеобщую массу атома.
Изотопы и число протонов
Изотопами называют атомы отдельных элементов с разным числом нейтронов. Данные атомы химически одинаковым, впрочем владеют различной массой, также они отличаются своей способностью испускать излучение.Ядерный номер (Z) — это порядковый номер химического элемента в периодической системе Менделеева, он определяется числом протонов в ядре. Весь атом характеризуется ядерным номером и массовым числом (А), которое равно суммарному числу протонов и нейтронов в ядре. Элемент может иметь атомы с разным числом нейтронов, но число протонов остается непоколебимым и равно числу электронов нейтрального атома. Для того, дабы определить, сколько протонов содержится в ядре изотопа, довольно посмотреть на его ядерный номер. Число протонов равно номеру соответствующего химического элемента в периодической таблице Менделеева.
Примеры
В качестве примера дозволено разглядеть изотопы водорода. В природе особенно распространены атомы водорода с одним протоном и без нейтронов. В то же время существуют изотопы водорода с одним либо двумя нейтронами, они имеют соответствующие наименования. Впрочем у них у всех один протон, что соответствует порядковому номеру водорода в периодической таблице. Изотоп водорода с одним нейтроном и массовым числом 2 называют дейтерием либо тяжелым водородом, он стабилен. Тритий, изотоп водорода с массовым числом 3 и двумя нейтронами, радиоактивен. Его изредка называют сверхтяжелым водородом, а ядро трития — тритоном.
jprosto.ru
Как определить протон, нейтрон, электрон
Атом – это мельчайшая частица, которую поделить на комбинированные части химическим путем немыслимо. Атом состоит из одобрительно заряженного ядра за счет протонов (р) с зарядом + и нейтральных частиц нейтронов (n). Вокруг него вращаются электроны (?), имеющие негативный заряд.
Вам понадобится
- Периодическая система химических элементов Д.И. Менделеева.
Инструкция
1. Вследствие знанию положительно вычислять число протонов , нейтронов либо электронов, дозволено определить валентность химического элемента, а также составить электронную формулу. Для этого понадобится только периодическая система химических элементов Д.И. Менделеева, которая является непременным справочным материалом.
2. Таблица Д.И. Менделеева поделена на группы (располагаются вертикально), которых каждого восемь, а также на периоды, расположенные горизонтально. Всякий химический элемент имеет свой порядковый номер и относительную ядерную массу, что указано в всякой клетке периодической таблицы. Число протонов (р) и электронов (?) численно совпадает с порядковым номером элемента. Для определения числа нейтронов (n) нужно из относительной ядерной массы (Ar) вычесть номер химического элемента.
3. Пример № 1. Вычислите число протонов , электронов и нейтронов атома химического элемента № 7.Химический элемент № 7 – это азот (N). Вначале определите число протонов (р). Если порядковый номер 7, значит, будет 7 протонов . Рассматривая, что это число совпадает с числом негативно заряженных частиц, электронов (?) тоже будет 7. Для определения числа нейтронов (n) из относительной ядерной массы (Ar (N) = 14) вычтите порядковый номер азота (№ 7). Следственно, 14 – 7 = 7. В всеобщем виде каждая информация выглядит таким образом:р = +7;? = -7;n = 14-7 = 7.
4. Пример № 2. Вычислите число протонов , электронов и нейтронов атома химического элемента № 20.Химический элемент № 20 – это кальций (Са). Вначале определите число протонов (р). Если порядковый номер 20, следственно, будет 20 протонов . Зная, что это число совпадает с числом негативно заряженных частиц, значит электронов (?) тоже будет 20. Для определения числа нейтронов (n) из относительной ядерной массы (Ar (Са) = 40) вычтите порядковый номер кальция (№ 20). Следственно, 40 – 20 = 20. В всеобщем виде каждая информация выглядит таким образом:р = +20;? = -20;n = 40-20 = 20.
5. Пример № 3. Вычислите число протонов , электронов и нейтронов атома химического элемента № 33.Химический элемент № 33 – это мышьяк (As). Вначале определите число протонов (р). Если порядковый номер 33, значит, будет 33 протона. Рассматривая, что это число совпадает с числом негативно заряженных частиц, электронов (?) тоже будет 33. Для определения числа нейтронов (n) из относительной ядерной массы (Ar (As) = 75) вычтите порядковый номер азота (№ 33). Следственно, 75 – 33 = 42. В всеобщем виде каждая информация выглядит таким образом:р = +33;? = -33;n = 75 -33 = 42.
Азот – газ, обширно применяемый в производстве, наравне с десятком другие инертных соединений. Транспортировать либо беречь данный газ в чистом виде не неизменно рационально, а порой требуется легко определить присутствие его в веществе. Для этого применяют способ Кьельдаля. Метод Кьельдаля заключается в том, что азот, тот, что содержится в безбелковой отфильтрованной жидкости, при реакции сжигания с серной кислотой переводится в аммоний. Полученный аммиак вольно выдается позже щелочной реакции.
Инструкция
1. Для обзора возьмите в объеме 4мл кровь, плазму либо сыворотку, разводите ее 8мл дистиллированной воды. В ту же колбу добавьте 8мл трихлоруксусной кислоты. Отлично перемешайте раствор и отфильтруйте.
2. В колбу для перегонки, влейте 5 мл отфильтрованной жидкости, которая по умолчанию будет содержать 1 мл анализируемой крови. Туда же добавьте 1 мл реактива №2, нагревайте колбу на слабеньком пламени до тех пор, пока не появится белый пар.
3. Колбу установите таким образом, дабы дно ее чуть-чуть касалось языков пламени. Процесс сжигания считайте завершенным, когда жидкость приобретет голубоватый цвет либо станет бесцветной.
4. Колбу отставьте в сторону для остывания. Довольно полторы-две минуты. В отвратном случае образуется нерастворимый осадок.
5. Лейте по стенке воду, промывая ею воронку. Взболтайте до полного смешивания, подогревая колбу при необходимости.
6. Соберите агрегат, присоедините приемник. В приемник пустите 10 мл 0,01 н. раствора серной кислоты. Внесите одну либо две капли метилрота. Позже соединения всех ингредиентов, пристройте водоструйный насос к приемнику.
7. Начните пропускать через препарат воздух, влейте в перегонную часть 33% резкого натрия, пока жидкость из бесцветной превратится в темно-синюю либо темно-бурую. Это свидетельствует о щелочной реакции.
8. По истечении десяти минут перегонку прекратите. Закройте кран водоструйного насоса, откройте пробку приемника, смойте серную кислоту с конца холодильной трубки. Замените иным приемником с таким же объемом 0,01 н. раствора серной кислоты, сделайте вторую перегонку.
9. В 1-й приемник добавьте резкий натр до приобретения устойчивого, в течение 30 сек, желтого цвета.
10. Итог: 1 мл 0,01 н. серной кислоты либо резкого натрия соответствует 0,14 мг азота.Разность между числом серной кислоты, размещенной в приемник, и числом резкого натрия, взятого при титровании, произведенная на 0,14 мг, равна числу остаточного азота в исследуемом 1 мл крови. Чтоб показать число азота в миллиграмм-процентах, нужно итог умножить на 100.
Валентность – это способность химических элементов держать определенное число атомов других элементов. В то же самое время, это число связей, образуемое данным атомом с другими атомами. Определить валентность довольно легко.
Инструкция
1. Возьмите на заметку, что обозначается показатель валентности римскими цифрами и ставится над знаком элемента.
2. Обратите внимание: если формула двухэлементного вещества написана верно, то,при умножении числа атомов всего элемента на его валентность, у всех элементовдолжны получиться идентичные произведения.
3. Примите к сведению, что валентность атомов одних элементов непрерывна, а других – переменна, то есть, имеет качество меняться. Скажем, водород во всех соединениях одновалентен, от того что образует только одну связь. Кислород горазд образовывать две связи, являясь при этом двухвалентным. А вот у серы валентность может быть II, IV либо VI. Все зависит от элемента, с которым она соединяется. Таким образом, сера – элемент с переменной валентностью.
4. Подметьте, что в молекулах водородных соединений вычислить валентность дюже легко. Водород неизменно одновалентен, а данный показатель у связанного с ним элемента будет равняться числу атомов водорода в данной молекуле. К примеру, в Cah3 кальций будет двухвалентен.
5. Запомните основное правило определения валентности: произведение показателя валентности атома какого-нибудь элемента и числа его атомов в какой-нибудь молекуле неизменно равно произведению показателя валентности атома второго элемента и числа его атомов в данной молекуле.
6. Посмотрите на буквенную формулу, обозначающую это равенство: V1 x K1 = V2 x K2, где V – это валентность атомов элементов, а К – число атомов в молекуле. С ее поддержкой легко определить показатель валентности всякого элемента, если вестимы остальные данные.
7. Разглядите пример с молекулой оксида серы SО2. Кислород во всех соединениях двухвалентен, следственно, подставляя значения в пропорцию: Vкислорода х Кислорода = Vсеры х Ксеры, получаем: 2 х 2 = Vсеры х 2. От сюда Vсеры = 4/2 = 2. Таким образом, валентность серы в данной молекуле равна 2.
Видео по теме
Электрон – самая легкая электрически заряженная частица, которая участвует фактически во всех электрических явлениях. Он, вследствие своей малой массе, особенно привлечен в становление квантовой механики. Эти стремительные частицы обнаружили широкое использование в области нынешней науки и техники.
Слово ???????? – греческое. Именно оно дало имя электрону. Переводится это слово как «янтарь». В древние времена греческие естествоиспытатели проводили разные эксперименты, которые заключались в натирании шерстью кусков янтаря, которые после этого начинали притягивать к себе различные мелкие предметы. Электрон ом названа негативно заряженная частица, которая является одной из основных единиц, составляющих конструкцию вещества. Электрон ные оболочки атомов состоят из электронов, при этом их расположение и число являются определяющими химических свойств вещества.О числе электронов в атомах разных веществ дозволено узнать из таблицы химических элементов, составленной Д.И. Менделеевым. Число протонов в ядре атома неизменно равно числу электронов, которое должно быть в электронной оболочке атома данного вещества. Электрон ы вращаются вокруг ядра с большой скоростью, и следственно они не «падают» на ядро. Это наглядно сравнимо Луной, которая не падает, невзирая на то, что Земля ее притягивает.Современные представления физики элементарных частиц свидетельствуют о бесструктурности и неделимости электрона. Движение этих частиц в полупроводниках и металлах разрешает легко переносить и руководить энергией. Это качество повсюду применяется в электронике, быту, промышленности, информатике и связи. Невзирая на то, что в проводниках скорость движения электронов дюже крошечная, электрическое поле способно распространяться со скоростью света. Вследствие этому ток по каждой цепи устанавливается мгновенно.Электрон ы, помимо корпускулярных, владеют еще и волновыми свойствами. Они участвуют в гравитационном, слабом и электромагнитном взаимодействиях. Стабильность электрона следует из законов сохранения энергии и сохранения заряда. Эта частица – самая легкая из заряженных, и следственно не может ни на что распасться. Распад на частицы больше легкие запрещен законом сохранения заряда, а распад на больше тяжелые, чем электрон частицы запрещен законом сохранения энергии. О точности, с которой исполнен закон сохранения заряда, судить дозволено по тому, что электрон, по крайней мере, за десять лет, своего заряда не теряет.
Видео по теме
Обратите внимание!
Относительную ядерную массу, указанную в таблице Д.И. Менделеева, нужно округлять до целого числа.
jprosto.ru
Структура атома: что такое нейтрон?
Что такое нейтрон? Каковы его структура, свойства и функции? Нейтроны — это самые большие из частиц, составляющих атомы, являющиеся строительными блоками всей материи.
Структура атома
Нейтроны находятся в ядре — плотной области атома, также заполненной протонами (положительно заряженными частицами). Эти два элемента удерживаются вместе при помощи силы, называем ядерной. Нейтроны имеют нейтральный заряд. Положительный заряд протона сопоставляется с отрицательным зарядом электрона для создания нейтрального атома. Несмотря на то что нейтроны в ядре не влияют на заряд атома, они все же обладают многими свойствами, которые влияют на атом, включая уровень радиоактивности.
Нейтроны, изотопы и радиоактивность
Частица, которая находится в ядре атома — нейтрон на 0,2% больше протона. Вместе они составляют 99,99% всей массы атома. Атомы одного и того же элемента могут иметь различное количество нейтронов. Когда ученые ссылаются на атомную массу, они имеют в виду среднюю атомную массу. Например, углерод обычно имеет 6 нейтронов и 6 протонов с атомной массой 12, но иногда он встречается с атомной массой 13 (6 протонов и 7 нейтронов). Углерод с атомным номером 14 также существует, но встречается редко. Итак, атомная масса для углерода усредняется до 12,011.
Когда атомы имеют различное количество нейтронов, их называют изотопами. Ученые нашли способы добавления этих частиц в ядро для создания больших изотопов. Теперь добавление нейтронов не влияет на заряд атома, так как они не имеют заряда. Однако они увеличивают радиоактивность атома. Это может привести к очень неустойчивым атомам, которые могут разряжать высокие уровни энергии.
Что такое ядро?
В химии ядро является положительно заряженным центром атома, который состоит из протонов и нейтронов. Слово «ядро» происходит от латинского nucleus, которое является формой слова, означающего «орех» или «ядро». Этот термин был придуман в 1844 году Майклом Фарадеем для описания центра атома. Науки, участвующие в исследовании ядра, изучении его состава и характеристик, называются ядерной физикой и ядерной химией.
Протоны и нейтроны удерживаются сильной ядерной силой. Электроны притягиваются к ядру, но двигаются так быстро, что их вращение осуществляется на некотором расстоянии от центра атома. Заряд ядра со знаком плюс исходит от протонов, а что такое нейтрон? Это частица, которая не имеет электрического заряда. Почти весь вес атома содержится в ядре, так как протоны и нейтроны имеют гораздо большую массу, чем электроны. Число протонов в атомном ядре определяет его идентичность как атома определенного элемента. Число нейтронов означает, какой изотоп элемента является атомом.
Размер атомного ядра
Ядро намного меньше общего диаметра атома, потому что электроны могут быть отдалены от центра. Атом водорода в 145 000 раз больше своего ядра, а атом урана в 23 000 раз больше своего центра. Ядро водорода является наименьшим, потому что оно состоит из одиночного протона.
Расположение протонов и нейтронов в ядре
Протон и нейтроны обычно изображаются как уплотненные вместе и равномерно распределенные по сферам. Однако это упрощение фактической структуры. Каждый нуклон (протон или нейтрон) может занимать определенный уровень энергии и диапазон местоположений. В то время как ядро может быть сферическим, оно может быть также грушевидным, шаровидным или дисковидным.
Ядра протонов и нейтронов представляют собой барионы, состоящие из наименьших субатомных частиц, называемых кварками. Сила притяжения имеет очень короткий диапазон, поэтому протоны и нейтроны должны быть очень близки друг к другу, чтобы быть связанными. Это сильное притяжение преодолевает естественное отталкивание заряженных протонов.
Протон, нейтрон и электрон
Мощным толчком в развитии такой науки, как ядерная физика, стало открытие нейтрона (1932 год). Благодарить за это следует английского физика Д. Чедвика, который был учеником Резерфорда. Что такое нейтрон? Это нестабильная частица, которая в свободном состоянии всего за 15 минут способна распадаться на протон, электрон и нейтрино, так называемую безмассовую нейтральную частицу.
Частица получила свое название из-за того, что она не имеет электрического заряда, она нейтральна. Нейтроны являются чрезвычайно плотными. В изолированном состоянии один нейтрон будет иметь массу всего 1,67·10—27, а если взять чайную ложку плотно упакованную нейтронами, то получившийся кусок материи будет весить миллионы тонн.
Количество протонов в ядре элемента называется атомным номером. Это число дает каждому элементу свою уникальную идентичность. В атомах некоторых элементов, например углерода, число протонов в ядрах всегда одинаково, но количество нейтронов может различаться. Атом данного элемента с определенным количеством нейтронов в ядре называется изотопом.
Опасны ли одиночные нейтроны?
Что такое нейтрон? Это частица, которая наряду с протоном входит в состав ядра атома. Однако иногда они могут существовать сами по себе. Когда нейтроны находятся вне ядер атомов, они приобретают потенциально опасные свойства. Когда они двигаются с высокой скоростью, они производят смертельную радиацию. Так называемые нейтронные бомбы, известные своей способностью убивать людей и животных, при этом оказывают минимальное влияние на неживые физические структуры.
Нейтроны являются очень важной частью атома. Высокая плотность этих частиц в сочетании с их скоростью придает им чрезвычайную разрушительную силу и энергию. Как следствие, они могут изменить или даже разорвать на части ядра атомов, которые поражают. Хотя нейтрон имеет чистый нейтральный электрический заряд, он состоит из заряженных компонентов, которые отменяют друг друга относительно заряда.
Нейтрон в атоме — это крошечная частица. Как и протоны, они слишком малы, чтобы увидеть их даже с помощью электронного микроскопа, но они там есть, потому что это единственный способ, объясняющий поведение атомов. Нейтроны очень важны для обеспечения стабильности атома, однако за пределами его атомного центра они не могут существовать долго и распадаются в среднем всего лишь за 885 секунд (около 15 минут).
fb.ru