Полярные и неполярные молекулы – две группы, на которые подразделяются все диэлектрики.
Полярные по-другому называются дипольными. А неполярные являются нейтральными или бездипольными.
Что такое полярность в химии
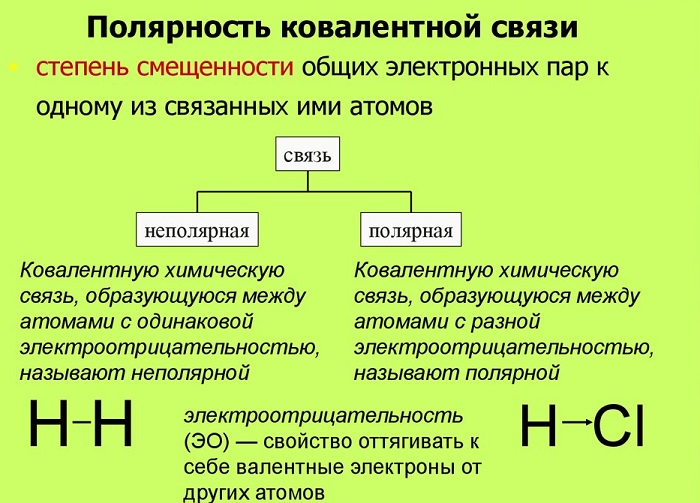
Полярность – свойство, показывающее изменение распределения электронной плотности около ядер, если сравнивать с изначальным ее распределением в образующих данную связь нейтральных частицах.
Поляризуемость — способность поляризоваться под воздействием электрического поля.
Мерой полярности называется электрический момент диполя. В нейтральных соединениях он равен нулю. Его значение зависит от разности электроотрицательностей элементов.
Длина диполя — расстояние между его полюсами. Данная характеристика также влияет на степень полярности.
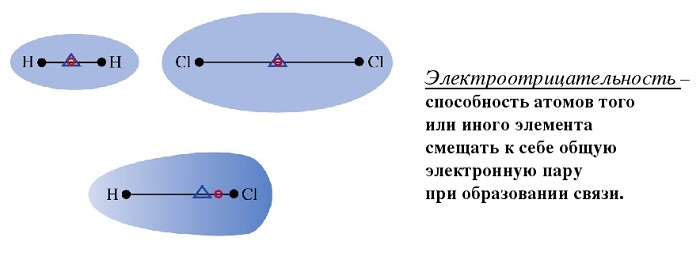
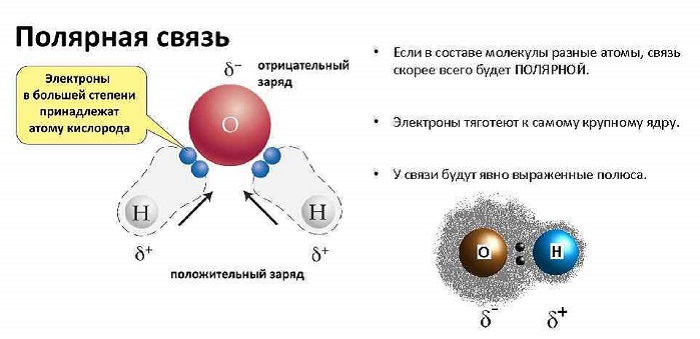
Любое соединение состоит из ядра (положительные частицы) и электронов (отрицательные частицы). И положительные, и отрицательные частицы имеют свой электрический центр тяжести.
Если центры тяжести частиц совпадают, то соединение считается неполярным. Если же полюса не накладываются друг на друга, то в этом случае речь идет о дипольной связи.
Примеры полярных молекул
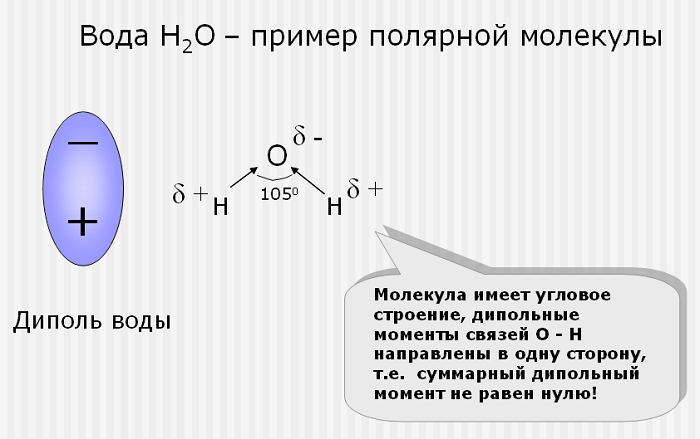
Эта связь образуется, если вещество состоит из атомов разных элементов и ассиметрична (имеются неспаренные электроны). Такие соединения имеют угловую, изогнутую геометрическую форму.
Например, это такие газы как NH3, SO2, NO2 и жидкость – вода.
Примеры неполярных молекул
В качестве примера таких связей можно привести молекулы, состоящие из одинаковых атомов: H2, Cl2, O2, N2, F2 и т. д.
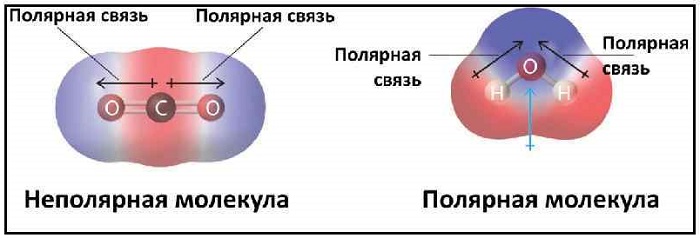
Эта связь также может встречаться в соединениях, состоящих из атомов разных элементов и при этом являющихся симметричными (линейные, тетраэдрические и т. д.). Такими веществами являются: BeH2, BF3, CH4, CO2(углекислый газ) и SO3.
При нейтральной связи электронное облако равномерно распределяется между ядрами всех атомов данного вещества. Поэтому ядра действуют на него в равной мере.
Как определить полярность молекулы и от чего она зависит
Чтобы определить, является ковалентная связь дипольной или нет, необходимо посмотреть на химическую формулу вещества.
Если молекула состоит из атомов одного и того же вещества, то она в любом случае нейтральна.
Если же молекулярное строение является сложным, то речь может идти как о полярной, так и неполярной ковалентной связи. Это зависит от геометрической формы.
Полярные и неполярные молекулы в органической
химии
Полярные и неполярные молекулы. Во
всякой молекуле имеются как положительно заряженные частицы — ядра атомов, так
и отрицательно заряженные — электроны. Для каждого рода частиц (или, вернее, зарядов)
можно найти такую точку, которая будет являться как бы их «электрическим
центром тяжести». Эти точки называются полюсами молекулы. Если в молекуле
электрические центры тяжести положительных и отрицательных зарядов
совпадут, то молекула
будет неполярной. Таковы, например, молекулы Н2,
N2, образованные одинаковыми атомами, у которых
общие пары электронов в равной мере принадлежат обоим атомам, а также многие
симметрично построенные молекулы с атомной связью, например метан СН4,
четыреххлористый углерод ССl4.
Но если молекула построена несимметрично, например состоит из двух разнородных
атомов, то, как мы
уже говорили, общая пара электронов может быть в большей или меньшей степени
смещена в сторону одного из атомов. Очевидно, что в этом случае,
вследствие неравномерного распределения положительных и отрицательных зарядов
внутри молекулы, их электрические центры тяжести не совпадут и получится
полярная молекула (рис. 32).
Полярные молекулы являются диполями. Этим
термином обозначают вообще всякую электронейтральную систему, т. е. систему,
состоящую из положительных и отрицательных зарядов, распределенных таким
образом, что их электрические центры тяжести не совпадают.
Полярность
молекул
Молекулы,
которые образованы атомами одного и того же элемента, как правило, будут неполярными,
как неполярны и сами связи в них. Так, молекулы Н2,
F2, N2 неполярны.
Молекулы,
которые образованы атомами разных элементов, могут быть полярными и неполярными.
Это зависит от геометрической формы.
Если форма симметрична, то молекула неполярна (BeH2,
BF3, CH4,
CO2, SO3),
если асимметрична (из-за наличия неподелённых пар или неспаренных электронов),
то молекула полярна (NH3, H2O,
SO2, NO2).
При
замене одного из боковых атомов в симметричной молекуле на атом другого
элемента также происходит искажение геометрической формы и появление
полярности, например в хлорпроизводных метана CH3Cl,
CH2Cl2 и
CHCl3 (молекулы метанаCH4 неполярны).
Полярность несимметричной по форме
молекулы вытекает из полярности ковалентных связей между
атомами элементов с разной электроотрицательностью.
Как отмечалось выше, происходит частичный сдвиг электронной
плотности вдоль оси связи к атому более электроотрицательного элемента,
например:
|
Hδ+ →Clδ− |
Bδ+ →Fδ− |
|
Cδ− ←Hδ+ |
Nδ− ←Hδ+ |
(здесь δ — частичный электрический заряд на атомах).
Чем
больше разность электроотрицательностей элементов, тем выше
абсолютное значение заряда δ и тем более полярной будет
ковалентная связь.
Старая поговорка о том, что подобное растворяется, происходит из понимания полярного или неполярного характера молекул. Полярность молекулы возрастает из электроотрицательности атомов в молекуле и пространственного расположения атомов. Симметричные молекулы неполярные, но по мере уменьшения симметрии молекулы становятся более полярными. Ковалентные связи делят электроны между атомами, причем большая часть электронов находится ближе к атому с более высокой электроотрицательностью.
Определите, является ли молекула ионной или ковалентной. Ионные молекулы полярны при растворении в растворе. Ионные молекулы высвобождают или принимают электроны от других атомов в молекуле.
Определите атомы молекулы и типы связей между ними. Ковалентная связь между атомами в молекуле будет определять пространственную ориентацию атомов и важна при определении областей заряда.
Найти относительную электроотрицательность атомов в молекуле. Тенденция электроотрицательности возрастает по мере движения к верхнему правому углу.
Создайте стрелку вдоль каждой связи, которая указывает положительный и отрицательный конец связи, а длина стрелки пропорциональна разнице в электроотрицательности. Это диполи молекулы.
Убедитесь, что каждая связь в молекуле правильно ориентирована на основе связи, в которой она участвует. Одиночные связи ориентированы под углом 109, 5 градусов в форме тетраэдра, атом с двойной связью имеет связи под углом 120 градусов с ориентацией плоского треугольника, а тройная связь — это плоская линия с углом связи 180 градусов. Примерами этого являются четыреххлористый углерод, вода и окись углерода.
Суммируйте отдельные диполи в молекуле, чтобы определить общий диполь молекулы. В такой молекуле, как диоксид углерода, есть два диполя, которые берут свое начало от атома углерода и указывают на атом кислорода. Эти диполи ориентированы на 180 градусов друг от друга и имеют одинаковую величину, что приводит к неполярной молекуле. Напротив, молекула воды имеет тетраэдрическую ориентацию, причем диполи направлены от атомов водорода к атому кислорода и имеют одинаковую длину. Между атомом кислорода и двумя неподеленными парами электронов существуют два других диполя, которые направлены от атома кислорода к остальным углам тетраэдра. Поскольку все диполи направлены в одном направлении, молекула является полярной.
Классифицируйте каждую молекулу как полярную или неполярную в зависимости от размера ее молекулярного диполя. Чем больше диполь молекулы, тем ближе молекула к полярной стороне шкалы классификации.
Before determining if a compound is polar, you need to determine whether or not the bonds in that compound are polar. You also have to determine the molecular geometry of the bonds and any electron lone pairs.
Before talking about whether or not an entire compound is polar, take a look at what determines whether or not a bond is polar. You can then apply these rules to determine if each molecule is polar or nonpolar.
What Makes a Bond Polar?
A molecule is polar if one part of it has a partial positive charge, and the other part has a partial negative charge.
When in a bond, atoms can either share electrons (covalent) or give them up (ionic). The atom that holds the electrons closer will thus be more negatively charged than the other atom.
Electronegativity is a measure of how much a particular element wants electrons. In the Resources section you will find a periodic table which reports the electronegativity of each element. The higher this number, the more an atom of that element will «hog» the electrons in a bond. For example, fluorine is the most electronegative element.
Electronegativity values can help you determine what kind of bond exists between two atoms. Is the bond likely to be ionic or covalent? To do this, find the absolute value of the difference between the electronegativities of the two atoms. Based on this value, the following table tells you if the bond is a polar covalent bond, covalent bond or ionic bond.
|
Bond Type |
Electronegativity Difference |
|
pure covalent |
<0.4 |
|
polar covalent |
between 0.4 and 1.8 |
|
ionic |
>1.8 |
Think about water. What is the electronegativity difference between atoms in water? The electronegativity difference between H (2.2) and O (3.44) is 1.24. As such, the bond is polar covalent.
Bond Polarity and Molecule Polarity
As you saw above, a bond within a molecule can be polar. What does this mean for the whole molecule?
When determining molecule polarity, all bonds must be considered. This means that the vector partial charge from each bond must be added up. If they a cancel out, then the molecule may not be polar. If there are vector components left, then the bond is polar.
In order to find the direction of these vectors, you have to examine the molecular geometry of the bonds. You can find this via valence shell electron-pair repulsion (VSEPR) theory.
The theory starts with the idea that electron pairs in the valence shell of an atom repel each other (since like charges repel). As a result, the electron pairs around an atom will orient themselves to minimize repulsive forces.
Take a look at water again. Water is bound to two hydrogens and also has two lone pair electrons. It has a tetrahedral bent shape.
To determine whether or not the molecule is polar, you have to look at the partial charge vectors on the two bonds in the molecule.
First, there are two electron pairs on the molecule, which means there will be a large negative partial charge vector in that direction.
Next, oxygen is more electronegative than hydrogen and will hog the electrons. This means that the partial charge vector on each bond will have a negative component pointing toward the oxygen.
The inward component of the vector on each bond will cancel. The portion pointing toward the oxygen will not cancel. As a result, there is a net partial negative charge toward the oxygen side of the molecule. There is also a net partial position toward the hydrogen side of the molecule.
This analysis reveals that water is a polar molecule.
What about CH4?
First, CH4 has no lone pairs since all the electrons are involved in a single bond between C and H. CH4 has a tetrahedral molecular geometry.
Next, the C-H bond is covalent as the difference in electronegativities is 0.35. All the bonds are covalent, and there will not be a big dipole moment. Thus, CH4 is a nonpolar molecule.
The difference between polar and nonpolar molecules can thus be found by the vectors of partial charge resulting from each bond.
Диэлектриками (или изоляторами) называются вещества, не способные проводить электрический ток. Идеальных изоляторов в природе не существует. Bce вещества хотя бы в ничтожной степени проводят электрический ток. Однако вещества, называемые диэлектриками, проводят ток в раз хуже, чем вещества, называемые проводниками.
Ecли диэлектрик внести в электрическое поле, то это поле и сам диэлектрик претерпевают существенные изменения. Чтобы понять, почему это происходит, нужно учесть, что в составе атомов и молекул имеются положительно заряженные ядра и отрицательно заряженные электроны.
Так как положительный заряд всех ядер молекулы равен суммарному заряду электронов, то молекула в целом электрически нейтральна. Если заменить положительные заряды ядер молекул суммарным зарядом +q, находящимся в центре «тяжести» положительных зарядов, а заряд всех электронов – суммарным отрицательным зарядом –q, находящимся в центре «тяжести» отрицательных зарядов, то молекулу можно рассматривать как электрический диполь с электрическим моментом, определяемым формулой (7.1)
У симметричных молекул в отсутствие внешнего электрического поля центры тяжести положительных и отрицательных зарядов совпадают. Такие молекулы не обладают собственным дипольным моментом и называются неполярными.
У несимметричных молекул центры тяжести зарядов разных знаков сдвинуты друг относительно друга. B этом случае молекулы обладают собственным дипольным моментом и называются полярными.
Под действием внешнего электрического поля заряды в неполярной молекуле смещаются друг относительно друга: положительные по направлению поля, отрицательные против поля. B результате молекула приобретает дипольный момент, величина которого, как показывает опыт, пропорциональна напряженности поля. B рационализованной системе коэффициент пропорциональности записывают в виде , где
– электрическая постоянная, а
– величина, называемая поляризуемостью молекулы. Учтя, что направления
и
совпадают, можно написать
Процесс поляризации неполярной молекулы протекает так, как если бы положительные и отрицательные заряды молекулы были связаны друг с другом упругими силами. Поэтому говорят, что неполярная молекула ведет себя во внешнем поле как упругий диполь.
Действие внешнего поля на полярную молекулу сводится в основном к стремлению повернуть молекулу так, чтобы ее дипольный момент установился по направлению поля. На величину дипольного момента внешнее поле практически не влияет. Следовательно, полярная молекула ведет себя во внешнем поле как жесткий диполь.
К диэлектрикам относятся еще и вещества (NaCl, KCl, KBr, …), молекулы которых имеют ионное строение. Ионные кристаллы представляют собой пространственные решетки с правильным чередованием ионов разных знаков. В этих кристаллах нельзя выделить отдельные молекулы, а рассматривать их можно как систему двух вдвинутых одна в другую ионных подрешеток. При наложении на ионный кристалл электрического поля происходит некоторая деформация кристаллической решетки или относительное смещение подрешеток, приводящее к возникновению дипольных моментов.
Таким образом, внесение всех трех групп диэлектриков во внешнее электрическое поле приводит к возникновению отличного от нуля результирующего электрического момента диэлектрика, или, иными словами, к поляризации диэлектрика. Поляризацией диэлектрика называется процесс ориентации диполей или появления под воздействием внешнего электрического поля ориентированных по полю диполей.
Соответственно трем группам диэлектриков различают три вида поляризации:
электронная, или деформационная, поляризация диэлектрика с неполярными молекулами, заключающаяся в возникновении у атомов индуцированного дипольного момента за счет деформации электронных орбит;
ориентационная, или дипольная, поляризация диэлектрика с полярными молекулами, заключающаяся в ориентации имеющихся дипольных моментов молекул по полю. Естественно, что тепловое движение препятствует полной ориентации молекул, но в результате совместного действия обоих факторов (электрическое поле и тепловое движение) возникает преимущественная ориентация дипольных моментов молекул по полю. Эта ориентация тем сильнее, чем больше напряженность электрического поля и ниже температура;
ионная поляризация диэлектриков с ионными кристаллическими решетками, заключающаяся в смещении подрешетки положительных ионов вдоль поля, а отрицательных – против поля, приводящем к возникновению дипольных моментов.