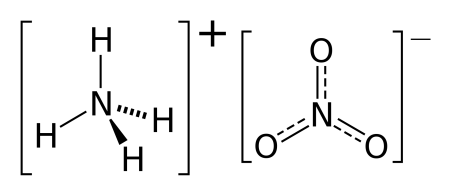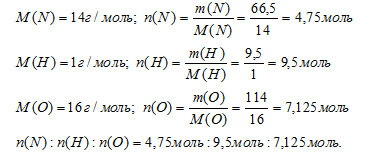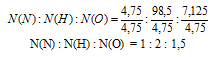|
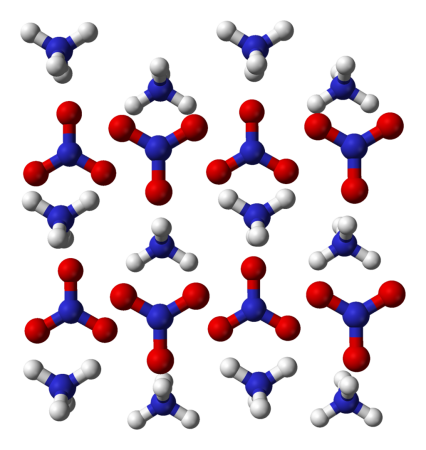
Нитрат аммония |
|
|---|---|
|
|
|
|
|
|
| Систематическое наименование |
Нитрат аммония |
| Хим. формула | NH4NO3 |
| Состояние | твёрдый |
| Молярная масса | 80,04 г/моль |
| Плотность | 1,725 (IV модификация) |
| Т. плав. | 169,6 °C |
| Т. кип. | 235 °C |
| Т. разл. | ~210 °C |
| Растворимость в воде | 20 °C — 190 г/100 мл |
| ГОСТ | ГОСТ 14702-79 |
| Рег. номер CAS | 6484-52-2 |
| PubChem | 22985 |
| Рег. номер EINECS | 229-347-8 |
| SMILES |
[NH4+].[N+](=O)([O-])[O-] |
| InChI |
1S/NO3.H3N/c2-1(3)4;/h;1H3/q-1;/p+1 DVARTQFDIMZBAA-UHFFFAOYSA-O |
| RTECS | BR9050000 |
| ChEBI | 63038 |
| ChemSpider | 21511 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Нитрат аммония (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Используется в качестве компонента взрывчатых веществ и как азотное удобрение.
Содержание
- 1 Физические свойства
- 1.1 Растворимость
- 1.2 Состав
- 2 Методы получения
- 2.1 Основной метод
- 2.2 Метод Габера
- 2.3 Нитрофосфатный метод
- 3 Химические свойства
- 4 Кристаллические состояния нитрата аммония
- 5 Применение
- 5.1 Удобрения
- 5.2 Взрывчатые вещества
- 6 Безопасный состав
- 7 Дополнительная информация
Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при пониженном давлении — 235 °C. Молекулярная масса 80,04 а. е.м. Скорость детонации 2570 м/с.
Растворимость
Растворимость в воде:
| Температура, °C | Растворимость, г/100мл |
|---|---|
| 0 | 119 |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Также соль растворима в аммиаке, пиридине, метаноле, этаноле.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
- O — 60 %,
- N — 35 %,
- H — 5 %.
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
- NH3 + HNO3 → NH4NO3↓
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен). После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания. Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём получить практически невозможно.
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
- 3H2 + N2 ⟶ 2NH3 при давлении, высокой температуре и катализаторе
- NH3 + 2O2 ⟶ HNO3 + H2O
- HNO3 + NH3 ⟶ NH4NO3
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
- Природный фосфат кальция (апатит) растворяют в азотной кислоте:
- Ca3(PO4)2 + 6HNO3 ⟶ 2H3PO4 + 3Ca(NO3)2
- Полученную смесь охлаждают до 0 °C, при этом нитрат кальция кристаллизуется в виде тетрагидрата — Ca(NO3)2·4H2O, и его отделяют от фосфорной кислоты.
- На полученный нитрат кальция, не очищенный от фосфорной кислоты, действуют аммиаком, получая в итоге нитрат аммония:
- Ca(NO3)2 + 4H3PO4 + 8NH3 ⟶ CaHPO4↓ + 2NH4NO3 + 3(NH4)2HPO4
А также амфотерный метод.
Химические свойства
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
- Температура ниже 200 °C:
- NH4NO3 ⟶ N2O↑ + 2H2O + Q
- Температура выше 350 °C, или детонация:
- 2NH4NO3 ⟶ 2N2 + O2 + 4H2O
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| Система | Диапазон температур (°C) | Состояние | Изменение объёма (%) | |
|---|---|---|---|---|
| — | > 169.6 | жидкость | ||
| I | 169.6 — 125.2 | кубическая | −2.13 | |
| II | 125.5 — 84.2 | тетрагональная | −1.33 | |
| III | 84.2 — 32.3 | α-ромбическая
(моноклинная) |
+0.8 | |
| IV | 32.3 — −16.8 | β-ромбическая
(бипирамидальная) |
−3.3 | |
| V | −50 — −16.8 | тетрагональная | +1.65 | |
| VI | существует при высоких давлениях | |||
| VII | 170 | |||
| VIII | существует при высоких давлениях | |||
| IX | существует при высоких давлениях |
Фазовый переход от IV к III при 32,3 °C приносит неприятности производителям удобрений, потому как изменения плотности приводят к разрушению частиц при хранении и применении. Это особенно важно в тропических странах, где нитрат аммония испытывает циклические изменения, приводящие к разрушению гранул, слёживанию, повышенному пылению и риску возникновения взрыва.
Применение
Удобрения
Бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений. Для предотвращения создания взрывчатых веществ на основе нитрата аммония в удобрения, доступные в широкой продаже, добавляют компоненты, снижающие взрывоопасность и детонационные свойства чистого нитрата аммония, такие как мел (карбонат кальция).
В Австралии, Китае, Афганистане, Ирландии и некоторых других странах свободная продажа нитрата аммония даже в виде удобрений запрещена или ограничена. После террористического акта в Оклахома-Сити ограничения на продажу и хранение нитрата аммония были введены в некоторых штатах США.
Взрывчатые вещества
Наиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси:
- составы типа аммиачная селитра/дизельное топливо (АСДТ)
- жидкая смесь аммиачная селитра/гидразин (Астролит)
- водонаполненные промышленные взрывчатые вещества (Акванал, Акванит и др.)
- смеси с другими взрывчатыми веществами (Аммонит, Детонит и др.)
- смесь с алюминиевой пудрой (аммонал)
Аммиачная селитра отличается большой гигроскопичностью, поэтому в качестве взрывчатого вещества не используется, так как в сыром виде взрывчатые свойства утрачиваются.
Безопасный состав
В 2013 г. сотрудники Sandia National Laboratories объявили о разработке безопасного и эффективного состава на основе смеси нитрата аммония с сульфатом железа, который не может быть использован для создания на его основе взрывчатых веществ. При разложении состава ион SO42− связывается с ионом аммония, а ион железа — с нитрат-ионом, что предотвращает взрыв. Введение в состав удобрения сульфата железа может улучшить и технологические характеристики удобрения, особенно на закисленных почвах. Авторы отказались от защиты формулы удобрения патентом с тем, чтобы этот состав мог получить быстрое распространение в регионах с высокой террористической опасностью.
Дополнительная информация
Мировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот.
Определение формулы нитрата аммония
Задача 1.2.
Образец некоторого неорганического вещества содержит 66,5 г азота, 9,5 г водорода, 114 г кислорода. Определите формулу этого соединения.
Дано:
масса азота: m(N) = 66,5 г;
масса водорода: m(Н) = 9,5 г;
масса кислорода: m(О) = 114 г.
Найти: формулу вещества.
Решение:
Шаг 1. Из условия однозначно следует, что вещество состоит только из азота, водорода и кислорода. Обозначим формулу как NхНуОz. Следовательно, требуется определить неизвестные индексы х, у, z.
Шаг 2. В условии нет указаний на химическую реакцию.
Шаг 3. Вычислим соотношение количеств вещества (n) азота, водорода и кислорода в данном образце. Используем соотношение: m = n . М.
Шаг 4. Находим простейшую формулу.
Следуя выводу, сделанному при рассмотрении четвертого шага общего алгоритма (в предыдущем разделе), можно записать:
N(N) : N(Н) : N(О) = 4,75 : 9,5 : 7,125
Выбираем наименьшее значение (в данном случае «4,75») и делим на него все три числа:
Получили набор чисел, одно из которых не целое. Умножим все числа на «2». Получим:
N(N) : N(Н) : N(О) = 2 : 4 : 3
Получили набор наименьших целых чисел. Это дает возможность записать простейшую формулу: N2Н4О3.
Шаг 5. Выявление истинной формулы.
Такая запись формулы не отражает химической сути вещества. Более того, по элементному составу невозможно однозначно отнести это вещество к какому-либо классу. С таким элементным составом наиболее известны азотная (НNО3) и азотистая (НNО2) кислоты. Но в обоих случаях соотношение азота и водорода в формуле 1 : 1. В нашем же случае соотношение азота и водорода — 1 : 2 . Такому же элементному составу соответствуют аммонийные соли этих кислот: нитрат аммония (NН4NО3) и нитрит аммония (NН4NО2). Соотношению атомов в простейшей формуле N2Н4О3 соответствует истинная формула — NН4NО3. Из последней записи видно, что искомое вещество — соль, состоящая из иона аммония (МН4)+ и кислотного остатка азотной кислоты (NO3)–.
Ответ: NН4NО3.
Как распознать нитрат аммония
Жизненные ситуации бывают разные, и зачастую имеют место обстоятельства, когда нужно определить и распознать реагенты, растворы в пробирках, которые совершенно идентичны по цвету и запаху. Это может быть нужно для практической работы, лабораторного опыта или просто из любопытства. Но что бы ни подвигло вас на эксперимент, необходимо все же иметь некоторые знания по химии и уметь применять их на практике.

Вам понадобится
- чистые пробирки в количестве двух штук, вещество, название которого необходимо определить, гидроксид натрия и нитрат серебра.
Инструкция
Наденьте перчатки и ватно-марлевую повязку. Помните, что техника безопасности при работе с химическими веществами очень важна, так как можно не только получить ожоги, но и другие кожные повреждения или повреждения дыхательных путей.
Возьмите вещество, название которого нужно определить. Влейте немного вещества в одну пробирку и немного во вторую. Достаточно будет наполнить колбочки наполовину.
Установите пробирки с веществом на специальный держатель. Возьмите одну из пробирок и добавьте в нее раствор гидроксида натрия.
Взболтните немного содержимое пробирки и поднесите к носу. Если из пробирки исходит специфический запах, напоминающий собой тот, который используют при приведении человека в чувства в случае потери сознания, то есть запах нашатырного спирта – в пробирку был налит нитрат аммония, так как произошла реакция взаимодействия. Соли аммония под воздействием щелочи разложились до аммиака (летучее газообразное вещество, имеющее запах мочевины).
Возьмите вторую пробирку и нитрат серебра. Добавьте нитрат в пробирку с веществом, которое необходимо определить и немного взболтайте его.
Установите пробирку на держатель и наблюдайте за химической реакцией. Так как в состав нитрата аммония входят хлорид-ионы, то при взаимодействии с добавленным раствором нитрата серебра выпадет белый осадок, похожий по своему виду на мыльный раствор, то есть выпадет осадок хлорида серебра. Если такой осадок появился и цвет в пробирке стал насыщенно-белым, значит вещество, которое предлагалось для эксперимента – нитрат аммония.
Кроме указанных двух способов, аммоний также можно определить путем добавления и нагревания в последующем концентрированной щелочи. При таком раскладе аммоний также будет выделять резкий запах – аммиак.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Химическое вещество нитрат аммония, формула которого NH4NO3, довольно давно известно химикам, еще в 1659 году его открыл И. Р. Глаубером. В литературе распространено еще одно название этого соединения — аммиачная селитра. Внешне аммония нитрат представляет собой кристаллы белого цвета, обладающие высокой гигроскопичностью. Температура кипения соединения равна 235°С, а при 169,6°С нитрат аммония начинает плавиться. Существует несколько кристаллических модификаций, которые довольно существенно влияют на химические, физические свойства и сферы его применения.
Например, эти отличия заключаются в том, что разные модификации кристаллов имеют различный вид решетки. Всего таких модификаций насчитывается пять. Для 1-ой модификации характерна кубическая форма кристаллической решетки, для 2-ой и 5-ой – тетрагоническая, для 3-й и 4-й – ромбическая. При этом в результате переходов соединения из одной модификации в другую обнаруживается постепенное, но устойчивое увеличение объема элементарной ячейки. Это свойство обусловливает различие в химических свойствах. Так, к примеру, модификация IV характеризуется плотностью вещества 1,725 г/см3, температура плавления составляет уже 139,4С°.
Растворимость аммония нитрата такова: в ста граммах воды при температуре 0°С растворяется 119 граммов вещества, при температуре в 25°С растворяется уже 212 граммов, а при 50°С – 346 граммов аммония нитрата. Кроме того, нитрат аммония может растворяться в пиридине, метаноле и этаноле. Очень важной характеристикой соединения выступает то, что при действии удара или же при достижении температуры окружающей среды свыше 270°С, аммония нитрат разлагается, вызывая взрывной эффект.
С помощью индикаторов можно определить кислую среду, которую заключает в себе нитрат аммония, гидролиз с его участием представляет собой реакцию, уравнение которой можно записать как: NH4NO3 + H2O = NH4OH + HNO3. Аммиачная селитра вступает в реакции со щелочными растворами. В результате таких реакций образуется аммиак, а сам процесс реакции выступает как качественная реакция на нитрат аммония.
Как правило, вещество получают путем проведения реакции нейтрализации 60%-ной HNO3. В качестве нейтрализующего вещества используется NH3 в газообразном состоянии. В процессе выделяется тепло, которое направляется на упаривание раствора аммония нитрата и получение вещества в виде гранул.
Наиболее распространенное использование нитрат аммония получил в сельском хозяйстве, в качестве ценного азотного удобрения. Соединение активно применяют и в производстве взрывчатых веществ, а как реагент – в качестве растворителя циркония в твэлах, во время проведения операций по регенерации ядерных отходов. Физико-химические свойства обуславливают постоянное повышение востребованности в веществе, поэтому его производство неуклонно растет и на сегодняшний день достигает 20 миллионов тонн в год, при перерасчете вещества на долю азота.
Аммиачную селитру можно получить в лабораторных условиях при соблюдении строжайших мер предосторожности и правил безопасности. Для этого в ледяной бане производят смешивание сильно разбавленной азотной кислоты и нашатырного спирта (водным раствором аммиака). Проводить такую реакцию лучше всего дистанционно, например, с применением манипуляторов, и находясь на достаточно безопасном расстоянии от места расположения смешиваемого раствора. Проведение реакции состоит в постоянном подмешивании кислоты в растворе аммиака при периодической проверке индикатором (лакмусовой бумажкой) достижения состояния нейтральной реакции. Таким же способом обеспечивается и контроль над течением реакции. При превышении кислотной среды – в раствор добавляют щелочной компонент, и наоборот.
У вас имеется два пакета с веществами: Нитрат аммония и нитрат натрия. Как определить, в каком пакете находится нитрат аммония?
Найди верный ответ на вопрос ✅ «У вас имеется два пакета с веществами: Нитрат аммония и нитрат натрия. Как определить, в каком пакете находится нитрат аммония? …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » У вас имеется два пакета с веществами: Нитрат аммония и нитрат натрия. Как определить, в каком пакете находится нитрат аммония?