Физические свойства
Нитрат натрия NaNO3 — соль щелочного металла натрия и азотной кислоты. Белое вещество, весьма гигроскопичное, которое плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 84,99; относительная плотность для тв. и ж. состояния d = 2,266; tпл = 306,5º C;
Способ получения
1. Нитрат натрия можно получить путем взаимодействия гидроксида натрия и разбавленной азотной кислоты, образуется нитрат натрия и вода:
NaOH + HNO3 = NaNO3 + H2O
2. В результате взаимодействия горячего гидроксида натрия, оксида азота (IV) и кислорода образуется нитрат натрия и вода:
4NaOH + 4NO2 + O2 = 4NaNO3 + 2H2O
3. В результате реакции между горячим гидроксидом натрия, оксидом натрия (IV) и кислородом, происходит образование нитрата натрия и воды:
4NO2 + O2 + 4NaOH = 4NaNO3 + 2H2O
4. При комнатной температуре, в результате взаимодействия оксида азота (IV) и натрия образуется нитрат натрия и газ оксид азота (II):
2NO2 + Na = NO↑ + NaNO3
5. При смешивании горячего пероксида водорода и нитрита азота происходит образование нитрата натрия и воды:
NaNO2 + H2O2 = NaNO3 + H2O
Качественная реакция
Качественная реакция на нитрат натрия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат натрия образует сульфат натрия, нитрат меди, газ оксид азота и воду:
NaNO3 + H2SO4 + Cu = Na2SO4 + Cu(NO3)2 + NO2↑ + H2O
Химические свойства
1. Hитрат натрия разлагается при температуре 380–500º С с образованием нитрита натрия и кислорода:
2NaNO3 = 2NaNO2 + O2
2. Нитрат натрия может реагировать с простыми веществами:
2.1. Нитрат натрия реагирует со свинцом при температуре выше 350 ºС. При этом образуется нитрит натрия и оксид свинца:
NaNO3 + Pb = NaNO2 + PbO
2.2. Нитрат натрия реагирует при комнатной температуре с цинком и разбавленной хлороводородной кислотой с образованием нитрита натрия и воды:
NaNO3 + Zn + 2HCl = NaNO2 + ZnCl2 + H2O,
NaNO3 это соль, металла натрия и азотной кислоты. Еще это соединение называют натриевая селитра. Нитрат натрия хорошо растворяется в воде. Один из способов определить нитрат натрия это провести качественную реакцию. Так как ионное уравнение этого вещества нитрата натрия можно представить в таком виде: Na⁺ + NO₃ — то качественную реакцию надо проводить в присутствии этих ионов.
Натрий можно определить, путем окрашивания пламени. Если соль содержит ионы натрия, то пламя окрасится в ярко — желтый цвет.
Теперь нам надо определить присутствие нитрат ионов. Для этого нам потребуется медь, как катализатор. Проводим реакцию, к нитрату натрия добавляем серную кислоту и медь.
NaNO3 + Cu + H₂SO₄ = NO₂ + СuSO₄ + H₂O
В результате реакции выделяется газ, оксид азота, он имеет характерный бурый цвет. Сам раствор который содержит сульфат меди и воду окрашивается в голубой цвет. Это и есть показатели присутствия в растворе нитрата натрия.
Как распознать нитрат натрия
Нитрат натрия представляет собой хорошо растворимую в воде среднюю соль, которая состоит из атомов металла – натрия и кислотного остатка – нитрата. Иное название – натриевая селитра, азотнокислый натрий или натриевая соль азотной кислоты. В твердом виде это бесцветные кристаллы, которые в совокупности дают вещество белого цвета. Азотнокислый натрий можно распознать с помощью качественных реакций.

Вам понадобится
- — Нитрат натрия;
- — концентрированная серная кислота;
- — медные стружки;
- — горелка;
- — пробирка или колба;
- — ложечка для нагревания.
Инструкция
Нитрат натрия – это сложное вещество, в растворе которого находятся ионы натрия и нитрат-ионы. Следовательно, качественные реакции должны последовательно проводиться на присутствие именно этих ионов.
Качественная реакция на ионы натрия. Единственный способ определить натрий – это провести окрашивание пламени. Для этого зажгите спиртовку, поместите в специальную ложечку несколько кристалликов нитрата натрия и внесите в пламя, которое сразу примет окраску ярко-желтого цвета.
Можно опыт несколько видоизменить. Для этого возьмите бумагу (можно фильтровальную), пропитайте ее раствором нитрата натрия и высушите. Для усиления дальнейшего эффекта можно проделать эти манипуляции несколько раз. Затем внесите в пламя горелки кусочки бумаги, в результате чего пламя также приобретет красивую желтую окраску. Это происходит за счет ионов натрия.
Качественная реакция на нитрат-ионы. Реагентом на нитрат является медь. Для этого сначала в пробирку или в колбу с нитратом натрия добавьте концентрированную серную кислоту, а затем осторожно опустите медные стружки или нарезанную на кусочки медную проволоку. В результате химического взаимодействия образуется сразу несколько продуктов реакции, одним из которых является газообразное вещество — оксид азота (IV). Иначе оно называется бурый газ или «лисий хвост» (такое название получил за окраску). Появление бурого газа как раз свидетельствует о присутствии в растворе нитрат-ионов. Сам раствор приобретет голубую окраску.
Во время проведения опытов обязательно соблюдайте правила техники безопасности, так как все вещества, как реагенты, так и продукты реакции, являются особенно опасными. Бурый газ – это чрезмерно ядовитое соединение, которое может вызвать отравление, а потому опыт необходимо проводить только под тягой (в вытяжном шкафу). Концентрированная серная кислота обладает водоотнимающим действием, поэтому при попадании на кожу рук может вызвать сильный ожог. Также опасен этот реагент и для одежды, которую необходимо защитить халатом.
Источники:
- Скачать Натриевая селитра ГОСТ 828
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Формула нитрата натрия
Определение и формула нитрата натрия
Плавится без разложения, но разлагается при дальнейшем нагревании. Хорошо растворяется в воде (не гидролизуется). Кристаллогидратов не образует. Практически не растворяется в концентрированной азотной кислоте. Сильный окислитель при спекании.
Рис. 1. Нитрат натрия. Внешний вид.
Химическая формула нитрата натрия
Химическая формула нитрата натрия NaNO3. Химическая формула показывает качественные и количественный состав молекулы (сколько и каких атомов присутствует в ней). По химической формуле можно вычислить молекулярную массу вещества (Ar(Na) =23а.е.м., Ar(N) = 14 а.е.м., Ar(O) = 16 а.е.м.):
Mr(NaNO3) = Ar(Na) + Ar(N) + 3×Ar(O);
Mr(NaNO3) = 23 + 14 + 3×16 = 23 + 14 + 48 = 85.
Структурная (графическая) формула нитрата натрия
Структурная (графическая) формула вещества является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы. Ниже представлена графическая формула нитрата натрия:
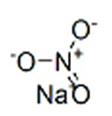
Ионная формула
Нитрат натрия электролит, поэтому он способен диссоциировать в водном растворе на ионы согласно следующему уравнению:
NaNO3 ↔ Na+ + NO3—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
Нитрат натрия: способы получения и химические свойства
Нитрат натрия NaNO3 — соль щелочного металла натрия и азотной кислоты. Белое вещество, весьма гигроскопичное, которое плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 84,99; относительная плотность для тв. и ж. состояния d = 2,266; tпл = 306,5º C;
Способ получения
1. Нитрат натрия можно получить путем взаимодействия гидроксида натрия и разбавленной азотной кислоты, образуется нитрат натрия и вода:
2. В результате взаимодействия горячего гидроксида натрия, оксида азота (IV) и кислорода образуется нитрат натрия и вода:
3. В результате реакции между горячим гидроксидом натрия, оксидом натрия (IV) и кислородом, происходит образование нитрата натрия и воды:
4. При комнатной температуре, в результате взаимодействия оксида азота (IV) и натрия образуется нитрат натрия и газ оксид азота (II):
2NO2 + Na = NO↑ + NaNO3
5. При смешивании горячего пероксида водорода и нитрита азота происходит образование нитрата натрия и воды:
Качественная реакция
Качественная реакция на нитрат натрия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат натрия образует сульфат натрия, нитрат меди, газ оксид азота и воду:
Химические свойства
1. Hитрат натрия разлагается при температуре 380–500º С с образованием нитрита натрия и кислорода:
2. Н итрат натрия может реагировать с простыми веществами :
2.1. Н итрат натрия реагирует со свинцом при температуре выше 350 ºС . При этом образуется нитрит натрия и оксид свинца:
NaNO3 + Pb = NaNO2 + PbO
2.2. Нитрат натрия реагирует при комнатной температуре с цинком и разбавленной хлороводородной кислотой с образованием нитрита натрия и воды:
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6df7d75a3c358741 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Как определить нитрат натрия уравнение
Распознавание растворов фосфата натрия, нитрата аммония и нитрата натрия (практическая работа).
В пронумерованных колбах растворы фосфата натрия Na 3 PO 4 , нитрата аммония NH 4 NO 3 и нитрата натрия NaNO 3 . Отбираем пробы растворов. Лакмусовая бумажка должна стать красной в растворе нитрата аммония. Соль сильной кислоты и слабого основания ‑ нитрат аммония ‑ гидролизуется с образованием кислоты. В колбе номер два – нитрат аммония. Раствор нитрата серебра AgNO 3 поможет определить, в какой из оставшихся двух пробирок находится фосфат натрия. Нитрат серебра с фосфатом натрия образует желтый нерастворимый фосфат серебра.
В колбе номер три – фосфат натрия. Осталось убедиться в том, что в колбе номер один – нитрат натрия. К пробе раствора из этой колбы добавляем немного концентрированной серной кислоты, кусочек медной стружки и нагреваем. Образуется голубой раствор нитрата меди и выделяется бурый диоксид азота.
В колбе номер один ‑ действительно нитрат натрия.
Оборудование: пробирки, штатив для пробирок, колбы, держатель для пробирок, лакмусовая бумага.
Техника безопасности . Соблюдать правила работы с кислотами, раствором нитрата серебра. Особо осторожно обращаться с концентрированной серной кислотой. Не вдыхать выделяющиеся оксиды азота.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
http://gomolog.ru/reshebniki/9-klass/kuznecova-2019/29/6.html
http://files.school-collection.edu.ru/dlrstore/a27e010d-d459-86f0-18c2-4468604c5c66/index.htm

