| Нитрат железа (III) | |
|---|---|
| Систематическое наименование |
Нитрат железа (III) |
| Хим. формула | Fe(NO3)3 |
| Состояние | гигроскопичные кристаллы |
| Молярная масса |
(ангидрид) 241,86 г/моль (гексагидрат) 349,951 г/моль (нонагидрат) 403,997 г/моль |
| Плотность |
(гексагидрат) 1,68 г/см3 (нонагидрат) 1,81 (1,29) г/см3 г/см³ |
| Температура | |
| • разложения |
(гексагидрат) 35°C (нонагидрат) 47,2 °C |
| Энтальпия | |
| • образования | (нонагидрат) -3338,8 кДж/моль |
| Растворимость | |
| • в воде(0°C) | 40,2% |
| • в воде (20°C) | 45,2% |
| • в воде (25°C) | 46,6% |
| • в воде (40°C) | 51,2% |
| Координационная геометрия | октаэдрическая |
| Рег. номер CAS |
10421-48-4 (ангидрид) 13476-08-9 (гексагидрат) 7782-61-8 (нонагидрат) |
| PubChem | 168014 |
| Рег. номер EINECS | 233-899-5 |
| SMILES |
[Fe+3].O.O.O.O.O.O.O.O.O.O=[N+]([O-])[O-].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
1S/C9H12O4S/c1-3-13-14(10,11)9-6-4-8(12-2)5-7-9/h4-7H,3H2,1-2H3 LPOCJNUBBCMEGA-UHFFFAOYSA-N |
| RTECS | NO7175000 |
| ChemSpider | 23584 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Нитрат железа (III) — неорганическое химическое соединение, соль азотной кислоты и трехвалентного железа.
Физические свойства
При обычной температуре в зависимости от концентрации и содержания в растворе кислоты нитрат железа (III) кристаллизуется в виде почти бесцветных кубиков, имеющих состав Fe(NO3)3·6H2O, или в моноклинных кристаллах состава Fe(NO3)3·9H2O.
Гексагидрат нитрата железа (III) Fe(NO3)3·6H2O — светло-фиолетовые гигроскопичные кристаллы с кубической решёткой. Образуется при кристаллизации из водных растворов с содержанием HNO3 не менее 57 % и 28 % Fe(NO3)3.
Нонагидрат нитрата железа (III) Fe(NO3)3·9H2O — очень гигроскопичные светло-фиолетовые кристаллы с моноклинной решёткой (a = 0,140 нм, b = 0,970 нм, c = 1,103 нм, β=95,52°, пространственная группа P21/с). Хорошо растворяются в воде. При нагревании плавится при 50,1 °C. Процесс сопровождается частичным разложением исходного продукта с выделением HNO3 и последующим кипячением раствора при 125 °C.
Таблица растворимости нитрата железа (III) в воде (в пересчете на безводную соль):
| Температура, °С | Концентрация, г/100 г воды | Концентрация, % |
| 0 | 67,08 | 40,15 |
| 20 | 82,48 | 45,2 |
| 40 | 104,83 | 51,18 |
Растворяется также в ацетоне, эфире, этаноле.
Безводный нитрат железа (III) получить не удалось.
В растворе бледно-фиолетовый гексааквакатион [Fe(H2O)6]3+ преобладает только в том случае, если pH~0. При более высоких значениях pH раствор желтеет из-за гидролиза, а если pH выше 2-3, происходит дальнейшая конденсация и начинается образование коллоидных гелей, и в конечном итоге образуется красновато-коричневый осадок гидратированного оксида железа (III).
Получение
- Нитрат железа (III) получают взаимодействием железной стружки с 20-30 % раствором азотной кислоты:
- Fe + 4HNO3 ⟶ Fe(NO3)3 + 2H2O + NO↑
- В производстве этот процесс проводят, продувая через раствор воздух:
- 4Fe + 12HNO3 + 3O2 ⟶ 4Fe(NO3)3 + 6H2O
- В лабораторной практике нитрат железа (III) можно получить обменной реакцией:
- Fe2(SO4)3 + 3Ba(NO3)2 ⟶ 2Fe(NO3)3 + 3BaSO4↓
- Добавив к гидроксонитрату церия (IV) азотную кислоту и сульфат железа (II), получим следующие продукты реакции:
- Ce(NO3)3OH + 3HNO3 + FeSO4 ⟶ Ce(NO3)3 + Fe(NO3)3 + H2SO4 + H2O
Химические свойства
- В водных растворах нитрат железа (III) подвергается сильному гидролизу:
- Fe(NO3)3 + 2H2O ⇄ Fe(OH)2NO3 + 2HNO3
Равновесие можно сместить в обратную сторону сильно подкислив раствор HNO3.
- Разрушается разбавленными щелочами:
- 2Fe(NO3)3 + 6NaOH +(n−6)H2O ⟶ Fe2O3 ⋅ nH2O↓ + 6NaNO3
- При нагревании разлагается:
- 4Fe(NO3)3 →t 2Fe2O3 + 12NO2↑ + 3O2↑
— Выступает в роли окислителя с металлами, например, с медью:
9Cu + 8Fe(NO3)3 = 9Cu(NO3)2 + 6NO + 4Fe2O3
Применение
- Применяется как коагулянт при очистке сточных вод.
- При окраске тканей и шерсти используют нитрат железа (III) как протраву.
- Нитрат железа(III) является катализатором для синтеза амида натрия из раствора натрия в аммиаке:
-
- 2NH3 + 2Na →Fe(NO3)3 2NaNH2 + H2
- Некоторые глины, пропитанные нитратом железа (III), являются полезными окислителями в органическом синтезе.
- Используется ювелирами и кузнецами для протравки серебра и его сплавов.
Iron (III) nitrate is also referred to as ferric nitrate or iron trinitrate, whose chemical (or) the molecular formula is Fe(NO3)3 (or) FeN3O9. It is an inorganic compound that appears as a violet crystalline solid. Nonahydrate is the most common hydrate form, with the chemical formula Fe(NO3)3.(H2O)9. It is completely soluble in water, alcohol, and acetone, and is slightly soluble in cold concentrated nitric acid. It is a strong oxidant and a non-combustible chemical compound. Though it is non-flammable, it will increase the intensity of a fire if it comes in contact with combustible materials. The solutions of Ferric Nitrate are corrosive to most metals. It is used as a mordant in dyeing, weighting silks, tanning, and inhibiting corrosion, as well as a fertilizer and food additive.
Structure of Iron (III) Nitrate
The chemical or chemical (or) molecular formula of Iron (III) nitrate is Fe(NO3)3 (or) FeN3O9.
Iron Nitrate (III) Formula
Preparation of Iron (III) Nitrate
- Iron (III) nitrate can also be prepared by treating hematite (Fe2O3) with nitric acid.
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
- The action of nitric acid on iron metal powder can produce iron(III) nitrate.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Properties of Iron (III) Nitrate
| Chemical formula | Fe(NO3)3 (or) FeN3O9 |
|---|---|
| IUPAC Name | Iron(III) nitrate |
| Other Chemical Names | Ferric nitrate, Nitric acid, Iron(3+) salt, Iron trinitrate |
| Appearance | Pale violet crystals |
| Molecular weight | 241.857 g/mol (Anhydrous) 403.999 g/mol (nonahydrate) |
| Density | 1.68 g/cm3 (hexahydrate) 1.6429 g/cm3(nonahydrate) |
| Melting point | 47.2 °C |
| Boiling point | 125 °C |
| Solubility |
Soluble in water, alcohol, and acetone. Slightly soluble in cold concentrated nitric acid. |
Chemical Properties of Iron (III) Nitrate
- When iron(III) nitrate is dissolved, it forms a yellow solution because of hydrolysis.
- Iron(III) oxide, nitrogen dioxide, and oxygen are formed during the thermal decomposition of iron(III) nitrate.
4Fe(NO3)3 → 2Fe2O3 + 12NO2 + 3O2
- When it is dissolved in molten stearic acid, the compound decomposes at about 120° C to form iron(III) oxide-hydroxide FeO(OH).
- When it is heated to a temperature that is close to boiling, nitric acid will evaporate from the solution, and all of the iron will precipitate as iron(III) oxide (Fe2O3).
- Iron (III) nitrate reacts with sodium hydroxide (NaOH) to produce sodium nitrate (NaNO3) and iron (III) hydroxide Fe(OH)3.
3NaOH + Fe(NO3)3 → 3NaNO3 + Fe(OH)3
- Iron (III) nitrate reacts with copper to form copper(II) nitrate (Cu(NO3)2) and ferrous nitrate (Fe(NO3)2).
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Uses of Iron (III) Nitrate
- As iron (III) nitrate has no large-scale applications, it acts as a catalyst in the production of sodium amide from a solution of sodium in ammonia.
2NH3 + 2Na → 2NaNH2 + H2
- Jewellers and metalworkers etch silver and silver alloys with the help of iron (III) nitrate solutions.
- In organic synthesis, certain clays impregnated with iron (III) nitrate are useful as oxidants.
- It is used as a mordant in dyeing, weighting silks, tanning, and inhibiting corrosion, and as a fertilizer and food additive.
- It is also used as a reagent in analytical chemistry.
Hazards
- The inhalation of ferric nitrate dust irritates the nose and throat.
- Ingestion of iron (III) Nitrate may irritate the mouth and stomach.
- Prolonged contact with it may irritate the skin and also irritate the eyes. Chronic exposure may affect the liver.
- It is a strong oxidant, and there is a possibility of a dangerous fire as it comes into contact with organic material. Toxic nitrogen oxides and nitric acid vapour may form in fires.
FAQs on Iron (III) Nitrate Formula
Question 1: What is the chemical formula of iron (III) nitrate?
Answer:
Iron (III) nitrate is also referred to as ferric nitrate or iron trinitrate, whose chemical (or) the molecular formula is Fe(NO3)3 (or) FeN3O9. It is an inorganic compound that appears as a violet crystalline solid. Nonahydrate is the most common hydrate form, with the chemical formula Fe(NO3)3. (H2O)9.
Question 2: How is iron (III) nitrate prepared?
Answer:
- Iron (III) nitrate can also be prepared by treating hematite (Fe2O3) with nitric acid.
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
- The action of nitric acid on iron metal powder can produce iron(III) nitrate.
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Question 3: What are the applications of iron (III) nitrate?
Answer:
As iron (III) nitrate has no large-scale applications, it acts as a catalyst in the production of sodium amide from a solution of sodium in ammonia. Jewelers and metalworkers etch silver and silver alloys with the help of iron (III) nitrate solutions. It is used as a mordant in dyeing, weighting silks, tanning, and inhibiting corrosion, and also as a reagent in analytical chemistry.
Question 4: Mention some properties of iron (III) nitrate.
Answer:
Iron (III) nitrate is also referred to as ferric nitrate or iron trinitrate, whose molecular formula is FeN3O9. It appears as a violet crystalline solid and is completely soluble in water, alcohol, and acetone, and is slightly soluble in cold concentrated nitric acid. Though it is non-flammable, it will increase the intensity of a fire if it comes in contact with combustible materials. Its melting point is 47.2 °C whereas its boiling point is 125 °C.
Question 5: Mention some hazards of iron (III) nitrate.
Answer:
The inhalation of ferric nitrate dust irritates the nose and throat. Ingestion of iron (III) Nitrate may irritate the mouth and stomach. Prolonged contact with it may irritate the skin and also irritate the eyes. Chronic exposure may affect the liver. It is a strong oxidant, and there is a possibility of a dangerous fire as it comes into contact with organic material. Toxic nitrogen oxides and nitric acid vapor may form in fires.
Question 6: What happens when iron (III) nitrate reacts with copper?
Answer:
Iron (III) nitrate reacts with copper to form copper(II) nitrate (Cu(NO3)2) and ferrous nitrate (Fe(NO3)2).
Cu + 2Fe(NO3)3 → Cu(NO3)2 + 2Fe(NO3)2
Last Updated :
12 Oct, 2022
Like Article
Save Article
Определение и формула нитрата железа 3
Сильногигроскопичное, поэтому существующее только в форме кристаллогидратов состава Fe(NO3)3×6H2O и Fe(NO3)3×9H2O. В первом случае – это бесцветные кристаллы с кубической решеткой, во втором – светло-фиолетовые с моноклинной.
Рис. 1. Нитрат железа (III). Внешний вид.
Нитрат железа (III) хорошо растворяется в воде. При нагревании плавится с разложением.
Химическая формула нитрата железа 3
Химическая формула нитрата железа (III) Fe(NO3)3. Она показывает, что в состав данной молекулы входят один атом железа (Ar = 56 а.е.м.), три атома азота (Ar = 14 а.е.м.) и девять атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу нитрата железа (III):
Mr(Fe(NO3)3) = Ar(Fe) + 3×Ar(N) + 9×Ar(O);
Mr(Fe(NO3)3) = 56 + 3×14 + 9×16 = 56 + 42 + 144 = 242.
Графическая (структурная) формула нитрата железа 3
Структурная (графическая) формула нитрата железа (III) является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
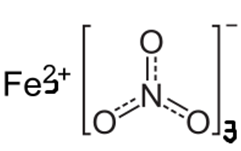
Ионная формула
Нитрат железа (III) является электролитом, т.е. в водном растворе диссоциирует на ионы согласно следующему уравнению:
Fe(NO3)3 ↔ Fe3+ + 3NO3—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |
 |
|
| Имена | |
|---|---|
| Название IUPAC Железо (III) нитрат | |
| Другие названия Нитрат железа. Азотная кислота, соль железа (3+) | |
| Идентификаторы | |
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.030.805 |
| PubChem CID |
|
| номер RTECS |
|
| UNII |
|
| Панель управления CompTox (EPA ) |
|
InChI
|
|
УЛЫБКА
|
|
| Свойства | |
| Химическая формула | Fe (NO 3)3 |
| Молярный масса | 403,999 г / моль (нонагидрат). 241,86 г / моль (безводный) |
| Внешний вид | Бледный v желтые кристаллы. гигроскопичные |
| Плотность | 1,68 г / см (гексагидрат). 1,6429 г / см (нонагидрат) |
| Температура плавления | 47,2 ° C (117,0 ° F; 320,3 K) (нонагидрат) |
| Температура кипения | 125 ° C (257 ° F; 398 K) (нонагидрат) |
| Растворимость в воде | 150 г / 100 мл (гексагидрат) |
| Растворимость | растворим в спирте, ацетоне |
| Магнитная восприимчивость (χ) | + 15,200,0 · 10 см / моль |
| Структура | |
| Координационная геометрия | октаэдрическая |
| Опасности | |
| Паспорт безопасности | Внешний SDS |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Предупреждение |
| Указания на опасность GHS | H272, H302, H319 |
| Меры предосторожности GHS | P210, P220, P221, P264, P270, P280, P301 + 312, P305 + 351 + 338, P330, P337 + 313, P370 + 378, P501 |
| NFPA 704 (огненный алмаз) |  0 1 0 OX 0 1 0 OX |
| Температура вспышки | негорючий |
| NIOSH (Пределы воздействия на здоровье в США): | |
| REL (рекомендуется) | TWA 1 мг / м |
| Родственные соединения | |
| Родственные соединения | Хлорид железа (III). Железо (III) сульфат |
| За исключением других Как отмечено выше, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Нитрат железа (III), или нитрат железа, представляет собой химическое соединение с формулой Fe (NO 3)3.
Содержание
- 1 Гидраты
- 2 Химические свойства
- 2.1 Разложение
- 3 Подготовка
- 4 Применение
- 4.1 В химической лаборатории
- 4.2 Другие области применения
- 5 Ссылки
Гидраты
Нитрат железа (III) расплывается и обычно встречается как нонагидрат Fe (NO 3)3·9H2O, который образует кристаллы от бесцветных до бледно-фиолетовых.
Другие гидраты Fe (NO. 3). 3· xH. 2O, включают:
- тетрагидрат (x = 4), точнее моногидрат нитрата триаквадинитратоирон (III), [Fe (NO. 3). 2(H. 2O). 3] [NO. 3] · H. 2O, имеет комплексные катионы, где атом Fe. координирован с двумя нитрат-анионами в качестве бидентатных лигандов и тремя из четырех молекул воды в конфигурация пентагональной бипирамиды с двумя молекулами воды на полюсах.
- пентагидрат (x = 5), точнее динитрат пента-акванитрата железа (III), [Fe (NO. 3) (H. 2O). 5]) [NO. 3]. 2, в котором атом Fe. координирован с пятью молекулами воды и однодентатным нитрат-анионным лигандом в октаэдрической конфигурации.
- гексагидрат (x = 6), точнее тринитрат гексаакваирона (III), [Fe (H. 2O). 6] [NO. 3]. 3, где атом Fe. координирован с шестью молекулами воды в октаэдрической конфигурации.
Химические свойства
Разложение
Когда растворенный нитрат железа (III) образует желтый раствор в результате гидролиза. При нагревании почти до кипения азотная кислота будет испаряться из раствора, и все железо будет выпадать в осадок в виде оксида железа (III) Fe. 2O. 3.
. Соединение растворяется в расплавленной стеариновой кислоте и разлагается примерно при 120 ° C с образованием оксида железа (III) — гидроксид FeO (OH).
Получение
Соединение может быть получено обработкой металлического порошка железа азотной кислотой.
- Fe + 4 HNO 3 → Fe (NO 3)3+ NO + 2 H 2O.
Применения
В химической лаборатории
Нитрат железа является предпочтительным катализатором для синтеза амида натрия из раствора натрия в аммиаке :
- 2 NH 3 + 2 Na → 2 NaNH 2 + H 2
Определенные глины, пропитанные нитратом железа (III), оказались полезными окислителями в органическом синтезе. Например, нитрат железа на монтмориллоните — реагент под названием «Клейфен » — использовался для окисления спиртов до альдегиды и тиолы до дисульфиды.
Другие применения
Растворы нитрата железа используются ювелирами и мастерами по металлу для травления серебра и серебряных сплавов.
Ссылки
- ^«Нонагидрат нитрата железа (III)». Американские элементы. Проверено 20 июня 2019 г.
- ^Карманный справочник NIOSH по химической опасности. «# 0346». Национальный институт профессиональной безопасности и здоровья (NIOSH).
- ^Информационная база данных по химической классификации HSNO, Управление по управлению экологическими рисками Новой Зеландии, получено 19 сентября 2010 г..
- ^ H. Schmidt, A. Asztalos, F. Bok и W. Voigt (2012): «Новые гидраты нитрата железа (III): Fe (NO. 3). 3· xH. 2O с x = 4, 5 и 6». Acta Crystallographica Раздел C — Неорганические соединения, том C68, страницы i29-i33. doi : 10.1107 / S0108270112015855
- ^Эгон Матиевич и Пол Шайнер (1978): «Золи закиси железа: III. однородные частицы гидролизом растворов хлорида, нитрата и перхлората Fe (III) «. Journal of Colloid and Interface Science, том 63, выпуск 3, страницы 509-524. doi : 10.1016 / S0021-9797 (78) 80011-3
- ^Дэн Ли, Сяохуэй Ван, Ганг Сюн, Люд Лу, Сюйцзе Ян и Синь Ван (1997): «Новый метод получения ультратонкого Fe. 2O. 3с помощью гидратированного железа ( III) нитрат ». Journal of Materials Science Letters, том 16, страницы 493–495 doi : 10.1023 / A: 1018528713566
- ^Hampton, KG Harris, TM; Hauser, CR (1973). «2,4-Нонандион». Органический синтез. CS1 maint: несколько имен: список авторов (ссылка ); Colle ctive Volume, 5, стр. 848 По состоянию на 2007 год еще 22 записи описывают аналогичные препараты в Organic Syntheses
- ^Cornélis, A. Laszlo, P.; Зеттлер, М. В. «Нитрат железа (III) — монтмориллонитовая глина K10» в Энциклопедии реагентов для органического синтеза (Эд: Л. Пакетт) 2004, J. Wiley Sons, Нью-Йорк. doi : 10.1002 / 047084289X.
- v
- t
Соли и ковалентные производные иона нитрат
| HNO 3 | He | ||||||||||||||||
| LiNO 3 | Be (NO 3)2 | B (NO. 3). 4 | RONO 2 | NO. 3. NH4NO3 | HOONO 2 | FNO 3 | Ne | ||||||||||
| NaNO 3 | Mg (NO 3)2 | Al (NO 3)3 | Si | P | S | ClONO 2 | Ar | ||||||||||
| KNO 3 | Ca (NO 3)2 | Sc (NO 3)3 | Ti (NO 3)4 | VO (NO 3)3 | Cr (NO 3)3 | Mn (NO 3)2 | . Fe (NO 3)3 | Co ( NO 3)2. Co (NO 3)3 | Ni (NO 3)2 | CuNO 3. Cu (NO 3)2 | Zn (NO 3)2 | Ga (NO 3)3 | Ge | As | Se | Br | Kr |
| RbNO 3 | Sr (NO 3)2 | Y (NO 3)3 | Zr (NO 3)4 | Nb | Mo | Tc | Pd (NO 3)2. | AgNO 3. | Cd (NO 3)2 | In | Sn | Te | I | Xe (NO 3)2 | |||
| CsNO 3 | Ba (NO 3)2 | Hf | Ta | W | Re | Os | Ir | . | Hg2(NO 3)2. Hg (NO 3)2 | . Tl (NO 3)3 | Pb (NO 3)2 | Bi (NO 3)3. BiO (NO 3) | At | Rn | |||
| Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||
| Ce (NO 3)3. Ce (NO 3)4 | Nd (NO 3)3 | Eu (NO 3)3 | Gd (NO 3)3 | Tb (NO 3)3 | |||||||||||||
| Th (NO 3)4 | UO2( НЕТ 3)2 | Bk | Cf | Es | Fm | Md | Нет | Lr |
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.




