Как определить тип оксида?
В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
1) несолеобразующие
2) основные
3) кислотные
4) амфотерные
Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
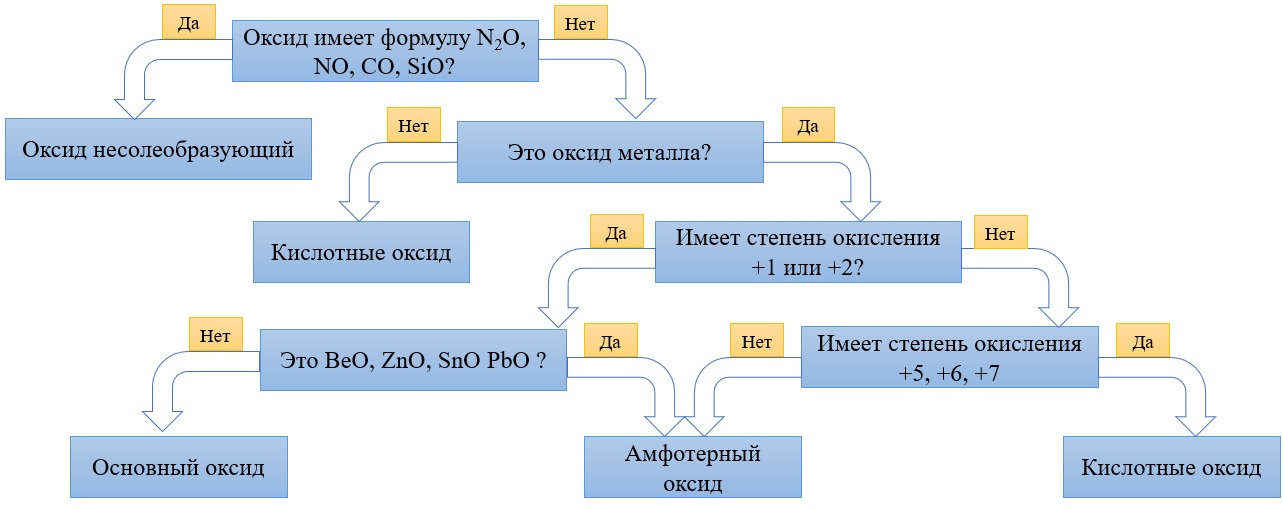
Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
|
Оксид неметалла |
Оксид металла |
|
1) Степень окисления неметалла +1 или +2 Вывод: оксид несолеобразующий Исключение: Cl2O не относится к несолеобразующим оксидам |
1) Степень окисления металла равна +1, +2 Вывод: оксид металла основный Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!! |
|
2) Степень окисления больше либо равна +3 Вывод: оксид кислотный Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1 |
2) Степень окисления металла +3, +4, Вывод: оксид амфотерный. Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов |
|
3) Степень окисления металла +5,+6,+7 Вывод: оксид кислотный. |
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь
Таблица оксидов.
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Таблица оксидов (1 часть):
| Атомный номер | Химический элемент | Символ | Оксиды |
| 1 | Водород | H | H2O (вода) |
| 2 | Гелий | He | нет |
| 3 | Литий | Li | Li2O (оксид лития) |
| 4 | Бериллий | Be | BeO (оксид бериллия) |
| 5 | Бор | B | B2O3 (оксид бора (III)) |
| 6 | Углерод | C | CO (оксид углерода (II), монооксид углерода, угарный газ),
CO2 (оксид углерода (IV), диоксид углерода, углекислый газ), C3O2 (диоксид триуглерода), (C3O2)n (политрикарбодиоксид), C5O2 (1,2,3,4-пентатетраен-1,5-дион), C6O6 (диангидрид этилентетракарбоновой кислоты) C12O9 (меллитовый ангидрид), C12O12 (гексагидроксибензол трисоксалат), и др. |
| 7 | Азот | N | N2O (оксид азота (I), закись азота, оксонитрид азота, веселящий газ),
NO (оксид азота (II), мон(о)оксид азота, окись азота, нитрозил-радикал), N2O3 (оксид азота (III), азотистый ангидрид, сесквиоксид азота), NO2 (диоксид азота, оксид азота (IV), двуокись азота), N2O5 (оксид азота (V), пентаоксид азота, пентаоксид диазота, нитрат нитрила, нитрат нитрония, азотный ангидрид), N2O4 (димер диоксида азота, тетраоксид диазота, азотный тетраоксид), и др. |
| 8 | Кислород | O | — |
| 9 | Фтор | F | нет |
| 10 | Неон | Ne | нет |
| 11 | Натрий | Na | Na2O (оксид натрия) |
| 12 | Магний | Mg | MgO (оксид магния) |
| 13 | Алюминий | Al | Al2O3 (оксид алюминия) |
| 14 | Кремний | Si | SiO (оксид кремния (II), монооксид кремния),
SiO2 (оксид кремния (IV), диоксид кремния, кремнезём) |
| 15 | Фосфор | P | P4O (монооксид тетрафосфора),
P4O2 (диоксид тетрафосфора), P2O3 или P4O6 (оксид фосфора (III), фосфористый ангидрид, гексаоксид тетрафосфора), P4O8 (оксид фосфора (IV), октаоксид тетрафосфора), P2O5 или P4O10 (оксид фосфора (V), пентаоксид фосфора, фосфористый ангидрид, гексаоксид тетрафосфора) |
| 16 | Сера | S | SO (оксид серы (II), монооксид серы, моноокись серы),
SO2 (оксид серы (IV), диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид), SO3 (оксид серы (VI), трёхокись серы, серный газ, ангидрид серной кислоты) |
| 17 | Хлор | Cl | Cl2O (оксид хлора (I), гемиоксид хлора, ангидрид хлорноватистой кислоты),
ClO2 (диоксид хлора, оксид хлора (IV), двуокись хлора), ClOClO3 (перхлорат хлора ), Cl2O6 (дихлоргексаоксид, оксид хлора (V, VII), перхлорат хлорила), Cl2O7 (оксид хлора (VII), дихлорогептаоксид, хлорный ангидрид), и др. |
| 18 | Аргон | Ar | нет |
| 19 | Калий | K | K2O (оксид калия) |
| 20 | Кальций | Ca | CaO (оксид кальция, окись кальция, негашёная известь, в просторечии — кирабит, кипелка) |
| 21 | Скандий | Sc | Sc2O3 (оксид скандия, сесквиоксид скандия) |
| 22 | Титан | Ti | TiO (оксид титана (II)),
Ti2O3 (оксид титана(III), трёхокись титана), TiO2 (оксид титана (IV), диоксид титана, двуокись титана, титановые белила) |
| 23 | Ванадий | V | VO (оксид ванадия (II), окись ванадия),
V2O3 (оксид ванадия (III), трехокись ванадия), VO2 (оксид ванадия (IV), диоксид ванадия, двуокись ванадия), V2O5 (оксид ванадия (V), пентаоксид диванадия) |
| 24 | Хром | Cr | CrO (оксид хрома (II), закись хрома),
Cr2O3 (оксид хрoма (III), сесквиоксид хрома, хромовая зелень, эсколаит), CrO2 (оксид хрома (IV), диоксид хрома, двуокись хрома), CrO3 (оксид хрома (VI), триоксид хрома, трёхокись хрома, хромовый ангидрид) |
| 25 | Марганец | Mn | MnO (оксид марганца (II), окись марганца, монооксид марганца),
Mn3O4 (оксид марганца (II,III), окисел марганца), Mn5O8 (оксид марганца (II,IV), окисел марганца), Mn2O3 (оксид марганца (III), окисел марганца), MnO2 (оксид марганца (IV), диоксид марганца), MnO3 (оксид марганца (VI), окисел марганца), Mn2O7 (оксид марганца (VII)) |
| 26 | Железо | Fe | FeO (оксид железа (II), закись железа),
Fe2O3 (оксид железа (III), окись железа, колькотар, крокус, железный сурик, гематит), Fe3O4 (оксид железа (II,III), закись-окись железа, железная окалина, магнетит, магнитный железняк), и др. |
| 27 | Кобальт | Co | CoO (оксид кобальта (II), окись кобальта),
Co3O4 (оксид кобальта (II,III), окись кобальта), Co2O3 (оксид кобальта (III), окись кобальта), CoO2•H2O (оксид кобальта (IV), гидрат оксида кобальта) |
| 28 | Никель | Ni | NiO (оксид никеля (II), окись никеля, бунзенит),
Ni2O3 (оксид никеля (III), окисел никеля; сесквиоксид никеля) |
| 29 | Медь | Cu | Cu2O (оксид меди (I), гемиоксид меди, оксид димеди, закись меди, куприт),
CuO (оксид меди (II), окись меди), Cu2O3 (оксид меди (III), триоксид димеди) |
| 30 | Цинк | Zn | ZnO (оксид цинка, окись цинка) |
| 31 | Галлий | Ga | Ga2O (оксид галлия (I), закись галлия, гемиоксид галлия),
Ga2O3 (оксид галлия (III)) |
| 32 | Германий | Ge | GeO (оксид германия (II), окись германия),
GeO2 (оксид германия (IV), диоксид германия, двуокись германия) |
| 33 | Мышьяк | As | As2O3 (оксид мышьяка (III), триоксид мышьяка),
As2O5 (оксид мышьяка (V), пентоксид мышьяка) |
| 34 | Селен | Se | SeO2 (оксид селена (IV), диоксид селена, двуокись селена, доунеит, селенолит),
SeO3 (оксид селена (VI), триоксид селена, селеновый ангидрид) |
| 35 | Бром | Br | Br2O (оксид брома, оксид брома (I), окись брома, ангидрид бромноватистой кислоты) |
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия),
Nb2O3 (оксид ниобия (III), окись ниобия), NbO2 (оксид ниобия (IV), окись ниобия), Nb2O5 (оксид ниобия (V), окись ниобия) |
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена),
MoO2 (оксид молибдена (IV), окись молибдена), Mo2O5 (оксид молибдена (V), окись молибдена), MoO3 (оксид молибдена (VI), триоксид молибдена, триоксомолибден, молибдит) |
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)),
Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения),
RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия),
Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия),
Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)),
Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)),
CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия),
InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись),
SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид),
Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты),
TeO3 (оксид теллура (VI), триоксид теллура, трёхокись теллура, ангидрид теллуровой кислоты), Te2O5, Te4O9 |
| 53 | Йод | I | I+12O (монооксид дийода),
I+2O (монооксид йода), I+4O2 (диоксид йода), I+3, +52O4 или I+3O(I+5O3) или (I+3, +5O2)2 (тетраоксид дийода, иодноватокислый йод), I+52O5 или O(IO2)2 (оксид йода (V), пентаоксид дийода, иодноватый ангидрид), I+3, +54O9 или I+3(I+5O3)3 или I+3(OI+5O2)3 (иодат йода (III), иодноватокислый йод, нонаоксид тетрайода) |
| 54 | Ксенон | Xe | XeO2 (оксид ксенона (IV), диоксид ксенона),
XeO3 (триоксид ксенона), XeO4 (тетраоксид ксенона) |
| 55 | Цезий | Cs | Cs2O (оксид цезия, окись цезия) |
| 56 | Барий | Ba | BaO (оксид бария, окись бария, безводный барит) |
| 57 | Лантан | La | La2O3 (оксид лантана (III), сесквиоксид лантана) |
| 58 | Церий | Ce | Ce2O3 (оксид церия (III)),
CeO2 (оксид церия (IV), диоксид церия, двуокись церия) |
| 59 | Празеодим | Pr | PrO (оксид празеодима (II), монооксид празеодима),
Pr2O3 (оксид празеодима (III), сесквиоксид празеодима), PrO2 (оксид празеодима (IV), окись празеодима), Pr6O11 (оксид празеодима (III, IV), ундекаоксид гексапразеодима) |
| 60 | Неодим | Nd | NdO (оксид неодима (II), окисел неодима),
Nd2O3 (оксид неодима (III), сесквиоксид неодима) |
| 61 | Прометий | Pm | Pm2O3 (оксид прометия (III), сесквиоксид прометия) |
| 62 | Самарий | Sm | SmO (оксид самария (II), монооксид самария, окись самария),
Sm2O3 (оксид самария (III), сесквиоксид самария, окись самария) |
| 63 | Европий | Eu | EuO (оксид европия (II), монооксид европия, окись европия),
Eu3O4 или или EuO•Eu2O3 (оксид европия (II,III)), Eu2O3 (оксид европия (III)) |
| 64 | Гадолиний | Gd | Gd2O3 (оксид гадолиния (III), окись гадолиния) |
| 65 | Тербий | Tb | Tb2O3 (оксид тербия (III), трехокись тербия, триоксид тербия),
Tb4O7 (оксид тербия (III, IV), гептаоксид тетратербия), TbO2 (оксид тербия (IV), диоксид тербия), Tb6O11 |
| 66 | Диспрозий | Dy | Dy2O3 (оксид диспрозия (III), окись диспрозия, триоксид диспрозия) |
| 67 | Гольмий | Ho | Ho2O3 (оксид гольмия (III), окись гольмия) |
| 68 | Эрбий | Er | Er2O3 (оксид эрбия (III), окись эрбия, триоксид эрбия) |
| 69 | Тулий | Tm | Tm2O3 (оксид тулия (III), сесквиоксид тулия) |
| 70 | Иттербий | Yb | Yb2O3 (оксид иттербия (III), окись иттербия , сесквиоксид иттербия) |
Таблица оксидов (3 часть):
| 71 | Лютеций | Lu | Lu2O3 (оксид лютеция (III), окисел лютеция) |
| 72 | Гафний | Hf | HfO2 (оксид гафния (IV), окись гафния) |
| 73 | Тантал | Ta | Ta2O (оксид тантала (I), закись тантала),
TaO (оксид тантала (II), окись тантала), TaO2 (оксид тантала (IV), окись тантала), Ta2O5 (оксид тантала (V), окись тантала, пентаоксид тантала) |
| 74 | Вольфрам | W | WO2 (оксид вольфрама (IV), окись вольфрама, двуокись вольфрама, диоксид вольфрама),
WO3 (оксид вольфрама (VI), триоксид вольфрама, трёхокись вольфрама, вольфрамовый ангидрид, ангидрид вольфрамовой кислоты) |
| 75 | Рений | Re | Re2O (оксид рения (I), окись рения),
ReO (оксид рения (II), окись рения), Re2O3 (оксид рения (III), окисел рения), ReO2 (оксид рения (IV), окись рения (IV)), Re2O5 (оксид рения (V), окисел рения), ReO3 (оксид рения (VI), окись рения (VI)), Re2O7 (оксид рения (VII), окись рения (VII), рениевый ангидрид) |
| 76 | Осмий | Os | |
| 77 | Иридий | Ir | |
| 78 | Платина | Pt | |
| 79 | Золото | Au | |
| 80 | Ртуть | Hg | |
| 81 | Таллий | Tl | |
| 82 | Свинец | Pb | |
| 83 | Висмут | Bi | |
| 84 | Полоний | Po | |
| 85 | Астат | At | |
| 86 | Радон | Rn | |
| 87 | Франций | Fr | |
| 88 | Радий | Ra | |
| 89 | Актиний | Ac | |
| 90 | Торий | Th | |
| 91 | Протактиний | Pa | |
| 92 | Уран | U | |
| 93 | Нептуний | Np | |
| 94 | Плутоний | Pu | |
| 95 | Америций | Am | |
| 96 | Кюрий | Cm | |
| 97 | Берклий | Bk | |
| 98 | Калифорний | Cf | |
| 99 | Эйнштейний | Es | |
| 100 | Фермий | Fm | |
| 101 | Менделевий | Md | |
| 102 | Нобелий | No | |
| 103 | Лоуренсий | Lr | |
| 104 | Резерфордий (Курчатовий) | Rf | |
| 105 | Дубний (Нильсборий) | Db | |
| 106 | Сиборгий | Sg | |
| 107 | Борий | Bh | |
| 108 | Хассий | Hs | |
| 109 | Мейтнерий | Mt | |
| 110 | Дармштадтий | Ds |
Коэффициент востребованности
33 601
Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
В оксидах химический элемент кислород находится в степени окисления (–2).
Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и литосфере.
Примеры оксидов:
— оксид водорода, или вода.
На Земле вода встречается во всех трёх агрегатных состояниях — газообразном (водяной пар), жидком и твёрдом (лёд, снег). На долю воды также приходится большая часть массы живых организмов.
 |
 |
 |
|
Рис. (1). Вода |
Рис. (2). Пар |
Рис. (3). Лёд |
— оксид углерода((IV)), двуокись углерода или углекислый газ.
Как вы уже знаете, углекислый газ нужен зелёным растениям для фотосинтеза.
Рис. (4). Фотосинтез
Оксид углерода((IV)), находящийся в твёрдом агрегатном состоянии, называют сухим льдом.
|
|
|
Рис. (5). Сухой лёд |
— оксид углерода((II)), угарный газ.
Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения является транспорт. Угарный газ образуется в результате неполного сгорания топлива. Этот же оксид образуется и во время пожаров.
 |
 |
|
Рис. (6). Горение газа |
Рис. (7). Выхлопные газы |
— оксид железа((III)).
В природе этот оксид встречается в виде минерала гематита. Он составляет основу руды, называемой красным железняком.
|
|
|
Рис. (8). Красный железняк |
— оксид кремния((IV)).
В природе встречается в виде кварцевого песка, кварца, горного хрусталя.
 |
 |
 |
|
Рис. (9). Песок |
Рис. (10). Кварц |
Рис. (11). Горный хрусталь |
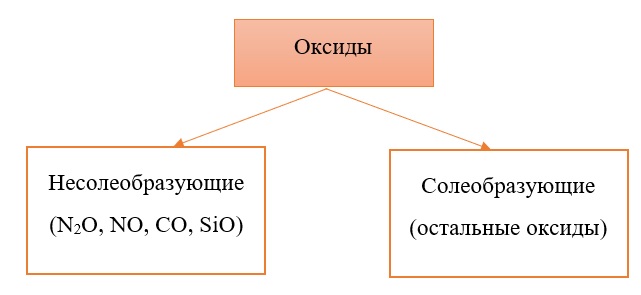
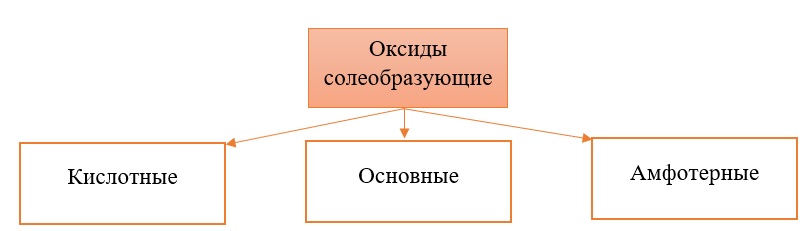
Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими.
- Основные оксиды.
Основными называют оксиды, которые реагируют с кислотами, образуя соль и воду.
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основный оксид, является невысокой: (+1) или (+2).
Примеры основных оксидов:
оксид натрия
Na2O
, оксид меди((II))
CuO
.
- Кислотные оксиды.
Кислотными называют оксиды, которые реагируют с основаниями, образуя соль и воду.
Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы((VI))
SO3
, оксид азота((IV))
NO2
.
Также кислотные оксиды могут быть образованы металлическими химическими элементами, в которых те проявляют степень окисления от (+5) до (+7). Например, оксид хрома((VI))
CrO3
и оксид марганца((VII))
Mn2O7
.
- Амфотерные оксиды.
Амфотерными называют оксиды, которые реагируют как с кислотами, так и с основаниями, образуя соли.
Амфотерные свойства проявляет оксид цинка
ZnO
, оксид алюминия
Al2O3
, оксид бериллия
BeO
.
Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления).
Например, хром может проявлять валентность равную двум, трём, шести.
Амфотерными свойствами обладает именно оксид хрома((III))
Cr2O3
.
- Несолеобразующие оксиды.
Несолеобразующие оксиды — оксиды, не реагирующие с кислотами или основаниями при обычных условиях.
К ним относятся: оксид углерода((II))
CO
, оксид кремния((II))
SiO
,оксид азота((I))
N2O
, оксид азота((II))
NO
.
Они не имеют кислотных гидроксидов, не вступают в реакции с образованием солей.
Номенклатура оксидов
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже.
Например:
Na2O
— оксид натрия,
Al2O3
— оксид алюминия.
Если элемент, образующий оксид, имеет переменную степень окисления (или валентность), то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела).
Например:
Cu2O
— оксид меди((I)),
CuO
— оксид меди((II)),
FeO
— оксид железа((II)),
Fe2O3
— оксид железа((III)),
Cl2O7
— оксид хлора((VII)).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, или моноокисью, если два — диоксидом, или двуокисью, если три — то триоксидом, или трёхокисью и т. д.
Например: монооксид углерода
CO
, диоксид углерода
CO2
, триоксид серы
SO3
.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ
CO
, серный ангидрид
SO3
и т. д.
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
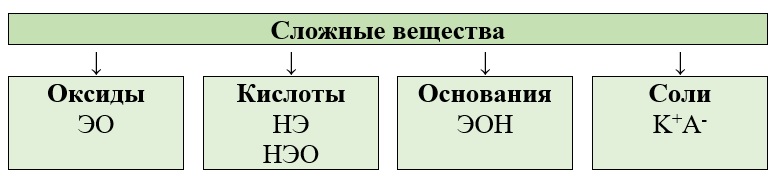
Химические вещества можно разделить на две группы: простые и сложные.
Простые вещества состоят из атомов одного элемента (О2, P4).
Сложные вещества состоят из атомов двух и более элементов (CaO, H3PO4).
Простые вещества можно разделить на металлы и неметаллы.
Металлы – это простые вещества, в которых атомы соединены между собой металлической химической связью. Металлы стремятся отдавать электроны и характеризуются металлическими свойствами (металлический блеск, высокая электро- и теплопроводность, пластичность и др.).
Неметаллы – это простые вещества, в которых атомы соединены ковалентными (или межмолекулярными) связями. Неметаллы стремятся принимать или притягивать электроны. Неметаллические свойства – это способность принимать или притягивать электроны.
Все элементы в Периодической системе химических элементов (ПСХЭ) расположены либо в главной подгруппе, либо в побочной. В различных формах короткопериодной ПСХЭ главные и побочные подгруппы расположены по-разному. Есть простой способ, который позволит вам быстро и надежно определять, к какой подгруппе относится элемент. Дело в том, что все элементы второго периода расположены в главной подгруппе. Те элементы, которые расположены в ячейке точно под элементами второго периода (справа или слева), относятся к главной подгруппе. Остальные — к побочной.
Например, в таблице Менделеева, которая используется на ЕГЭ по химии, элемент номер 31, галлий, расположен в ячейке справа, точно под соответствующим ему элементом второго периода, бором. Следовательно, галлий относится к главной подгруппе. А вот скандий, элемент номер 21, расположен в ячейке слева. Следовательно, скандий относится к побочной подгруппе.
Неметаллы расположены в главных подгруппах, в правом верхнем угле ПСХЭ. К металлам относятся все элементы побочных подгрупп и элементы главных подгрупп, расположенные в левой нижней части ПСХЭ. Разделяют металлы и неметаллы обычно, проводя условную линию от бериллия до астата. На рисунке показано точное разделение на металлы и неметаллы. Закрашены цветом неметаллы.
Основные классы сложных веществ — это оксиды, гидроксиды, соли.
Оксиды — это сложные вещества, которые состоят из атомов двух элементов, один из которых кислород, имеющий степень окисления -2.
В зависимости от второго элемента оксиды проявляют разные химические свойства. Некоторым оксидам соответствуют гидроксиды (солеобразующие оксиды), а некоторым нет (несолеобразующие).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
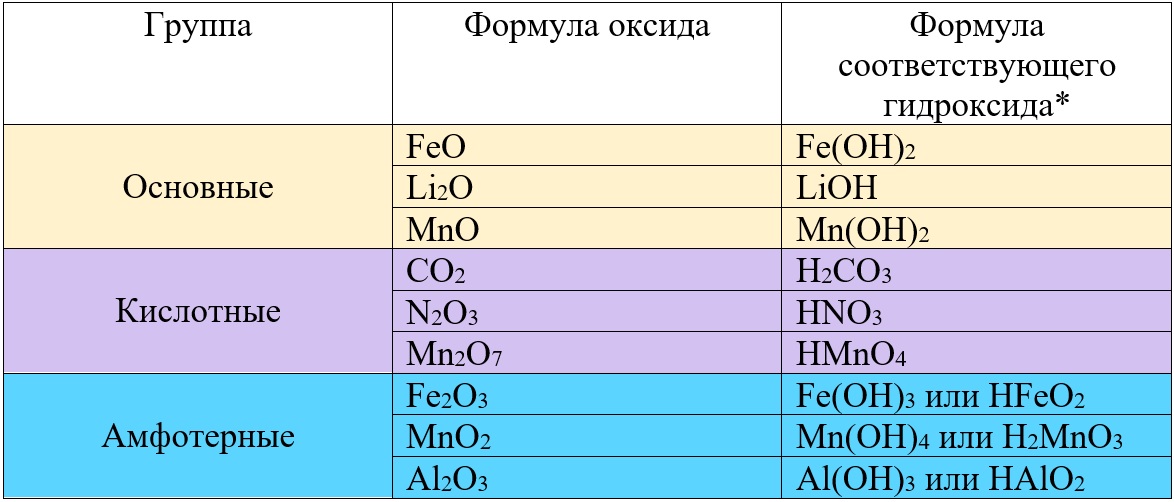
Основные оксиды — это оксиды, которые проявляют характерные основные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +1 и +2. Например, оксид лития Li2O, оксид железа (II) FeO.
Кислотные оксиды — это оксиды, которые проявляют кислотные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов с любой степенью окисления. Например, оксид хлора (I) Cl2O, оксид хрома (VI) CrO3.
Амфотерные оксиды — это оксиды, которые проявляют и основные, и кислотные свойства. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Встречаются и оксиды, похожие на соли, т.е. солеобразные (двойные).
Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления. Например, магнетит (магнитный железняк) FeO·Fe2O3.
Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид – металл или неметалл. Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный (если это не исключение).
Гидроксиды — это сложные вещества, в составе которых есть группа Э-O-H. К гидроксидам относятся основания, амфотерные гидроксиды, и кислородсодержащие кислоты.
Солеобразующим оксидам соответствуют гидроксиды:
основному оксиду соответствует гидроксид основание,
кислотному оксиду соответствует гидроксид кислота,
амфотерному оксиду соответствует амфотерный гидроксид.
Например, оксид хрома (II) CrO — основный, ему соответствует гидроксид основание. Формулу гидроксида легко получить, просто добавив к металлу гидроксидную группу OH: Cr(OH)2.
Оксид хрома (VI) — кислотный, ему соответствует гидроксид кислота H2CrO4, и кислотный остаток хромат-ион CrO42-.
Если все индексы кратны 2, то мы делим все индексы на 2.
Например: N2O5 + H2O → H2N2O6, делим на 2, получаем HNO3. Так получаем мета-формулу кислоты. Если мы добавим еще одну молекулу воды, то получим орто-формулу кислоты.
Например: оксид P2O5, мета-форма: HPO3. Добавляем воду, орто-форма: H3PO4. Орто-форма устойчива у фосфора и мышьяка.
Оксид хрома (III) — Cr2O3 — амфотерный, ему соответствует амфотерный гидроксид, который может выступать и как основание, и как кислота: Cr(OH)3 = HCrO2, кислотный остаток хромит: CrO2—.
Взаимосвязь оксидов и гидроксидов:
Основания (основные гидроксиды) — это сложные вещества, которые при диссоциации в водных растворах в качестве анионов (отрицательных ионов) образуют только гидроксид-ионы OH—.
Основания можно разделить на растворимые в воде (щелочи), нерастворимые в воде, и разлагающиеся в воде.
К разлагающимся в воде (неустойчивым) основаниям относят гидроксид аммония, гидроксид серебра (I), гидроксид меди (I). В водном растворе такие соединения практически необратимо распадаются:
NH4OH → NH3 + H2O
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
Основания с одной группой ОН – однокислотные (например, NaOH), с двумя – двухкислотные (Ca(OH)2) и с тремя – трехкислотные (Fe(OH)3).
Кислоты – это сложные вещества, которые при диссоциации в водных растворах образуют в качестве катионов только ионы гидроксония H3O+(H+). Кислоты состоят из водорода H+ и кислотного остатка.
По числу атомов водорода, которые можно заместить на металлы: одноосновные (HNO3), двухосновные (H2SO4), трехосновные (H3PO4) и т.д.
По содержанию атомов кислорода кислоты бывают бескислородные (например, соляная кислота HCl) и кислородсодержащие (например, серная кислота H2SO4).
Кислоты также можно разделить на сильные и слабые.
Сильные кислоты. К ним относятся:
- Бескислородные кислоты: HCl, HBr, HI. Остальные бескислородные кислоты, как правило, слабые.
- Некоторые высшие кислородсодержащие кислоты: H2SO4, HNO3, HClO4 и др.
Слабые кислоты. К ним относятся:
- Слабые и растворимые кислоты: это H3PO4, CH3COOH, HF и др.
- Летучие или неустойчивые кислоты: H2S — газ; H2CO3 — распадается на воду и оксид: H2CO3 → Н2О + СО2↑; H2SO3 — распадается на воду и оксид: H2SO3 → H2O+ SО2↑.
- Нерастворимые в воде кислоты: H2SiO3 и другие.
Определить, сильная кислота перед вами, или слабая, позволяет простой прием. Мы вычитаем из числа атомов O в кислоте число атомов H. Если получаем число 2 или 3, то кислота сильная. Если 1 или 0 — то кислота слабая.
Например: HClO: 1-1 = 0, следовательно, кислота слабая.
Соли – сложные вещества, состоящие из катиона металла (или металлоподобных катионов, например, иона аммония NH4+) и аниона кислотного остатка. Также солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
Если рассматривать соли, как продукты взаимодействия кислоты и основания, то соли делят на средние, кислые и основные.
Средние соли – продукты полного замещения катионов водорода в кислоте на катионы металла (например, Na2CO3, K3PO4).
Кислые соли – продукты неполного замещения катионов водорода в кислоте на катионы металлов (например, NaHCO3, K2HPO4).
Основные соли – продукты неполного замещения гидроксогрупп основания на анионы кислотных остатков кислоты (например, малахит (CuOH)2CO3).
По числу катионов и анионов соли разделяют на:
Простые соли – состоящие из катиона одного типа и аниона одного типа (например, хлорид кальция CaCl2).
Двойные соли – это соли, состоящие из двух или более разных катионов и аниона одного типа (например, алюмокалиевые квасцы – KAl(SO4)2).
Смешанные соли – это соли, состоящие из катиона одного типа и двух или более анионов разного типа (например, хлорид-гипохлорит кальция Ca(OCl)Cl).
По структурным особенностям выделяют также гидратные соли и комплексные соли.
Гидратные соли (кристаллогидраты) – это такие соли, в состав которых входят молекулы кристаллизационной воды (например, декагидрат сульфата натрия Na2SO4·10 H2O).
Комплексные соли – это соли, содержащие комплексный катион или комплексный анион (K3[Fe(CN)6], [Cu(NH3)4]Cl2).
Помимо основных классов неорганических соединений, существуют и другие.
Например, бинарные соединения элементов с водородом.
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водород образует солеобразные гидриды и летучие водородные соединения.
Солеобразные гидриды ЭНх – это соединения металлов IA, IIA групп и алюминия с водородом. Степень окисления водорода равна -1. Например, гидрид натрия NaH.
Летучие водородные соединения НхЭ – это соединения неметаллов с водородом, в которых степень окисления водорода равна +1. Например, аммиак NH3, фосфин PH3.
Тренировочный тест «Классификация неорганических веществ» 10 вопросов, при каждом прохождении новые.
282
Создан на
02 февраля, 2022 От Admin
Классификация неорганика
1 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) нерастворимому основанию,
Б) кислой соли,
В) несолеобразующему оксиду.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
2 / 10
Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия:
А) кислоты;
Б) средней соли;
В) кислотного оксида.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
3 / 10
Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия:
А) пероксида;
Б) кислотного оксида;
В) амфотерного гидроксида.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
4 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) растворимому основанию,
Б) кислой соли,
В) несолеобразующему оксиду.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
5 / 10
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) двойной соли;
Б) амфотерного гидроксида;
В) ангидрида кислоты.
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
6 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) щёлочи,
Б) кислой соли,
В) несолеобразующему оксиду.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
7 / 10
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) сильной кислоты;
Б) несолеобразующего оксида;
В) основного оксида.
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
8 / 10
Среди предложенных формул/названий веществ, расположенных в пронумерованных ячейках, выберите формулы/названия:
А) средней соли;
Б) кислотного оксида;
В) нерастворимого основания.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
9 / 10
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:
А) кислой соли;
Б) кислотного оксида;
В) летучего водородного соединения.
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
10 / 10
Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее
А) кислотному оксиду,
Б) амфотерному. гидроксиду,
В) двухосновной кислоте.
Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
Ваша оценка
The average score is 57%
Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами)
Классификация оксидов
Материал по химии
Все сложные неорганические вещества можно разделить на следующие группы:
Классификация оксидов
Классификация веществ
Рассмотрим эти классы по отдельности, начиная с оксидов.
Оксиды – это соединения кислорода в степени окисления «‒2» с другими элементами. Но не все соединения кислорода с элементами будут являться оксидами, степень окисления кислорода очень важна!
Таб. «Соединения кислорода»
* Так как фтор принимает только отрицательную степень окисления (так как может выступать только в качестве окислителя), кислород во фториде кислорода может быть только положительным. Положительные ионы записываются первыми в формуле, поэтому правильнее писать OF2.
** Hадпероксид калия состоит из ионов K+ и O2-1.
Зачем нужно знать классификацию оксидов?
Рассмотрим несколько уравнений:
- K2O + H2O = 2KOH
- CaO + H2O = Ca(OH)2
- FeO + H2O ≠
- CuO + H2O ≠
Почему какие-то оксиды реагируют с водой, а другие – нет? Нужно знать классификацию оксидов на растворимые и нерастворимые.
- CaO + N2O3 = Ca(NO3)2
- CaO + Cs2O ≠
Как определить, какие оксиды реагируют друг с другом, а какие нет? Для ответа на этот вопрос нужно знать, какие оксиды относятся к кислотным, а какие к основным, амфотерным или несолеобразующим.
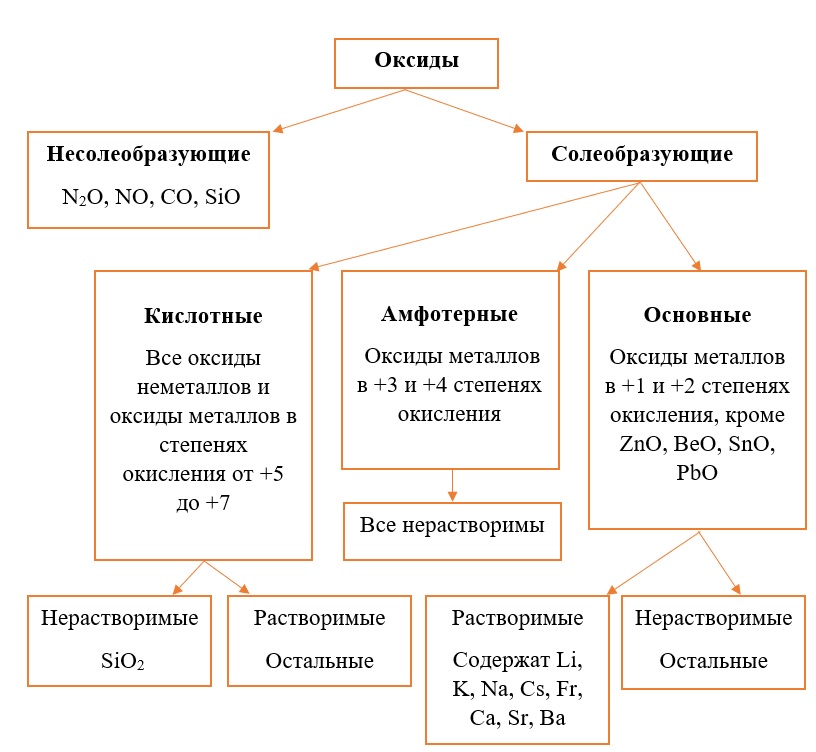
Классификация оксидов на солеобразующие и несолеобразующие
Существует две группы оксидов – те, что при взаимодействии с кислотами/основаниями или друг с другом образуют соли и те, что не вступают в типичные реакции оксидов и не способны образовывать соли (несолеобразующие), их свойства рассматриваются отдельно.
Самыми распространёнными несолеобразующими оксидами являются: N2O, NO, CO, SiO, остальные оксиды считаем солеобразующими (с типичными свойствами).
Классификация солеобразующих оксидов
Все солеобразующие оксиды делятся на основные, кислотные и амфотерные.
Кислотные оксиды соответствуют определенным кислотам, они легко взаимодействуют со своими противоположностями – основными веществами.
Основные оксиды соответствуют определенным основаниям, они легко взаимодействуют со своими противоположностями – кислотными веществами.
Амфотерные оксиды, соответствуют определённым гидроксидам, имеют двойственную природу: с кислотными веществами реагируют как основные соединения, а с основными – как кислотные соединения.
Таб. «Некоторые оксиды и соответствующие им гидроксиды»
* Гидроксид – соединение элемента с гидроксо-группой (OH‒).
Проанализировав таблицу, Вы заметите, что разные оксиды железа могут быть основными или амфотерными, а разные оксиды марганца оказались во всех трех группах. Что бы лучше понимать, от чего зависит принадлежность к тому или иному виду оксидов, необходимо глубже разобраться в классификации этих веществ.
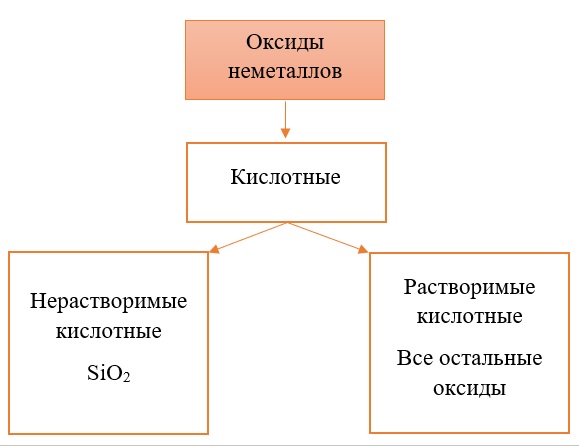
Классификация оксидов неметаллов.
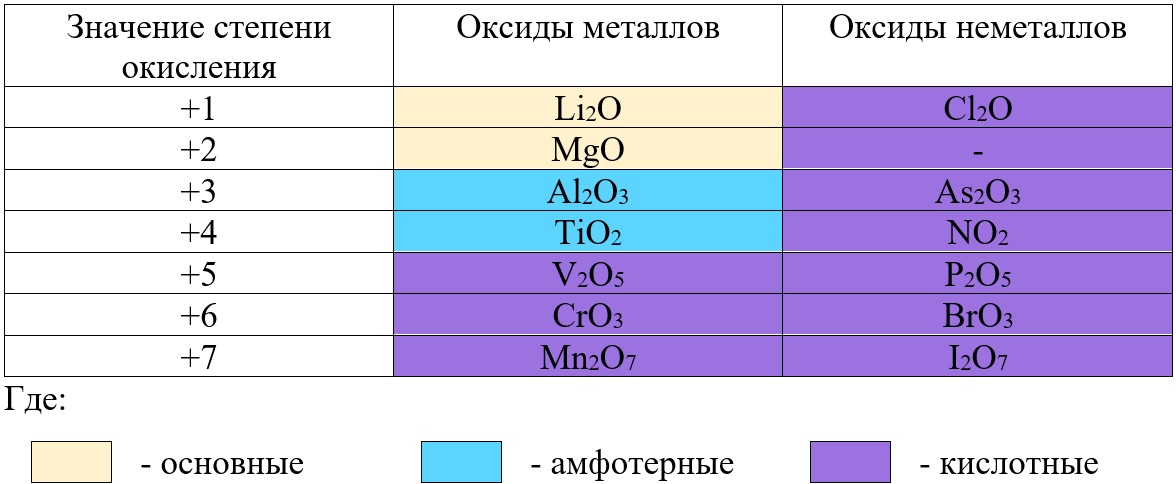
Все солеобразующие оксиды неметаллов относятся к кислотным. Большая часть из них являются растворимыми:
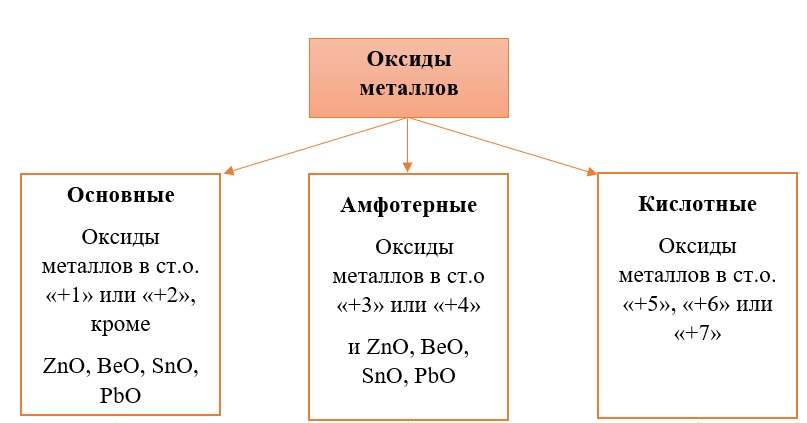
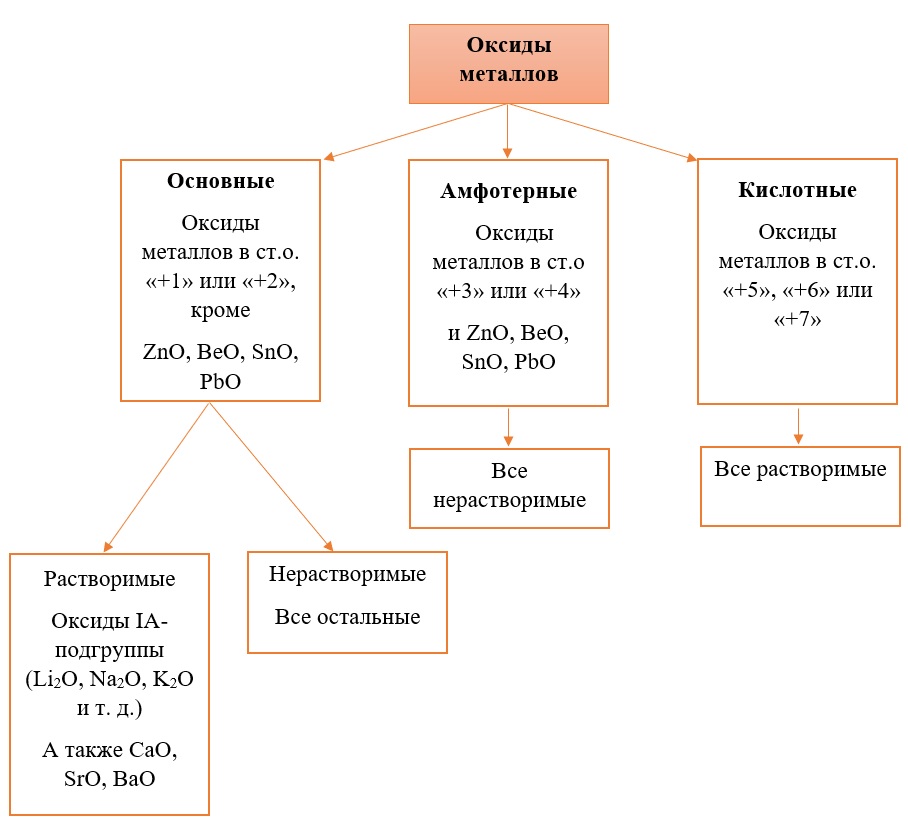
Классификация оксидов металлов.
В отличие от предыдущей группы, в этой не так всё однозначно. Среди оксидов металлов встречаются как основные, так и амфотерные, и даже кислотные. А принадлежность к определённой группе зависит он степени окисления металла, который входит в состав оксида.
Основные оксиды – это оксиды, в которых металл имеет степень окисления «+1» или «+2» (для элементов с большим диапазоном возможных степеней окисления это будут низшие степени окисления). Есть исключения, например, BeO, ZnO хоть и имеют в своём составе металлы в степени окисления «+2», проявляют амфотерные свойства. Список таких оксидов гораздо шире (SnO, PbO, CuO), но в ЕГЭ остальные примеры исключений игнорируются.
Амфотерные оксиды содержат металлы в степени окисления «+3» и «+4» (промежуточные значения степеней окисления для веществ с большим диапазоном возможных степеней окисления), и два примера оксидов с металлами в ст. о. «+2», написанных выше (BeO, ZnO).
Кислотные оксиды содержат металлы в степени окисления «+5», «+6» и «+7» (для элементов с большим диапазоном возможных степеней окисления это будут высшие степени окисления).
Все кислотные оксиды металлов растворяются в воде и реагируют с ней. Все амфотерные оксиды не растворяются в воде и не реагируют с ней. Среди основных оксидов большинство нерастворимы и только оксиды, образованные кальцием, стронцием, барием, а также всеми металлами IА-подгруппы являются растворимыми.
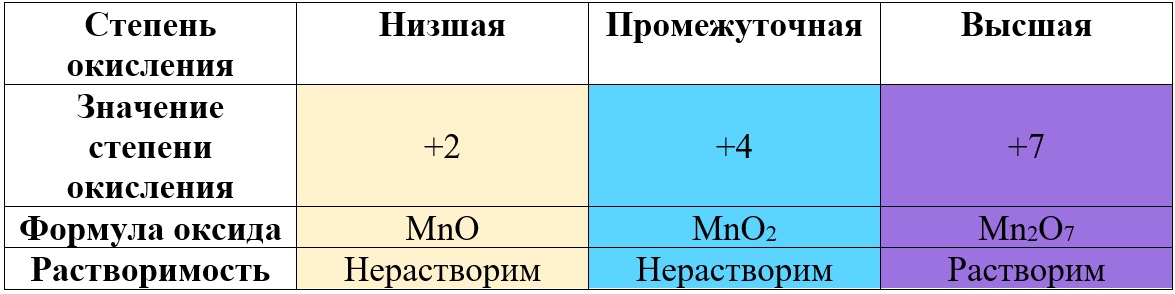
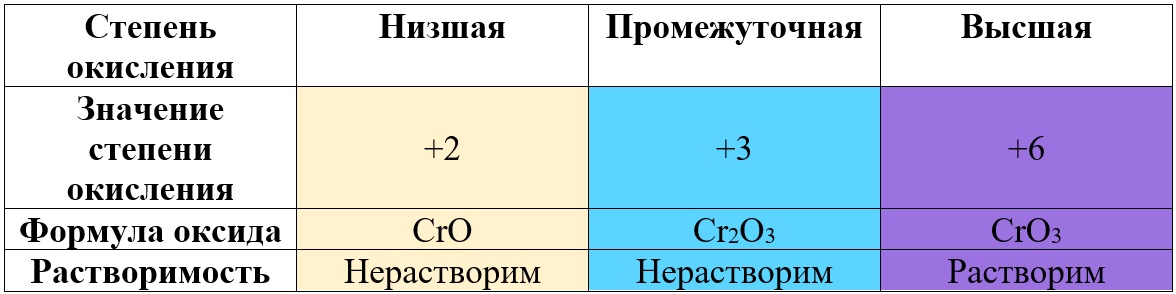
Таким образом металлы, имеющие большой диапазон возможных степеней окисления, могут образовывать совершенно разные по характеру оксиды, например оксиды марганца и хрома:
Таб. «Зависимость характера оксида от степени окисления марганца» (рассмотрены только наиболее распространённые степени)
Таб. «Зависимость характера оксида от степени окисления хрома» (рассмотрены только наиболее степени)
Не следует путать оксиды металлов и неметаллов: у оксидов металлов степень окисления определяет характер оксида, а у оксида неметалла – нет.
Таб. «Зависимость характера оксида от степени окисления элемента»
Обобщим всю классификацию оксидов одной схемой:
Алгоритм для определения характера оксида:
Простая таблица для определения принадлежности к группе оксидов: