Определить объем аммиака (NH3) (в л), занимаемый при нормальных условиях 3,4 грамм аммиака (NH3).
Решение задачи
Учитывая, что аммиак (NH3) – бесцветный газ с резким запахом, вычислим объем аммиака (NH3), по формуле перерасчета, устанавливающей связь между объемом и массой газа:
Откуда:
Рассчитаем молярную массу аммиака (NH3):
M (NH3) = 14 + 3 ∙ 1 = 71 (г/моль).
Получаем, что объем аммиака равен:
V (NH3) = 3,4 ∙ 22,4 / 17 = 4,48 (л).
Ответ:
oбъем аммиака 4,48 литра.
Вычислите объём аммиака (н.у.), который выделится при взаимодействии нитрата аммония массой 890 г, содержащего 20% примесей, с раствором гидроксида натрия. Какая масса 20%−го раствора щёлочи потребуется для реакции?
reshalka.com
ГДЗ учебник по химии 8 класс Габриелян. §40. Вопросы и задания. Номер №4
Решение
Дано:
m (
N
H
4
N
O
3
+ присмеси) = 890 г;
ω (примеси) = 20 %;
ω (NaOH) = 20 %;
Найти:
V (
N
H
3
) − ?
m
р
−
р
а
(
N
a
O
H
)
− ?
Решение:
N
H
4
N
O
3
+
N
a
O
H
=
N
a
N
O
3
+
H
2
O
+
N
H
3
↑;
ω
(
N
H
4
N
O
3
)
=
100
−
ω
(
п
р
и
м
е
с
и
)
=
100
−
20
=
80
% или 0,8;
m (вещ−во) = m (р−ра) * ω;
m
(
N
H
4
N
O
3
)
=
m
(
N
H
4
N
O
3
+
п
р
и
м
е
с
и
)
∗
ω
(
N
H
4
N
O
3
)
=
890
∗
0
,
8
=
712
г;
n
=
m
M
;
M (
N
H
4
N
O
3
) = 1 * Ar (N) + 4 * Ar (H) + 1 * Ar (N) + 3 * Ar (O) = 1 * 14 + 4 * 1 + 1 * 14 + 3 * 16 = 80 г/моль;
n
(
N
H
4
N
O
3
)
=
m
(
N
H
4
N
O
3
)
M
(
N
H
4
N
O
3
)
=
712
80
=
8
,
9
моль;
Запишем уравнение реакции и составим пропорции:
N
H
4
N
O
3
8
,
9
м
о
л
ь
1
м
о
л
ь
+
N
a
O
H
x
1
м
о
л
ь
=
N
a
N
O
3
+
H
2
O
+
N
H
3
y
1
м
о
л
ь
↑
;
x
=
n
(
N
a
O
H
)
=
8
,
9
∗
1
1
=
8
,
9
моль;
y
=
n
(
N
H
3
)
=
8
,
9
∗
1
1
=
8
,
9
моль;
V
=
V
m
∗
n
;
V
m
= 22,4 л/моль;
V
(
N
H
3
)
=
V
m
∗
n
(
N
H
3
)
=
22
,
4
∗
8
,
9
=
199
,
36
л.
m = n * M;
M (NaOH) = 1 * Ar (Nа) + 1 * Ar (O) + 1 * Ar (H) = 1 * 23 + 1 * 16 + 1 * 1 = 40 г/моль;
m (NaOH) = n (NaOH) * M (NaOH) = 8,9 * 40 = 356 г;
m
(
р
−
р
)
=
m
(
в
−
в
о
)
ω
(
в
е
щ
−
в
о
)
m
р
−
р
а
(
N
a
O
H
)
=
m
(
N
a
O
H
)
ω
(
N
a
O
H
)
=
356
20
∗
100
г = 1,78 кг.
Ответ. 199,36 л; 1,78 кг.
Дано:
m (NH₃) = 450 г.
Найти:
V (NH₃) — ?
Решение:
1. Найдём количество вещества аммиака. По формуле:
‣ n = m ÷ M; где: n — количество вещества (моль), m — масса (г), M — молярная масса (г/моль).
n (NH₃) = 450 г ÷ 17 г/моль ≈ 26,47 (моль).
2. Найдём объём аммиака. По формуле:
‣ V = n · Vm; где: V — объём (л), n — количество вещества (моль), Vm — молярный объём газов при н.у., постоянная величина, равная 22,4 (л/моль).
V (NH₃) = 26,47 моль · 22,4 л/моль = 593 (л).
Ответ: 593 л.
Аммиак
Физические свойства аммиака
Аммиак (NH3) – бесцветный газ с резким запахом (запах «нашатырного спирта»), легче воздуха, хорошо растворим в воде (один объем воды растворят до 700 объемов аммиака). Концентрированный раствор аммиака содержит 25% (массовых) аммиака и имеет плотность 0,91 г/см3.
Строение молекулы аммиака
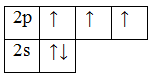
Связи между атомами в молекуле аммиака – ковалентные. Общий вид молекулы AB3, следовательно, чтобы определить тип гибридизации и строение молекулы можно использовать метод валентных связей и метод Гиллеспи:
7
N 1s22s22p3
1H 1s1
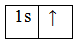
В гибридизацию вступают все валентные орбитали атома азота, следовательно, тип гибридизации молекулы аммиака – sp3. Для определения структуры строения молекулы рассчитаем число неподеленных электронных пар:
НЕП = (5-3)/2 = 1
Следовательно, имеется одна неподеленная пара электронов. Аммиак имеет структуру типа AB3E – тригональной пирамиды.
Получение аммиака
Выделяют промышленные и лабораторные способы получения аммиака. В лаборатории аммиак получают действием щелочей на растворы солей аммония при нагревании:
NH4Cl + KOH = NH3↑ + KCl + H2O
NH4+ + OH— = NH3↑+ H2O
Эта реакция является качественной на ионы аммония.
Химические свойства аммиака
В химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами. Степень окисления азота в аммиаке «-3» —
минимальная, поэтому аммиак проявляет только восстановительные свойства.
При нагревании аммиака с галогенами, оксидами тяжелых металлов и кислородом образуется азот:
2NH3 + 3Br2 = N2 + 6HBr
2NH3 + 3CuO = 3Cu + N2 + 3H2O
4NH3 +3O2 = 2N2 + 6H2O
В присутствии катализатора аммиак способен окисляться до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O (катализатор – платина)
В отличие от водородных соединений неметаллов VI и VII групп, аммиак не проявляет кислотные свойства. Однако, атомы водорода в его молекуле все же способны замещаться на атомы металлов. При полном замещении водорода металлом происходит образование соединений, называемых нитридами, которые также можно получить и при непосредственном взаимодействии азота с металлом при высокой температуре.
Основные свойства аммиака обусловлены наличием неподеленной пары электронов у атома азота. Раствор аммиака в воде имеет щелочную среду:
NH3 + H2O ↔ NH4OH ↔ NH4+ + OH—
При взаимодействии аммиака с кислотами образуются соли аммония, которые при нагревании разлагаются:
NH3 + HCl = NH4Cl
NH4Cl = NH3 + HCl (при нагревании)
Примеры решения задач
Чтобы вопрос опубликовался, войди или зарегистрируйся
Восстановление пароля
Мы отправили письмо со ссылкой на смену пароля на username@mail.ru.
Если письма нет, проверь папку «Спам».
Чтобы вопрос опубликовался, войди или зарегистрируйся
Нужна регистрация на Учи.ру
«Ваш урок» теперь называется Учи.Ответы. Чтобы зайти на сайт, используй логин и пароль от Учи.ру. Если у тебя их нет, зарегистрируйся на платформе.

