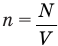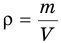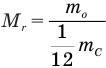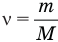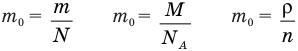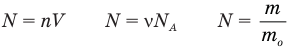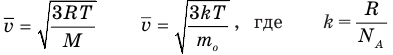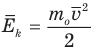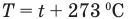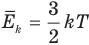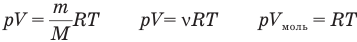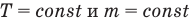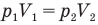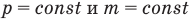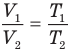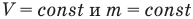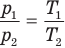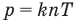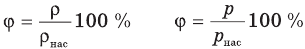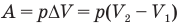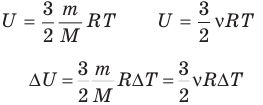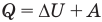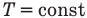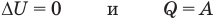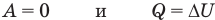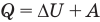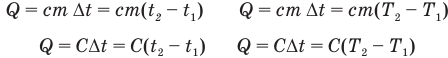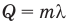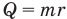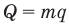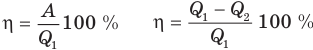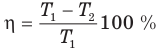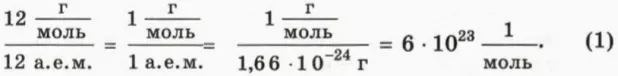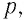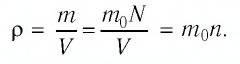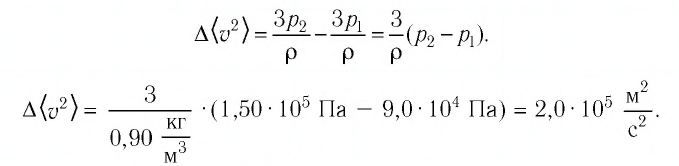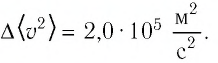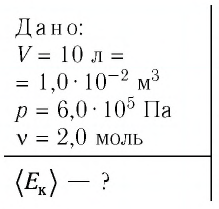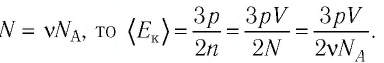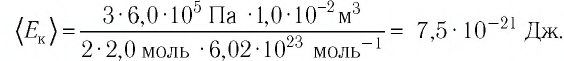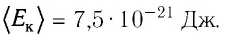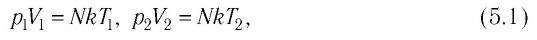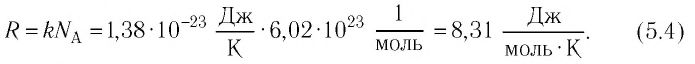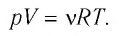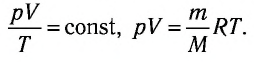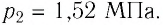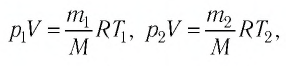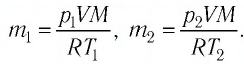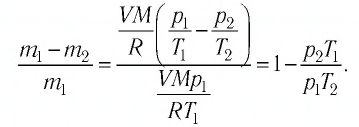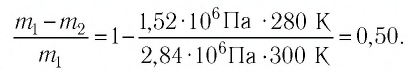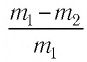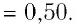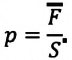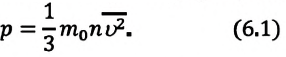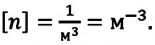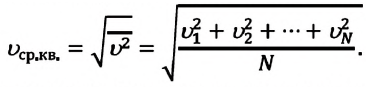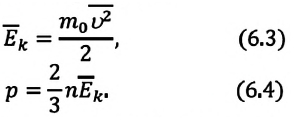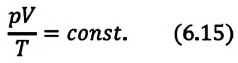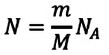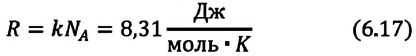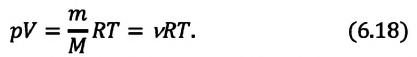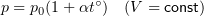Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация 

Формула плотности
Здесь 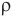
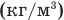

Формула относительной молекулярной массы
Здесь 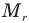
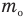
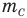
Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 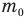
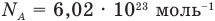
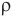
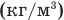

Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул 

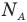
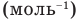
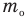
Формулы средней квадратичной скорости молекул
Здесь 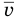
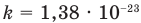
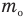
Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), 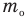

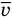
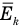
Формула средней кинетической энергии молекул
Здесь 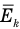
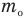
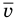
Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь 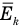
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем 
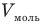
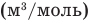
Объединенный газовый закон — уравнение Клапейрона
при
Здесь 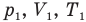

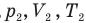

Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 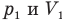

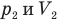

Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), 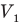
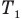

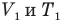

Закон Шарля
при
Здесь V — объем газа 
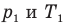
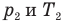
Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа 
Формулы относительной влажности
Здесь 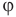
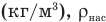
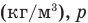
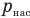
Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), 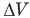
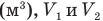

Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 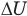
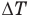
Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 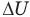
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
к адиабатному: при Q = 0
Здесь Т — абсолютная температура (К), 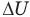
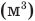
Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 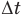
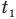
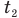
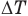
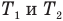
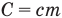
Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 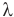
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь 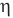
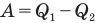
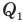
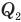
Коэффициент полезного действия идеального теплового двигателя
Здесь 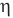
Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы:
-
Основное уравнение молекулярно-кинетической теории:
,
где
– давление
газа,
– концентрация
молекул,
–
масса одной молекулы,
–
средняя квадратичная скорость одной
молекулы,
—
плотность газа,
–абсолютная
температура,
–
постоянная
Больцмана.
-
Средняя
кинетическая энергия поступательного
движения одной молекулы:
.
-
Изопроцессы
(газовые законы) –
для
:
1)
— изотермический:
;
2)
—
изобарный:;
3)
—
изохорный:
.
-
Уравнение
Менделеева-Клапейрона:
,
где
–
объём газа,
– масса газа,
– молярная масса;
)
– универсальная
газовая постоянная.
-
Количество
вещества:
,
где
– общее число молекул;
– постоянная Авогадро.
-
Скорости
молекул:
—
средняя квадратичная,
—
средняя арифметическая,
—
наиболее вероятная.
-
Нормальные
условия:
—
объём
одного моля газа.
Примеры решения задач
Задача
1.
Смесь кислорода и азота при температуре
t=270С
находится под давлением Р=2,3·102
Па.
Масса кислорода составляет 75% от общей
массы смеси. Определите концентрацию
молекул каждого из газов.
|
Дано: Т=300 Р=2,3·102 m1=0,75 М1=0,032 М2=0,028 |
Решение:
Смесь где (2) концентрация смеси газов; азота; |
|
n1 |
Из
выражений (1) и (2) имеем:
.
(3)
Выразим
концентрацию n1
через концентрацию n2.
По
условию задачи масса кислорода:
m1
= 0,75 m
,
(4)
где
m
– масса смеси.
Массу
кислорода можно выразить также через
концентрацию n1
и объем газа:
m1
=
,
(5)
где
М1
–
молярная масса кислорода;
NA
– число Авогадро;
V
– объем газа.
Приравняв
правые части выражений (4) и (5), получим:
.
(6)
Масса
азота m2=0,25m,
или иначе
.
Приравняв значенияm2
из последних двух формул, найдем:
.
(7)
Из
выражений (6) и (7) имеем:
.
(8)
Подставив
в формулу (3) значение n2
из
последнего выражения, получим n1
=.
После подстановки значений и вычисленияn1
=
0,40·1023
1/м3,
n2
=
0,15·1023
(1/м3).
Ответ:
n1
=
0,40·1023
1/м3,
n2
=
0,15·1023
(1/м3).
Задача
2.
В
закрытом сосуде объемом V=1
м3
находится
m1=1кг
азота и m2=1,5
кг воды. Определите давление в сосуде
при температуре t=6000С,
зная, что при этой температуре вся вода
превратится в пар.
|
Дано: V=1 m1=1 m2=1,5 Т=873 M1=0,028 M2=0,018 |
Решение:
По
Р=Р1+Р2 где
где
где |
|
Р |
Из
уравнений (2) и (3) имеем:
,
.
После подстановки давленийР1
и
Р2
в
выражение
(1)
имеем
Используя числовые значения, получим:
Р
=
8,62·105
Па.
Ответ:
Р =
8,62·105
Па.
Задача
3.
Определите
число молекул воздуха в аудитории
объемом V=180
м3
при температуре t=220С
и давлении Р=0,98·105
Па. Какова концентрация молекул воздуха
при этих условиях?
|
Дано: V=180 Т=295 Р=0,98· |
Решение:
Число
где
Из N |
|
N |
Число
молей воздуха в аудитории можно выразить,
используя уравнение Клапейрона-Менделеева
откуда
После
подстановки
из последней формулы в выражение (2)
получим:
.
(3)
Используя
числовые значения, определим N
=
0,43·1028.
Проверим единицы измерения правой части
выражения (3)
. Концентрацию (число молекул в единице
объема) определим по формуле:
.
После
подстановки:
n=0,24·1026.
Ответ:
N =
0,43·1028,
n=0,24·1026.
Задача
4.
Определите
среднюю квадратичную скорость молекул
некоторого газа, плотность которого
при давлении Р=1,1·105
Па
равна ρ=0,024.
Какова масса одного моля этого газа,
если значениеплотности
дано для температуры 270
С?
|
Дано:
|
Решение: Для
где Так |
|
|
в
таком виде:
,
откуда,после
подстановки числовых значений и
вычисления получим:
.
Для
определения массы одного моля газа
используем уравнение Клапейрона-Менделеева
—
откуда
.
Так как,
то,
или.
После подстановки числовых значений и
вычисления:
.
Ответ:
,
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
1. Закон Авогадро
Из уравнения Клапейрона (см. предыдущий параграф) следует, что в процессах, происходящих с данной массой газа, произведение давления газа p на его объем V, деленное на абсолютную температуру T газа, постоянно: (pV)/T = const.
Однако если масса газа в процессе изменилось, то значение выражения (pV)/T тоже изменится! Это очень легко проверить.
Поставим опыт
Надуйте щеки (рис. 40.1). При этом одновременно увеличились и давление воздуха во рту, и его объем, а температура этого воздуха осталась практически неизменной (равной температуре тела). Следовательно, значение выражения (pV)/T увеличилось. Причина, конечно, в том, что при надувании щек увеличивается масса воздуха во рту.
От чего же зависит значение отношения (pV)/T? Может, только от массы газа?
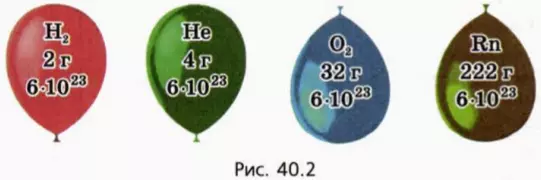
Оказывается, что это не так: опыт показывает, что если для различных газов сделать одинаковым значение отношения (pV)/T, то массы газов могут сильно различаться. На рисунке 40.2 схематически изображены воздушные шарики одинакового объема, наполненные водородом, гелием, кислородом и радоном при одинаковых температуре и давлении. (Из дальнейшего вы догадаетесь, почему масса водорода взята равной 2 г.)
Ответ на вопрос, от чего зависит значение выражения (pV)/T, оказался на удивление простым. Его нашел в начале 19-го века итальянский ученый Амедео Авогадро.
Исследуя химические реакции между газами, он открыл закон, который называют сегодня законом Авогадро:
в равных объемах различных газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Отсюда следует, что значение выражения (pV)/T для данной массы газа пропорционально только числу молекул:
(pV)/T = kN,
где k — коэффициент пропорциональности, одинаковый для всех газов. Его назвали настоянной Больцмана в честь австрийского физика Людвига Больцмана.
Измерения показали, что
k = 1,38 * 10-23 Дж/К.
Из закона Авогадро следует, что главной характеристикой газа является число молекул.
2. Единица количества вещества
Число молекул в образце вещества характеризуют физической величиной, которую называют количеством вещества и обозначают греческой буквой ν (произносится «ню»). (Это исторически сложившееся название может ввести в заблуждение, потому что его легко спутать с массой образца. Количество вещества надо понимать именно как характеристику числа молекул!)
Единицу количества вещества называют моль.
Один моль – это такое количество вещества, которое содержит столько же молекул, сколько атомов в 12 г углерода.
? 1. Во сколько раз число молекул в шести молях водорода больше, чем в двух молях кислорода?
? 2. Сколько молей водорода и кислорода нужно для того, чтобы в результате реакции между ними образовалось 2 моль воды?
Подсказка. Вспомните химическую формулу воды.
Скоро мы поймем, почему ученые выбрали «произвольное» на первый взгляд определение моля.
Атомная единица массы
Массы атомов и молекул можно выражать в граммах: например, масса самого легкого атома (водорода) равна 1,67 * 10-24 г. Но это неудобно: получаются громоздкие числа.
В качестве атомной единицы массы (сокращенно а. е. м.) взяли величину, близкую к массе атома водорода, а именно 1/12 массы атома углерода:
Такой выбор атомной единицы массы был обусловлен соображениями удобства при расчетах: во-первых, углерод входит в очень большое число химических соединений, во-вторых, при таком выборе атомной единицы массы значения масс многих атомов оказываются близкими к целым числам.
Сколько молекул а одном моле?
По определению в одном моле любого вещества содержится столько же молекул, сколько атомов в 12 г углерода. Значит, чтобы найти число молекул в одном моле, надо разделить 12 г, то есть массу одного моля углерода, на массу одного атома углерода, равную 12 а. е. м. В результате получим:
Число молекул в одном моле называют постоянной Авогадро (обозначают NA) и записывают в виде
NA = 6 * 1023 моль-1. (2)
Сколько молекул в образце вещества, содержащем ν молей? В каждом моле NA молекул. Следовательно, число N молекул в образце, содержащем ν молей, выражается формулой
N = νNA. (3)
? 3. Сколько молекул содержится:
а) в 2 моль воды?
б) в 5 моль кислорода?
в) в 0,33 моль углекислого газа?
Есть ли в условии лишние данные?
? 4. Сколько молей в образце вещества, число молекул в котором равно: а) 6 * 1024; б) 3 * 1022; в) З,З * 1022; г) 6 * 1020?
Относительная атомная и молекулярная масса
Массу атома, выраженную в атомных единицах массы, называют относительной атомной массой.
Относительные массы всех атомов измерены. Вы можете найти их в Периодической системе химических элементов (таблице Менделеева, стр. 238-239). Приведенное в ней значение часто округляют до целого числа.
Например, относительная атомная масса водорода равна 1, гелия – 4, а кислорода – 16.
Аналогично относительной атомной массе определяют и относительную молекулярную массу: она равна массе молекулы, выраженной в атомных единицах массы.
Чтобы найти относительную молекулярную массу молекулы данного вещества, надо знать:
– химическую формулу этого вещества, то есть из каких атомов состоит молекула вещества,
– относительные атомные массы этих атомов.
Например, относительная молекулярная масса воды равна 18, потому что молекула воды состоит из одного атома кислорода и двух атомов водорода.
? 5. Чему равна относительная молекулярная масса:
а) водорода?
б) гелия?
в) кислорода?
г) углекислого газа?
3. Молярная масса
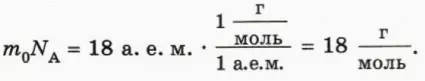
Массу одного моля вещества называют малярной массой и обозначают M.
Найдем молярную массу воды. Для этого массу m0 молекулы воды (18 а. е. м.) умножим на число молекул в одном моле, то есть на постоянную Авогадро NA. Согласно формуле (1) значение постоянной Авогадро равно отношению 1 г к 1 а. е. м., поэтому для молярной массы воды получаем:
Следовательно, полстакана воды (примерно 100 г) – это около 5,5 моль воды (рис. 40.3).
Обратите внимание: масса одного моля, выраженная в граммах, численно равна относительной молекулярной массе.
Это справедливо как для воды, так и для любого вещества, потому что для него можно провести точно такой же расчет молярной массы.
Равенство численного значения массы одного моля вещества (в граммах) и относительной молекулярной массы этого вещества не случайно: оно обусловлено тем, что в одном моле столько молекул, сколько атомных единиц массы в одном грамме. Это оказалось очень удобным для расчетов при проведении опытов, потому что массу образцов веществ измеряют часто в граммах.
В СИ молярную массу измеряют в кг/моль. Переводя граммы в килограммы, получаем для молярной массы воды:
MH2O = 18 * 10-3 кг * моль-1.
? 6. Чему равна молярная масса:
а) водорода? б) кислорода? в) углекислого газа?
Воздух представляет собой смесь различных газов, главным образом – азота и кислорода. При решении задач воздух часто считают газом с молярной массой
Mвозд = 29 * 10-3 кг * моль-1.
? 7. Объясните, почему масса образца вещества m, его молярная масса M и число молей ν в данном образце связаны соотношением
ν = m/M. (4)
? 8. Сколько молей:
а) в одном литре воды? б) в 1 кг поваренной соли? в) в воздухе, занимающем объем классной комнаты шириной 5 м, длиной 10 м и высотой 4 м? Плотность воздуха при комнатной температуре и атмосферном давлении равна 1,2 кг/м3.
? 9. Объясните, почему массу m0 молекулы вещества можно выразить через его молярную массу M формулой
m0 = M/NA. (5)
? 10. Чему равна масса одной молекулы воды?
? 11. Объясните, почему число N молекул в образце вещества массой m можно найти с помощью соотношений
N = νNA = (m/M)NA.
? 12.Оцените число молекул в капельке воды радиусом 1 мм. Сравните найденное число молекул с числом звезд в галактике, содержащей сто миллиардов звезд (рис. 40.4).
? 13. Почему изображенные на рисунке 40.2 шарики имеют равные объемы при одинаковых температурах и давлениях?
4. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
Вернемся теперь к соотношению (pV)/T = kN.
? 14. Объясните, почему справедлива формула
(pV)/T = (m/M)kNA. (6)
Произведение постоянной Больцмана k на постоянную Авогадро NA называют универсальной газовой постоянной и обозначают R:
R = kNA = 8,31 Дж/(моль * К).
Используя универсальную газовую постоянную, уравнение (6) можно переписать в виде
pV = (m/M)RT. (7)
Это соотношение называют уравнением состояния идеального газа.
Дело в том, что модель идеального газа (которую мы рассмотрим в следующем параграфе) хорошо описывает уже известные нам свойства всех достаточно разреженных газов, например окружающего нас воздуха.
Уравнение идеального газа в виде формулы (7) предложил русский ученый Дмитрий Иванович Менделеев, поэтому его называют также уравнением Менделеева-Клапейрона.
Какие же задачи можно решать с помощью уравнения состояния идеального газа?
Плотность газа. Напомним, что плотность ρ = m/V.
? 15. Объясните, почему уравнение состояния идеального газа можно записать в виде
p = (ρ/M)RT.
Во многих задачах используют понятие нормальных условий для газа. По определению такими условиями называют давление 105 Па и температуру 0 ºС = 273 К.
? 16. Чему равна плотность воздуха:
а) при нормальных условиях?
б) при давлении 105 Па и комнатной температуре (20 ºС)?
Концентрация молекул газа. Концентрацией молекул и называют число молекул в единице объема. Ее можно выразить через число молекул N в данной массе газа и объем газа V:
n = N/V.
Концентрация молекул измеряется в 1/м3. Зная концентрацию молекул и объем газа, можно найти число молекул в нем.
? 17. Объясните, почему уравнение состояния идеального газ» можно записать в виде
p = nkT.
? 18. Рассмотрим газ при нормальных условиях.
а) Чему равна при этом концентрация молекул?
б) Различаются ли концентрации молекул различных газов при нормальных условиях? Обоснуйте свой ответ.
в) Сколько молекул воздуха вы вдыхаете при глубоком вдохе при 0 ºС, если объем легких увеличивается при этом на 2 л? Давление в легких считайте равным атмосферному.
Изменение массы газа. Из уравнения состояния идеального газа следует, что для одного и того же газа значение выражения (pV)/T пропорционально массе газа.
? 19. Гелий в баллоне с неплотно закрытым краном нагрели от 0 ºС до 20 ºС. При этом давление газа увеличилось от 2,2 * 105 Па до 2,3 * 105 Па. Объем баллона 100 л.
а) Во сколько раз увеличилась абсолютная температура газа?
б) Во сколько раз увеличилось давление газа?
в) Осталось ли неизменным значение выражения (pV)/T?
г) На сколько уменьшилось число молей газа?
д) Насколько уменьшилась масса газа?
Изменение числа молекул вследствие изменения состава молекулы. Значение выражения (pV)/T пропорционально числу молекул, поэтому оно изменяется, если масса газа остается неизменной, но изменяется число молекул.
? 20. При нагревании водорода от 300 К до 1350 К все молекулы распались на атомы. Начальное давление равно атмосферному. Объем сосуда не изменился.
а) Во сколько раз увеличилась абсолютная температура газа?
б) Во сколько раз увеличилось число молекул газа?
в) Каким стало давление газа?
Дополнительные вопросы и задания
21. Сколько молей вещества:
а) в ванне воды (200 л)?
б) в баллоне, содержащем 100 г кислорода?
в) в кубическом кристалле поваренной соли с длиной ребра 3 см? Плотность поваренной соли 2,2 * 102 кг/м3.
22. Сколько молекул:
а) в литре воды?
б) в баллоне, содержащем 100 г углекислого газа (CO2)?
в) в чайной ложке поваренной соли (6 г)?
23. Чему равна масса:
а) 6 * 1023 молекул водорода?
б) 3 * 1024 молекул воды?
в) 4,2 * 1022 атомов кислорода?
24. В 1 г некоторого двухатомного газа содержится 2,14 * 1022 молекул.
а) Чему равна молярная масса газа?
б) Какой это газ?
25. Какой высоты слой воды покрыл бы земной шар, если бы на него вылили столько же чайных ложек воды (по 5 мл), сколько молекул воды содержится в одной чайной ложке? Площадь поверхности земного шара примите равной 500 млн км2.
26. Имеются алюминиевый и медный кубики. В каком из них больше атомов, и во сколько раз больше, если у них: а) равные массы? б) равные объемы? Примите, что плотность алюминия составляет 0,3 от плотности меди.
27. Полный стакан воды (200 мл) полностью испарился за 10 дней. Сколько молекул воды покидало стакан ежесекундно? Сравните это число с населением Земли.
28. В бассейн глубиной 2 м, длиной 50 м и шириной 10 м бросили один кристаллик поваренной соли массой 0,1 г. Спустя очень длительное время из бассейна зачерпнули стакан воды. Сколько ионов натрия окажется в атом стакане?
29. Одинакова ли концентрация молекул газов, содержащихся в шариках, изображенных на рисунке 40.2 (с. 22)? Чему она равна при нормальных условиях?
30. В цилиндре под постоянным давлением находился озон (трехатомный кислород O3) при температуре 727 ºС. Когда температуру понизили до 127 ºС, весь озон превратился в кислород O2. Как изменился объем газа?
31. В расположенном вертикально цилиндрическом сосуде с площадью поперечного сечения 10 см2 под поршнем с грузом общей массой 40 кг находится 0,05 молей газа. Температура газа 27 ºС, давление атмосферы 105 Па.
а) Чему равно давление газа?
б) На какой высоте от дна сосуда находится поршень?
32. Цилиндрический сосуд разделен тонким подвижным поршнем на две части. В одной части сосуда находится 1 г водорода, а в другой – 1 г кислорода. Давление и температура газов одинаковы. Какую часть сосуда занимает водород?
Содержание:
Идеальный газ:
Наиболее простым из всех агрегатных состояний вещества является газообразное. Поэтому изучение свойств веществ начинают с газов. Газ (греч. chaos — хаос) — такое агрегатное состояние вещества, когда составляющие его частицы почти свободно и хаотически движутся между соударениями, во время которых происходит резкое изменение их скорости. Термин «газ» предложил в начале XVII в. нидерландский химик Ян Батист ван Гельмонт (1579— 1644).
Макро- и микропараметры:
При изучении механики в 9-м классе вы познакомились с понятием «состояние механической системы тел». Параметрами этого состояния являются координаты, скорости или импульсы тел. В тепловых процессах основными физическими величинами, характеризующими состояние макроскопических тел без учёта их молекулярного строения, являются давление
Одна из важнейших задач молекулярно-кпнетической теории состоит в установлении связи между макроскопическими и микроскопическими параметрами.
Идеальный газ
Для теоретического объяснения свойств газов используют их упрощённую модель — идеальный газ.
Идеальный газ — модель газа, удовлетворяющая следующим условиям: 1) молекулы газа можно считать материальными точками, которые хаотически движутся; 2) силы взаимодействия между молекулами идеального газа практически отсутствуют (потенциальная энергия их взаимодействия равна нулю); силы действуют только во время столкновений молекул, причём это силы отталкивания.
Поведение молекул идеального газа можно описать, используя законы Ньютона и учитывая, что между соударениями молекулы движутся практически равномерно и прямолинейно.
Модель идеального газа можно использовать в ограниченном диапазоне температур и при достаточно малых давлениях. Так, например, свойства водорода и гелия при нормальном атмосферном давлении и комнатной температуре близки к свойствам идеального газа.
Изучая физику в 7-м классе, вы узнали, что давление газа на стенки сосуда, в котором он находится, как и на любое тело, помещённое внутрь сосуда, создаётся в результате ударов частиц, образующих газ (рис. 14). Вследствие хаотичности их движения усреднённое по времени давление газа в любой части сосуда одинаково, и его можно определить по формуле
Выражение (3.1) называют основным уравнением молекулярно-кинетической теории идеального газа. Это уравнение позволяет рассчитать макроскопический параметр давление р идеального газа через массу 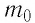
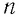
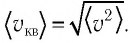
Зависимость давления газа от среднего значения квадрата скорости 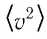
Обозначим через 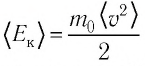
Из выражения (3.2) следует, что давление идеального газа зависит от средней кинетической энергии поступательного движения его молекул и их концентрации.
Пример №1
Баллон электрической лампы наполнен газом, плотность которого 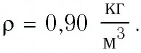
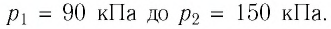
Решение. Покажем, что между плотностью р газа и концентрацией 
Тогда основное уравнение молекулярно-кинетической теории можно записать в виде: 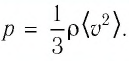
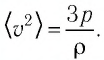
Ответ:
Пример №2
В сосуде вместимостью 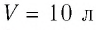
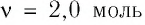
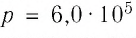
Решение. Из основного уравнения молекулярно-кинетической теории, записанного в виде 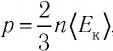
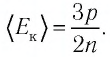
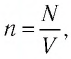
Ответ:
Уравнение состояния идеального газа
Выясним, как связаны между собой макроскопические параметры идеального газа, которые характеризуют его равновесное состояние: давление, масса всего газа, объём, предоставленный ему, и температура.
Состояние макроскопической системы полностью определено, если известны её макроскопические параметры — давление р, масса 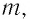
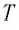
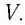
Если при переходе идеального газа из одного состояния в другое число его т
молекул 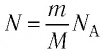
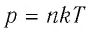
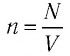
где 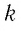
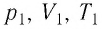
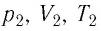
или
При неизменных массе и молярной массе идеального газа отношение произведения его давления и объёма к абсолютной температуре является величиной постоянной.
Уравнение (5.2) связывает два рассматриваемых состояния идеального газа независимо от того, каким образом газ перешёл из одного состояния в другое.
Уравнение состояния в виде (5.2) впервые вывел в 1834 г. французский физик Бенуа Клапейрон (1799—1864), поэтому его называют уравнением Клапейрона.
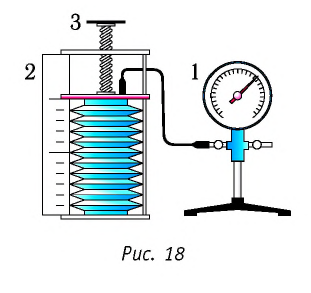
В справедливости уравнения состояния можно убедиться, воспользовавшись установкой, изображённой на рисунке 18. Манометром 1, соединённым с герметичным гофрированным сосудом, регистрируют давление газа внутри сосуда. Объём газа в сосуде можно рассчитать, используя линейку 2. Температура газа в сосуде равна температуре окружающей среды и может быть измерена термометром.
Измерив параметры газа 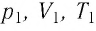
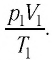
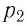
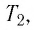
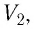
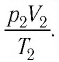
Уравнение состояния (5.2) можно применять для газов при следующих условиях:
- не очень большие давления (пока собственный объём всех молекул газа пренебрежимо мал по сравнению с предоставленным ему объёмом);
- не слишком низкие или же высокие температуры (пока абсолютное значение потенциальной энергии межмолекулярного взаимодействия пренебрежимо мало по сравнению с кинетической энергией теплового движения молекул).
Поскольку число частиц 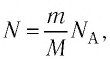
Величину, равную произведению постоянной Больцмана 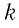
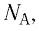
С учётом выражения (5.4) уравнение (5.3) примет вид:
Поскольку количество вещества 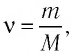
Уравнение состояния в виде (5.5) впервые получил русский учёный Д. И. Менделеев (1834—1907) в 1874 г., поэтому его называют уравнением Клапейрона—Менделеева.
Отметим, что уравнение Клапейрона—Менделеева связывает между собой макроскопические параметры конкретного состояния идеального газа. Используя уравнение Клапейрона-Менделеева, можно описать различные процессы, происходящие в идеальном газе.
Давление смеси газов
В повседневной жизни часто приходится иметь дело не с газом, состоящим из одинаковых молекул, а со смесью нескольких разнородных газов, не вступающих в химические реакции при рассматриваемых условиях. Например, воздух в комнате является смесью азота, кислорода, инертных газов и водорода, а также некоторых других газов.
Вследствие теплового движения частиц каждого газа, входящего в состав газовой смеси, они равномерно распределяются по всему предоставленному смеси объёму. Столкновения частиц обеспечивают в смеси тепловое равновесие.
Каждый газ вносит свой вклад в суммарное давление, производимое газовой смесью, создавая давление, называемое парциальным.
Парциальное давление — давление газа, входящего в состав газовой смеси, если бы он один занимал весь объём, предоставленный смеси, при той же температуре.
Смесь идеальных газов принимают за идеальный газ.
Из истории физики:
Фундаментальные исследования газовых смесей провёл английский учёный Джон Дальтон (1766-1844). Им сформулирован закон независимости парциальных давлений компонентов смеси (1801-1802). В 1802 г. на несколько месяцев раньше французского учёного Жозефа Гей-Люссака (1778-1850) Дальтон установил закон теплового расширения газов, а также ввёл понятие атомного веса.
При постоянных массе и молярной массе отношение произведения давления идеального газа и его объёма к абсолютной температуре является величиной постоянной (уравнение состояния идеального газа):
Парциальное давление — давление газа, входящего в состав газовой смеси, если бы он один занимал весь объём, предоставленный смеси, при той же температуре.
Пример №3
Баллон с газом, давление которого 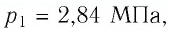
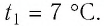
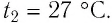
Решение. Если пренебречь тепловым расширением баллона, то его вместимость не изменяется. Запишем уравнение Клапейрона—Менделеева для начального и конечного состоянии газа, считая его идеальным:
откуда
Тогда
Ответ:
Основное уравнение молекулярно-кинетической теории идеального газа
В молекулярной физике изучаются свойства вещества во всех агрегатных состояниях, в том числе и газообразном. В природе почти нет отдельно взятого газа, реальный газ атмосферы представляют собой сложную систему разных газов.
Основная задача молекулярно-кинетической теории — установление связи между макроскопическими и микроскопическими параметрами, характеризующими свойства этой сложной системы. С этой целью реальный газ сложного состава заменяется упрощенной, идеализированной моделью.
Идеальный газ:
Первый шаг в создании любой физической теории состоит в построении идеализированной модели реального объекта. Такая модель всегда имеет упрощенный вид действительности, и с ее помощью изучаются количественные и качественные закономерности и свойства реального объекта с учетом определенных ограничений.
Для изучения свойств газов в молекулярно-кинетической теории применяется идеализированная модель — «идеальный газ».
Идеальный газ — это газ, удовлетворяющий следующим условиям:
- — линейные размеры молекул во много раз меньше расстояний между ними и не принимаются во внимание. Поэтому можно сказать, что молекулы идеального газа не взаимодействуют друг с другом, то есть потенциальная энергия взаимодействия молекул идеального газа равна нулю:
Поэтому идеальный газ можно сколько угодно сжимать; —только при соударении молекул друг с другом или со стенками сосуда между ними возникают силы отталкивания;
- — соударения молекул абсолютно упругие;
- — скорость молекул может иметь произвольные значения, движение каждой молекулы подчиняется законам классической механики.
Свойства идеального газа характеризуются микроскопическими и макроскопическими параметрами и связями между ними.
Микроскопические параметры газа — это параметры, характеризующие движение молекул газа. К ним относятся масса молекулы, его скорость, импульс и кинетическая энергия поступательного движения молекулы.
Макроскопическими являются такие параметры газа, как ее давление, объем и температура, определяющие свойства газа в целом.
Основной задачей молекулярно-кинетической теории является установление взаимной связи между микроскопическими параметрами, характеризующими молекулы газа, и макроскопическими (измеряемыми) величинами, характеризующими газ.
Основное уравнение молекулярно-кинетической теории идеального газа:
Известно, что давление газа возникает в результате многочисленных непрерывных и беспорядочных соударений молекул газа о стенки сосуда, в котором он находится. Это давление равно среднему значению модуля равнодействующей силы, приходящейся на единицу площади:
В 1857 г. немецкий физик Рудольф Клаузиус (1822-1888), используя модель идеального газа, определил уравнение для давления газа, называемое основным уравнением молекулярно-кинетической теории идеального газа.
Основное уравнение молекулярно-кинетической теории идеального газа — это уравнение, связывающее макроскопический параметр газа — его давление, с микроскопическими параметрами, характеризующими молекулы газа:
Где 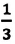
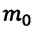
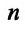
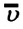
Концентрация молекул — это число молекул в единице объема:
Единица концентрации в СИ:
Средняя квадратичная скорость молекул равна корню квадратному из средней арифметической величины квадратов скоростей отдельных молекул:
Так как среднее значение квадрата скорости молекул связано со средним значением кинетической энергии их поступательного движения, то, следовательно, и давление идеального газа зависит от среднего значения кинетической энергии молекул:
Давление идеального газа прямо пропорционально концентрации молекул и среднему значению кинетической энергии молекул.
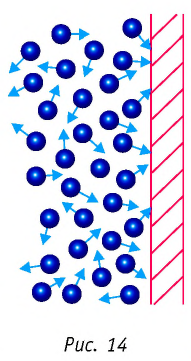
Если принять во внимание, что плотность газа 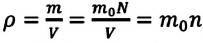
Вы исследовали идеальный газ с позиций MKT и определили связь между его макроскопическими и микроскопическими параметрами.
Уравнение Клапейрона
Связь между тремя макроскопическими параметрами (давление, объем и температура), характеризующими состояние идеального газа, определяет уравнение состояние идеального газа.
Уравнение состояния идеального газа — это уравнение, описывающее состояние газа и устанавливающее связь между параметрами его начального и конечного состояний.
Если число молекул идеального газа остается постоянным, то есть масса и молярная масса не меняются, то при переходе идеального газа из одного состояния в другое, из формул (6.2) и (6.9) имеем для этих состояний:
Где 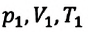
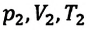
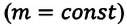
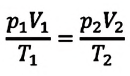
Это уравнение (6.15), характеризующее состояние идеального газа, впервые в 1834 году получил французский физик Бенуа Клапейрон (1799-1864), поэтому его назвали уравнением Клапейрона.
Отношение произведения давления идеального газа данной массы на его объем к абсолютной температуре является постоянной величиной.
Уравнение Менделеева-Клапейрона:
Приняв во внимание формулу, связывающую число частичек вещества, общую массу вещества, молярную массу и число Авогадро,
в формуле (6.14), получим:
Произведение постоянной Больцмана на постоянную Авогадро также является постоянной величиной. Оно называется универсальной газовой постоянной, обозначается буквой 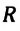
Приняв во внимание выражение (6.17) в (6.16), получаем выражение, характеризующее состояние идеального газа и называемое уравнением Менделеева-Клапейрона.
Физический смысл универсальной газовой постоянной определяется из последнего выражения.
Универсальная газовая постоянная равна отношению произведения давления и объема к абсолютной температуре одного моля любого газа.
Уравнение Менделеева-Клапейрона можно записать и в таком виде:
Где 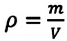
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
- Температура в физике
- Парообразование и конденсация
- Зависимость веса тела от вида движения
- Движение тел под воздействием нескольких сил
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
Содержание
- Молекулярная физика Основные формулы
- 1. Основы молекулярно-кинетической теории. Газовые законы
- 2. Основы термодинамики
- Как найти объем молекулы через плотность
- Основные положения молекулярно-кинетической теории (МКТ)
- Масса и размеры молекул
- Количество вещества
- Формулы для решения задач
- Молекулярная физика
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
μ — молярная масса вещества;
NA = 6,02·10 23 моль -1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
n = N/V — концентрация молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10 -23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C -1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Источник
Как найти объем молекулы через плотность
МКТ — это просто!
«Ничто не существует, кроме атомов и пустого пространства …» — Демокрит
«Любое тело может делиться до бесконечности» — Аристотель
Основные положения молекулярно-кинетической теории (МКТ)
Цель МКТ — это объяснение строения и свойств различных макроскопических тел и тепловых явлений, в них протекающих, движением и взаимодействием частиц, из которых состоят тела.
Макроскопические тела — это большие тела, состоящие из огромного числа молекул.
Тепловые явления — явления, связанные с нагреванием и охлаждением тел.
Основные утверждения МКТ
1. Вещество состоит из частиц (молекул и атомов).
2. Между частицами есть промежутки.
3. Частицы беспорядочно и непрерывно движутся.
4. Частицы взаимодействуют друг с другом (притягиваются и отталкиваются).
Подтверждение МКТ:
1. экспериментальное
— механическое дробление вещества; растворение вещества в воде; сжатие и расширение газов; испарение; деформация тел; диффузия; опыт Бригмана: в сосуд заливается масло, сверху на масло давит поршень, при давлении 10 000 атм масло начинает просачиваться сквозь стенки стального сосуда;
— диффузия; броуновское движение частиц в жидкости под ударами молекул;
— плохая сжимаемость твердых и жидких тел; значительные усилия для разрыва твердых тел; слияние капель жидкости;
2. прямое
— фотографирование, определение размеров частиц.

Броуновское движение
Броуновское движение — это тепловое движение взвешенных частиц в жидкости (или газе).
Броуновское движение стало доказательством непрерывного и хаотичного (теплового) движения молекул вещества.
— открыто английским ботаником Р. Броуном в 1827 г.
— дано теоретическое объяснение на основе МКТ А. Эйнштейном в 1905 г.
— экспериментально подтверждено французским физиком Ж. Перреном.
Масса и размеры молекул
Размеры частиц
Диаметр любого атома составляет около 

Число молекул в веществе
где V — объем вещества, Vo — объем одной молекулы
Масса одной молекулы
где m — масса вещества,
N — число молекул в веществе
Единица измерения массы в СИ: [m]= 1 кг
В атомной физике массу обычно измеряют в атомных единицах массы (а.е.м.).
Условно принято считать за 1 а.е.м. :
Относительная молекулярная масса вещества
Для удобства расчетов вводится величина — относительная молекулярная масса вещества.
Массу молекулы любого вещества можно сравнить с 1/12 массы молекулы углерода.
где числитель — это масса молекулы, а знаменатель — 1/12 массы атома углерода

Относительная атомная масса химического элемента
где числитель — это масса атома, а знаменатель — 1/12 массы атома углерода

Относительная атомная масса каждого химического элемента дана в таблице Менделеева.
Другой способ определения относительной молекулярной массы вещества
Относительная молекулярная масса вещества равна сумме относительных атомных масс химических элементов, входящих в состав молекулы вещества.
Относительную атомную массу любого химического элемента берем из таблицы Менделеева!)
Количество вещества
Количество вещества (ν) определяет относительное число молекул в теле.
где N — число молекул в теле, а Na — постоянная Авогадро
Единица измерения количества вещества в системе СИ: [ν]= 1 моль
1 моль — это количество вещества, в котором содержится столько молекул (или атомов), сколько атомов содержится в углероде массой 0,012 кг.
Запомни!
В 1 моле любого вещества содержится одинаковое число атомов или молекул!
Но!
Одинаковые количества вещества для разных веществ имеют разную массу!
Постоянная Авогадро
Число атомов в 1 моле любого вещества называют числом Авогадро или постоянной Авогадро:
Молярная масса
Молярная масса (M) — это масса вещества, взятого в одном моле, или иначе — это масса одного моля вещества.


Единица измерения молярной массы: [M]=1 кг/моль.
Формулы для решения задач
Эти формулы получаются в результате подстановки вышерассмотренных формул.
Масса любого количества вещества
Количество вещества
Число молекул в веществе
Молярная масса
Масса одной молекулы
Связь между относительной молекулярной массой и молярной массой

Молекулярная физика. Термодинамика — Класс!ная физика
Источник
Молекулярная физика
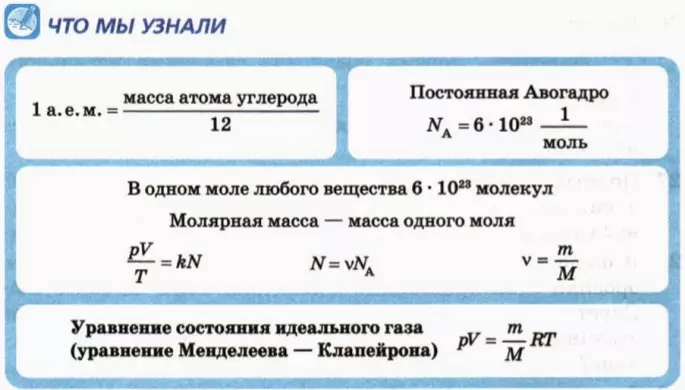
Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация 

Формула плотности
Здесь 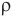
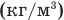

Формула относительной молекулярной массы
Здесь 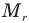
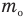
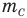
Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 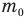
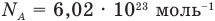
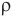
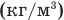

Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул 

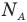
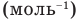
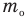
Формулы средней квадратичной скорости молекул
Здесь 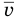
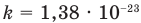
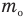
Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), 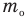

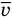
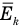
Формула средней кинетической энергии молекул
Здесь 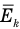
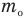
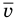
Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь 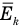
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем 
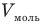
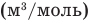
Объединенный газовый закон — уравнение Клапейрона
при
Здесь 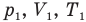

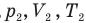

Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 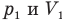

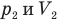

Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), 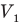
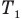

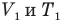

Закон Шарля
при
Здесь V — объем газа 
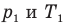
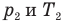
Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа 
Формулы относительной влажности
Здесь 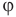
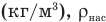
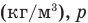
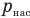
Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), 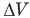
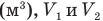

Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 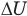
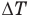
Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 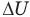
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
Здесь Т — абсолютная температура (К), 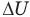
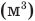
Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 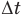
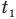
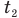
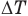
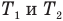
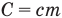
Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 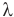
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь 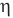
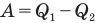
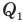
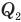
Коэффициент полезного действия идеального теплового двигателя
Здесь 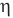
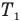
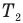
Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Возможно вам будут полезны эти страницы:





















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Источник