Как говорит народная пословица: «Семь раз отмерь, один раз отрежь». Этот метод не устареет никогда. Каждый строитель знает, что перед тем как приступать к той или иной работе, нужно все тщательно просчитать, изучить и составить план. Для чего это нужно? Одна из причин – узнать нужное количество расходуемого материала, подсчитать, во сколько это обойдется, и приобрести все что нужно. Если вы планируете строить дом, вас может интересовать вопрос, каков расход раствора на 1 м2 кладки кирпича? Ведь вам нужно заранее купить все составляющие для смеси, такие как песок, цемент и другие расходные материалы. Обратите внимание, что на качество готовой стены влияют такие факторы: качество материала и качество раствора. Если стену построить неправильно, то могут возникнуть мостики холода. Поэтому важно правильно приготовить раствор и нанести нужное его количество. Прочитав данную информацию, вы узнаете расход раствора на кладку кирпича.
Что влияет на расход
Раствор – связующее звено между кирпичами. Без него произвести возвести стену невозможно. Он должен быть качественным, правильно приготовленным и иметь подходящую консистенцию. Один из важных моментов, которые нужно учитывать при расчете – это его вид состава. Самыми распространенными являются 4 типа раствора:
- Цементно-песчаная смесь. В ее состав входит цемент, песок и вода. Такой состав можно назвать самым прочным, если четко придерживаться технологии нанесения. А не то есть опасность, что он потрескается.
- Известняковая смесь. В ее составе отсутствует цемент, он заменяется негашеной известью. Смесь довольно пластичная, и с ней легко работать. Но, есть один минус – дождь ее легко вымоет. Вот почему она применяется только для внутренних работ.
- Смешанный раствор. Состав этой смеси комбинированный, и соединяет в себе материалы из первых двух видов. В итоге получается качественный раствор, превосходящий первые два.
- Состав с пластификатором. Песок фракции 2 мм и цемент дополнительно перемешивают с полимерной добавкой, которая повышает его пластичность.
Это самые популярные смеси, которые применяют в строительстве. Но, вы должны знать, что не только они влияют на расход. Немаловажный фактором является и сам кирпич. Его размер, формат, способность поглощать воду и наличие пустот напрямую определяют, сколько раствора будет в 1 м2 кладки кирпича. В целом, расход на 1 м2 составляет 0,2–0,25 м3. Все сводится к тому, что роль играет толщина стены, будь то в полкирпича, один, полтора или два. Чем больше толщина, тем больший расход. То же касается формы кирпича. К примеру, если он крупный, то расход снижается, если он с отверстиями, то расход значительно увеличивается. Как производится расчет раствора для кладки кирпича?
РАСХОД РАСТВОРА НА 1 М3
Чтобы узнать количество раствора на 1м3 кладки кирпича, рассмотрим такие данные. Рядовой кирпич имеет размеры 250×120×65. Существуют некие стандарты, которые показывают, сколько раствора нужно на 1 м3кладки кирпича:
- 0,189 м3 при строительстве в полкирпича (120 мм);
- 0,221 м3 при строительстве в один (250 мм);
- 0,234 м3 при строительстве в полтора (380 мм);
- 0,240 м3 при строительстве в два, (510 мм);
- 0,245 м3 при строительстве в два с половиной, (640 мм).
Получается, что на 1 стандартный кирпич, приходится 0,0006305 м3 раствора. Если перевести это в литры, то на 1 м2 толщиной 12 см, припадает 75 литров готовой смеси, а когда толщина равна 1,5 кирпичам (380 мм), расход увеличивается до 115 литров.
Если говорить об утолщенных изделиях (модулированных), то при их размерах 250×120×88, расход следующий:
- 0,160 м3 состава, при работе в полкирпича (120 мм);
- 0,20 м3 состава, при работе в один, (250 мм);
- 0,216 м3 состава, при работе в полтора, (380 мм);
- 0,222 м3 состава, при работе в два, (510 мм);
- 0,227 м3 состава, при работе в два с половиной, (640 мм).
Исходя из этих данных, видно, как размер материала влияет на расход раствора, на куб кладки кирпича. Есть некая закономерность: чем больше площадь, тем меньше требуется состава. Зная эти данные, вы можете приготовить нужное количество смеси для кладки. Вам остается подсчитать общий метраж и умножить его на расход за 1 м3. Теперь вы подготовлены и можете закупать материал для работы. Ниже приведена таблица, которая поможет вам узнать расход цемента и добавок, для получения идеальной консистенции состава.
Как определить сколько мешков цемента покупать
Теперь, давайте выясним расход цемента на 1 м2 кладки кирпича. Для этого, вы должны сделать 3 шага:
- Полностью рассчитать объем кладки.
- Определить объем необходимого количества смеси.
- Учитывая выбранные соотношения составляющих, рассчитать количество цемента.
К примеру, вам требуется подсчитать, сколько цемента уйдет на возведение наружных стен дома, размером 10×12 м. При этом, высота такого одноэтажного здания, составляет 3,2 м, а в качестве материала используются стандартные кирпичи 250×120×65 . Толщина стен выбрана 51 см. Итак, пункт 1 гласит, что требуется узнать общий объем. Из школы нам известна формула для нахождения объема: длина стен умножается на ее высоту и толщину. В нашем случае это следующие показатели: (10+10+12+12) × 3,2×0,51 = 71,808 м3. Получается, что требуемое число составляет 71,808 м3. Настало время узнать общий объем раствора.
Исходя из данных, приведенных выше, расход готовой смеси на 1 м3, при толщине стены в 51 см, составляет 0,240 м3. Узнать общее количество можно, умножив объем кладки на расход за 1 м3. Вот что должно выйти: 71,808 нужно умножить на 0,240. Используя калькулятор, получаем 17,233 м3. Это число указывает, сколько цементного раствора потребуется для работы. Из него требуется вычесть исключительно количество цемента.
Если выбранная пропорция составляет соотношение компонентов 1:3, то получается следующее: 17,233 требуется разделить на 4. Теперь вы знаете, сколько цемента вам необходимо для качественного раствора. Это число равно 4,308 м3. Остается пойти в магазин и купить столько мешков цемента, сколько потребуется. Но, цемент в кубометрах не продают. Материал расфасован в мешки по 25 или 50 кг, поэтому следует перевести наш показатель в килограммы. Чтобы сделать это, требуется знать плотность отвердителя. Как правило, в среднем этот показатель равен 1300 кг/м3. Производим вычисления: 4,308×1300 = 5600 кг. Теперь, 5600 кг делим на 50 (количество кг в одном мешке) и получаем расход в 112 мешков.
Вот и все, систему вы поняли, осталось только поменять числа, подставить свои и произвести необходимые вычисления. Все что требуется – калькулятор под рукой и готовые данные. Если все правильно сделать, то вы сможете значительно сэкономить свои средства и избежать того, что на складе останутся лишние материалы.
Выбор
соответствующей методики определения
витамина С обусловлен возможностями
школьной химической лаборатории. Так
как эти методики отличаются от методик,
рекомендованных ГОСТом [7], результаты
исследования не могут быть абсолютно
точными, но для сравнения различных
соков между собой они вполне подходят.
Содержание
витамина С (аскорбиновой кислоты)
определяется методом титрования. Как
правило, содержание кислот определяется
методом кислотно-основного титрования
в присутствии индикатора. Но в данном
случае определить аскорбиновую кислоту
с помощью щелочи невозможно, т.к. в соке
кроме аскорбиновой кислоты, есть еще
множество других кислот – лимонная,
яблочная, винная и другие. И отличить
одну кислоту от другой с помощью щелочи
не удается. Однако у аскорбиновой кислоты
есть свойство, которого нет у других
кислот – это быстрая реакция с йодом:
C6H8O6+
I2→
C6H6O6+
2HI
Один
моль аскорбиновой кислоты (176 г) реагирует
с одним молем йода (254 г). Аскорбиновая
кислота превращается в дегидроаскорбиновую
кислоту.
В
основе метода йодометрического титрования
лежат свойства йода и йодид-иона.
Свободный йод ведет себя как окислитель:
I2+
2e → 2I–
Йодид-ионы
(I–)
отдают свои электроны окислителями
играют роль восстановителей:
2I–+
2e → I20
Если
какой-нибудь восстановитель (в нашем
случае аскорбиновую кислоту) титровать
йодом в присутствии крахмала, то после
окончания титрования избыточная капля
йода вызовет неисчезающую синюю окраску.
[8]
Индикатор
йодометрического титрования
Кипячением
суспензии крахмала в воде получают
коллоидный раствор, используемый в
йодометрии как индикатор. Высокая
чувствительность крахмала к водному
раствору йода еще более увеличивается
в присутствии йодида калия, но с повышением
температуры она сильно понижается. Для
приготовления индикатора необходимо
взять 2 г крахмала, растереть с водой и
полученную кашицу влить в 0,5 л кипящей
дистиллированной воды, кипятить 2-3
минуты, дать остыть (жидкость должна
быть прозрачной, без комочков крахмала).
Правильно приготовленный индикатор
дает с каплей 0,1 н. раствора йода чистую
синюю окраску. [9]
Приготовление
рабочих растворов для определения
витамина С
Для
определения витамина С в соках необходимо
взять аптечную йодную настойку с
концентрацией йода 5 %, т.е. 5 г в 100 мл. Это
соответствует концентрации йода примерно
0,2 моль/л. Однако, аскорбиновой кислоты
в некоторых соках может быть так мало,
что на титрование определенного объема
сока (например, 20 мл) уходит всего 1-2
капли йодной настойки. При этом ошибка
анализа оказывается очень большой.
Чтобы результат был точнее, нужно брать
много сока, либо разбавить йодную
настойку. В обоих случаях число капель
йода, израсходованных на титрование,
увеличивается, и анализ будет точнее.
Для анализа фруктовых соков удобно к 1
мл йодной настойки добавить дистиллированной
воды до общего объема 40 мл, то есть
разбавить настойку в 40 раз. Концентрация
такого раствора будет около 0,005 моль/л;
1 мл его соответствует 0,88 мг аскорбиновой
кислоты. [9]
Проверка
методики
Прежде
чем приступить к анализу сока, необходимо
проверить методику на растворе, в котором
содержание витамина С уже известно.
Лучше всего подходит аскорбиновая
кислота в таблетках, продающаяся в
аптеке. Одна таблетка содержит 0,1 или
0,5 г чистого витамина. Растворим ее в
500 мл воды, тщательно перемешаем раствор
и отберем из него с помощью мензурки 25
мл. В этом количестве раствора аскорбиновой
кислоты будет в 20 раз меньше, чем в
таблетке. Добавим к нему 2-3 мл раствора
крахмала и осторожно, по каплям, добавляем
из бюретки разбавленный раствор йода,
постоянно взбалтывая содержимое.
Внимательно следим за цветом раствора.
Как только вся аскорбиновая кислота
прореагирует с йодом, следующая его
капля окрасит раствор в синий цвет.
Титрование надо вести до появления
устойчивого синего окрашивания. Определив
объем израсходованного раствора йода,
мы легко можем рассчитать, сколько
аскорбиновой кислоты было с самого
начала. Например, на титрование ушло 6
мл раствора йода. Следовательно,
аскорбиновой кислоты в растворе было
0,88 мг ∙ 6 мл = 5,28 мг, а в исходной таблетке
– в 20 раз больше, то есть 105,6 мг. Если
таблетка содержала 0,1 г (100 мг) аскорбиновой
кислоты, то это означает, что точность
анализа (около 5 %) вполне достаточна и
можно переходить к дальнейшим опытам
– определению витамина С в соках. [9]
Определение
аскорбиновой кислоты в соке
Необходимо
взять 25 мл апельсинового сока, добавить
к нему 2-3 мл раствора крахмала и осторожно,
по каплям, добавлять из бюретки
разбавленный раствор йода, постоянно
взбалтывая содержимое и внимательно
следя за цветом раствора. Как только
вся аскорбиновая кислота прореагирует
с йодом, следующая его капля окрасит
раствор в синий цвет. Титрование надо
вести до появления устойчивого синего
окрашивания. Определив объем
израсходованного раствора йода,
рассчитываем, сколько аскорбиновой
кислоты содержится в соке по формуле:
C
=
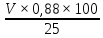
где
С – содержание витамина С в мг на 100 г
сока,
V
– объем израсходованного раствора йода
в мл. [9]
Титрование
повторять для каждого образца сока,
записывая объем израсходованного
раствора йода и рассчитывая содержание
витамина С в каждом образце.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
“
Один из самых простых в исполнении и наиболее распространенный метод количественного химического анализа — титриметрический. Он основан на измерении объема раствора с точно известной концентрацией реактива — титрованного раствора, расходуемого для реакции с определяемым веществом. О том, как приготовить титрованный раствор, поговорим в этом уроке.
Для успешного освоения материала рекомендуем вам изучить следующие понятия:
Точно измеренный объем раствора, взятый для анализа, который сохраняет свойства основного образца
Лабораторный сосуд для точного определения небольших объемов жидкостей, тонкая градуированная стеклянная трубка, открытая на одном конце и снабженная краном (стеклянным или тефлоновым) или зажимом на другом
Соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH
Метод определения кислот, оснований, солей, основанный на реакции взаимодействия между кислотой и основанием
Перенос точного количества сухого вещества или жидкости, сопровождающийся многократным ополаскиванием исходной тары
Раздел аналитической химии, в задачу которого входит определение количества элементов, функциональных групп, соединений в анализируемом объекте
Коническая колба, которую применяют при аналитических работах, в частности при титровании
Число, выражающее отношение действительной (практической) концентрации раствора к заданной (теоретической)
Нанесение условных знаков, букв, цифр, графических знаков или надписей на объект с целью его дальнейшей идентификации (узнавания), указания его свойств и характеристик
Число молей растворенного вещества в 1 литре раствора
Точно отведенное количество вещества
Метод определения окислителей или восстановителей, основанный на использовании окислительно-восстановительных реакций, протекающих между определяемым веществом и титрантом
Основано на определении конечной точки титрования (КТТ) по результатам измерения потенциала индикаторного электрода, реагирующего на изменение активности одного из участвующих в реакции веществ или продукта реакции
Соответствие техническим требованиям
Характеристика близости результатов, полученных для одного и того же образца одним и тем же методом в одних и тех же условиях (оператор, аппаратура, лаборатория) в течение короткого промежутка времени
Вещество, участвующее в химической реакции
Одна из наиболее распространенных мер центральной тенденции, представляющая собой сумму всех зафиксированных значений, деленную на их количество
Наборы химических реактивов, выпускаемые промышленностью в запаянных ампулах. Ампулы содержат точно известное количество вещества
Определение точной концентрации раствора
Образец вещества или материала с установленными по результатам испытаний значениями одной или более величин, характеризующих свойство или состав этого вещества или материала
Масса вещества в граммах / миллиграммах в 1 мл раствора (г/мл или мг/мл)
Отношение массы определяемого вещества к объему раствора, пошедшего на титрование данной массы, показывает массу вещества, титруемую 1 мл раствора
Метод количественного / массового анализа, который часто используется в аналитической химии, основанный на измерении объема раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом
Раствор точно известной концентрации, предназначенный для целей титриметрического анализа
Высшая степень чистоты реактива. Содержание основного компонента более 99%
Вид мерной химической посуды, предназначенной для измерения объемов жидкостей как на налив, так и для последующего выливания в другую посуду
Выражения для концентрации титрованного раствора
Молярная концентрация — количество моль растворенного вещества, содержащееся в 1 л раствора.
Титр — выраженная в миллиграммах масса растворенного вещества, содержащаяся в 1 мл раствора.
Титр по определяемому веществу — масса определяемого вещества, эквивалентная 1 мл данного титранта.
Эквивалент вещества — такое количество вещества, которое может присоединять или высвобождать один катион водорода в кислотно-основных (ионообменных) реакциях или один электрон в окислительно-восстановительных реакциях. Он определяется исходя из его химической формулы, принадлежности к тому или иному классу химических соединений, а также химической реакции протекающей между определяемым веществом и титрованным раствором.
Растворы стандартизируют двумя способами:
1. По стандартному титрованному раствору
2. По точной навеске соответствующего стандартного образца.
Формула расчета концентрации по стандартному титрованному раствору:
— молярная концентрация эквивалента стандартного раствора, моль/л
— молярная концентрация эквивалента титранта, моль/л
— аликвотная часть стандартного раствора, взятого на анализ, мл
— объем титранта, израсходованный на титрование, мл
Формула расчета концентрации по навеске:
— молярная концентрация эквивалента титранта, моль/л
— масса навески установочного вещества, г
— молярная масса эквивалента определяемого вещества, г/моль
— объем титранта, израсходованный на титрование, мл
Установление коэффициента поправки
- Использовать не менее 3 навесок установочного вещества или разных объемов раствора установочного вещества.
- Устанавливать коэффициент тем методом, которым будет проводиться количественный анализ.
- Состав среды, в которой стандартизируется титрованный раствор, должен быть таким же, как и тот, в котором он будет использован.
- Перед стандартизацией титрованный раствор необходимо тщательно перемешать.
- По итогам как минимум 3 титрований должны получиться коэффициенты поправки с относительным расхождением не более 0,2% и средний арифметический результат в промежутке от 0,98 до 1,02.
Приготовление 1М раствора соляной кислоты
Концентрированная соляная кислота

Концентрированная соляная кислота

1. Заполнить колбу на ⅓ объема водой.
2. Промыть пипетку, используя промежуточный промаркированный стакан с концентрированной кислотой и слив.
3. Отобрать 8,7 мл концентрированной соляной кислоты и перенести аликвоту в мерную колбу.
5. Проверить температуру.
6. Раствор комнатной температуры довести водой до метки.
7. Перемешать еще раз раствор.
Установка приготовленного раствора по карбонату натрия

Раствор индикатора метилового оранжевого

3 навески карбоната натрия

1. Перенести и растворить навеску карбоната натрия в 50 мл воды очищенной.
2. Добавить 2−3 капли раствора индикатора.
3. Титровать до красно-желтого оттенка раствора.
4. Зафиксировать объем титрованного раствора, который пошел на титрование. Повторить определение еще 2 раза.
5. Рассчитать коэффициент поправки по формуле:
6. Проверить приемлемость каждого из коэффициентов.
Сходимость:
На емкости с титрованным раствором должна содержаться следующая информация:
- Формула растворенного вещества
- Концентрация растворенного вещества
- Установленный коэффициент поправки
- Дата приготовления и установки коэффициента
- Индикатор, с которым устанавливался коэффициент
- Температура приготовления раствора
- ФИО готовившего
“
Вы узнали, как приготовить титрованный раствор. Закрепите новые знания с помощью тестов и интерактивных заданий.
Для закрепления полученных знаний пройдите тест
Какой концентрацией не может маркироваться титрованный раствор?
Титр раствора по определяемому веществу
Молярная концентрация эквивалента
В каких пределах должно находиться среднее арифметическое значение коэффициента поправки?
Масса определяемого вещества, эквивалентная 1 мл данного титранта, — это:
Титр по определяемому веществу
К сожалению, вы ответили неправильно
Прочитайте лекцию и посмотрите видео еще раз
Но можно лучше. Прочитайте лекцию и посмотрите видео еще раз
Вы отлично справились. Теперь можете ознакомиться с другими компетенциями














