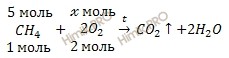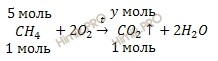Общая формула циклоалканов CnH2n.
Реакция горения:
CnH2n + 1,5*n О2 ——> n СО2 + n Н2О.
Из уравнения реакции видно, что число молей израсходованного кислорода в 1,5 раза больше числа молей образовавшейся воды. В реакциях с участием газов объёмные соотношения равны мольным. Значит и объём израсходованного кислорода будет в 1,5 раза больше объёма полученных водяных паров. Значит израсходовано 30 мл кислорода.
Здесь есть одна неточность, или условность. В условии указано 20 мл водных паров (н.у). Но при нормальных условиях (0°С, большая часть воды будет в жидкой фазе, и только небольшая часть в виде паров. Равенство мольных и объёмных соотношений нарушится. Но в таких простых задачах условно считается, что даже при нормальных условиях водяной пар имеет свойства идеального газа, и 1 моль (18 г) занимает объём 22,4 л, хотя на самом деле это далеко не так. Вот в этом и заключается условность.
Светило науки — 761 ответ — 8060 раз оказано помощи
1) Записываем уравнение реакции горения этана (C2H6):
2C2H6 + 7O2 -> 4CO2 + 6H2O
2) Находим кол-во вещества кислорода:
Так как нам известно кол-во вещества этана, мы можем соотнести кол-во вещества кислорода и этана, тогда мы найдём кол-во вещества кислорода.
n(O2) = 2 моль C2H6 — 7 моль O2
1,4 моль C2H6 — x моль O2
тогда, n(O2) = 7 * 1,4 моль : 2 = 4,9 моль
3) Находим объём кислорода:
V(O2) = Vm * n(O2) = 22,4 лмоль * 4,9 моль = 109,76 л
Ответ: V(O2) = 109,76 л.
Прошу вас.
Рассчитайте массу кислорода (O2), необходимого для полного сгорания метана (CH4) химическим количеством 5 моль. Определите объём (н. у.) углекислого газа (CO2), который при этом образуется.
Решение задачи
Запишем реакцию сгорения метана (CH4):
По уравнению реакции, найдем химическое количество кислорода (O2), который необходим для полного сгорания метана (CH4):
для сгорания метана 5 моль необходимо моль O2
для сгорания метана 1 моль необходимо 2 моль O2
Откуда:
Учитывая, что молярная масса кислорода равна 32 г/моль, по формуле, устанавливающей связь между химическим количеством вещества и массой, рассчитаем массу кислорода (O2), необходимого для полного сгорания метана (CH4):
Получаем:
m (O2) = 10 ∙ 32 = 320 (г).
По уравнению реакции, найдем химическое количество углекислого газа (CO2), который образуется при полном сгорании метана (CH4):
при сгорании метана 5 моль образуется y моль CO2
при сгорании метана 1 моль образуется 1 моль CO2
Откуда:
Воспользовавшись формулой, устанавливающей связь между химическим количеством вещества и объемом, рассчитаем объем углекислого газа (CO2), который образуется при полном сгорании метана (CH4):
Получаем:
V (CO2) = 5 ∙ 22,4 = 112 (л).
Ответ:
масса кислорода равна 320 грамм,
объем углекислого газа равен 112 литров.
Дано:
m(CH₄)=64г.
Vm=22,4л./моль
—————————
V(O₂) -?
1. Находим молярную массу метана:
M(CH₄)= 12+1×4=16г./моль.
2. Находим количество вещества n метана в 64г.
n=m÷M n(CH₄) = m(CH₄) ÷ M(CH₄)=64г.÷16г./моль= 4моль.
3. Запишем уравнение реакции горения метана:
CH₄ +2O₂ = CO₂ + 2H₂O
4. Анализируем уравнение реакции: по уравнению реакции на 1моль метана требуется 2моль кислорода , а у нас в условии
4моль метана, значит потребуется 8моль кислорода
n(O₂) =8моль
5. Определяем объем кислорода количеством вещества 8 моль:
V =n х Vm
V(O₂) =n(O₂) х Vm =8моль х 22,4л./моль=179,2 л.
6. Ответ при сжигании 64г. метана необходимо 179,2л.
Расчеты горения
Расчеты горения ведут по химическим уравнениям реакций, используя законы газового состояния: Бойля – Мариотта 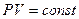
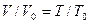
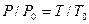
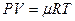
Рассмотрим реакцию горения водорода в кислороде: 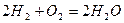
Рассмотрим реакцию горения метана в кислороде: 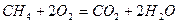
В практических условиях сжигание газа осуществляется в воздухе. Примем состав сухого воздуха: О2 – 21 %, N2 – 79%. Следовательно, 1 м 3 кислорода содержится в 100/21 = 4,76 м 3 воздуха. Или на 1 м 3 кислорода приходится 3,76 м 3 азота. Отсюда условная формула воздуха: (О2 + 3,76N2).
Запишем реакцию горения водорода в воздухе:
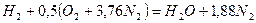
Из уравнения следует, что при нормальных условиях для полного сгорания 1 м 3 водорода требуется 0,5 × 4,76 = 2,38 м 3 воздуха. Таким образом, для сгорания 1 м 3 водорода требуется 2,38 м 3 воздуха. В результате образуются продукты сгорания: 1 м 3 воды в виде пара и 1,88 м 3 азота.
Запишем реакцию горения метана в воздухе:
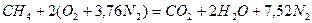
Из уравнения следует, что для полного сгорания 1 м 3 метана необходимо 2 × 4,76 = 9,52 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 метана требуется 9,52 м 3 сухого воздуха. Продукты сгорания содержат 1 м 3 диоксида углерода, 2 м 3 паров воды и 7,52 м 3 азота.
Запишем реакцию горения пропана в воздухе:
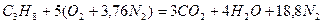
Из уравнения видно, что для полного сгорания 1 м 3 пропана необходимо 5 × 4,76 = 23,8 м 3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м 3 пропана требуется 23,8 м 3 сухого воздуха.
Приведенные расчеты выполнены для стехиометрических уравнений и полученные соотношения воздуха и газа называются стехиометрическими. Например, для горения метана в воздухе стехиометрическое соотношение – 9,52. В реальных условиях воздуха может не хватать для полного сгорания газа или, напротив, воздух подается в избыточном количестве. Для характеристики реальных соотношений воздуха и газа в процессе горения введена безразмерная величина: коэффициент избытка воздуха (окислителя) – коэффициент α. Для стехиометрического соотношения α = 1. Если имеет место недостаток воздуха, то α 1. Например, в процессе горения израсходовано 23 м 3 воздуха и 2 м 3 метана. Подсчитываем коэффициент α. Реальное соотношение воздуха и газа 23/2 = 11,5. Отсюда α = 11,5/9,52 = 1,2.
Выше показано, как можно подсчитывать необходимое количество воздуха для сгорания и определять объем продуктов сгорания для индивидуальных газов. Но обычно используемый газ – смесь различных газов. В этом случае расчет теоретически необходимого объема воздуха (воздуха сухого) ведется по формуле:
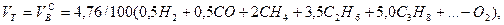
где 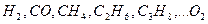
Используемый для сжигания атмосферный воздух содержит влагу, поэтому расчет объема влажного воздуха производят по формуле:
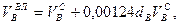
где 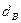
0,00124 – объем 1 г водяного пара.
И, наконец, определяется объем воздуха действительный с учетом величины коэффициента α по формуле:
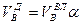
Пример. Имеется газ состава СН4 – 95%, С3Н8 – 5%. Определить объем воздуха действительного для сжигания данного газа при α = 1,1 и 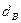

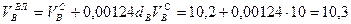
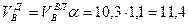
Объем продуктов сгорания газовой смеси определяется по следующим формулам.
Объем диоксида углерода
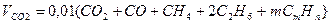
Объем водяных паров
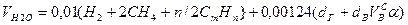
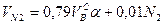
где N2 – процентное содержание азота в газовой смеси.
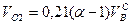
Суммарный объем продуктов сгорания

Дата добавления: 2015-06-22 ; просмотров: 8076 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Кислород горение расчеты по уравнениям реакций
Репетитор по химии и биологии
Богунова В.Г.
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
Диплом II степени
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускница репетитора В.Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
МГМСУ им. А.И. Евдокимова
выпускник репетитора В.Богуновой
Секретная шпаргалка по химии
4.3 Горение смеси газов
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Ребята, как мне нравится ваша реакция на мои статьи! Это что-то! Раньше я даже не подозревала, что буду получать удовольствие от написания статей, а еще большее удовольствие — от вашей реакции на них. В цирк ходить не нужно. Правда, пишут в комментариях мало, боятся попасться мне на зубок. Правильно боятся. Нехороший комментарий включает во мне дух воина-победителя, который издает боевой крик «Давай играть, как будто я голодная гиена, а ты — кость!» Дальше я за себя не отвечаю. Моим почитателям лучше не знать, чем такая игра заканчивается. А недруги до сих пор раны зализывают и, давясь слезами, фанатично читают мои статьи, издавая нервное икание.
Пишут мало, зато звонят много. И утром звонят, и днем звонят, и вечером звонят. Многие вполне нормальные вопросы задают, знакомятся и получают на свои вопросы вполне нормальные ответы. Но есть такие. Я же говорю, в цирк можно не ходить — развлекают прямо дома, за чашечкой кофе, бесплатно. Настоящее реалити-шоу! Народ не знает, что у меня на телефоне стоит программа-диктофон. Пишет все разговоры. И номер телефона тоже высвечивается. Обязательно помещу эти разговоры на YouTube и дам ссылку на Яндекс Дзен. Читайте мои статьи, и вы тоже услышите много чего интересного! Кстати, тех, кто дочитает статью до конца, ждет очень интересный подарок «На закуску»!
А теперь — к основной теме статьи. Я обещала рассказать хайповый прикол 28-го задания ЕГЭ? Выполняю обещание. Только не спрашивайте, откуда я это знаю — сорока на хвосте принесла и на ушко нашептала. Согласно «Спецификации контрольных измерительных материалов для проведения в 2019 году единого государственного экзамена по ХИМИИ» (серьезный документ ФИПИ), 28-е задание в проверяемые элементы содержания включает «Расчеты объемных отношений газов при химических реакциях. Расчеты по термохимическим уравнениям». Сегодня речь пойдет только о реакциях с газами (термохимию рассмотрим позже). До 2018 года задачи 28-го задания были несложными. Давайте вспомним:
Рассчитайте объем воздуха, необходимый для сжигания 1,4 л этилена. Считать объемную долю кислорода в воздухе равной 21%.
Задачу решаем стандартно, по Четырем Заповедям
• Первая Заповедь . Выписать данные в разделе «Дано»
• Вторая Заповедь . Написать уравнение реакции
• Третья Заповедь . Сделать предварительные расчеты по данным условия задачи и по уравнению реакции. По уравнению реакции определяем объем кислорода.
• Четвертая запов едь. Составить алгоритм решения задачи. Объем воздуха рассчитываем по формуле объемной доли кислорода
Как вы убедились, задача абсолютно легкая. Такого же уровня сложности и все остальные задания 28-й позиции. Но. мы наблюдаем тенденцию ежегодного усложнения заданий ЕГЭ. Я считаю, это абсолютно правильно! Химию сдают будущие медики, которым мы с вами доверим самое дорогое, что у нас есть — наши жизни. Думаю, никто из нас не захочет иметь дело с туповатым врачом, все ищут доктора получше. Потому медицинские ВУЗы стараются отбирать толковых учеников. Как это сделать? На простых заданиях невозможно определить достойный уровень знаний. Сложные задачи — хороший индикатор! Тот, кто хорошо решает задачи по химии, становится отличным врачом-диагностом (доказано на армии моих самых любимых учеников). Для повышения уровня знаний и мастерства будущих медиков (и не только) раскрываю великую тайну — новые приколы 28-го задания ЕГЭ . Почему множественное число? Потому что их, как минимум, четыре:
1) Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно
2) Определение объемного состав смеси по продуктам сжигания (задачи на уравнения с двумя неизвестными)
3) Определение состава смеси газообразных продуктов, если в условии избыток-недостаток, степень превращения или выход реакции
4) Задачи на изменение объема газовой смеси в процессе реакции
Каждый алгоритмический прием (фишку) я опишу в отдельной статье, с подробным анализом соответствующих задач. Сегодня мы разложим по полочкам первое гипотетическое нововведение «Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно». Итак, поехали!
Прежде чем вы приступите к изучению новых алгоритмических приемов 28-го задания, настоятельно рекомендую внимательно прочитать статью «Секретная шпаргалка по химии. 4.2. Состав смеси газов», в которой я рассказала о газовых смесях, плотности газа (абсолютной и относительной), средней молярной массе смеси газов, разложила по полочкам алгоритмы решения задач на определение средней молярной массы и плотности газа по компонентам газовой смеси и наоборот.
Рассчитайте объем воздуха, необходимый для сжигания 20 л смеси СО и Н2 (н.у.). Плотность этой смеси по аммиаку — 1,2.
Задачу решаем стандартно, по Четырем Заповедям
• Первая Заповедь . Выписать данные в разделе «Дано»
• Вторая Заповедь . Написать уравнение реакции. В задаче протекает две реакции. При написании реакций, не забываем делать отступ над каждой — для дальнейших расчетов.
• Третья Заповедь . С делать предварительные расчеты по данным условия задачи и по уравнению реакции. В задачах со смесями газов, предварительные расчеты связаны с определением состава смеси и объема каждого газа в смеси. Состав смеси газов определяем по формуле расчета средней молярной массы. вначале рассчитываем значение средней молярной массы по относительной плотности. Затем, по основной формуле составляем уравнение и решаем его. Определяем объем каждого газа в смеси по рассчитанным объемным долям и делаем расчеты по уравнению реакции.
• Четвертая запов едь. Составить алгоритм решения задачи. Алгоритм решения составляем по вопросу задачи: «Рассчитайте объем воздуха. « Объем воздуха рассчитывают по объему кислорода и объемной доле кислорода в воздухе. Вначале определяем общий объем кислорода, который был затрачен на сжигание газов. Затем, по формуле объемной доли определяем объем воздуха.
Решим еще несколько задач с новым алгоритмическим приемом «Расчеты по уравнениям реакции горения смеси газов, состав которой нужно определить предварительно».
Плотность по водороду смеси метана и угарного газа равна 10. Вычислите объем кислорода (н.у.), который израсходуется на сжигание 5 моль исходной смеси.
Рассчитайте объем воздуха (н.у.), необходимый для сжигания 4 л эквимолярной смеси метана и угарного газа. Вычислите плотность исходной смеси по аммиаку.
Вычислите плотность по водороду смеси пропана и метана, если известно, что смесь содержит 40% метана по объему. Какой объем кислорода израсходуется на сжигание 20 л этой смеси?
Обещанный подарок «На закуску» — задача на газы моего самого любимого автора И.Ю. Белавина. Решайте и наслаждайтесь! «Мама, вытри слезы, а иначе быть беде. Глупые вопросы — что я делаю и где? Пропадаю я — Белавина решаю я!»
И.Ю. Белавин, 2005, задача 206
Избыток кислорода смешали с триметиламином, подожгли, и продукты сгорания привели к нормальным условиям. Определите объемные составы исходной и конечной газовых смесей, если известно, что масса исходной газовой смеси оказалась на 8,1 г, а объем на 63,7% больше массы и объема конечной газовой смеси соответственно. (Ответ: Исходная V((CH3)3N) = 2,24 л; V(О2) = 13,6 л. Конечная V(СО2) = 6,72 л; V(N2) = 1,12 л; V(О2) = 1,84 л.)
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами.
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на видео-канал Репетитор по химии и биологии. Ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения заданий ЕГЭ.
Разработка урока по химии «Решение задач по теме»Кислород. Горение»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Тема урока: «Решение задач по теме «Кислород. Горение.»
Тип урока: закрепление знаний и умений учащихся
Цели урока: 1. обобщить и закрепить знания учащихся в решении задач по теме «Кислород. Горение»;
2. развивать умение анализирования заданий, нахождения способа решения задач;
3. привитие интереса к дальнейшему развитию науки.
Оборудование: презентация, карточки с заданиями; маркеры, ватман, клей, воздушные шары для заданий, корзина
Сообщение темы и целей урока.
Деление учащихся на группы
На интерактивную доску выводятся вопросы. От каждой команды один представитель выбирает вопрос. Если группа не отвечает на этот вопрос правильно, то ответ могут дать другие группы
Кем и когда был открыт кислород?
Назовите физические свойства кислорода.
Из приведенных ниже веществ определите те, из которых в лаборатории получают кислород: CaCO 3 , KClO 3 , Na 2 O , H 2 O , KMnO 4 , BaSO 4 , H 2 O 2 , K 3 PO 4
Каким образом можно проверить наличие кислорода в пробирке?
Нахождение кислорода в природе. Как пополняется запас кислорода в воздухе?
О чем идет речь в данных предложениях:
А) Кислород – газ, не имеющий цвета и запаха, необходим для дыхания живых организмов.
Б) В ПС кислород занимает 8 номер, его атомная масса равна 16.
№ 1. Вычисление массовой доли элемента.
Определите, в каком из этих веществ массовая доля кислорода больше: CO , NO , Н 2 О.
№ 2. Задачи на определение количества вещества
Определите, какую массу занимает кислород О 2 объемом 16л при н.у.( V m =22,4л/моль)
Определите число атомов кислорода О 2 , масса которого равна 5г ( N A = 6,02·10 23 моль -1 )
Ответ: 1. m (О 2 ) =22.7 г (23г) 2. N (О 2 )=0,96·10 23 = 9,6·10 22
Каждая группа получает конверт с разрезанными уравнениями реакций. Необходимо правильно составить уравнения реакций и расставить коэффициенты
№ 4. Решение задач по уравнению химической реакции
Определите массу кислорода O 2 необходимого для сжигания 8 г магния. (Ответ: 5,3г)
Сколько граммов оксида меди (II) С uO образовалось при сгорании 6,4 г меди в кислороде. (Ответ: 8г)
Сколько грамм сульфида алюминия Al 2 S 3 можно получить при взаимодействии 2,7 г алюминия с серой. (Ответ: 7,5г)
Подсчитывают баллы в листах оценивания
На стикерах учащиеся пишут отзывы об уроке и крепят на доску на соответствующую ступень
– все смог решить, могу помочь другу
– смог решить не все, нужно повторить
3 – не смог решить, нужна помощь друга
Повторить §§ 31-38, № , стр. .
Лист оценивания уч-ся _____ класса
Лист оценивания уч-ся _____ класса
Активность на уроке
Активность на уроке
Работа в группе
Работа в группе
Задачи на определение количества вещества
Задачи на определение количества вещества
Решение задач по уравнению химической реакции
Решение задач по уравнению химической реакции
Лист оценивания уч-ся _____ класса
Лист оценивания уч-ся _____ класса
Активность на уроке
Активность на уроке
Работа в группе
Работа в группе
Задачи на определение количества вещества
Задачи на определение количества вещества
Решение задач по уравнению химической реакции
Решение задач по уравнению химической реакции
Лист оценивания уч-ся _____ класса
Лист оценивания уч-ся _____ класса
Активность на уроке
Активность на уроке
Работа в группе
Работа в группе
Задачи на определение количества вещества
Задачи на определение количества вещества
Решение задач по уравнению химической реакции
Решение задач по уравнению химической реакции
Лист оценивания уч-ся _____ класса
Лист оценивания уч-ся _____ класса
Активность на уроке
Активность на уроке
Работа в группе
Работа в группе
Задачи на определение количества вещества
Задачи на определение количества вещества
Решение задач по уравнению химической реакции
Решение задач по уравнению химической реакции
Сколько грамм сульфида алюминия Al 2 S 3 можно получить при взаимодействии
2,7 г алюминия с серой.
Сколько граммов оксида меди (II) С uO образовалось при сгорании 6,4 г меди в кислороде.
Определите, в каком из этих веществ массовая доля кислорода больше: CO , NO , Н 2 О.
Определите, в каком из этих веществ массовая доля кислорода больше: CO , NO , Н 2 О.
Определите, в каком из этих веществ массовая доля кислорода больше: CO , NO , Н 2 О.
Определите, какую массу занимает кислород О 2 объемом 16л при н.у. ( V m =22,4л/моль)
Определите число атомов кислорода О 2 , масса которого равна 5г ( N A = 6,02·10 23 моль -1 )
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 956 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 51 человек из 29 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 572 024 материала в базе
Другие материалы
- 14.02.2018
- 337
- 0
- 14.02.2018
- 172
- 0
- 14.02.2018
- 750
- 2
- 14.02.2018
- 655
- 0
- 14.02.2018
- 1168
- 27
- 14.02.2018
- 6032
- 43
- 14.02.2018
- 349
- 0
- 14.02.2018
- 353
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 14.02.2018 2029
- DOCX 21.2 кбайт
- 19 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Бабаян Елена Размиковна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 7 лет
- Подписчики: 1
- Всего просмотров: 59149
- Всего материалов: 31
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В России действуют более 3,5 тысячи студенческих отрядов
Время чтения: 2 минуты
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
В школах Хабаровского края введут уроки спортивной борьбы
Время чтения: 1 минута
В Забайкалье в 2022 году обеспечат интернетом 83 школы
Время чтения: 1 минута
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
В России могут объявить Десятилетие науки и технологий
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
http://repetitor-him.ru/sthim_ssh_4(3).htm
http://infourok.ru/razrabotka-uroka-po-himii-reshenie-zadach-po-temekislorod-gorenie-2604216.html