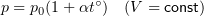Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация 

Формула плотности
Здесь 


Формула относительной молекулярной массы
Здесь 


Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 




Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул 




Формулы средней квадратичной скорости молекул
Здесь 


Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), 



Формула средней кинетической энергии молекул
Здесь 


Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь 
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем 


Объединенный газовый закон — уравнение Клапейрона
при
Здесь 



Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 



Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), 




Закон Шарля
при
Здесь V — объем газа 


Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа 
Формулы относительной влажности
Здесь 



Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), 


Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 

Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
к адиабатному: при Q = 0
Здесь Т — абсолютная температура (К), 

Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 





Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь 



Коэффициент полезного действия идеального теплового двигателя
Здесь 


Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы:
Молекулярная физика Основные формулы
1. Основы молекулярно-кинетической теории. Газовые законы
1.1 Количество вещества
m — масса;
μ — молярная масса вещества;
N — число молекул;
NA = 6,02·1023 моль-1 — число Авогадро
1.2 Основное уравнение молекулярно-кинетической теории идеального газа
p — давление идеального газа;
m — масса одной молекулы;
n = N/V — концентрация молекул;
V — объем газа;
N — число молекул;

1.3 Средняя квадратичная скорость молекул идеального газа
k = 1,38·10-23 Дж/К — постоянная Больцмана;
R = kNA = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T = t+273 — абсолютная температура;
t — температура по шкале Цельсия.
1.4 Средняя кинетическая энергия молекулы одноатомного газа
1.5 Давление идеального газа
n — концентрация молекул;
k — постоянная Больцмана;
T — абсолютная температура.
1.6 Закон Бойля-Мариотта
p — давление;
V — объем газа.
1.7 Закон Шарля
p0 — давление газа при 0 °С;
α = 1/273 °C-1 — температурный коэффициент давления.
1.8 Закон Гей-Люссака
V0 — объем газа при 0 °С.
1.9 Уравнение Менделеева-Клапейрона
1.10 Объединенный закон газового состояния (уравнение Клапейрона)
1.11 Закон Дальтона
pi — парциальное давление i-й компоненты смеси газов.
2. Основы термодинамики
2.1 Внутренняя энергия идеального одноатомного газа
ν — количество вещества;
R = 8,31 Дж/(моль·К) — универсальная газовая постоянная;
T — абсолютная температура.
2.2 Элементарная работа, совершаемая газом,
при изменении объема на бесконечно малую величину dV
p — давление газа.
При изменении объема от V1 до V2
2.3 Первый закон термодинамики
ΔQ — количество подведенной теплоты;
ΔA — работа, совершаемая веществом;
ΔU — изменение внутренней энергии вещества.
2.4 Теплоемкость идеального газа
ΔQ — количество переданной системе теплоты на участке процесса;
ΔT — изменение температуры на этом участке процесса.
Количество вещества (моль)
ν — количество вещества
N — число молекул
N_A — Число Авогадро
Мольная масса
M — мольная масса
m — масса
ν — количество вещества
Масса молекулы
m0 — масса молекулы
m — масса
N — число молекул
Мольная масса
M — мольная масса
m0 — масса молекулы
N_A — Число Авогадро
Число молекул
N — число молекул
m — масса
N_A — Число Авогадро
M — мольная масса
Основное уравнение молекулярно-кинетической теории
p — давление
n — концентрация
m0 — масса молекулы
v — скорость
Внутренняя энергия молекул
E — энергия
m — масса
v — скорость
Давление идеального газа
p — давление
n — концентрация
E — энергия
Концентрация молекул
n — концентрация
N — число молекул
V — объём
Газ: давление, объем, средняя кинетическая энергия
p — давление
V — объём
N — число молекул
E — средняя кинетическая энергия
Газ: давление, объем, температура
p — давление
V — объём
N — число молекул
k — постоянная больцмана
T — температура
Средняя кинетическая энергия
E — средняя кинетическая энергия
k — постоянная больцмана
T — температура
Газ: давление, концентрация, температура
p — давление
n — концентрация
k — постоянная больцмана
T — температура
Газ: количество вещества, громкость
ν — количество вещества
V — объём
V_M — мольный (молярный) объём
Уравнение среднеквадратичной скорости молекулы
v — скорость
k — постоянная больцмана
T — температура
m0 — масса молекулы
Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона)
p — давление
V — объём
m — масса
R — универсальная газовая постоянная
T — температура
M — мольная масса
Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона)
p — давление
V — объём
T — температура
ν — количество вещества
R — универсальная газовая постоянная
Закон бойля-мариотта (изотермический процесс)
p1, p2 — давление
V1, V2 — объемы
Закон гей-люссака (изобарный процесс)
T1, T2 — температуры
V1, V2 — объемы
Тепловое расширение газа
V — объём
V0 — объем при 0 C
α — коэффициент объемного расширения
T — температура
Закон Шарля (изохорный процесс)
p1, p2 — давление
V1, V2 — объемы
Температурная зависимость давления газа
p — давление
p0 — давление газа при 0 C
T — температура
γ — термический коэффициент давления газа
Основные формулы молекулярной физики
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
В кодификаторе ЕГЭ нет тем, непосредственно относящихся к содержанию данного листка. Однако без этого вводного материала дальнейшее изучение молекулярной физики невозможно.
Введём основные величины молекулярной физики и соотношения между ними.
— масса вещества,
— объём вещества,
— плотность вещества (масса единицы объёма). Отсюда
— число частиц вещества (атомов или молекул).
— масса частицы вещества. Тогда
— концентрация вещества (число частиц в единице объёма),
. Отсюда
Что получится, если умножить на
? Произведение массы частицы на число частиц в единице объёма даст массу единицы объёма, т. е. плотность. Формально:
Итак,
Массы и размеры частиц невообразимо малы по нашим обычным меркам. Например, масса атома водорода порядка г, размер атома порядка
см. Из-за столь малых значений масс и размеров число частиц в макроскопическом теле огромно.
Оперировать столь грандиозными числами, как число частиц, неудобно. Поэтому для измерения количества вещества используют специальную единицу — моль.
Один моль — это количество вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится в граммах углерода. А в
граммах углерода содержится примерно
атомов. Стало быть, в одном моле вещества содержится
частиц. Это число называется постоянной Авогадро:
моль
.
Количество вещества обозначается . Это число молей данного вещества.
Что получится, если умножить на
? Число молей, умноженное на число частиц в моле, даст общее число частиц:
Масса одного моля вещества называется молярной массой этого вещества и обозначается (
= кг/моль). Ясно, что
Как найти молярную массу химического элемента? Оказывается, для этого достаточно заглянуть в таблицу Менделеева! Нужно просто взять атомную массу (число нуклонов) данного элемента — это будет его молярная масса, выраженная в г/моль. Например, для алюминия
, поэтому молярная масса алюминия равна
г/моль или
кг/моль.
Почему так получается? Очень просто. Молярная масса углерода равна г/моль по определению. В то же время ядро атома углерода содержит
нуклонов. Выходит, что каждый нуклон вносит в молярную массу
г/моль. Поэтому молярная масса химического элемента с атомной массой
оказывается равной
г/моль.
Молярная масса вещества, молекула которого состоит из нескольких атомов, получается простым суммированием молярных масс. Так, молярная масса углекислого газа равна
г/моль
кг/моль.
Будьте внимательны с молярными массами некоторых газов! Так, молярная масса газообразного водорода равна г/моль, поскольку его молекула состоит из двух атомов
. То же касается часто встречающихся в задачах азота и кислорода
Вместе с тем, наиболее частый персонаж задач — гелий
— является одноатомным газом и имеет молярную массу
г/моль, предписанную таблицей Менделеева.
Ещё раз предостережение: при расчётах не забывайте переводить молярную массу в кг/моль! Если ваш ответ отличается от правильного на три порядка, то вы наверняка сделали именно эту, очень распространённую ошибку 
Что получится, если умножить на
? Масса частицы, умноженная на число частиц в моле, даст массу моля, т. е. молярную массу:
Благодарим за то, что пользуйтесь нашими публикациями.
Информация на странице «Основные формулы молекулярной физики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к экзаменам.
Чтобы успешно сдать нужные и поступить в ВУЗ или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023
Что такое молекулярная физика
Молекулярная физика — раздел физики, который изучает физические свойства тел на основе рассмотрения их молекулярного строения.
Свойства любого вещества диктуются особенностями его молекулярного строения. От индивидуальных характеристик строения молекулярной решетки, изменения межмолекулярных связей под воздействием факторов окружающей среды и времени их контакта зависят закономерности тех или иных процессов.
На физические свойства тел могут влиять давление, температура, электромагнитные поля. В результате этого первоначальные свойства предмета частично либо полностью видоизменяются. На практике, выбирая тот или иной состав вещества, обязательно учитывают его поведение при различных условиях эксплуатации: смену фазового состояния, появление поверхностных явлений и т.п.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Дать объяснение кардинальному либо частичному качественному изменению свойств можно только с позиции описания их макроскопических характеристик, вытекающих из микроскопического строения. Проявление законов межмолекулярных связей дают пояснение поведению тел при любых условиях.
Основные величины молекулярной физики и соотношения между ними
В основе физики, основывающейся на молекулярных особенностях, лежат величины, от них зависящие. Схематически их можно охарактеризовать следующим образом:
- Масса вещества (m).
- Объем (V).
- Плотность (ρ).
- Концентрация (n).
- Число частиц вещества (N).
Основные величины молекулярной физики взаимосвязаны друг с другом посредством следующих математических выражений:
(rho=mdiv V)
а значит (rho m=rhotimes V\)
Если N — число частиц вещества, а mo — масса каждой из них, то общая масса равна:
(m=Ntimes mo\)
Концентрацию вещества можно высчитать по формуле:
(n=Ndiv Vleft{right}\)
При умножении mo на N получится плотность ρ.
Формулы с пояснениями и обозначениями, к каким процессам применимы
В зависимости от условий окружающей среды вещества могут переходить из одного агрегатного состояния в другое:
- твердое;
- жидкое;
- газообразное.
Исходя из этого, оно проявляет различные свойства, изучение которых — задача молекулярной физики. Ее главной основой является молекулярно-кинетическая теория, рассматривающая тепловое движение молекул и атомов.
Основное уравнение молекулярно-кинетической теории идеального газа
Основополагающими моментами молекулярно-кинетической теории являются следующие:
- любое вещество имеет молекулярно-атомное строение;
- внутренние микрочастицы находятся в постоянном, хаотическом движении;
- они способны взаимодействовать друг с другом.
Примечание
Атомы, как и молекулы, электрически нейтральны, однако способны становиться положительными или отрицательными ионами, получая элетрозаряд. Тогда они называются катионами и анионами.
Если в обычном состоянии молекулы движутся хаотично (беспорядочно), то с возрастанием температуры увеличивается их кинетическая энергия, они разлетаются, а само вещество постепенно переходит в газообразную стадию. При низких температурах, напротив, молекулы конденсируются, а вещество переходит в жидкую или твердую форму.
Характер движения молекул в различных фазах различается. Если в твердой фазе они колеблются вокруг зафиксированных центров, то в жидкостях более свободны и могут осуществлять движение по всему объему. Именно этой особенностью вызывается такое свойство, как текучесть.
Для газообразного состояния характерно значительное превышение размеров расстояния между молекулами, чем их собственные габариты. Поэтому силы взаимодействия между ними невелики. Каждая микрочастица движется беспорядочно, пока не столкнется с себе подобной или стенкой сосуда. Это свойство вызывает способность газа расширяться и распространяться по всему объему сосуда.
Идеальный газ — теоретическая модель, широко применяемая для описания свойств и поведения реальных газов при умеренных давлениях и температурах.
Математическое выражение основного уравнения молекулярно-кинетической теории выглядит так:
(p=1⁄3ntimes motimes V2 кв)
Где p — давление газа, n — концентрация молекул в единице объема, mo — масса одной молекулы, Vкв — среднеквадратичная скорость молекулы.
Теоретическая суть уравнения заключается в определении зависимости между макротелом (газ, заключенный в сосуд) и его микропараметрами (характер движения молекул и атомов).
Молекула, сталкиваясь со стенкой сосуда, меняет свой импульс, поскольку не только она передает энергию стенке, но и получает противоположно направленный импульс. Это явление объясняют второй и третий законы Ньютона. Сумма всех ударов молекул о стенку создает давление газа.
Уравнение Менделеева-Клапейрона
Из постулатов молекулярно-кинетической теории вытекает уравнение состояния идеального газа:
(ptimes V=vtimes Rtimes T)
Где p — давление, V — объем, v — скорость движения частиц, R — универсальная газовая постоянная, равная 8,31 Дж/(моль∙К), T — температура
Это уравнение состояния идеального газа. Его открытие принадлежит Клайперону.
Примечание
Первоначально оно было сформулировано для одного моля газообразного вещества, позднее Менделеев установил его справедливость для большего количества молей.
Данное уравнение подразумевает определение параметров идеального газа, находящегося при нормальных условиях (температуре 273 К и давлении 1 атм).
Исходя из анализируемого равенства, известные параметры состояния идеального газа всегда помогут найти искомую величину. В то же время изменение любого из них вызовет коррекцию всех остальных.
Законы физиков Бойля, Гей-Люссака и Шарля
Физические законы, которые объясняют поведение идеального газа и дают возможность определить заданные показатели, носят имена своих открывателей. В зависимости от того, о чем идет речь в задаче, важно правильно выбрать закон, отражающий нужный критерий. Перед тем, как перейти к их характеристике, нужно обозначить следующие термины:
- парциальное давление — P, оказываемое газом, если бы в смеси не присутствовали другие компоненты;
- изотермический процесс — условия с постоянной температурой;
- изобарный процесс — условия с постоянным давлением;
- изохорный — с постоянным объемом.
Примечание
Если в задаче идет речь о количестве молекул применяется закон Авагадро, о смеси газов — закон Дальтона, при постоянном объеме газа — закон Шарля, изобарном процессе — Гей-Люссака, изотермическом — Бойля-Мариотта. При постоянной массе газа действует универсальный закон Клайперона.
Следствием уравнения Клайперона-Менделеева является газовый закон, открытый в 1662 году Р.Бойлем и параллельно — Э.Мариоттом (1676 г). Он гласит, что при постоянных массе и температуре величина, равная произведению давления газа на его объем остается неизменной.
Существует и другая, параллельная первой, формулировка: если температура газа постоянна, то давление его определенной массы обратно пропорционально объему.
Математическая запись выглядит следующим образом:
(p1div p2=V2div V1)
Закон Гей-Люссака гласит, что объем газа прямо пропорционален его абсолютной температуре. Обязательное условие для данного выражения — постоянное давление (процесс изобарный). Закон был открыт в 1802 году.
В качестве следствия из этого закона в курсе физики приводится заключение, что при постоянных массе и давлении газа соотношение объема и температуры газа остается постоянной величиной.
Для закона Гей-Люссака необходимо соблюдение изобарности процесса и постоянстве массы.
Закон Шарля называют вторым законом Гей-Люссака. В нем идет речь о соотношении температуры и давления идеального газа при постоянном объеме. Закон был открыт в 1787 году Шарлем. Уточнен в 1802 году Гей-Люссаком.
Формулировка закона Шарля: при фиксированных массе и объеме идеального газа давление прямо пропорционально абсолютной температуре идеального газа.
Закон имеет теоретическое подтверждение, поскольку мера средней кинетической энергии вещества — это температура. При ее увеличении частицы сильнее ударяются о стенку сосуда и количество ударов создает более высокое давление.
В качестве следствия из этого закона часто применяется следующее понятие: при постоянных массе и объеме идеального газа отношение его давления к температуре является постоянным. Обязательное условие — изохорность процесса.
Для решения задач с помощью газовых законов температура переводится из градусов Цельсия в Кельвины.
Закон Дальтона
Если сосуд заполняется не чистым газом, а смесью нескольких компонентов, то для определения давления на стенки применяется закон Дальтона.
Согласно закону Дальтона, общее давление будет равно сумме давлений каждого из компонентов смеси.
В этом законе вводится термин «парциальное» давление, т.е. то, которое производил бы один из компонентов, если бы был единственным.
Математическое выражение выглядит следующим образом:
p=p1+p2+p3+…pn
Обязательным условием действия этого закона является отсутствие химического взаимодействия между входящими в состав газовой смеси элементами.