Как найти объем одного моля
Чтобы найти объем одного моля вещества в твердом или жидком состоянии, найдите его молярную массу и поделите на плотность. Один моль любого газа в нормальных условиях имеет объем 22,4 л. В том случае если условия изменяются, рассчитайте объем одного моля при помощи уравнения Клапейрона-Менделеева.

Вам понадобится
- периодическая таблица Менделеева, таблица плотности веществ, манометр и термометр.
Инструкция
Определение объема одного моля жидкости или твердого тела
Определите химическую формулу твердого тела или жидкости, которая изучается. Затем, с помощью периодической таблицы Менделеева найдите атомные массы элементов, которые входят в формулу. Если один элемент входит в формулу несколько раз, умножьте его атомную массу на это число. Сложите атомные массы всех элементов и получите молекулярную массу вещества, из которого состоит твердое тело или жидкость. Она будет численно равна молярной массе, измеренной в граммах на моль.
По таблице плотности веществ найдите эту величину для материала изучаемого тела или жидкости. После этого поделите молярную массу на плотность данного вещества, измеренную в г/см³ V=M/ρ. В результате получите объем одного моля в см³. Если химическая формула вещества осталась неизвестной, определить объем одного его моля будет невозможно.
Определение объема одного моля газа
Если газ находится в так называемых нормальных условиях, при давлении 760 мм рт. ст. и 0ºС, то объем одного его моля, не зависимо от химической формулы равен 22,4 л (закон Авогадро, определяющий молярный объем газа). Чтобы перевести его в см³ умножьте на 1000, а в м³ — поделите на это же число.
Если же газ не находится в нормальных условиях, измерьте с помощью манометра его давление в паскалях и температуру в градусах Кельвина, для чего к измеренной термометром температуре в градусах Цельсия прибавьте число 273.
Из уравнения Клапейрона-Менделеева P•V= υ•R•T, выразите отношение объема газа на его количество вещества. Это и будет объем одного моля, которые равен произведению температуры газа на универсальную газовую постоянную, которая равна 8,31, поделенному на давление газа V/υ=R•T/P. Результат получите в м³ на моль. Чтобы перевести значение в см³, полученное число умножьте на 1000000.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Молярный объем газа

4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
Для того, чтобы узнать состав любых газообразных веществ необходимо уметь оперировать такими понятиями, как молярный объем, молярная масса и плотность вещества. В данной статье рассмотрим, что такое молярный объем, и как его вычислить?
Количество вещества
Количественные расчеты проводят с целью, чтобы в реальности осуществить тот или иной процесс или узнать состав и строение определенного вещества. Эти расчеты неудобно производить с абсолютными значениями массы атомов или молекул из-за того, что они очень малы. Относительные атомные массы также в большинстве случаев невозможно использовать, так как они не связаны с общепринятыми мерами массы или объема вещества. Поэтому введено понятие количество вещества, которое обозначается греческой буквой v (ню) или n. Количество вещества пропорционально числу содержащихся в веществе структурных единиц (молекул, атомных частиц).
Единицей количества вещества является моль.
моль – это такое количество вещества, которое содержит столько же структурных единиц, сколько атомов содержится в 12 г изотопа углерода.
Масса 1 атома равна 12 а. е. м., поэтому число атомов в 12 г изотопа углерода равно:
Na= 12г/12*1,66057*10в степени-24г=6,0221*10 в степени 23
Физическая величина Na называется постоянной Авогадро. Один моль любого вещества содержит 6,02*10 в степени 23 частиц.
Молярный объем газа
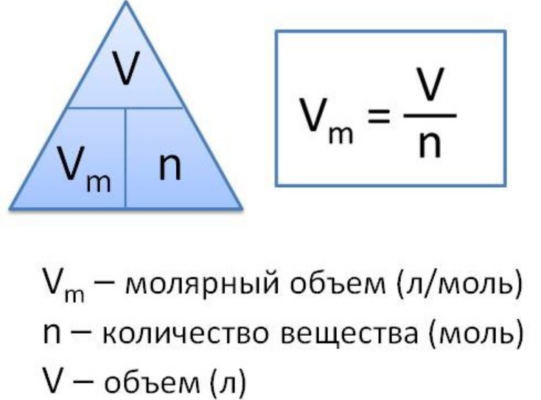
Молярный объем газа – это отношение объема вещества к количеству этого вещества. Эту величину вычисляют при делении молярной массы вещества на его плотность по следующей формуле:
Vm=M/p,
где Vm – молярный объем, М – молярная масса, а p – плотность вещества.
В международной системе Си измерение молярного объема газообразных веществ осуществляется в кубических метрах на моль (м3 /моль)
Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа. Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм3 /м.
Таблица «молярный объем газов»
В следующей таблице представлен объем некоторых газов:
| Газ | Молярный объем, л |
| H2 | 22,432 |
| O2 | 22,391 |
| Cl2 | 22,022 |
| CO2 | 22,263 |
| NH3 | 22,065 |
| SO2 | 21,888 |
| Идеальный | 22,41383 |
Что мы узнали?
Молярный объем газа, изучаемый по химии (8 класс) наряду с молярной массой и плотностью являются необходимыми величинами для определения состава того или иного химического вещества. Особенностью молярного газа является то, что в одном моле газа всегда содержится одинаковый объем. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта

Чтобы попасть сюда — пройдите тест.
-
Аэлита Коробка
5/5
-
Александр Котков
5/5
-
Настя Бабич
5/5
-
Александр Котков
5/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 503.
А какая ваша оценка?
Данный онлайн калькулятор рассчитывает молярный объем идеального газа в зависимости от условий (разных значений температуры и давления). Формулы и перечисление некоторых часто используемых значений для описания физических условий можно найти под калькулятором.
Молярный объем газа
Точность вычисления
Знаков после запятой: 3
Калькулятор использует уравнение молярного объема идеального газа:
Уравнение идеального газа является достаточно близкой аппроксимацией для многих реальных газов. Для заданных температуры и давления, молярный объем для всех идеальных газов один и тот же, и известен с точностью совпадающей с точностью универсальной газовой постоянной: R = 0.082 057 338(47) Л атм K−1 моль−1, то есть относительная стандартная неопределенность молярного объема равна 5.7×10−7, в соответствии с рекомендацией CODATA от 20141
Так как молярный объем одинаков для всех газов, он может быть вычислен независимо от газа по температуре и давлению (физическим условиям). Например, для стандартных условий по версии НИСТ (стандартной температуре 273.15 K и стандартному давлению 101.325 kPa), молярный объем идеального газа равен 22.413962×10-3 м3 моль-1 со стандартной неопределенностью 0.000013 x 10-3 м3 моль-12
Собственно, слова стандартные условия или нормальные условия (что не одно и тоже) для давления и температуры — это отсылка к «справочным», известным значениям температуры и давления, применяющимся для вычисления значений других физических величин, зависящих от давления и температуры.
Для удобства значения молярного объема для некоторых общеупотребимых физических условий приведены в таблице ниже.
| Физические условия | Температура | Давление | Молярный объем, литры |
|---|---|---|---|
| Стандартные условия (НИСТ) | 0C (273.15K) | 101.325кПа (1атм) | 22.414 |
| Стандартные условия (ИЮПАК) | 0C (273.15K) | 100.000кПа (1бар) | 22.711 |
| Нормальные условия (некоторые ГОСТы, НИСТ) | 20C (293.15K) | 101.325кПа (1атм) | 24.055 |
Разные отрасли и организации, могут использовать свои значения температуры и давления для расчетов. Используя калькулятор, мы можете ввести нужные вам значения температуры и давления и получить молярный объем газа.
Обратите внимание, что для больших значений (сотни атмосфер и тысячи градусов) поведение реальных газов отличается от поведения идеальных газов (собственно, поэтому они и не «идеальные») и использовать уравнение, приведенное выше, нельзя.
Концепция идеального газа. Закон Авогадро и молярный объем газа
Идеальный газ представляет собой удобную физическую модель, с использованием которой можно успешно решать многие практические проблемы реальных газов. В данной статье рассмотрим вопросы, что понимают под молярным объемом газа и как его вычислять.
Идеальный газ и его отличие от реального
Следует сразу сказать, что все газы, которые известны человеку, являются реальными. Тем не менее в большинстве случаев их можно считать идеальными. В последних полагают, что взаимодействия между атомами и молекулами не существует, и их размеры пренебрежимо малы, по сравнению со средними межмолекулярными расстояниями. Эти условия с высокой точностью соблюдаются в следующих случаях:
- давление в газах низкое (порядка 1 атмосферы);
- абсолютная температура высокая (300 К и выше);
- составляющие газ молекулы и атомы являются химически инертными, то есть они не способны образовывать друг с другом никакие типы химических связей.

Примером идеальной смеси газов является воздух, который в основном состоит из инертных молекул N2 и O2. Наоборот, водяной пар практически ни при каких давлениях не может считаться идеальным газом из-за существования между его полярными молекулами водородных связей.
Закон Клапейрона-Менделеева
Этот закон позволяет определить любой термодинамический параметр газовой идеальной системы, если известны два других параметра. Речь идет о таких термодинамических характеристиках, как температура T, объем V и давление P. Закон Клапейрона-Менделеева полезно рассмотреть в рамках данной темы статьи, поскольку с его помощью легко определить молярный объем газа идеального.
Закон Клапейрона-Менделеева записывается в виде следующего уравнения:
P*V = n*R*T.
Часть величин уже была описана выше. Величина n — это количество вещества в молях, буквой R обозначена универсальная постоянная для всех газов (8,314 Дж/(моль*К)).
Принцип Авогадро

Изучая в начале XIX века различные газы, итальянский ученый Амедео Авогадро пришел к важному экспериментальному открытию. Он установил, что объем, который занимают газы при постоянных условиях, оказывается прямо пропорциональным количеству вещества и не зависит от химического состава. Под постоянными условиями имеется в виду одинаковая температура и давление для всех газов в эксперименте.
Если положить T, P = const в уравнении Клапейрона-Менделеева, то мы получим математическую формулировку принципа или закона Авогадро:
n/V = const.
То есть при увеличении числа частиц в газовой системе ее объем растет пропорциональным образом.
В некоторых учебниках по физике формулируют следующим образом закон Авогадро: молярный объем газов при одинаковых температурах и давлениях является величиной постоянной, не зависящей от химической природы газовых частиц.
Из описанного принципа Авогадро можно вывести закон Джона Дальтона о парциальных давлениях газовых смесей, согласно которому парциальное давление компонента прямо пропорционально его атомной доле в газовой смеси.

Вычисление молярного объема газа при нормальных условиях
Речь идет об объеме, который в пространстве занимает 1 моль идеального газа при заданных условиях (температура, давление). Для вычисления этой величины воспользуемся уравнением Клапейрона-Менделеева. Из него получаем формулу для объема газовой системы:
V = n*R*T/P.
Поскольку мы вычисляем молярный объем, то n = 1 моль, тогда:
V = 8,314*T/P.
Подставляя в эту формулу интересующие нас значения температуры и давления, мы может рассчитать молярный объем идеального газа. Например, при нормальных условиях (0 oC и 1 атм.), получаем:
V = 8,314*273,15/101325 = 0,0224 м3.
Переводя в более удобные на практике единицы измерения объема, получаем V = 22,4 литра. Заметим, что в формулу мы подставили давление в паскалях и температуру в кельвинах. Обе единицы используются в качестве основных в системе СИ.
Автор:
19-01-2019 12:26
Жду ваши вопросы и мнения в комментариях