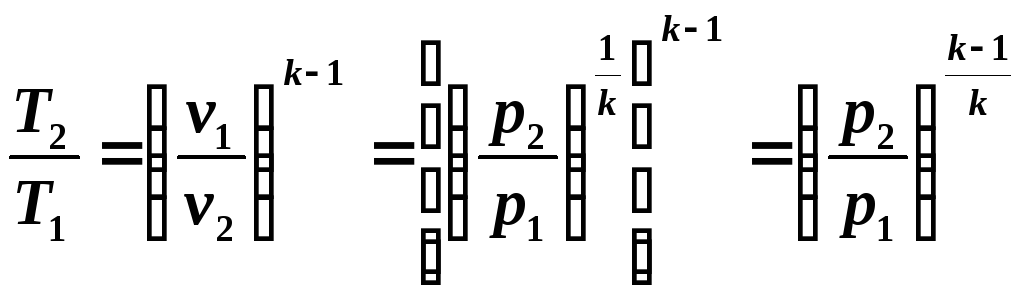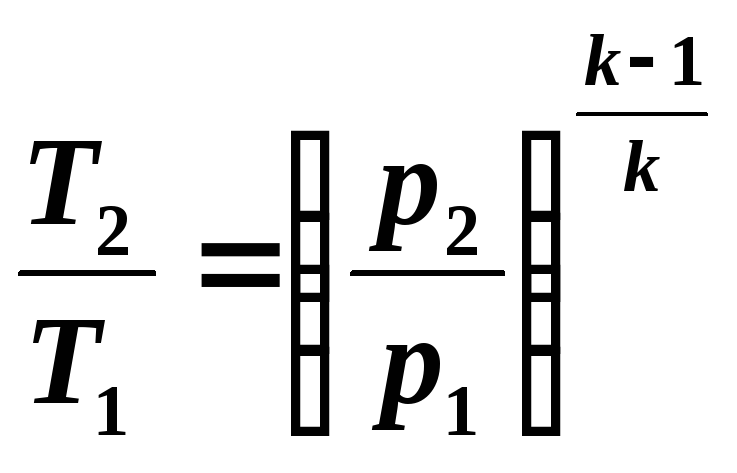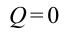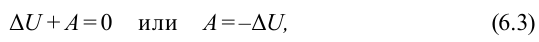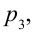Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.

Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R — газовая константа, которая играет роль коэффициента пропорциональности.
Что это адиабатический процесс?
Адиабатический процесс — это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Уравнения Пуассона для адиабатического процесса
Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV — изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV — малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP — изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ — это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
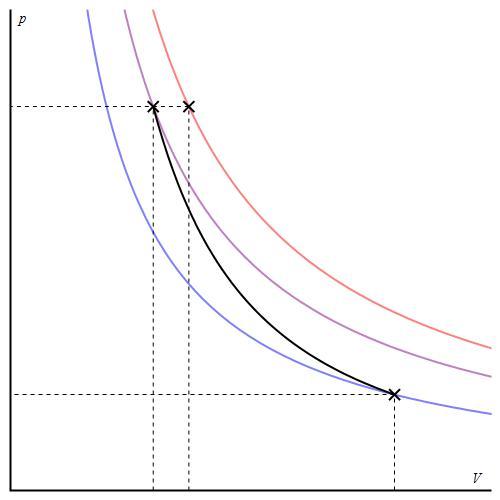
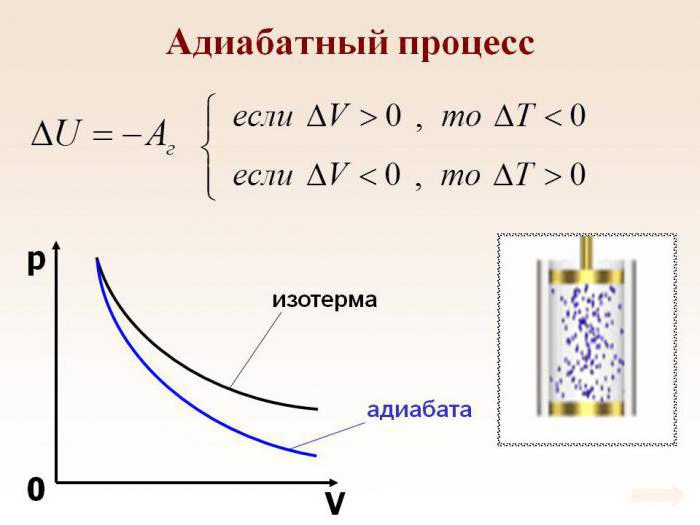
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
Цветные линии на графике соответствуют изотермам, черная кривая — это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.
Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 oC?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 oC.
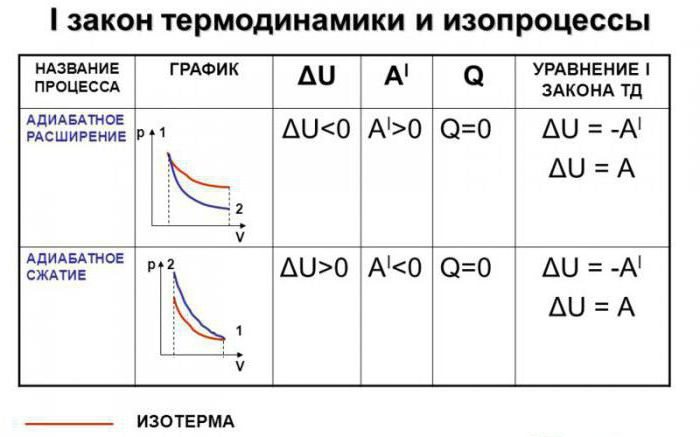
2.4. Адиабатный процесс
Адиабатный процесс — это процесс, при котором не происходит теплообмена с внешней средой.
Физически это означает, что процесс протекает достаточно быстро и система не успевает обменяться теплотой с внешними телами. Однако коль скоро мы имеем дело с равновесными процессами, скорость адиабатного процесса не должна быть слишком уж велика. Примером таких процессов может служить распространение звуковых колебаний в упругой среде.
Выведем уравнение, описывающее адиабатный процесс. Ранее мы имели дело с самыми простыми уравнениями процессов
— для изотермического процесса;
— для изобарного процесса;
— для изохорного процесса.
Поскольку в адиабатном процессе dQ = 0, из первого начала термодинамики следует, что
C другой стороны,
Приравнивая эти выражения, находим
Умножая уравнение (2.28) на V g –1 , получаем в левой части полный дифференциал
В результате интегрирования (2.29) приходим к уравнению адиабатного процесса
Графически адиабатный процесс описывается на (р,V) — диаграмме кривыми, похожими на изотермы (рис. 2.12), но идущими круче, так как g > 1, поскольку Сp > СV.
Рис. 2.12. Адиабатный процесс в идеальном газе: 1 — адиабата, 2 — изотерма
Это и понятно, так как при адиабатном расширении газ совершает работу за счет внутренней энергии, и его температура падает, что еще больше уменьшает давление по сравнению с изотермическим расширением.
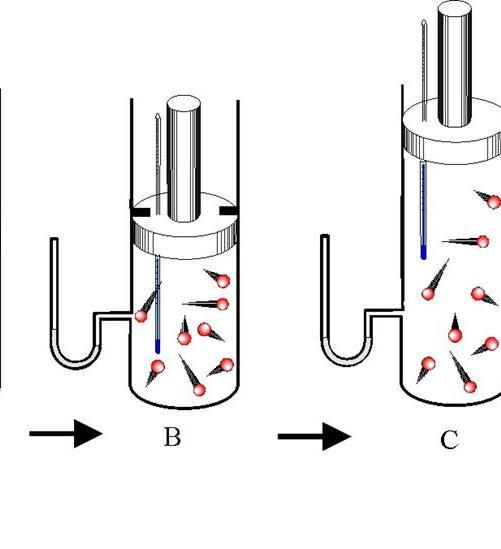
Экспериментальное исследование адиабатного процесса в идеальном газе можно выполнить с помощью установки, представленной на рис. 2.13.
Рис. 2.13. Экспериментальное изучение адиабатного процесса в идеальном газе
Учитывая, что из уравнения состояния идеального газа следует пропорциональность
уравнение адиабатного процесса можно также представить в виде
Первый закон термодинамики в применении к адиабатному процессу позволяет вычислить работу газа при адиабатном расширении:
Выражения для работы при адиабатном процессе с учетом уравнения Клапейрона — Менделеева можно выразить также через температуры в начале и конце процесса
Для бесконечно малых изменений параметров уравнения (2.32), (2.33) переходят в соотношения
Пример. Горючая смесь в двигателе Дизеля (см. рисунок выше) воспламеняется при температуре Т2 = 1 100 К. Начальная температура смеси Т1 = 350 К. Определим, во сколько раз нужно уменьшить объем смеси при сжатии, чтобы она воспламенилась. Сжатие будем считать адиабатным. Показатель адиабаты для смеси g = 1,4.
Для решения удобнее воспользоваться уравнением адиабатного процесса в форме (2.31):
Отсюда сразу следует выражение для степени сжатия горючей смеси:
Адиабатный процесс, его суть и и формулы
Адиабатный процесс (в некоторых источниках упоминается как адиабатический) — это термодинамический процесс, который происходит при отсутствии теплообмена с окружающей средой. Есть несколько факторов, которые характеризуют этот класс. Например, адиабатный процесс происходит динамично и укладывается в короткий срок времени. Происходят процессы данного класса, как правило, мгновенно.
Связь с первым началом термодинамики
Адиабатный процесс (адиабатический) можно напрямую связать с первым законом термодинамики. Его формулировка “по умолчанию” звучит следующим образом: изменение количества теплоты в системе при протекании в ней термодинамического процесса будет численно равно сумме изменения внутренней энергии идеального газа и работы, совершаемой этим газом.
Если мы попытаемся записать первое начало термодинамики в его стандартном виде, то получим следующее выражение: dQ = dU + dA. А теперь постараемся видоизменить эту формулу применительно к адиабатическому процессу. Как было сказано ранее, подобные процессы протекают при условии отсутствия теплообмена с окружающей (внешней, как ее называют некоторые литературные источники) средой.
В таком случае формула, описывающая первое начало термодинамики, примет следующий вид: dA = -dU. Теперь несколько подробнее о видоизменении. Если мы говорим о том, что теплообмена в системе не происходит, изменение количества теплоты (обозначенное в формуле первого закона термодинамики через dQ) будет равно нулю. Следовательно, мы можем перенести одно из слагаемых из правой части в левую, после чего получим формулу, приведенную к описанному ранее виду.
Следствие из первого начала термодинамики для адиабатического процесса
Допустим, что в системе произошел адиабатный процесс. В этом случае можно, не вдаваясь в мельчайшие детали, говорить о том, что газ при расширении совершает работу, но при этом он теряет свою внутреннюю энергию. Иными словами, работа, совершаемая при адиабатном расширении газа, будет осуществляться за счет убыли внутренней энергии. Следовательно, в качестве исхода этого процесса мы будем рассматривать понижение температуры самого вещества.
Абсолютно логично можно предположить, что если газ будет адиабатически сжат, его температура вырастет. Несложно заметить, что в ходе процесса будут изменяться все главные характеристики идеального газа. Речь идет о его давлении, объеме и температуре. Следовательно, грубой ошибкой стало название адиабатического процесса изопроцессом.
Адиабатный процесс. Формулы
Ранее была записана формула, выведенная из первого начала термодинамики. Используя ее, мы без особого труда можем вычислить работу в общем виде, которую будет выполнять газ при течении адиабатного процесса. Как вы уже могли догадаться, делать это мы будет при помощи интегрирования.
Итак, чтобы получить общую формулу работы для x молей газа, проинтегрируем выражение первого закона термодинамики для адиабатного процесса. Выглядеть все это будет следующим образом: A = — (интеграл) от dU. Раскроем это выражение, получим: A = — xCv (интеграл в пределах от T1 до T2) dT.
Теперь, когда мы привели интеграл к конечному виду, мы можем его упростить. На выходе получим формулу следующего вида: A = — xCv (T2 – T1). Ну и последним шагом станет небольшое упрощение. Избавимся от минуса перед формулой. Для этого сделаем в скобках небольшую перестановку, поменяв конечную температуру с начальной местами. В итоге получим: A = xCv (T1 – T2).
Уравнение адиабаты
Используя первое начало термодинамики для адиабатного процесса, мы можем найти уравнение адиабаты. При этом оно будет записано для произвольного числа молей идеального газа. Итак, запишем первоначальную формулу. Она имеет такой вид: dA + dU = 0. Но ведь мы прекрасно знаем, что работа идеального газа представляет численно собой не что иное, как произведение давления на изменение объема.
В то же время изменение внутренней энергии будет равно работе, взятой с обратным знаком. А ее-то мы уже нашли при помощи интегрирования. Значит, первое начало термодинамики для адиабатического процесса может принять следующий вид: pdV + xCvdT = 0. Из этого уравнения нам нужно исключить один показатель, а именно, температуру. Вернее, ее изменения. Чтобы сделать это, мы обратимся к достаточно часто используемому в молекулярной физики уравнению. А именно к уравнению Менделеева-Клапейрона.
Первичное выражение
Его нам нужно продифференцировать, чем мы и займемся. Итак, в общем виде уравнение выглядит следующим образом: PV = XRT. Вследствие дифференцирования оно будет приведено к такой форме: pdV + Vdp = xRdT. Отсюда мы можем выразить изменение энергии. Оно будет равно левой части, деленной на произведение количества вещества на универсальную газовую постоянную. Иными словами, формула будет такой: (pdV + Vdp)/xR. Остается только упростить ее. В итоге получим следующее выражение: dT = (pdV + Vdp)/x(Cp — Cv)
По сути дела, первая часть задачи выполнена. Остается только довести все до ума.
Вторичное выражение. Подстановка значения
Возьмем полученную в результате дифференцирования формулу Менделеева-Клапейрона и подставим ее в выражение, выведенное нами ранее для первого закона термодинамики по отношению к адиабатному процессу. Итак, что мы получим? Все это громоздкое выражение примет следующий вид: pdV + xCv ((pdV + Vdp)/x(Cp-Cv)) = 0.
Чтобы упростить все это, мы должны принять во внимание пару фактов. Во-первых, упростить выражение можно за счет приведения к общему знаменателю. Когда мы получим одну дробь, мы можем воспользоваться старым добрым правилом, которое гласит, что дробь равна нулю, когда ее числитель равен нулю, а знаменатель от нуля отличен. В результате совокупности всех этих действий мы получим следующее выражение: pCpdV – pCvdV + pCvdV + VCvdp = 0.
Теперь следующим шагом мы можем разделить данное выражение на pVCv. Получим сумму двух частей, дающих в итоге ноль. Это будет Cp/Cv * dV/V + dp/p = 0. Эту формулу необходимо проинтегрировать. Тогда мы получим следующее выражение: y (интеграл) dV/V + (интеграл) dp/p = (интеграл) 0.
Ну а дальше все достаточно просто. Воспользовавшись формулами интегрирования (можно использовать табличные интегралы, чтобы все было проще), получим в итоге следующую запись: y ln V + ln p = ln (const). Получается, что p(V)y = const. Данное выражение называется в молекулярной физике уравнением Пуассона. Многие литературные источники научной направленности также называют эту формулу уравнением адиабаты. В то же время величина y, которая имеет место в данной записи, называется показателем адиабаты. Она равна (i+2)/i. Нужно отметить, что показатель адиабаты всегда больше единицы, что, в принципе, логично.
Примеры адиабатных процессов
Вскоре после того, как был открыт адиабатический процесс, стартовало огромное количество различных исследований. Так, была создана первая теоретическая модель, имеющая отношение к циклу Карно. Именно она позволила установить условные пределы, ограничивавшие развитие тепловых машин. Но в случае некоторых реальных процессов осуществлять цикл Карно достаточно трудно. Все дело в том, что в его состав входят изотермы. А они, в свою очередь, требуют задания определенной скорости термодинамических процессов.
Заключение
С целью обойти подобные проблемы был придуман цикл Отто, а также цикл сжижения газа. Они стали широко применяться при решении конкретных задач на практике. Стартовавшие исследования показали возможность описания некоторых природных процессов в адиабатическом плане, что позволило выявлять общие закономерности соответствующих процессов. Примером адиабатического процесса можно смело назвать химическую реакцию, которая происходит внутри некоторого объема газа, если система является замкнутой, а обмен с внешней средой теплом отсутствует.
http://online.mephi.ru/courses/physics/molecular_physics/data/course/2/2.4.1.html
http://www.syl.ru/article/206205/mod_adiabatnyiy-protsess-ego-sut-i-i-formulyi
-
Адиабатный процесс
Адиабатный
процесс- это процесс без теплообмена с
внешней средой. При адиабатном процессе
энергообмен рабочего тела с окружающей
средой происходит только в форме работы,
энергообмена в форме теплоты нет. Эти
условия выражаются соотношением:
.
Тогда уравнение первого закона
термодинамики для адиабатного процесса
имеет вид:
.
(5.4)
Из
этого уравнения видно, что работа
адиабатного процесса расширения
совершается вследствие уменьшения
внутренней энергии газа и, следовательно,
температура газа уменьшается. Работа
адиабатного сжатия полностью идет на
увеличение внутренней энергии газа, то
есть на повышение его температуры. Таким
образом, изменение внутренней энергии
и работа в адиабатном процессе эквивалентны
по величине и противоположны по знаку.
Выведем
уравнение адиабаты для идеального газа.
Воспользуемся уравнением первого закона
термодинамики:
т.к.
,
то
(5.5)
Разделив
переменные, получим:
(5.6)
Интегрируя
(5.6) при k
= const,
получим
,
откуда
(5.7)
Уравнение
(5.7) является уравнением адиабаты.
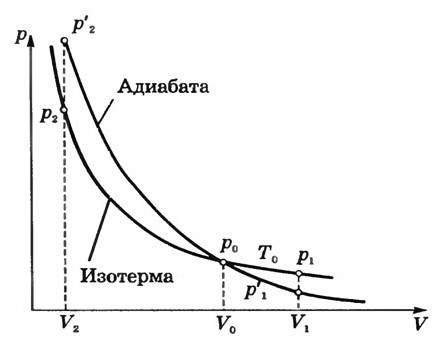
На
рис. 5.10 приведен адиабатный процесс
расширения газа в
-диаграмме.
Из
уравнения (5.7) следует:

то
есть при адиабатном расширении давление
падает, а при сжатии возрастает.
Рис.
5.10. Адиабата идеального газа
Учитывая,
что в адиабатном процессе изменяются
все три параметра состояния, необходимо
выявить зависимости между v
и T,
p
и T.
Зависимость
между температурой T
и объемом
v
можно получить из уравнения (5.8) и
уравнений состояния, записанных для
точек процесса 1
и 2:
Р1v1
= RT1
и Р2v2=RT2,
откуда
(5.9)
Из
уравнений (5.8) и (5.9) следует:
(5.10)
Далее
из уравнений (5.8) и (5.10) следует:
(5.11)
При
k
= const
для вычисления работы адиабатного
процесса можно записать несколько
формул. Из уравнения
приcv
= const
имеем:

Учитывая
соотношения (5.10) и (5.11), уравнение (5.12)
запишем в виде:
(5.13)
Располагаемая
работа в адиабатном процессе определим
из соотношения
,
то есть
(5.14)
Для
обратимого адиабатного процесса
,
поэтому
,
то есть обратимый адиабатный процесс
будет изоэнтропным и в
-диаграмме
изображается прямой линией, параллельной
оси(рис. 5.11). Процесс адиабатного расширения
изображается вертикальной прямой 2-1,
идущей вниз, а процесс адиабатного
сжатия 1-2 – вертикальной прямой, идущей
вверх.
Рис.
5.11. Адиабатный процесс в
-диаграмме
Теплоемкость
в адиабатном процессе равна нулю:
.
-
a
a
Рис.
5.12. Схема распределения энергии в
адиабатном процессе:
а-
при расширении газа; б – при сжатии газа
-
Политропный процесс
Политропный
процесс – любой произвольный процесс
изменения состояния рабочего тела,
протекающий при постоянной теплоемкости
сx,
то есть
c =
cx
= const. Линия
процесса называется политропой.
Из
определения политропного процесса
следует, что основные термодинамические
процессы (изохорный, изобарный,
изотермический, адиабатный, если они
протекают при постоянной удельной
теплоемкости, являются частными случаями
политропного процесса.
Другими
словами, политропный процесс характеризуется
одной и той же долей количества подводимой
теплоты, расходуемой на изменение
внутренней энергии системы.
Уравнение
политропного процесса можно получить
из уравнений первого закона термодинамики
для идеального газа:
далее
имеем:
Разделим
первое уравнение на второе
и
обозначим
,
тогда
Интегрируя
полученное соотношение в пределах от
начала до конца процесса, находим:
,
или
после потенцирования
получаем
уравнение политропного процесса
Поскольку
уравнение политропы отличается от
уравнения адиабаты только значением
показателя n,
то все соотношения между основными
параметрами могут быть представлены
формулами, аналогичными формулам для
адиабатного процесса:
Удельная
теплоемкость политропного процесса
может быть определена из выражения для
показателя политропы
,
откуда
,
где
k
– показатель адиабаты.
Последнее
уравнение позволяет определить удельную
теплоемкость политропного процесса
для любого значения n.
Если в это уравнение подставить значения
для частных случаев, то можно получить:
|
Изохорный |
n |
c |
v |
|
Изобарный |
n |
c |
p |
|
Изотермический |
n |
c |
T |
|
Адиабатный |
n |
c |
pvk |
Характер
зависимости
от показателя политропыn
графически показан на рис. 5.13.
Рис.5.13.
Зависимость теплоемкости от показателя
политропы.
Уравнение
удельной работы изменения объема,
совершаемой телом при политропном
процессе, имеет аналогичный вид с
уравнением удельной работы в адиабатном
процессе
или

Располагаемая
работа равна:
Изменение
удельной внутренней энергии газа и
теплота в политропном процессе
определяются из уравнений:
.
Изменение
удельной энтальпии определяется по
формуле, справедливой для всех процессов
идеального газа, включая политропный
процесс:
.
Изменение
удельной энтропии газа в политропном
процессе равно:
или
для конечного изменения состояния
.
Значение
показателя политропы в любом политропном
процессе может быть определено по
координатам любых двух точек графика:



Если
в vP—
и sT
– координатах
выбрать некоторую произвольную точку
и провести из нее все рассмотренные
термодинамические процессы, то все поле
построенной таким образом диаграммы
делится на восемь областей, характеризующихся
определенными признаками (рис. 5.14).
Рис.
5.14. Взаимное расположение политроп в
зависимости от величины показателя n
Соседние файлы в папке Термодинамика
- #
- #
- #
- #
- #
- #
- #
- #
Адиабатным называют такой процесс в термодинамике, при котором не происходит теплообмена с окружающей средой.
Уравнение
Первое начало гласит, что общее количество теплоты есть сумма изменения внутренней энергии∆U системы и работы внешних сил А.
Q = ∆U + A.
При отсутствии обмена теплотой выражение будет иметь вид:
∆U + A = 0 или А = − ∆U
Иными словами, в адиабатном термодинамическом процессе работа газа равна убыли его внутренней энергии.
Продолжим преобразования.
Если работа А равна произведению давления p на бесконечно малое изменение объема, то
dU = − pdV
Используя уравнение Менделеева-Клапейрона (МК), запишем для идеального газа:
pdV = − CvdT.
Откуда следует, что dU = ν CvdT.
Дифференцирование все части, полная запись преображается следующим образом:
pdV + Vdp = ν RdT,
где R – универсальная газовая постоянная.
Выражаем dT как dU/ν Cv, а dU как – pdV и получаем:
pdV + Vdp = – pdV
Группируем подобные слагаемые:
Vdp = − pdV (1+R/Cv).
Примем сумму (1+R/Cv) за коэффициент γ:
γ = −
После интегрирования получим запись:
γln V = — ln p + const
Применяя свойства логарифмов, окончательно имеем:
pVγ = const
Равенство, к которому мы пришли есть уравнение адиабатного процесса. Другое название выражения – уравнение Пуассона. Следует напомнить, что рассматриваемая система – идеальный газ.
В этом уравнении коэффициент γ – показатель адиабаты (коэффициент Пуассона). Его физический смысл – отношение теплоемкостей системы при p = const и V = const, соответственно.
Графическое описание процесса
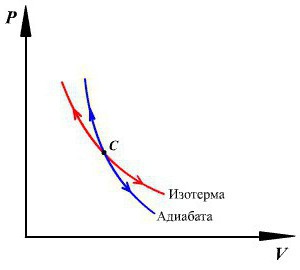
В координатах «давление – объём» адиабатические явления описываются графиком адиабатой. Кривая напоминает изотерму, но имеет более крутой вид. Это следует из пропорциональности произведения pV температуре T, согласно уравнению МК.
На рисунке кривая 1 является адиабатой, кривая 2 – изотермой для одной и той же идеальной системы.
Исходя из того, что:
pV T, адиабатный закон можно описать и так: TVγ−1 = const.
Соотношение между температурой и давлением в адиабатическом процессе:
pT(γ/1-γ) = const
Как найти работу газа
Чтобы выразить работу А, которую совершает система при Q = 0, снова используем уравнение МК:
dA = − νCvdT, что после дифференцирования преобразуется так:
А = − νCv(T1 – T2).
Уравнение Мейера для идеальных газов показывает связь между теплоёмкостями при изобарном и изохорном процессах. Согласно этому равенству, разность Cp и Сv есть универсальная газовая постоянная R. Тогда учитывая, что показатель адиабаты – это отношение этих теплоемкостей, выразим Сv в формуле для полной работы:
Подставляем теплоемкость изохорного процесса:
Связь температур, объёмов и давлений в термодинамике идеальных систем выглядит так:
Таким образом, работу можно представить через соотношение давлений или объемов:
Примеры задач
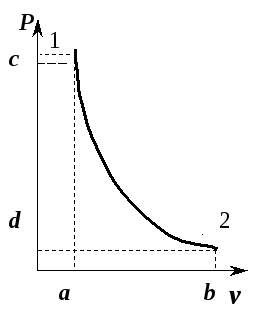
- Температура воспламенения T2 горючей смеси с показателем адиабаты 1,4 в двигателе Дизеля 1100 К (см. рисунок). Исходная температура Т1 равна 350 К. Найти, во сколько раз необходимо уменьшить объем смеси сжатием, чтобы произошло воспламенение.
Решение. Воспользуемся соотношением температур и объемов для адиабатного процесса идеального газа. Тогда:
T1V1γ−1 = T2V2γ−1. Выражаем отношение объемов и получаем ответ:
V1/V2 = (T2/T1)(1/(γ−1)) = (1100/3500)2,5 ≈ 17,5 раз.
- Начальные параметры воздуха Р1 0,1 МПа и Т1 = 300 К. После адиабатного сжатия в компрессоре двигателя давление Р2 стало 0,28 МПа. После этого при постоянном давлении произошло охлаждение воздушной смеси до 37 °С. Найти работу сжатия и количество отводимой теплоты при охлаждении.
Решение.
Для адиабатического процесса соотношение давлений и температуры:
(Р2/Р1)(γ−1)/γ = Т2/Т1, откуда находим температуру по завершении сжатия:
Т2 = Т1((Р2/Р1)(γ−1)/γ = 300 (0,28/0,1)1/0,4 = 402 К.
Показатель адиабаты равен 1,4 для воздуха в данных условиях.
Количество теплоты, которое отводится при изобарном охлаждении равно с учетом перевода градусов Цельсия в Кельвины:
Q = Cp(Т2 – Т3) = 1000(402-310) = 92 кДж/кг.
Тогда работа сжатия компрессора равна:
А = R (T2 – T1)/γ-1 ≈ 73,2 кДж/кг.
Адиабатический процесс:
Процесс, который происходит без обмена тепловой энергии с окружающей средой, называется адиабатическим процессом.
Примерами адиабатического процесса могут служить процессы, которые происходят быстро. Например, выполненная работа при быстром сжатии газа приводит к росту его температуры, т.е. внутренней энергии. Для распространения тепла в окружающую среду в результате повышения температуры требуется определенное время. Поэтому
Горение горючей смеси в двигателе внутреннего сгорания является примером адиабатического процесса.
Для адиабатического процесса первый закон термодинамики имеет следующий вид:
т.е. в адиабатическом процессе работа выполняется за счет изменения внутренней энергии.
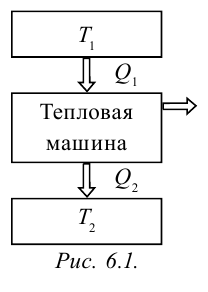
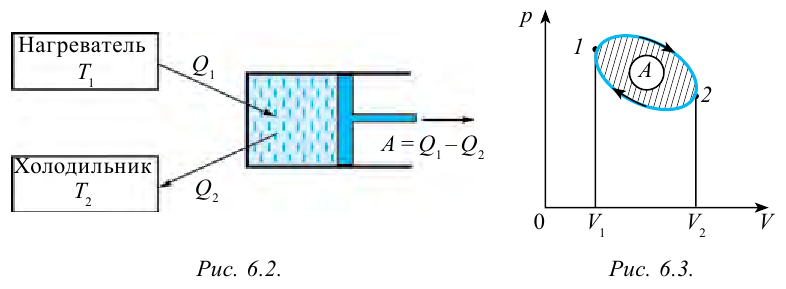
Тепловыми машинами называют машины, которые превращают внутреннюю энергию горючего в механическую энергию.
Принцип работы тепловой машины показан на рисунке 6.1. За один цикл нагреватель с температурой 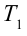
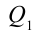
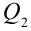
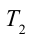
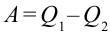
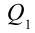
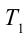
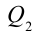
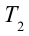
циклически.
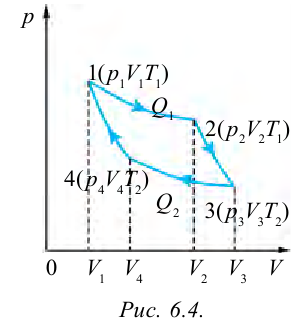
Круговым процессом или циклом называется процесс, в котором система проходит через несколько состояний и возвращается в начальное состояние (рис. 6.3). Процесс, который происходит по направлению часовой стрелки (газ сначала расширяется, затем сжимается) называется правильным циклом, процесс, который происходит против часовой стрелки (газ сначала сжимается, затем расширяется) называется обратным циклом. Тепловые машины работают на основе правильного цикла, а холодильники работают на основе обратного цикла. Когда цикл завершается, рабочее вещество возвращается в свое первоначальное состояние, т.е. его внутренняя энергия равна начальному значению.
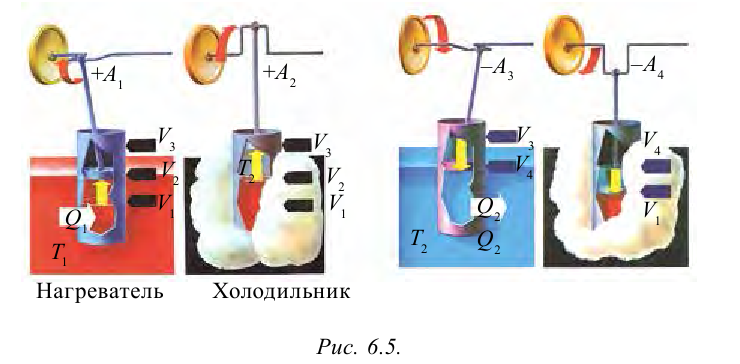
Цикл Карно – это обратимый круговой тепловой процесс, который состоит из последовательно взаимно меняющихся двух изотермических и двух адиабатических процессов (рис. 6.4).
Рассмотрим на примере поршневого цилиндра с коленчатым валом и шатуном (рис. 6.5) цикл, который состоит из двух изотермических и двух адиабатических процессов, так называемый цикл Карно.
1. На самом нижнем уровне поршня в цилиндре объем газа равен 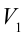
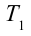
будет 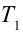
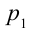
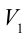
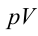
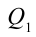
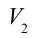
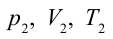
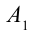
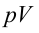
2. На второй адиабатической стадии расширения, несмотря на уменьшение количества тепла 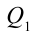
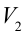
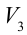
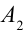
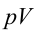
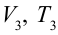
3. Для совершения изотермического сжатия газа цилиндр с температурой 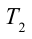
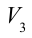
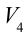
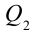
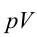
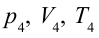
4. В последней части цикла газ адиабатически сжимается, поршень уменьшает объем газа с 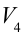
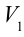
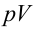
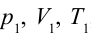
Таким образом, идеальный газ возвращается в свое начальное состояние и полностью восстанавливает свою внутреннюю энергию. В течение цикла идеальный газ от нагревателя забирает количество тепла 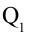
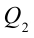
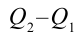
Коэффициент полезного действия тепловой машины:
Коэффициентом полезного действия тепловой машины или цикла Карно называется следующая величина:
Если учесть работу, выполненную тепловой машиной, т.е. 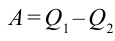
Также КПД цикла Карно можно выразить через температуру нагревателя 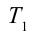
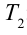
Значит, КПД идеальной тепловой машины не зависит от вида рабочего вещества и определяется только температурами нагревателя и охладителя.
Из выражения (6.6) можно сделать следующие выводы:
- Для повышения КПД тепловой машины следует повышать температуру нагревателя, а температуру охладителя следует понижать;
- КПД тепловых машин всегда будет меньше единицы. На основании выражения (6.6) Карно составил свою теорему о КПД. При заданных температурах нагревателя и охладителя КПД любого двигателя не будет больше, чем КПД цикла Карно.
- Молекулярно-кинетическая теория
- Работа в термодинамике
- Первый закон термодинамики
- Второй закон термодинамики
- Релятивистская механика в физике
- Теория относительности Эйнштейна
- Термодинамика — основные понятия, формулы и определения
- Необратимость тепловых процессов
Первый закон термодинамики
-
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
-
Работа газа в изобарном процессе
-
Работа газа в произвольном процессе
-
Работа, совершаемая над газом
-
Применение первого закона термодинамики к изопроцессам
-
Адиабатный процесс
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: работа в термодинамике, первый закон термодинамики, адиабатный процесс.
Начнём с обсуждения работы газа.
Газ, находящийся в сосуде под поршнем, действует на поршень с силой , где
— давление газа,
— площадь поршня. Если при этом поршень перемещается, то газ совершает работу.
При расширении газа эта работа будет положительной (сила давления газа и перемещение поршня направлены в одну сторону). При сжатии работа газа отрицательна (сила давления газа и перемещение поршня направлены в противоположные стороны).
к оглавлению ▴
Работа газа в изобарном процессе
Предположим, что газ расширяется при постоянном давлении . Тогда сила
, с которой газ действует на поршень, также постоянна. Пусть поршень переместился на расстояние
(рис. 1).
Рис. 1.
Работа газа равна:
Но — изменение объёма газа. Поэтому для работы газа при изобарном расширении мы получаем формулу:
(1)
Если и
— начальный и конечный объём газа, то для работы газа имеем:
. Изобразив данный процесс на
-диаграмме, мы видим, что работа газа равна площади прямоугольника под графиком нашего процесса (рис. 2).
Рис. 2. Работа газа как площадь
Пусть теперь газ изобарно сжимается от объёма до объёма
. С помощью аналогичных рассуждений приходим к формуле:
Но , и снова получается формула (1).
Работа газа опять-таки будет равна площади под графиком процесса на -диаграмме, но теперь со знаком минус.
Итак, формула выражает работу газа при постоянном давлении — как в процессе расширения газа, так и в процессе сжатия.
к оглавлению ▴
Работа газа в произвольном процессе
Геометрическая интерпретация работы газа (как площади под графиком процесса на -диаграмме) сохраняется и в общем случае неизобарного процесса.
Действительно, рассмотрим малое изменение объёма газа — настолько малое, что давление
будет оставаться приблизительно постоянным. Газ совершит малую работу
. Тогда работа
газа во всём процессе найдётся суммированием этих малых работ:
Но данный интеграл как раз и является площадью криволинейной трапеции (рис. 3):
Рис. 3. Работа газа как площадь
к оглавлению ▴
Работа, совершаемая над газом
Наряду с работой , которую совершает газ по передвижению поршня, рассматривают также работу
, которую поршень совершает над газом.
Если газ действует на поршень с силой , то по третьему закону Ньютона поршень действует на газ с силой
, равной силе
по модулю и противоположной по направлению:
(рис. 4).
Рис. 4. Внешняя сила , действующая на газ
Следовательно, работа поршня равна по модулю и противоположна по знаку работе газа:
Так, в процессе расширения газ совершает положительную работу ; при этом работа, совершаемая над газом, отрицательна
. Наоборот, при сжатии работа газа отрицательна
, а работа, совершаемая поршнем над газом, положительна
0 right )’ class=’tex’ alt=’left ( {A}’ > 0 right )’ />.
Будьте внимательны: если в задаче просят найти работу, совершённую над газом, то имеется в виду работа .
Как мы знаем, существует лишь два способа изменения внутренней энергии тела: теплопередача и совершение работы.
Опыт показывает, что эти способы независимы — в том смысле, что их результаты складываются. Если телу в процессе теплообмена передано количество теплоты , и если в то же время над телом совершена работа
, то изменение внутренней энергии тела будет равно:
(2)
Нас больше всего интересует случай, когда тело является газом. Тогда (где
, как всегда, есть работа самого газа). Формула (2) принимает вид:
, или
(3)
Соотношение (3) называется первым законом термодинамики. Смысл его прост: количество теплоты, переданное газу, идёт на изменение внутренней энергии газа и на совершение газом работы.
Напомним, что величина может быть и отрицательной: в таком случае тепло отводится от газа. Но первый закон термодинамики остаётся справедливым в любом случае. Он является одним из фундаментальных физических законов и находит подтверждение в многочисленных явлениях и экспериментах.
к оглавлению ▴
Применение первого закона термодинамики к изопроцессам
Напомним, что в изопроцессе остаётся неизменным значение некоторой величины, характеризующей состояние газа — температуры, объёма или давления. Для каждого вида изопроцессов запись первого закона термодинамики упрощается.
1. Изотермический процесс, .
Внутренняя энергия идеального газа зависит только от его температуры. Если температура газа не меняется, то не меняется и внутренняя энергия: . Тогда формула (3) даёт:
Всё подведённое к газу тепло идёт на совершение газом работы.
2. Изохорный процесс, .
Если объём газа остаётся постоянным, то поршень не перемещается, и потому работа газа равна нулю: . Тогда первый закон термодинамики даёт:
Всё тепло, переданное газу, идёт на изменение его внутренней энергии.
3. Изобарный процесс, .
Подведённое к газу тепло идёт как на изменение внутренней энергии, так и на совершение работы (для которой справедлива формула (1)). Имеем:
к оглавлению ▴
Адиабатный процесс
Процесс называется адиабатным, если он идёт без теплообмена с окружающими телами.
Адиабатный процесс совершается газом, находящимся в теплоизолированном сосуде. Такой сосуд препятствует всем видам теплопередачи: теплопроводности, конвекции, излучению. Пример теплоизолированного сосуда — термос.
Приблизительно адиабатным будет всякий процесс, протекающий достаточно быстро: в течение процесса теплообмен просто не успевает произойти.
При адиабатном процессе . Из первого закона термодинамики получаем:
, или
.
В процессе адиабатного расширения газ совершает положительную работу, поэтому (работа совершается за счёт убыли внутренней энергии). Следовательно, газ охлаждается. Если заставить газ совершить достаточно большую работу, охладить его можно весьма сильно. Именно на этом основаны методы сжижения газов.
Наоборот, в процессе адиабатного сжатия будет , поэтому
: газ нагревается. Адиабатное нагревание воздуха используется в дизельных двигателях для воспламенения топлива.
Кривая, изображающая ход адиабатного процесса, называется адиабатой. Интересно сравнить ход адиабаты и изотермы на -диаграмме (рис. 5).
Рис. 5. Сравнительный ход изотермы и адиабаты
В обоих процессах давление убывает с увеличением объёма, но в адиабатном процессе убывание идёт быстрее. Почему?
При изотермическом расширении давление падает потому, что уменьшается концентрация частиц газа, в результате чего удары частиц по стенкам сосуда становятся реже. Однако интенсивность этих ударов остаётся прежней: ведь температура газа не меняется — значит, не меняется и средняя кинетическая энергия его частиц.
А при адиабатном расширении, наряду с уменьшением концентрации частиц, падает также и температура газа. Удары частиц становятся не только более редкими, но и более слабыми. Вот почему адиабата убывает быстрее изотермы.
Благодарим за то, что пользуйтесь нашими статьями.
Информация на странице «Первый закон термодинамики» подготовлена нашими редакторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать нужные и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими материалами из данного раздела.
Публикация обновлена:
08.05.2023