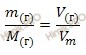Известно, что масса углекислого газа (CO2) 35 грамм. Определите объём углекислого газа (CO2).
Решение задачи
Так как, углекислый газ (CO2) – газообразное вещество, то для нахождения объема углекислого газа (CO2) массой 35 г будем использовать формулу перерасчета, которая устанавливает связь между массой и объемом газа:
Откуда выразим объем произвольной массы газа:
Учитывая, что молярная масса углекислого газа (CO2) равна:
M (CO2) = 12 + 2 ∙ 16 = 44 (г/моль)
Рассчитаем объем углекислого газа (CO2):
Ответ:
объем углекислого газа равен 17,82 литра.
Чтобы вопрос опубликовался, войди или зарегистрируйся
Восстановление пароля
Мы отправили письмо со ссылкой на смену пароля на username@mail.ru.
Если письма нет, проверь папку «Спам».
Чтобы вопрос опубликовался, войди или зарегистрируйся
Нужна регистрация на Учи.ру
«Ваш урок» теперь называется Учи.Ответы. Чтобы зайти на сайт, используй логин и пароль от Учи.ру. Если у тебя их нет, зарегистрируйся на платформе.
Рассчитать объем углекислого газа.
Рассчитать объем углекислого газа при нормальных условиях, если известна его масса, можно по формуле: V = m · Vm / M = ν · Vm. Рассчитать объем углекислого газа, если известна его масса, температура и давление, можно по формуле: V = m · R · T / (p · M) = ν · R · T / p.
Химическая формула углекислого газа CO₂.
Расчет объема воздуха (газа)
Теория расчета объема газа
Пример: Рассчитайте объем для 1 кг углекислого газа
Рассчитать объем газа: азота, водорода, гелия, кислорода, углекислого газа, хлора
Рассчитать объем углекислого газа при нормальных условиях:
Рассчитать объем углекислого газа:
Теория:
Рассчитать объем углекислого газа при нормальных условиях, если известна его масса, можно по формуле:
V = m · Vm / M = ν · Vm,
где
V – объем газа, л,
ν – количество вещества, моль,
Vm – молярный объем газа, л/моль, Vm = 22,4 л/моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(СО₂) = 12 + 2·16 = 44 г/моль,
Нормальные условия: 0 оС (или 273,15 К), 101,325 кПа или 1 атм.
Рассчитать объем углекислого газа, если известна его масса, температура и давление, можно по формуле:
V = m · R · T / (p · M) = ν · R · T / p,
где
V – объем газа, л,
ν – количество вещества, моль,
ν = m / M,
m – масса газа, г,
М – молярная масса газа, г/моль,
M(СО₂) = 12 + 2·16 = 44 г/моль,
R – универсальная газовая постоянная, R ≈ 8,314 Дж/(моль⋅К),
T – термодинамическая температура, К.
P – давление, кПа.
Пример: Рассчитайте объем для 1 кг углекислого газа:
Рассчитайте объем для 1 кг углекислого газа при нормальных условиях.
V = m · Vm / M = 1 000 грамм · 22,4 л/моль / 44 г/моль = 509,090 литров.
Рассчитайте объем для 1 кг углекислого газа при 30 градусах Цельсия (303,15 К), давлении 30 кПа.
V = m · R · T / p · M = 1 000 грамм · 8,314 Дж/(моль⋅К) · 303,15 К / (30 кПа · 44 г/моль) = 1 909,385 литров или 1,909385 м3.
Рассчитать объем газа: азота, водорода, гелия, кислорода, углекислого газа, хлора
Коэффициент востребованности
1 583
Составная часть атмосферы, основное сырье для процесса фотосинтеза зеленых растений, продукт жизнедеятельности живых организмов.
По систематической международной номенклатуре (IUPAC) вещество с формулой СО2 получило название – Оксид углерода(IV). Тривиальные (общепринятые названия) – двуокись или диоксид углерода, угольный ангидрид (солеобразующий оксид, обладающий кислотными свойствами).
Формула углекислого газа
СО2
Молекула углекислого газа образована двумя атомами кислорода и атомом углерода. Структурная формула – О=С=О. Валентность углерода равна 4. Степень окисления – (+4). Тип связи – ковалентная полярная.
Получение углекислого газа
Природные источники углекислого газа
Углекислый газ образуется при медленном окислении в процессах дыхания, брожения, гниения органических веществ. Выделяется при разложении природных карбонатов, сгорании топлива, образовании дымовых газов. Содержится в воздухе, минеральных источниках.
В сутки организм человека выделяет 1 кг СО2. В воздухе содержится 0,03% углекислого газа.
Лабораторные способы получения
В лаборатории газ можно получить взаимодействием соляной кислоты с мелом, мрамором, содой. Собирается газ методом вытеснения воздуха.
CaCO3 + 2HCl → CaCl2+ H2O + CO2,
NaHCO3+ HCl → NaCl + H2O + CO2.
Промышленные способы получения
- Обжиг известняка: CaCO3 → CaO + CO2.
- Как побочный продут разделения воздуха при получении кислорода, азота, аргона.
Свойства углекислого газа
Физические свойства
Вещество нетоксичное, негорючее.
| Свойство | Описание |
|---|---|
| Агрегатное состояние при н.у. | Газ |
| Цвет | Бесцветный |
| Запах | Без запаха |
| Температура плавления | -750оC |
| Температура кипения | -56,50оC |
| Растворимость в воде | Растворяется частично. При t +150оC в 1 литре воды может раствориться 1,7 л углекислого газа |
| Плотность | 1,977 г/л |
| Молярная масса | 44г/моль |
Вещество в твердом агрегатном состоянии называется «сухим льдом».
Высокую концентрацию диоксида углерода можно определить органолептически – во рту, на языке появляется кисловатый привкус. Повышенное содержание опасно для организма – вызывает удушье.
Химические свойства
- Качественная реакция: при взаимодействии углекислого газа с известковым молочком (гидроксидом кальция) образуется карбонат кальция – осадок белого цвета.
CO2 + Ca(OH)2 = CaCO3↓ + H2O.
- CO2, как кислотный оксид, реагирует с водой с образованием угольной кислоты. Эта кислота – соединение нестойкое, легко распадается на углекислый газ и воду. Тип реакции – реакция соединения, обратимая.
CO2 + H2O ↔ H2CO3.
-
При нагревании распадается на оксид углерода(II) и воду: 2CO2 = 2CO + O2.
-
Взаимодействует с основными оксидами, с образованием солей:
CaO + CO2 = CaCO3; Al2O3 + 3CO2 = Al2(CO3)3.
Тип реакции – реакция соединения.
- Взаимодействует со щелочами, с образованием кислых и средних солей:
CO2 + NaOH = NaHCO3;
CO2 + 2NaOH = Na2CO3 + H2O.
Средняя соль образуется при избытке щелочи. Кислая соль образуется при отношении количеств вещества оксида и щелочи – 1:1.
- При температуре реагирует с активными металлами:
CO2 + 2Mg = C + 2MgO
Углекислый газ в основном проявляет восстановительные свойства, но при взаимодействии с активными металлами является окислителем.
- Вступает в реакции взаимодействия с простыми веществами:
CO2 + 4H2 = CH4 + 2H2O (условия протекания реакции – высокая температура, катализатор Cu2O).
Применение углекислого газа
В пищевой промышленности:
- используется при производстве минеральной воды и газированных напитков;
- как пищевая добавка (Е290), повышает сроки хранения продуктов;
- в качестве разрыхлителя придает легкость и пышность кондитерским изделиям;
- как хладогент;
- для удаления из кофе кофеина.
В авиамоделировании используется как источник энергии для двигателей; применяется в пневматическом оружии; как заправка для углекислотных огнетушителей. Используется в качестве защитной среды при сварке.
Находит углекислый газ применение и в медицине – используется для криоабляции новообразований, служит стимулятором глубокого дыхания.
В химической промышленности газ используется в синтезе химических веществ, производстве солей угольной кислоты, процессах осушки и очистки полимеров, волокон растительного и животного происхождения. Применяется для очистки сточных вод, повышает проводимость сверхчистой воды.
Примеры решения задач
Задача 1
Найти массовую долю углерода в углекислом газе.
Решение
М(СО2) = 12+2х16 = 44 г/моль.
Аr(С) = 12 г/моль.
W(С) = 12/44 = 0,27 или 27%
Ответ: массовая доля углерода в углекислом газе равна 27%.
Задача 2
Вычислить объем углекислого газа, выделившегося при взаимодействии соляной кислоты с мрамором массой 100 г.
Решение
300 г — х л
CaCO3 + 2HCl → CaCl2+ H2O + CO2
1 моль — 1 моль
100 г/моль — 22,4 л/моль
100 г — 22,4 л
х(СО2) = 300х22,4/100 = 67, 2 (л).
Ответ: Объем углекислого газа равен 67, 2 л.
Тест по теме «Углекислый газ»
Какой объём углекислого газа (н. у.) образуется при взаимодействии 730 г 20 %−ной соляной кислоты с необходимым количеством мрамора? Какое количество вещества карбоната кальция потребуется для реакции?
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. §23. Примените свои знания. Номер №6
Решение
Дано:
m р−ра (HCl) = 730 г
ω = 20%
Найти:
V(
C
O
2
) − ?
n(
C
a
C
O
3
) − ?
Решение:
Запишем уравнение реакции:
C
a
C
O
3
+ 2HCl =
C
a
C
l
2
+
C
O
2
+
H
2
O
m(HCl) = m(р−ра) * ω = 730 г * 0,2 = 146 г
n(HCl) = m : М = 146 г : 36,5 г/моль = 4 моль
n(
C
O
2
) = 0,5 * n(HCl) = 0,5 * 4 моль = 2 моль
V(
C
O
2
) = n * Vm = 2 моль * 22,4 л/моль = 44,8 л
n(
C
a
C
O
3
) = 0,5 * n(HCl) = 0,5 * 4 моль = 2 моль
Ответ: объем углекислого газа − 44,8 л; количество вещества карбоната кальция − 2 моль.