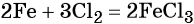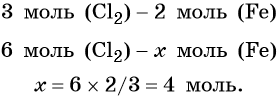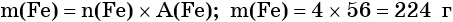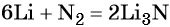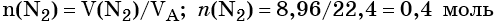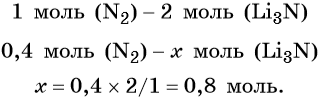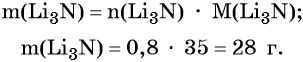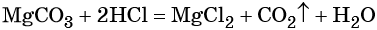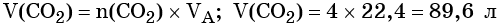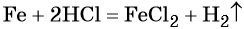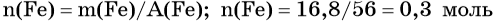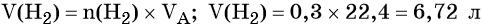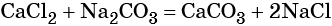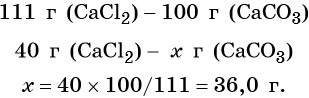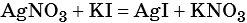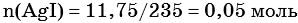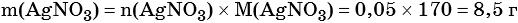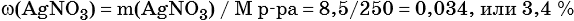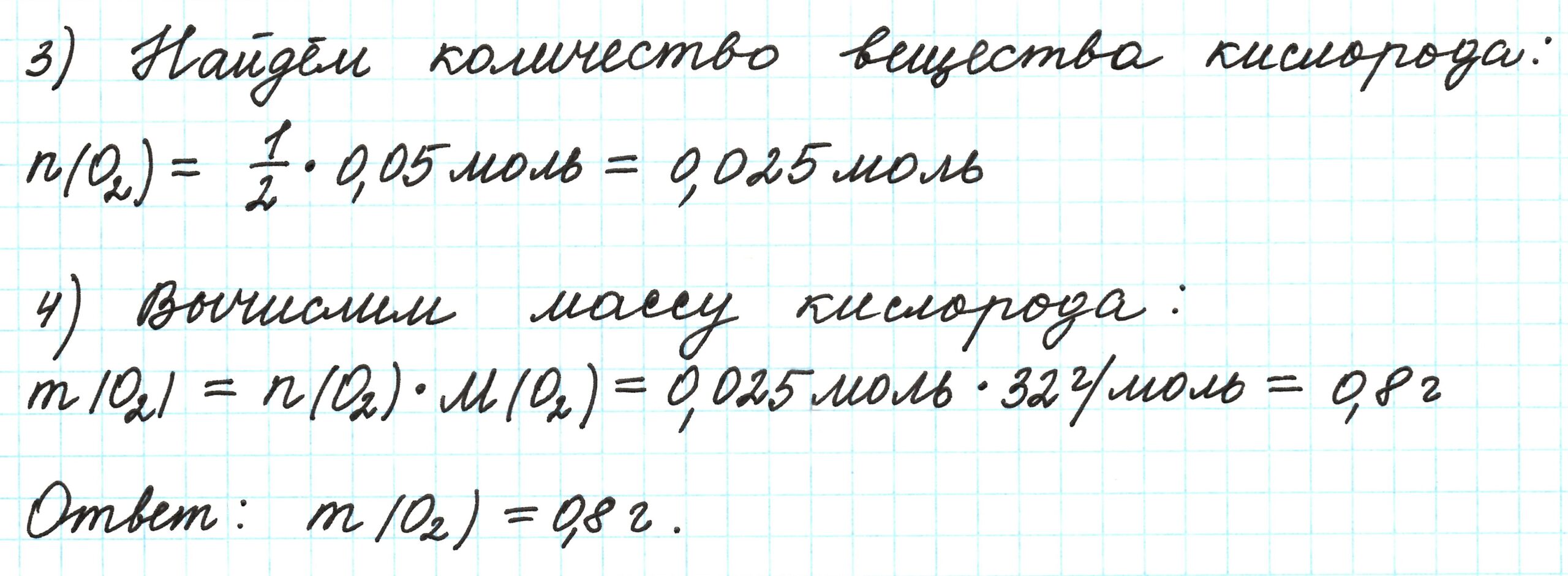Вычисление количества вещества, массы или объема вещества по количеству веществ, массе или объему одного из реагентов или продуктов реакции
Основой для проведения количественных расчётов в химии является закон сохранения массы. Согласно этому закону масса реагентов равна массе продуктов реакции.
Отсюда следует, что для любой химической реакции массы реагентов и продуктов реакции относятся между собой как молярные массы веществ, умноженные на их стехиометрические коэффициенты.
Для расчёта по химическим уравнениям можно использовать два эквивалентных способа: через количество вещества или через пропорцию. Подчеркнём ещё раз: официального запрета на использование метода пропорций при решении задач на ОГЭ и ЕГЭ нет!
Для определения массы (или количества вещества) продуктов реакции или исходных веществ по уравнениям химических реакций вначале составляют уравнение химической реакции и устанавливают стехиометрические коэффициенты; затем определяют молярную массу, массу и количество вещества известных реагентов химической реакции; составляют и решают пропорцию, в которую в зависимости от условий задачи вводят числовые значение величин: молярные массы, массы, количества веществ или их объёмы (для газов).
При этом в одном столбце пропорций должны находиться одинаковые характеристики вещества с одной и той же размерностью.
Пример 1. Масса железа, вступившего в реакцию с 6 моль хлора, равна _________ г. (Ответ запишите с точностью до целого числа.)
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что 3 моль Cl2 реагируют с 2 моль Fe, т. е.:
Определяем массу железа:
Пример 2. Масса нитрида лития, образовавшегося в результате его реакции с азотом объёмом 8,96 л, равна_______________ г.
Решение. Составляем уравнение химической реакции:
Определяем количество вещества азота, вступившего в реакцию:
Из уравнения реакции следует, что из 1 моль N2 образуется 2 моль Li3N, т. е.:
Определим массу Li3N:
Пример 3. Объём углекислого газа, образовавшегося в результате разложения карбоната магния количеством вещества 4 моль избытком соляной кислоты, равен________ л.
Решение. Составляем уравнение химической реакции:
Из этого уравнения следует, что количество вещества углекислого газа и карбоната магния равны между собой, т. е. n(CO2) = 4 моль.
Определим V(CO2):
Пример 4. Объём водорода, который выделится при растворении 16,8 г железа в избытке разбавленной соляной кислоты, равен _________ л.
Решение. Составляем уравнение химической реакции:
Определим количество вещества железа:
Количество вещества железа и водорода в данном уравнении реакции равны между собой. Следовательно, количество вещества водорода также равно 0,3 моль.
Вычислим объём водорода:
Пример 5. Масса осадка, который образуется в результате взаимодействия 40,0 г хлорида кальция с избытком карбоната натрия, равна _________г.
Решение. Составляем уравнение реакции:
Согласно уравнению химической реакции составим пропорцию и решим её:
Пример 6. 250 г раствора нитрата серебра смешали с избытком раствора йодида калия. Выпал осадок массой 11,75 г. Вычислите массовую долю нитрата серебра в исходном растворе.
Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла)
1) Составлено уравнение химической реакции:
2) По массе осадка йодида серебра рассчитано его количество вещества, а затем в соответствии с уравнением реакции — количество вещества и масса нитрата серебра, содержащегося в исходном растворе:
Из уравнения реакции следует, что n(AgI) = n(AgNO3) = 0,05 моль, тогда:
3) Вычислена массовая доля нитрата серебра в исходном растворе:
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых элемента из названных выше | 2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Тренировочные задания
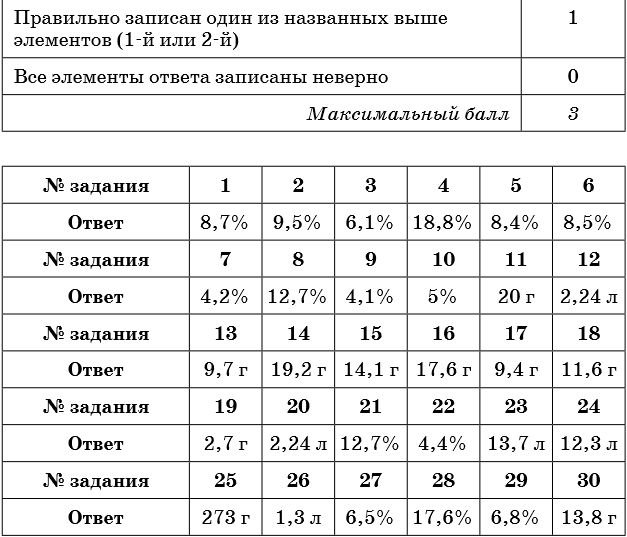
1. К 300 г раствора нитрата бария прибавили избыток раствора сульфата натрия. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
2. К 150 г раствора сульфата натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 23,3 г. Определите концентрацию соли в исходном растворе.
3. К 300 г раствора силиката натрия прибавили избыток раствора нитрата кальция. Масса выпавшего осадка составила 12,0 г. Определите концентрацию соли в исходном растворе.
4. К 150 г раствора карбоната калия прибавили избыток раствора соляной кислоты. При этом выделился газ объёмом 3,36 л (н. у.). Определите концентрацию соли в исходном растворе.
5. К 250 г раствора гидрокарбоната натрия прибавили избыток раствора бромоводородной кислоты. При этом выделился газ объёмом 5,6 л. Определите концентрацию соли в исходном растворе.
6. К 50 г раствора карбоната натрия прибавили избыток раствора хлорида бария. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
7. К 200 г раствора хлорида бария прибавили избыток раствора карбоната калия. Масса выпавшего осадка составила 7,88 г. Определите концентрацию соли в исходном растворе.
8. К 200 г раствора хлорида железа (II) прибавили избыток раствора гидроксида калия. Масса выпавшего осадка составила 18,0 г. Определите концентрацию соли в исходном растворе.
9. К 400 г раствора нитрата свинца прибавили избыток раствора йодида натрия. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
10. К 300 г раствора йодида натрия прибавили избыток раствора нитрата свинца. Масса выпавшего осадка составила 23,05 г. Определите концентрацию соли в исходном растворе.
11. Определите массу осадка, который выпадет при взаимодействии 150 г 14,8%-ного раствора хлорида кальция с избытком раствора карбоната натрия.
12. Определите объём газа (н. у.), который выделится при взаимодействии 120 г 8,8%-ного раствора карбоната натрия с избытком раствора соляной кислоты.
13. Определите массу соли, которая выпадет в осадок при взаимодействии 140 г 13,5%-ного раствора нитрата цинка с избытком раствора сульфида натрия.
14. Определите массу осадка, который выделится при взаимодействии 200 г 18,8%-ного раствора нитрата меди с избытком раствора сульфида натрия.
15. Определите массу осадка, который выпадет при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора хлорида цинка.
16. Определите массу осадка, который выделится при взаимодействии 200 г 12,7%-ного раствора хлорида железа (II) с избытком раствора сульфида натрия.
17. Определите массу осадка, который выделится при взаимодействии 50 г 17%-ного раствора нитрата серебра с избытком раствора бромида калия.
18. Определите массу осадка, который образуется при взаимодействии 200 г 6,1%-ного раствора силиката натрия с избытком раствора нитрата кальция.
19. Определите массу осадка, который образуется при взаимодействии 50 г 5,8%-ного раствора хлорида магния с избытком раствора фосфата натрия.
20. Определите объём газа, который выделится при взаимодействии 200 г 6,9%-ного раствора карбоната калия с избытком раствора соляной кислоты.
21. Оксид фосфора (V) массой 21,3 г растворили в растворе гидроксида калия, в результате чего был получен раствор средней соли массой 500 г. Определите концентрацию фосфата калия в конечном растворе.
22. Раствор хлорида железа (II) полностью прореагировал со 120 г раствора гидроксида натрия, в результате чего образовалось 6,0 г осадка. Определите массовую долю гидроксида натрия в исходном растворе.
23. Какой объём аммиака (н. у.) может полностью прореагировать со 150 г 20%-ного раствора серной кислоты с образованием средней соли?
24. В 200 г 20%-ного раствора соляной кислоты растворили магний до прекращения выделения газа. Определите объём выделившегося при этом водорода (н. у.).
25. Аммиак объёмом 10 л (н. у.) пропустили через раствор серной кислоты с массовой долей 8% до образования средней соли. Определите массу исходного раствора.
26. Определите объём сероводорода (н. у.), который необходимо пропустить через 130 г 6%-ного раствора хлорида меди (II) до полного осаждения сульфида меди (II).
27. Сероводород объёмом 3,36 л (н. у.) пропустили через раствор гидроксида натрия, в результате чего получили 180 г раствора сульфида натрия. Определите массовую долю соли в полученном растворе.
28. Алюминий массой 8,1 г может нацело прореагировать с 250 г раствора серной кислоты. Определите массовую долю серной кислоты в исходном растворе.
29. К 250 г раствора нитрата серебра добавили раствор хлорида калия до прекращения выделения осадка, масса которого составила 14,35 г. Определите массовую долю нитрата серебра в исходном растворе.
30. К 300 г 5%-ного раствора хлорида магния добавили избыток раствора фосфата калия. Вычислите массу выпавшего при этом осадка.
Ответы
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, или Как вычислить массу вещества (или объем газа) по известному количеству вещества одного из вступающих в реакцию или образующихся в результате нее веществ
Расчеты по химическим уравнениям являются одними из самых широко используемых в химии.
Это самый простой тип расчетных задач, в основе которых лежит химическое уравнение.
Содержание
Особенности задач с расчетами по химическим уравнениям
Основной алгоритм расчетов с использованием химических уравнений
Расчеты по химическим уравнениям: примеры
Особенности задач с расчетами по химическим уравнениям
В задачах с расчетами по химическим уравнениям речь идет о каком-либо химическом превращении (например, разложении) одного какого-то вещества или химическом взаимодействии двух или нескольких веществ. Причем:
- Масса или объем одного из них известны. Требуется найти массу или объем продукта реакции – вещества (или одного из веществ), образующегося в результате взаимодействия.
- Либо, наоборот, известны масса или объем образовавшегося вещества, требуется найти массу или объем исходного вещества.
- Либо известны масса или объем одного из реагентов, необходимо вычислить массу или объем второго реагента.
Прежде, чем приступить к вычислениям, важно составить уравнение реакции взаимодействия и правильно расставить коэффициенты.
Необходимо помнить, что коэффициенты, стоящие перед формулами веществ в уравнении реакции, показывают, в каких эквивалентных (достаточных, необходимых, пропорциональных) количествах реагируют вещества. Эти количества называют «количествами вещества по уравнению реакции» и записывают под формулами соответствующих веществ в уравнении.
Те количества вещества, которые находят, используя данные задачи, называют «количествами вещества по условию задачи» и в уравнение не записывают.
В ходе решения сравнивают «количества вещества по уравнению реакции» для того, чтобы узнать, в каком соотношении находятся вещества, о которых идет речь в задаче. Используя данные об этом соотношении, определяют «количества вещества по условию задачи». А затем, применяя основную расчетную формулу, вычисляют искомые массу или объем вещества.
Основной алгоритм расчетов с использованием химических уравнений
Основные шаги, которые необходимо сделать при решении задач с использованием химических уравнений, можно отобразить в виде схемы:
Расчеты по химическим уравнениям: примеры
Приведем несколько примеров с расчетами по химическим уравнениям.
Пример 1. В избытке воды растворили 11,5 г металлического натрия. Какой объем водорода выделился при этом?
- Так как в задаче говорится о химическом процессе: натрий реагирует с водой, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярную массу натрия (смотрим по таблице Менделеева) и молярный объем для водорода (так как требуется найти объем этого газа, а не массу).
- В условии говорится, что натрий реагирует с избытком воды. Это означает только то, что её будет достаточно для взаимодействия с металлом.
Пример 2. Кальций массой 2 г прореагировал с кислородом. Какая масса кислорода вступила в реакцию?
- Так как в задаче говорится о химическом процессе: кальций реагирует с кислородом, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
Пример 3. Смесь, состоящую из 3 г магния и 3,9 г цинка, сплавили с серой, которая находилась в избытке. Рассчитайте массу полученной смеси сульфидов металлов.
- В составе смеси два металла: магний и цинк. Однако каждый из них прореагирует с серой самостоятельно. Поэтому запишем два уравнения реакции и решим фактически две задачи в одной.
- Над формулами веществ в уравнениях реакций расставим данные условия задачи.
- Под формулами веществ в уравнениях реакций расставим количества веществ (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
- Поскольку требуется найти массу смеси образовавшихся сульфидов, то рассчитаем массу каждого из них из соответствующего уравнения. Укажем это в уравнениях над формулами сульфидов.
- Избыток серы говорит только о том, что ее будет достаточно для полного реагирования как магния, так и цинка.
Итак, при расчетах по химическим уравнениям важно правильно записать уравнение реакции и расставить коэффициенты.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
На данный момент задачи по этой теме кодификатора идут в КИМе ЕГЭ под номером 29.
Для их решения можно воспользоваться следующим алгоритмом:
1) записать уравнение реакции, о которой идет речь в задаче, и убедиться в правильности расставленных коэффициентов;
2) рассчитать количество молей вещества, масса или объем которого указаны в условии.
Если указана масса некого вещества A, то расчет количества вещества для него следует вести по формуле:
где mA – масса вещества А, а MA – молярная масса вещества А.
Если указан объем газообразного вещества А:
где VA – объем газообразного вещества А, а Vm – молярный объем, одинаковый для всех газов и при н.у. равный 22,4 л/моль.
Иногда вместо массы или объема вещества дается его количество вещества (моль). В таком случае действия по его нахождению не требуются.
3) далее от молей вещества А нужно перейти к молям вещества, массу или объем которого спрашивают в условии.
Допустим спрашивают объем или массу вещества B. Тогда для перехода от количества моль вещества А к количеству моль вещества B следует пользоваться тем правилом, что для любого вещества его количество, деленное на его коэффициент, в уравнении реакции одно и то же. Т.е. количества веществ А и В связаны друг с другом через коэффициенты в уравнении следующим образом:
где n(A) и n(B) – количества вещества А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
Из этого выражения следует, что количество вещества В равно:
4) далее, зная количество вещества B, мы можем найти его массу по формуле:
Если же вещество B является газом и спрашивают его объем, то рассчитать его можно следующим образом:
В общем, последовательность решения таких задач можно изобразить следующей схемой:
1) Зная массу или объем вещества A, рассчитываем его количество вещества.
2) Зная количество вещества A, рассчитываем количество вещества B по формуле:
где n(A) и n(B) – количества веществ А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
3) В зависимости от того, требуется найти массу вещества В или объем газа В, умножаем его количество либо на молярную массу, либо на молярный объем газа:
Пример
Какая масса сульфида алюминия потребуется для того, чтобы в результате его взаимодействия с избытком соляной кислоты образовался газ объемом 33,6 л (н.у.).
Решение:
1) Запишем уравнение реакции:
2) Рассчитываем количество вещества, для которого известна его масса или объем (в случае газа). Нам известен объем сероводорода, рассчитаем его количество вещества:
3) Отношение количества вещества любого фигуранта реакции к его коэффициенту в уравнении этой реакции всегда одно и то же. Т.е. для сульфида алюминия и сероводорода мы можем записать, что:
где k(Al2S3) и k(H2S) – коэффициенты перед Al2S3 и H2S соответственно.
Из этого выражения выразим n(Al2S3):
Подставим известные значения n(H2S) и коэффициентов перед H2S и Al2S3:
Тогда масса сульфида алюминия будет равна:
Задачи с реальных экзаменов ЕГЭ на тему «Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ» можно порешать здесь.
Как вычислить объем продукта реакции
В задачах по химии школьного курса, как правило, требуется вычислить объем для газообразного продукта реакции. Вы можете это сделать, если известно количество молей любого участника химического взаимодействия. Или найдите это количество из других данных задачи.

Вам понадобится
- — ручка;
- — бумага для записей;
- — калькулятор;
- — таблица Менделеева.
Инструкция
Прежде всего, составьте уравнение реакции. Возьмите для примера реакцию горения аммиака в кислороде с образованием азота и воды. Вам необходимо найти объем выделившегося газа N2.
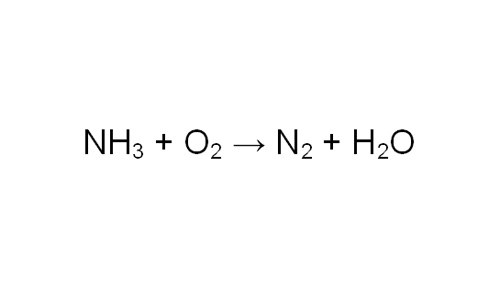
Проставьте коэффициенты в уравнении. Чтобы проверить себя, сосчитайте количество атомов одного элемента в левой и правой части уравнения. Обратите внимание, в каком соотношении химические соединения участвуют в реакции. Теперь, зная количество любого из участников реакции, вы можете определить, сколько молей азота образовалось.
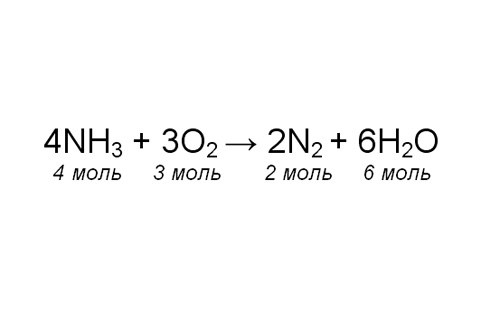
Например, известно, что масса полученной воды, m(H2O), 72 грамма. Рассчитайте молярную массу воды. Для этого найдите в таблице Менделеева значения атомных масс элементов, составляющих молекулу, и сложите их: М(H2O) = 2*1 + 16 = 18 г/моль. Вычислите количество молей образовавшейся воды: v(H2O) = m(H2O)/M(H2O) = 72/18 = 4 моля.
Определите, сколько молей азота получилось, составив пропорцию: 6 моль Н2О — 2 моля N2; 4 моля Н2О – х моль N2. Решите уравнение, найдя х: х = 2*4/6 = 1,33 моль.
Согласно закону Авогадро, один моль любого газа в нормальных условиях, т.е. при температуре 0о и давлении 101325 Па, занимает 22,4 литра. Рассчитайте объем выделившегося 1,33 моля азота: V(N2) = 22,4*1,33 = 29,8 литра.
Если вы знаете, что в реакцию вступило, к примеру, 18 литров кислорода, воспользуйтесь законом объемных отношений Гей-Люссака. Он определяет, что объемы газов, участвующих в реакции, относятся друг к другу, как простые целые числа. То есть из уравнения реакции следует, что из трех литров O2 получается два литра N2. Вы можете сделать вывод, что из 18 литров кислорода образуется 12 литров азота.
Источники:
- вычислите продукт реакции н2 s
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Расчеты, связанные
с уравнениями реакций, называются
стехиометрическими. Они основаны на
законе сохранения массы веществ и
позволяют решать следующие задачи:
-
вычислить массу
(объем, количество вещества) продуктов
реакции по массе (объему, количеству
вещества) одного из реагирующих веществ
или двух (задачи на «избыток» и
«недостаток»), -
определить массовые
(объемные) доли примесей в исходном
веществе, -
рассчитать массовую
(объемную) долю выхода продукта, -
выполнить расчеты
с учетом концентраций веществ.
Стехиометрические
расчеты используются также для решения
задач, обратных вышеперечисленным.
В расчетах по
уравнениям реакций важно уметь правильно
расставить стехиометрические коэффициенты.
Для уравнивания реакций можно использовать
прикладную программу, составленную
студентом химического факультета
Самарского госуниверситета А.Скугаревым.
Вид рабочего окна
этой программы:
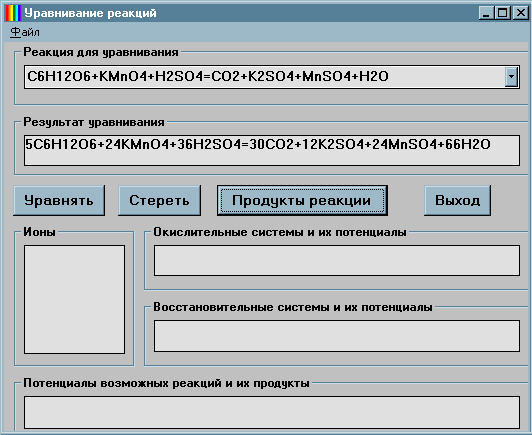
Эта
программа на данном web-сайте не размещена.
Ее можно найти в интерактивном компьютерном
учебнике на CD ROM (см. описание
учебного комплекса
3.6.1. Расчет массы (объема, количества) продуктов реакции по массе (объему, количеству вещества) исходных веществ и обратные вычисления
Задача.
Какую массу углекислого газа можно
получить, если сжечь
3,2 г метана?
Определите объем, который займет
углекислый газ, образовавшийся в этой
реакции при нормальных условиях.
Краткие условия
в данном случае целесообразно записать,
учитывая уравнение реакции сгорания
метана, следующим образом:
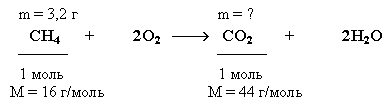
Решение
1. Находим количество
вещества метана, вступившего в реакцию:
2. Количество
углекислого газа согласно уравнению
реакции равно количеству метана:
(CO2)
=
(CH4)
= 0,2 моль
3.
Определяем массу CO2:
m(CO2)
=
(CO2)
M(CO2)
= 0,2 моль
44 г/моль = 8,8 г
Ответ:
m(CO2)
= 8,8 г
3.6.2. Расчет массы (объема, количества) продуктов реакции при условии, что одно из реагирующих веществ взято в избытке
Задача.
Какой объем метана (н.у.) выделится при
взаимодействии 10 г карбида алюминия
(Al4C3)
с 10 г воды ?
Краткие условия:
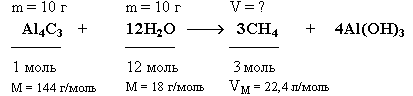
Решение
1. Находим количества
вступивших в реакцию веществ:
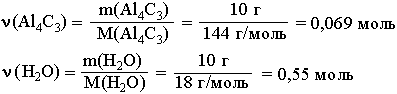
Так как на 1 моль
Al4C3
требуется в 12 раз большее количество
вещества воды, то на 0,069 моль Al4C3
необходимо 0,828 моль воды. Следовательно,
0,55 моль воды недостаточно для реакции
с 0,069 моль
Al4C3,
который взят в избытке и прореагирует
неполностью.
2. Определим
(CH4)
по веществу, взятому в недостатке:
3. Рассчитаем объем
метана, образовавшегося в реакции:
V(CH4)
=
(CH4)
Vm
= 0,137 моль
22,4 л/моль = 3,07 л
Ответ:
V(CH4)
= 3,07 л
3.6.3.
Расчет массы, объема и количества
исходных веществ или продуктов реакции
с учетом примесей
Задача.
Определить массу образца технического
углерода, содержащего 3% примесей,
необходимого для получения 67,2 л (н.у.)
метана.

3.6.4. Расчет массы,
объема и количества исходных веществ
или продуктов реакции с учетом концентрации
их в растворе (смеси)
Задача.
Сколько грамм бромной воды с массовой
долей брома 3,2% потребуется для реакции
с 10 л смеси этана и этилена, в которой
объемная доля этилена равна 28%?
3.6.5.
Расчет массы, объема и количества веществ
с учетом выхода продукта реакции
Задача.
Бензол количеством вещества 0,5 моль
прореагировал с избытком брома (в
присутствии катализатора). При этом
получили бромбензол массой 70 г. Определите
массовую долю выхода бромбензола.

3.7. Задачи
повышенной трудности
На олимпиадах и
вступительных экзаменах в вузы
предлагаются более сложные задачи, чем
рассмотренные нами ранее. Обычно в них
сочетаются различные типы расчетов –
как по формулам веществ, так и по
уравнениям реакций. Решение таких задач
требует не только глубоких знаний химии,
но и развитого логического мышления,
владения алгебраическим аппаратом
(системы уравнений с несколькими
неизвестными, неравенства, степенные
и логарифмические функции и т.п.).
Рассмотрим решение
одной из олимпиадных задач (г.Самара).
Задача.
При
дегидрировании смеси циклогексана и
циклогексена в бензол выделился водород
массой, достаточной для полного
восстановления 36,9 г нитробензола в
анилин. Найти %-ный (по массе) состав
исходной смеси, если известно, что такая
же масса этой смеси может обесцветить
480 г 10%-ного раствора брома в CCl4.

1.
Определим m(Br2)
в растворе СCl4:
m(Br2)
= m(раствора)
(Br2)
= 480 г
0,1 = 48 г
2. Из
углеводородов исходной смеси с Br2
реагирует только циклогексен С6Н10,
являющийся ненасыщенным соединением.
По
уравнению этой реакции рассчитаем массу
С6Н10.

(С6Н10)
=
(Br2)
= 0,3 моль
m(C6Н10)
=
(С6
Н10)
M(С6
Н10)
= 0,3 моль
82 г/ моль = 24,6 г
3.
Рассчитаем количество вещества Н2,
использованного на восстановление
нитробензола:
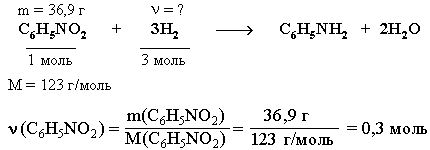
(Н2)
= 3
(С6Н5NO2)
= 0,9 моль
4. Массу циклогексана
рассчитаем из уравнений реакций
дегидрирования углеводородов.
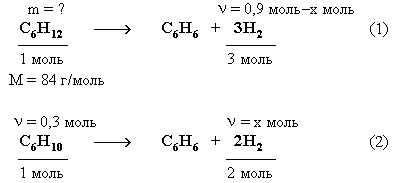
Из
уравнения (2) следует, что x =
(H2)
= 0,6 моль.
Тогда количество
водорода, выделившегося в реакции (1)
равно:
(Н2)
= 0,9 моль – 0,6 моль = 0,3 моль.
m(C6H12)
=
(C6H12)
M(C6H12)
= 0,1 моль
84 г/моль = 8,4 г
5. Определим массу
исходной смеси углеводоров:
m(смеси)
= m(C6H12)
+ m(C6H10)
= 8,4 г + 24,6 г = 33,0 г
6. Рассчитаем
массовые доли углеводородов в исходной
смеси:
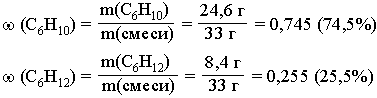
Ответ:
(С6Н10)
= 0,745 (74,5%)
(С6Н12)
= 0,255 (25,5%)
4.
КОНТРОЛЬНЫЕ ЗАДАЧИ
Примечание: знаком * отмечены задачи
повышенной трудности.
Калькулятор
1.
Какое количество вещества составляет
92 г этанола С2Н5ОН?
Ответ
1
: 1 моль
Ответ
2
: 2 моль
Ответ
3
: 2.5 моль
Ответ
4
: 1.5 моль
2.
Определите массу глюкозы, содержащей
0,6 моль атомного углерода.
Ответ
1
: 3,6 г
Ответ
2
: 7,2 г
Ответ
3
: 14,4 г
Ответ
4
: 18 г
3.
Определите массовую долю кислорода (в
%) в метиловом спирте, состав которого
выражен формулой СН3ОН.
Ответ
1
: 50
Ответ
2
: 25
Ответ
3
: 15
Ответ
4
: 10
4.
Какой объем водорода (н.у.) может
присоединить смесь газов массой 15,4 г,
которая содержит этилен (
= 54,5%),
пропилен (
= 27,3%) и бутилен (
= 18,2%).
Ответ
1
: 5 л
Ответ
2
: 10 л
Ответ
3
: 15 л
Ответ
4
: 20 л
5.
Природный газ одного из месторождений
содержит
метан (
= 92%), этан (
= 3%), пропан (
= 1,6%),
бутан (
= 0,4%), азот (
= 2%), другие газы (
= 1%). Определите массу органических
веществ, входящих в состав 20 л (н.у.)
природного газа.
Ответ
1
: 5,3 г
Ответ
2
: 10,1 г
Ответ
3
: 14,8 г
Ответ
4
: 20,2 г
6.
При сгорании алкана массой 3,6 г образуется
оксид углерода (IV) объемом 5,6 л (н.у).
Плотность алкана по водороду равна 36.
Установите молекулярную формулу алкана.
Ответ
1
: С2Н6
Ответ
2
: С3Н8
Ответ
3
: С4Н10
Ответ
4
: С5Н12
7.
Вывести молекулярную формулу вещества,
если оно содержит С (
= 39,97%), Н (
= 6,73%) и О (
= 53,3%) и 300 мл паров этого вещества (н.у.)
имеют массу, равную 2,41 г.
Ответ
1
: С12Н22О11
Ответ
2
: С6Н12О6
Ответ
3
: С2Н6О
Ответ
4
: С3Н8О
8.
Сколько г хлора потребуется для
превращения 19 г бензола С6Н6
в гексахлоран С6Н6Сl6
?
Ответ
1
: 10,3 г
Ответ
2
: 32,4 г
Ответ
3
: 51,9 г
Ответ
4
: 68,1 г
9.
При нагревании иодметана СH3I
массой 2,84 г с металлическим натрием
массой 0,69 г получили этан С2Н6
объемом 179,2 мл при н.у. Определите объемную
долю выхода продукта реакции.
Ответ
1
: 60%
Ответ
2
: 70%
Ответ
3
: 80%
Ответ
4
: 90%
10.
Сколько граммов 80% — го технического
карбида кальция CaC2
потребуется для получения 2,8 л ацетилена
при н.у.?
Ответ
1
: 10 г
Ответ
2
: 20 г
Ответ
3
: 30 г
Ответ
4
: 40 г
11.
Сколько граммов толуола С7Н8
потребуется для получения 113,5 г
тринитротолуола С7Н5(NO2)3,
если массовая доля выхода продукта
составляет 80% от теоретически возможного?
Ответ
1
: 35,4 г
Ответ
2
: 64,3 г
Ответ
3
: 81,2 г
Ответ
4
: 93,4 г
12.
Какую массу бромной воды с массовой
доле брома 1,6% может обесцветить пропилен
объемом 1,12 л (н.у.)?
Ответ
1
: 200 г
Ответ
2
: 300 г
Ответ
3
: 400 г
Ответ
4
: 500 г
13.
Какой объем воздуха потребуется для
сжигания 30 л ацетилена С2Н2
(н.у.), содержащего 5% негорючих примесей?
Содержание кислорода в воздухе считать
равным 20% по объему.
Ответ
1
: 356,25 л
Ответ
2
: 428,50 л
Ответ
3
: 282,45 л
Ответ
4
: 648,35 л
14.
Сколько л водорода (н.у.) выделится при
каталитическом дегидрировании 49 г
метилциклогексана в толуол, если объемная
доля выхода продукта равна 75% от
теоретически возможного?
Ответ
1
: 15,5 л
Ответ
2
: 25,2 л
Ответ
3
: 22,4 л
Ответ
4
: 4,48 л
15*.
При сгорании 13,44 л (н.у.) смеси монооксида
углерода, метана и ацетилена образовалось
17,99 л СО2
(н.у.) и 9 г Н2О.
Сколько литров каждого газа содержится
в смеси?
Ответ
1
: V(CO) = 10 л; V(CH4)
= 1,72 л; V(C2H2)
= 1,72 л
Ответ
2
: V(CO) = 5,04 л; V(CH4)
= 3,16 л; V(C2H2)
= 5,24 л
Ответ
3
: V(CO) = 2,5 л; V(CH4)
= 3 л; V(C2H2)
= 7,94 л
Ответ
4
: V(CO) = 5 л; V(CH4)
= 2,5 л; V(C2H2)
= 4,94 л
16*.
При взаимодействии 11,2 г алкена с
бромоводородом получено 27,4 г вещества.
Напишите формулы всех возможных изомеров
алкена.
Ответ
1
:
Ответ
2
:
Ответ
3
:
Ответ
4
:
17*.
Анализ смеси метана и ацетилена показал,
что общее содержание углерода в смеси
по массе равно 88, 46%. Определите состав
смеси в % по массе.
Ответ
1
: (CH4)
= 30%; (C2H2)
= 70%
Ответ
2
: (CH4)
= 25,5%; (C2H2)
= 74,5%
Ответ
3
: (CH4)
= 20,8%; (C2H2)
= 79,2%
Ответ
4
: (CH4)
= 40%; (C2H2)
= 60%
18*.
При сгорании 14,6 г хлорсодержащего
органического вещества было получено
13,44 л СО2
и 3,6 г Н2О.
Весь хлор, содержавшийся в навеске,
вдвое меньшей, чем исходная, переведен
в AgCl массой 14,3 г. Плотность по водороду
исследуемого хлорорганического вещества
равна 74. Определите молекулярную формулу
этого вещества.
Ответ
1
: C2H4Cl2
Ответ
2
: C4H8Cl2
Ответ
3
: C3H6Cl2
Ответ
4
: C6H4Cl2
19*.
Какой объем хлороводорода может
прореагировать с 15 г смеси, состоящей
из триметиламина, пропиламина и
метилэтиламина?
Ответ
1
: 2,24 л
Ответ
2
: 5,7 л
Ответ
3
: 4,48 л
Ответ
4
: 6,72 л
20*.
При окислении одноатомного спирта m =
11,2 г кислородом воздуха в присутствии
катализатора при 500°С образовалась
кислота, на нейтрализацию которой
потребовалось 59,4 мл 20% раствора КОН
(=1,18
г/мл). Какова формула исходного спирта?
Ответ
1
: C4H9ОН
Ответ
2
: C3H7ОН
Ответ
3
: C2H5ОН
Ответ
4
: CH3ОН
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #