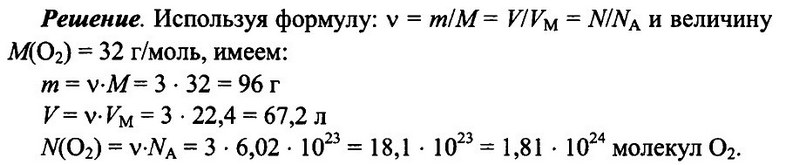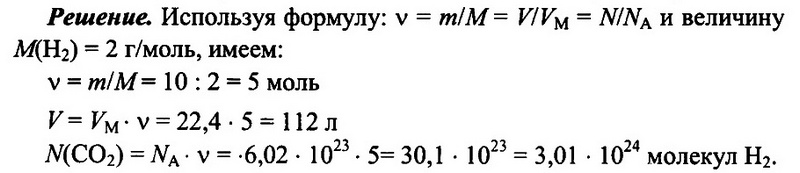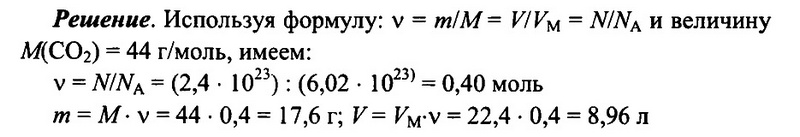Основные формулы для решения задач по химии
05-Авг-2012 | комментариев 450 | Лолита Окольнова
Все, все основные задачи по химии решаются с помощью
нескольких основных понятий и формул.
У всех веществ разная масса, плотность и объем. Кусочек металла одного элемента может весить во много раз больше, чем точно такого же размера кусочек другого металла.
Моль (количество моль)
обозначение: моль, международное: mol — единица измерения количества вещества. Соответствует количеству вещества, в котором содержится NA частиц (молекул, атомов, ионов). Поэтому была введена универсальная величина — количество моль. Часто встречающаяся фраза в задачах — «было получено… моль вещества»
NA = 6,02 · 1023
NA — число Авогадро. Тоже «число по договоренности». Сколько атомов содержится в стержне кончика карандаша? Несколько миллионов. Оперировать такими величинами не удобно. Поэтому химики и физики всего мира договорились — обозначим 6,02 · 1023 частиц (атомов, молекул, ионов) как 1 моль вещества.
1 моль = 6,02 · 1023 частиц
Это была первая из основных формул для решения задач.
Молярная масса вещества
Молярная масса вещества — это масса одного моль вещества. Обозначается как M
Есть еще молекулярная масса — Mr
Находится по таблице Менделеева — это просто сумма атомных масс вещества.
Например, нам дана серная кислота — H2SO4. Давайте посчитаем молярную массу вещества: атомная масса H =1, S-32, O-16.
Mr(H2SO4)=1•2+32+16•4=98 гмоль.
Вторая необходимая формула для решения задач —
формула массы вещества:
Т.е., чтобы найти массу вещества, необходимо знать количество моль (n), а молярную массу мы находим из Периодической системы.
Закон сохранения массы — масса веществ, вступивших в химическую реакцию, всегда равна массе образовавшихся веществ.
Если мы знаем массу (массы) веществ, вступивших в реакцию, мы можем найти массу (массы) продуктов этой реакции. И наоборот.
Третья формула для решения задач по химии —
объем вещества:
Откуда взялось число 22.4? Из закона Авогадро:
в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул.
Согласно закону Авогадро, 1 моль идеального газа при нормальных условиях (н.у.) имеет один и тот же объём Vm = 22,413 996(39) л
Т.е., если в задаче нам даны нормальные условия, то, зная количество моль (n), мы можем найти объем вещества.
Итак, основные формулы для решения задач по химии
Число Авогадро NA
6,02 · 1023 частиц
Количество вещества n (моль)
n=mM
n=V22.4 (лмоль)
Масса вещества m (г)
m=n•Mr
Объем вещества V(л)
V=n•22.4 (лмоль)
или вот еще удобная табличка:
Это формулы. Часто для решения задач нужно сначала написать уравнение реакции и (обязательно!) расставить коэффициенты — их соотношение определяет соотношение молей в процессе.
В ОГЭ и ЕГЭ по химии задач , в которых нужно было бы найти только объем массу кол-во моль нет — это обычно ЧАСТЬ решения задачи. Однако, чтобы легко решать более сложные задачи, нужно тренироваться на таких вот небольших упражнениях.
Находим количество вещества по массе
1 Какое количество вещества алюминия содержится в образце металла массой 10.8 г?2 Какое количество вещества содержится в оксиде серы (VI) массой 12 г?
3 Определите количество моль брома, содержащееся в массе 12.8 г.
Находим массу по количеству вещества:
4. Определите массу карбоната натрия количеством вещества 0.25 моль.Объем по количеству вещества:
5. Какой объем будет иметь азот при н.у., если его количество вещества 1.34 моль?6. Какой объем занимают при н.у. 2 моль любого газа?
Ответы:/p>
- 0.4 моль
- 0.15 моль
- 0.08 моль
- 26.5 г
- 30 л
- 44.8 л
Категории:
|
Обсуждение: «Основные формулы для решения задач по химии»
(Правила комментирования)
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
Молярная масса вещества Х обозначается символом M(Х). Она равна отношению массы данной порции вещества m(Х) (в г или кг) к его химическому количеству n(Х) (в моль):
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
Например:
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Формула и алгоритм нахождения объёма
Сегодня мы научимся одному немаловажному умению в химии – находить объём различных растворов и прочих веществ. Это знание необходимо потому, что оно поможет нам в решении многих задач как в тетради, так и в жизни. Нужно лишь знать устоявшуюся формулу.
Важно понимать, что формула нахождения объёма может быть разной в зависимости от того вещества, объём которого нам предстоит найти, а точнее, от агрегатного состояния этого вещества. Для нахождения объёма газа и жидкости используются разные, непохожие друг на друга формулы.
Чёткая и правильная формула для расчёта объёма жидкости выглядит следующим образом: С=n/V.
В этом случае:
- C – молярная масса раствора (моль на литр).
- n – количество вещества (моль).
- V – объём вещества-жидкости (литры).
Из этого следует что V=n/c.
Cуществует и вторая формула для нахождения объёма жидкости при другой задаче и других данных: V=m/p.
Здесь, соответственно:
- V – объём и измеряется он в миллилитрах.
- m – масса, измеряется в граммах.
- p – плотность, измеряется в граммах, делённых на миллилитры.
В случае если, кроме объёма, требуется также найти массу, это можно сделать, зная формулу и количество нужного вещества. При помощи формулы вещества находим его молярную массу путём сложения атомной массы всех элементов, которые входят в его состав.
Для примера возьмём M (AuSo2) и при расчётах у нас должно выйти 197+32+16 * 2 = 261 г/моль. После проведённых расчётов находим массу по формуле m=n*M, где, следовательно:
- m – масса.
- n – количество вещества, которое измеряется в молях (моль).
- M – молярная масса вещества: граммы, делённые на моль.
Количество вещества, как правило, даётся в задаче. Если же нет, то, скорее всего, допущена опечатка или ошибка в условии, и вам стоит обратиться за помощью и объяснениями к учителю, а не пытаться самим вывести несуществующую величину. Основные формулы и алгоритмы решения приведены в данной статье.
Также существует формула для нахождения объёма газа, и выглядит она так – V=n*Vm:
- V – объём газа (литры).
- n – количество вещества (моль).
- Vm – молярный объём газа (литры/моль).
Но есть своего рода исключение. Оно состоит в том, что при нормальных условиях, то есть при определённом давлении и температуре, объём газа является постоянной величиной, равной 22,3 л/моль.
Есть и третий вариант. Если в самом задании будет присутствовать уравнение реакции, тогда ход решения должен проходить иначе. Из уравнения, которое у вас имеется, можно найти количество каждого вещества, оно будет равняться коэффициенту. К примеру, Ch4 + 2O2 = CO2 + H2O. Из этого уравнения следует, что 1 моль метана и 2 моль кислорода при взаимодействии дают 1 моль углерода и 1 моль воды. Даже если учесть тот факт, что в условии имеется количество вещества лишь одного-единственного компонента, не составит труда найти количество всех остальных веществ. Если количество метана составит 0,3 моль, значит, n(Сh4) будет равняться 0,6 моль, n(CO2) = 0,3 моль, n(H2O) = 0.3 моль.
б) Газовые законы объем газа
Кроме вышеуказанной формулы для решения расчетных химических задач, нередко приходится использовать газовые законы, известные из курса физики.
— Закон Бойля-Мариотта
При постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится:
pV = const
— Закон Гей-Люссака
При постоянном давлении изменение объема газа прямо пропорционально температуре:
V/T = const
— Объединенный газовый закон Бойля-Мариотта и Гей-Люссака
pV/T = const
Помимо этого, если известна масса или количество газа, его объем можно вычислить, используя уравнение Менделеева-Клапейрона:
pV = nRT;
pV = n/M ×RT,
где n–число молей вещества, m–масса (г), Ь – молярная масса газа (г/моль), R – универсальная газовая постоянная равная 8,31 Дж/(моль×К).
Молярный объем кристаллов
Объем Vя элементарной ячейки кристалла вычисляют с помощью характеристик кристаллической структуры, которые определяют на основании результатов рентгеноструктурного анализа.
Зависимость между объемом ячейки и молярным объемом:
Vm=VяNA/Z
где Z — определяет, сколько формульных единиц в элементарной ячейке.
Молярный объем
В отличие от твердых и жидких веществ все газообразные вещества химическим количеством 1 моль занимают одинаковый объем (при одинаковых условиях). Эта величина называется молярным объемом и обозначается Vm.
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х):
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм3/моль. Другими словами, молярный объем любого газа при нормальных условиях:
Молярный объем — это объем, равный 22,4 дм3, который занимает 1 моль любого газа при нормальных условиях.
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Спойлер
[свернуть]
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Спойлер
[свернуть]
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Спойлер
[свернуть]
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Спойлер
[свернуть]
Краткие выводы урока:
- Масса вещества химическим количеством 1 моль называется его молярной массой. Она равна отношению массы данной порции вещества к его химическому количеству.
- Объем газообразных веществ химическим количеством 1 моль при нормальных условиях одинаков и равен 22,4 дм3.
- Величина, равная 22,4 дм3/моль, называется молярным объемом газов.
Надеюсь урок 9 «» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «».
Теги
Решение задач на количество вещества,
массу и объем
Ключевые слова: решение задач на количество вещества, решение задач по химии на массу и объем, какое количества вещества содержится, какое число молекул содержится, определите объем (н.у.), определите массу, какова масса порции, определите молярную массу, назовите вещество, найдите молярную массу, определите абсолютную массу молекулы, сколько атомов содержится, определите относительную плотность.
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества. Единицей измерения количества вещества является моль. Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:

Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
Na = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:
Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
РЕШЕНИЯ ПРОСТЫХ ЗАДАЧ
Задача № 1.
Какое количество вещества содержится в 33 г оксида углерода (IV)?
Ответ: ν(СО2) = 0,75 моль.
Задача № 2.
Какое число молекул содержится в 2,5 моль кислорода?
Ответ: N(O2) = 1,505 • 1024.
Задача № 3.
Определите объем (н. у.), который займут 0,25 моль водорода.
Задача № 4.
Какую массу будет иметь порция оксида серы (IV), объем которой 13,44 л (н. у.)?
Задача № 5.
Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 1024.
Задача № 6.
Имеется 10 г водорода Н2. Определите количество водорода, его объем при н.у., а также число имеющихся молекул водорода.
Ответ: 5 моль; 112 л; 3,01 • 1024.
Задача № 7.
Имеется 56 л хлора Сl2 при н.у. Определите количество вещества хлора, его массу и число имеющихся молекул хлора.
Ответ: 2,5 моль; 177,5 г; 1,5 • 1024.
Задача № 8.
Имеется 2,4 • 1023 молекул оксида углерода (IV) СO2. Определите количество вещества углекислого газа, его массу, а также объем (н.у.) углекислого газа.
Ответ: 0,4 моль; 17,6 г; 8,96 л.
Задача № 9.
Какова масса порции оксида азота (IV), содержащей 4,816 • 1023 молекул? Каков ее объем (н. у.)?
Задача № 10.
Масса порции простого вещества, содержащей 1,806 • 1024 молекул, равна 6 г. Определите молярную массу данного вещества и назовите его.
Внимание! В данном конспекте рассматриваются задачи обычной сложности. Чтобы перейти к конспекту решения сложных задач на количественные характеристики и задачи с кратким ответом нажмите на кнопку ниже…
Сложные задачи на количество …
Решение задач на количество вещества, массу и объем. Выберите дальнейшие действия:
- Перейти дальше: Решение задач с долей вещества в смеси, в соединении
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
На данный момент задачи по этой теме кодификатора идут в КИМе ЕГЭ под номером 29.
Для их решения можно воспользоваться следующим алгоритмом:
1) записать уравнение реакции, о которой идет речь в задаче, и убедиться в правильности расставленных коэффициентов;
2) рассчитать количество молей вещества, масса или объем которого указаны в условии.
Если указана масса некого вещества A, то расчет количества вещества для него следует вести по формуле:
где mA – масса вещества А, а MA – молярная масса вещества А.
Если указан объем газообразного вещества А:
где VA – объем газообразного вещества А, а Vm – молярный объем, одинаковый для всех газов и при н.у. равный 22,4 л/моль.
Иногда вместо массы или объема вещества дается его количество вещества (моль). В таком случае действия по его нахождению не требуются.
3) далее от молей вещества А нужно перейти к молям вещества, массу или объем которого спрашивают в условии.
Допустим спрашивают объем или массу вещества B. Тогда для перехода от количества моль вещества А к количеству моль вещества B следует пользоваться тем правилом, что для любого вещества его количество, деленное на его коэффициент, в уравнении реакции одно и то же. Т.е. количества веществ А и В связаны друг с другом через коэффициенты в уравнении следующим образом:
где n(A) и n(B) – количества вещества А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
Из этого выражения следует, что количество вещества В равно:
4) далее, зная количество вещества B, мы можем найти его массу по формуле:
Если же вещество B является газом и спрашивают его объем, то рассчитать его можно следующим образом:
В общем, последовательность решения таких задач можно изобразить следующей схемой:
1) Зная массу или объем вещества A, рассчитываем его количество вещества.
2) Зная количество вещества A, рассчитываем количество вещества B по формуле:
где n(A) и n(B) – количества веществ А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
3) В зависимости от того, требуется найти массу вещества В или объем газа В, умножаем его количество либо на молярную массу, либо на молярный объем газа:
Пример
Какая масса сульфида алюминия потребуется для того, чтобы в результате его взаимодействия с избытком соляной кислоты образовался газ объемом 33,6 л (н.у.).
Решение:
1) Запишем уравнение реакции:
2) Рассчитываем количество вещества, для которого известна его масса или объем (в случае газа). Нам известен объем сероводорода, рассчитаем его количество вещества:
3) Отношение количества вещества любого фигуранта реакции к его коэффициенту в уравнении этой реакции всегда одно и то же. Т.е. для сульфида алюминия и сероводорода мы можем записать, что:
где k(Al2S3) и k(H2S) – коэффициенты перед Al2S3 и H2S соответственно.
Из этого выражения выразим n(Al2S3):
Подставим известные значения n(H2S) и коэффициентов перед H2S и Al2S3:
Тогда масса сульфида алюминия будет равна:
Задачи с реальных экзаменов ЕГЭ на тему «Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ» можно порешать здесь.
В этой статье мы коснемся нескольких краеугольных понятий в химии, без которых совершенно невозможно
решение задач. Старайтесь понять смысл физических величин, чтобы усвоить эту тему.
Я постараюсь приводить как можно больше примеров по ходу этой статьи, в ходе изучения вы увидите множество примеров
по данной теме.

Относительная атомная масса — Ar
Представляет собой массу атома, выраженную в атомных единицах массы. Относительные атомные массы указаны в периодической
таблице Д.И. Менделеева. Так, один атом водорода имеет атомную массу = 1, кислород = 16, кальций = 40.
Относительная молекулярная масса — Mr
Относительная молекулярная масса складывается из суммы относительных атомных масс всех атомов, входящих в состав вещества.
В качестве примера найдем относительные молекулярные массы кислорода, воды, перманганата калия и медного купороса:
Mr (O2) = (2 × Ar(O)) = 2 × 16 = 32
Mr (H2O) = (2 × Ar(H)) + Ar(O) = (2 × 1) + 16 = 18
Mr (KMnO4) = Ar(K) + Ar(Mn) + (4 × Ar(O)) = 39 + 55 + (4 * 16) = 158
Mr (CuSO4*5H2O) = Ar(Cu) + Ar(S) + (4 × Ar(O)) + (5 × ((Ar(H) × 2) +
Ar(O))) = 64 + 32 + (4 × 16) + (5 × ((1 × 2) + 16)) = 160 + 5 * 18 = 250
Моль и число Авогадро
Моль — единица количества вещества (в системе единиц СИ), определяемая как количество вещества, содержащее столько же структурных единиц
этого вещества (молекул, атомов, ионов) сколько содержится в 12 г изотопа 12C, т.е. 6 × 1023.
Число Авогадро (постоянная Авогадро, NA) — число частиц (молекул, атомов, ионов) содержащихся в одном моле любого вещества.

Больше всего мне хотелось бы, чтобы вы поняли физический смысл изученных понятий. Моль — международная единица количества вещества, которая
показывает, сколько атомов, молекул или ионов содержится в определенной массе или конкретном объеме вещества. Один моль любого вещества
содержит 6.02 × 1023 атомов/молекул/ионов — вот самое важное, что сейчас нужно понять.
Иногда в задачах бывает дано число Авогадро, и от вас требуется найти, какое вам дали количество вещества (моль). Количество вещества в химии
обозначается N, ν (по греч. читается «ню»).
Рассчитаем по формуле: ν = N/NA количество вещества 3.01 × 1023 молекул воды и 12.04 × 1023 атомов углерода.

Мы нашли количества вещества (моль) воды и углерода. Сейчас это может показаться очень абстрактным, но, иногда не зная, как найти
количество вещества, используя число Авогадро, решение задачи по химии становится невозможным.
Молярная масса — M
Молярная масса — масса одного моля вещества, выражается в «г/моль» (грамм/моль). Численно совпадает с изученной нами ранее
относительной молекулярной массой.
Рассчитаем молярные массы CaCO3, HCl и N2
M (CaCO3) = Ar(Ca) + Ar(C) + (3 × Ar(O)) = 40 + 12 + (3 × 16) = 100 г/моль
M (HCl) = Ar(H) + Ar(Cl) = 1 + 35.5 = 36.5 г/моль
M (N2) = Ar(N) × 2 = 14 × 2 = 28 г/моль
Полученные знания не должны быть отрывочны, из них следует создать цельную систему. Обратите внимание: только что мы рассчитали
молярные массы — массы одного моля вещества. Вспомните про число Авогадро.
Получается, что, несмотря на одинаковое число молекул в 1 моле (1 моль любого вещества содержит 6.02 × 1023 молекул),
молекулярные массы отличаются. Так, 6.02 × 1023 молекул N2 весят 28 грамм, а такое же количество молекул
HCl — 36.5 грамм.
Это связано с тем, что, хоть количество молекул одинаково — 6.02 × 1023, в их состав входят разные атомы, поэтому и
массы получаются разные.

Часто в задачах бывает дана масса, а от вас требуется рассчитать количество вещества, чтобы перейти к другому веществу в реакции.
Сейчас мы определим количество вещества (моль) 70 грамм N2, 50 грамм CaCO3, 109.5 грамм HCl. Их молярные
массы были найдены нам уже чуть раньше, что ускорит ход решения.

ν (CaCO3) = m(CaCO3) : M(CaCO3) = 50 г. : 100 г/моль = 0.5 моль
ν (HCl) = m(HCl) : M(HCl) = 109.5 г. : 36.5 г/моль = 3 моль
Иногда в задачах может быть дано число молекул, а вам требуется рассчитать массу, которую они занимают. Здесь нужно использовать
количество вещества (моль) как посредника, который поможет решить поставленную задачу.
Предположим нам дали 15.05 × 1023 молекул азота, 3.01 × 1023 молекул CaCO3 и 18.06 × 1023 молекул
HCl. Требуется найти массу, которую составляет указанное число молекул. Мы несколько изменим известную формулу, которая поможет нам связать
моль и число Авогадро.

Теперь вы всесторонне посвящены в тему. Надеюсь, что вы поняли, как связаны молярная масса, число Авогадро и количество вещества.
Практика — лучший учитель. Найдите самостоятельно подобные значения для оставшихся CaCO3 и HCl.
Молярный объем
Молярный объем — объем, занимаемый одним молем вещества. Примерно одинаков для всех газов при стандартной температуре
и давлении составляет 22.4 л/моль. Он обозначается как — VM.
Подключим к нашей системе еще одно понятие. Предлагаю найти количество вещества, количество молекул и массу газа объемом
33.6 литра. Поскольку показательно молярного объема при н.у. — константа (22.4 л/моль), то совершенно неважно, какой газ мы
возьмем: хлор, азот или сероводород.
Запомните, что 1 моль любого газа занимает объем 22.4 литра. Итак, приступим к решению задачи. Поскольку какой-то газ
все же надо выбрать, выберем хлор — Cl2.


Моль (количество вещества) — самое гибкое из всех понятий в химии. Количество вещества позволяет вам перейти и к
числу Авогадро, и к массе, и к объему. Если вы усвоили это, то главная задача данной статьи — выполнена 

Относительная плотность и газы — D
Относительной плотностью газа называют отношение молярных масс (плотностей) двух газов. Она показывает, во сколько раз одно вещество
легче/тяжелее другого. D = M (1 вещества) / M (2 вещества).
В задачах бывает дано неизвестное вещество, однако известна его плотность по водороду, азоту, кислороду или
воздуху. Для того чтобы найти молярную массу вещества, следует умножить значение плотности на молярную массу
газа, по которому дана плотность.
Запомните, что молярная масса воздуха = 29 г/моль. Лучше объяснить, что такое плотность и с чем ее едят на примере.
Нам нужно найти молярную массу неизвестного вещества, плотность которого по воздуху 2.5

Предлагаю самостоятельно решить следующую задачку (ниже вы найдете решение): «Плотность неизвестного вещества по
кислороду 3.5, найдите молярную массу неизвестного вещества»

Относительная плотность и водный раствор — ρ
Пишу об этом из-за исключительной важности в решении
сложных задач, высокого уровня, где особенно часто упоминается плотность. Обозначается греческой буквой ρ.
Плотность является отражением зависимости массы от вещества, равна отношению массы вещества к единице его объема. Единицы
измерения плотности: г/мл, г/см3, кг/м3 и т.д.
Для примера решим задачку. Объем серной кислоты составляет 200 мл, плотность 1.34 г/мл. Найдите массу раствора. Чтобы не
запутаться в единицах измерения поступайте с ними как с самыми обычными числами: сокращайте при делении и умножении — так
вы точно не запутаетесь.

Иногда перед вами может стоять обратная задача, когда известна масса раствора, плотность и вы должны найти объем. Опять-таки,
если вы будете следовать моему правилу и относится к обозначенным условным единицам «как к числам», то не запутаетесь.
В ходе ваших действий «грамм» и «грамм» должны сократиться, а значит, в таком случае мы будем делить массу на плотность. В противном случае
вы бы получили граммы в квадрате 
К примеру, даны масса раствора HCl — 150 грамм и плотность 1.76 г/мл. Нужно найти объем раствора.

Массовая доля — ω
Массовой долей называют отношение массы растворенного вещества к массе раствора. Важно заметить, что в понятие раствора входит
как растворитель, так и само растворенное вещество.
Массовая доля вычисляется по формуле ω (вещества) = m (вещества) / m (раствора). Полученное число будет показывать массовую долю
в долях от единицы, если хотите получить в процентах — его нужно умножить на 100%. Продемонстрирую это на примере.

Решим несколько иную задачу и найдем массу чистой уксусной кислоты в широко известной уксусной эссенции.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.