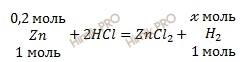Вычислить объем водорода
13,5 грамм цинка (Zn) взаимодействуют с соляной кислотой (HCl). Объемная доля выхода водорода (H2) составляет 85 % . Вычислить объем водорода, который выделился?
Решение задачи
Запишем уравнение реакции взаимодействия цинка (Zn) с соляной кислотой (HCl):
Напомню, что под выходом продукта реакции понимают отношение массы (объема, числа молей) практически полученного вещества к массе (объему, числу молей), теоретически рассчитанной по уравнению реакции.
Учитывая, что молярная масса цинка (Zn) равна 65 г/моль (смотри таблицу Менделеева), найдем химическое количество цинка (Zn) по формуле, устанавливающей связь между химическим количеством вещества и массой:
Получаем:
n (Zn) = 13,5 / 65 = 0,2 (моль).
Вычислить объем водорода. По уравнению реакции найдем химическое количество водорода (H2) (теоретический выход), который выделяется в ходе реакции:
1 моль Zn вытесняет 1 моль водорода (H2)
0,2 моль Zn вытесняет х моль водорода (H2)
Откуда:
По формуле, устанавливающей связь между химическим количеством вещества и объемом, вычислим объем водорода, который образуется в ходе реакции:
Получаем:
V теор.(H2) = 0,2 ∙ 22,4 = 4,48 (л).
Вычислим объем водорода практический по формуле:
Получаем:
V практ. (H2) = 85 ⋅ 4,48 / 100 = 3,81 (л).
Ответ:
объем водорода равен 3,81 литра.
Определите объем водорода (н.у.), выделившегося при взаимодействии 69 г натрия с водой, и количество вещества полученного гидроксида натрия NaOH.
Дано: _
Решение: $2Na + 2HOH = 2NaOH + H_{2}↑$
reshalka.com
ГДЗ Химия 8 класс рабочая тетрадь Габриелян. §20. Расчеты по химическим уравнениям. Номер №3
Решение
Дано:
m (Na) = 69 г
Найти:
V ($H_{2}$) −?
n (NaOH) − ?
Решение:
$2Na + 2HOH = 2NaOH + H_{2}↑$
V ($H_{2}$) = Vm * n
n ($H_{2}$) = $frac{1}{2}$ * n (Na)
n (Na) = m : M = 69 г : 23 г/моль = 3 моль
n ($H_{2}$) = $frac{1}{2}$ * 3 моль = 1,5 моль
V ($H_{2}$) = 22,4 л/моль * 1,5 моль = 33,6 л
n (NaOH) = n (Na) = 3 моль
Ответ: V ($H_{2}$) = 33,6 л; n (NaOH) = 3 моль
Как найти объём выделившегося газа
В учебном курсе химии часто встречаются задачи, в которых требуется вычислить объем газа, выделившегося в результате химической реакции. Почти все задачи такого типа можно решить по следующему алгоритму.

Вам понадобится
- — таблица Менделеева;
- — ручка;
- — бумага для записей.
Инструкция
К примеру, вам требуется найти объем выделившегося водорода в результате реакции ортофосфорной кислоты и карбоната натрия. Самое главное для решения – правильно составить уравнение реакций. Если вы сомневаетесь, как реагируют данные в вашей задаче вещества, посмотрите в справочной литературе свойства химических веществ, участвующих в реакции.
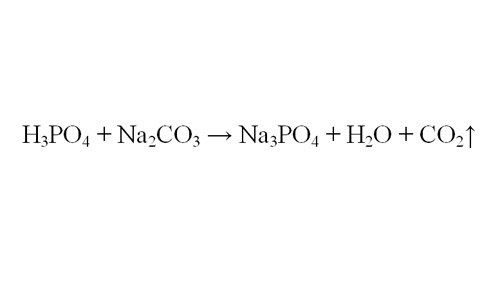
Расставьте коэффициенты в уравнении, чтобы число атомов элементов в левой и правой части уравнения совпадали. Теперь вы видите, в каком соотношении реагируют вещества. По известному количеству любого из них вы можете определить количество молей выделившегося газа. Например, если в реакцию вступило 4 моля ортофосфорной кислоты, получится 6 молей углекислого газа.
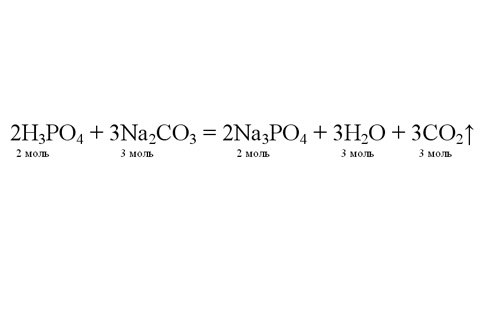
Зная количество молей газа, найдите его объем. По закону Авогадро 1 моль любого газа в нормальных условиях занимает 22,4 литра объема. Объем 6 молей газа будет равен: 6*22,4 = 134,4 литра.
Если в условии не дано количество реагента или продукта реакции, найдите из его других данных. При известной массе одного из веществ вы вычислите его количество молей по формуле: v = m/M, где v – количество вещества, моль; m – масса вещества, г; M – молярная масса вещества, г/моль. Молярную массу вы получите, сложив атомные веса элементов, составляющих вещество, из таблицы Менделеева. Например, молярная масса H3PO4: М = 3*1+31+16*4 = 98 г/моль.
Массу или количество нетрудно рассчитать из концентрации вещества, если известен объем раствора. Из молярности определите количество молей растворенного вещества по уравнению: v = V*Cм, где V – объем раствора, л; См – молярная концентрация, моль/л. Нормальность раствора связана с молярностью выражением: Сн = z*Cм, г моль-экв/л, где z – эквивалент реагента, количество протонов водорода, которое он может принять или отдать. Например, эквивалент H3PO4 – 3.
Также массу растворенного вещества вы можете найти из титра раствора: m = T*V, где Т – титр раствора, г/л; V – объем раствора. Или из плотности: m = p*V, где р – плотность раствора, г/мл.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
ответы
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
похожие вопросы 5
Водород – первый элемент таблицы Менделеева, бесцветный газ.В природе существует в виде трех изотопов, самый распространенный из них – протий. Широко применяется в разных областях промышленности, а также в качестве компонента ракетного топлива. Весьма перспективен и в качестве автомобильного топлива, поскольку продукты сгорания водорода не причиняют вреда окружающей среде. Часто возникает необходимость определить, какой объем водорода потребуется для реакции с тем или иным веществом. Как это можносделать?
Перед вами стоит следующая задача: сколько литров водорода понадобится, чтобы провести гидрирование 20-илитров этилена? То есть, чтобы осуществить реакцию:С2Н4+ Н2=С2Н6.Сделайте вывод: и этилен, и водород – газы.Исходя из уравнения реакции и закона Авогадро вы увидите, что объемы прореагировавших газов в данном случае пропорциональны их количествам. Следовательно, требуемый объем водорода такой же, как и объем этилена, и равен двадцати литрам.
Или: определите какой объем водорода выделится при взаимодействии 2,23 граммов натрия с избытком соляной кислоты? Вы видите, что кислота взята в избытке, значит, реакция прошла до конца, то есть было израсходовано все количество натрия, с образованием соли – хлорида натрия – и вытеснением водорода. Запишите уравнение реакции следующим образом: 2Na+2HCl=2NaCl+ H2
Исходя из коэффициентов, а также из того, что 2,23 грамма натрия составляют 0,1 моля этого вещества, сделайте вывод: выделилось 0,05 моля водорода. Поскольку, согласно закону Авогадро, при нормальных условиях один моль газа занимает 22,4 литра, получите ответ:22,4 * 0,05 = 1,12 литра
Найдите объем, занимаемый водородом, зная его массу. Тут вам на помощь придет универсальное уравнение Менделеева – Клапейрона, описывающее состояние идеального газа. Разумеется, водород не является идеальным газом, но при температурах и давлениях, не слишком отличающихся от нормальных, это уравнение используйте в расчетах. Запишите его следующим образом:PVm=MRT
Путем элементарного преобразования, вы получите нужную формулу: V = MRT/Pm,где M – известная нам масса водорода, R – универсальная газовая постоянная, Т – температура в градусах Кельвина, Р – давление в паскалях, m – молярная масса водорода.
Подставляя в формулу известные вам величины, получите искомый результат.