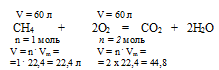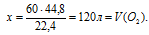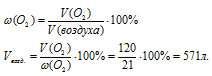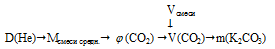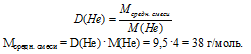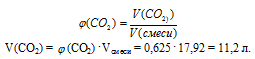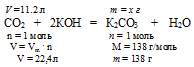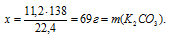Примеры
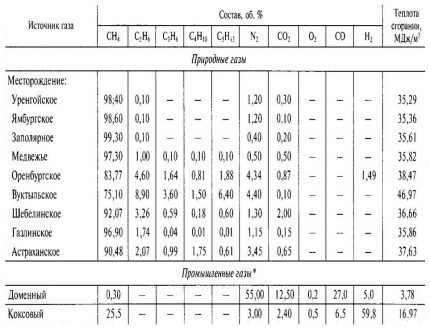
Пример 1. определить
теоретическую массу и объём воздуха,
необходимого для сгорания 1 м3
метана при нормальных условиях.
Решение.
Горючее вещество
является индивидуальным химическим
соединением, поэтому для расчёта его
объёма надо пользоваться формулой
(1.1.3,а), запишем уравнение химической
реакции горения СН4
в воздухе
.
Из уравнения
находим
тогда
м3/м3
или кмоль/кмоль
По формуле (1.1.15) с
учётом уравнения (1.1.16) рассчитаем массу
воздуха
кг/м3.
Пример 2. Определить
теоретический объём воздуха, необходимого
для горения 1 кг бензола.
Решение.
Горючее –
индивидуальное химическое соединение,
поэтому для расчёта по формуле (1.1.3,б)
запишем уравнение химической реакции
горения
найдём
.
Молекулярная масса
бензола
.
Объём 1 кмоля газа
при нормальных условиях составляет
22,4 м3
м3/кг.
Пример 3. Определить
объём и массу воздуха, необходимого для
горения 1 кг органической массы состава
С – 60%, Н – 5%, О – 25%, N
– 5%, W
– 5%(влажность), если коэффициент избытка
воздуха
;
температура воздуха 305 К, давление 99500
Па.
Решение.
Так как горючее
вещество сложного состава, то теоретическое
количество воздуха при нормальных
условиях определим по формуле (1.1.4)
м3/кг.
Из формулы (1.1.7)
рассчитаем практическое количество
воздуха при нормальных условиях
м3/кг.
Находи количество
воздуха, пошедшего на горение веществ
при заданных условиях горения. Используя
формулу (1.1.6), получим
м3/кг,
кг/кг.
Пример 4. Определить
объём воздуха, необходимого для горения
5 м смеси газов, состоящих из 20% — СН4;
40% — С2Н2;
10% — СО; 5% — N2
и 25% — O2,
если коэффициент избытка воздуха 1,8.
Решение.
Горючее-смесь
газов, поэтому для расчёта объёма
воздуха, пошедшего на горение, воспользуемся
формулой (1.1.5). Для определения
стехиометрических коэффициентов при
кислороде
запишем уравнение реакций горения
горючих компонентов в кислороде
тогда
м3/м3.
Для горения 5 м3
газовой смеси необходимый теоретический
объём воздуха составит
м3.
Практическое количество воздуха:
м3.
Пример 5. Определить
коэффициент избытка воздуха при горении
уксусной кислоты, если на горение 1 кг
поступило 3 м3
воздуха.
Решение.
Для определения
коэффициента избытка воздуха по формуле
(1.1.7) необходимо рассчитать его
теоретическое количество. Молекулярная
масса уксусной кислоты 60.
м3/кг.
Тогда коэффициент
избытка воздуха по формуле (1.1.7) равен
Горение протекало
при недостатке воздуха.
Пример 6. Определить
объём воздуха, пошедшего на окисление
1 м3
аммиака, если в продуктах горения
содержание кислорода составило 18%.
Решение. Определяем
теоретическое количество воздуха,
необходимого для горения 1 м3
аммиака:
тогда
м3/м3.
Для определения
коэффициента избытка воздуха необходимо
рассчитать теоретическое количество
продуктов горения 1 м3
аммиака
м3/м3.
Коэффициент
избытка воздуха
Объём воздуха,
участвующего в процессе горения 1 м3
аммиака, определим из формулы (1.1.7)
м3/м3.
Пример 7. Определить
объём окислительной среды, состоящей
из 60% О2
и 40% N2,
необходимый для горения 1 кг изоприлового
спирта, если её температура равна 295 К,
давление 62,0 кПа.
Решение.
Так как окислительная
среда отличается по составу от воздуха,
определим по формуле (1.1.1) объёмное
соотношение кислорода и азота 40:60=0,67.
Уравнение реакции
горения изоприлового спирта
Теоретический
объём окислительной среды при нормальных
условиях рассчитаем по формуле (1.1.3,б).
Молекулярная масса горючего равна 60,
м3/кг.
Объём окислительной
среды при заданных условиях горения
определим из формулы (1.1.6)
м3/кг.
Пример 8. Определить
массу динитротолуола, сгоревшего в
герметичном объёме 100м3,
если содержание кислорода в продуктах
горения составило 12%.
Решение.
Так как в продуктах
горения содержится кислород, то горение
протекало в избытке воздуха, коэффициент
избытка определим по формуле(1.1.10).
.
Молекулярная масса
горючего равна 183. Теоретический объём
воздуха
м3/кг.
Теоретический
объём продуктов горения (формула 1.1.15)
м3/кг,
.
Практический объём
воздуха, пошедший на горение
м3/кг.
Тогда массу
сгоревшего динитротолуола Мг
определим из соотношения
м3—
полный объём помещения
кг.
Задание на
самостоятельную работу
Задача 1: Рассчитать
теоретически необходимое количество
воздуха для сгорания m кг вещества при
Т= … и Р= … . (жидкость)
|
Вариант |
Вещество |
m, |
Т,оС |
Р, |
|
1 |
Амилбензол |
3 |
-20 |
780 |
|
2 |
Н-Амиловый |
5 |
20 |
760 |
|
3 |
Анизол |
7 |
-15 |
778 |
|
4 |
Анилин |
15 |
15 |
762 |
|
5 |
Бутилацетат |
20 |
-10 |
776 |
|
6 |
Бутиловый |
10 |
10 |
764 |
|
7 |
Бензол |
2 |
-5 |
774 |
|
8 |
Диэтиловый |
4 |
5 |
768 |
|
9 |
Ксилол |
6 |
-18 |
772 |
|
10 |
Уайт-спирит |
8 |
18 |
770 |
|
11 |
Этиленгликоль |
9 |
-16 |
740 |
|
12 |
Трет-Амиловый |
11 |
16 |
758 |
|
13 |
Гексан |
12 |
-14 |
742 |
|
14 |
Метиловый |
13 |
14 |
756 |
|
15 |
Толуол |
14 |
-12 |
744 |
|
16 |
Стирол |
16 |
12 |
754 |
|
17 |
Пентан |
19 |
-8 |
746 |
|
18 |
Этанол |
17 |
8 |
752 |
|
19 |
Амилметилкетон |
18 |
-6 |
748 |
|
20 |
Бутилбензол |
22 |
6 |
750 |
|
21 |
Бутилвиниловый |
24 |
-4 |
769 |
|
22 |
Ацетон |
1 |
4 |
779 |
|
23 |
Этиловый |
21 |
-2 |
749 |
|
24 |
Гептан |
25 |
2 |
761 |
|
25 |
Октан |
28 |
-25 |
765 |
|
26 |
Гексан |
1,5 |
19 |
759 |
|
27 |
Бутиловый |
8 |
-6 |
757 |
|
28 |
Анилин |
4,6 |
21 |
769 |
|
29 |
Бензол |
9 |
-11 |
770 |
|
30 |
Ксилол |
2 |
13 |
754 |
Задача 2: Рассчитать
теоретически необходимое количество
воздуха для сгорания V м3горючего
газа
|
Вариант |
Горючий |
V, |
|
1 |
Ацетилен |
25 |
|
2 |
Метан |
5 |
|
3 |
Окись |
15 |
|
4 |
Этан |
7 |
|
5 |
Водород |
10 |
|
6 |
Пропан |
8 |
|
7 |
Сероводород |
3 |
|
8 |
Бутан |
27 |
|
9 |
Ацетилен |
4 |
|
10 |
Метан |
26 |
|
11 |
Окись |
6 |
|
12 |
Этан |
24 |
|
13 |
Водород |
9 |
|
14 |
Пропан |
23 |
|
15 |
Сероводород |
11 |
|
16 |
Бутан |
22 |
|
17 |
Метан |
12 |
|
18 |
Этан |
21 |
|
19 |
Пропан |
13 |
|
20 |
Бутан |
20 |
|
21 |
Окись |
10 |
|
22 |
Ацетилен |
30 |
|
23 |
Водород |
14 |
|
24 |
Метан |
16 |
|
25 |
Ацетилен |
3 |
|
26 |
Метан |
6 |
|
27 |
Окись |
4 |
|
28 |
Этан |
5 |
|
29 |
Водород |
2 |
|
30 |
Пропан |
1,5 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Задать вопрос
Задать вопрос
Ваш вопрос
Вопрос должен состоять из 4 и более символов (не считая знаков препинания)
Подробное описание
Можно ввести 4000 cимволов
Темы
Темы обязательны для заполнения
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
Выберите причину жалобы и оставьте комментарий
Содержит грамматические или орфографические ошибкиСпамНе соответствует тематике сайтаНарушает закон РФМожет показаться обиднымНеверно указана темаПлохо сформулированДругое
Опишите, пожалуйста, подробно причину для более быстрой
обработки вашей жалобы:
Можно ввести 4000 cимволов
E-mail для обратной связи
Отправить
Нажимая кнопку «Отправить», вы принимаете условия пользовательского соглашения
Спасибо
Ваша заявка будет рассмотрена в течение 5 рабочих дней.
Абдигапар
[7.1K]
3 месяца назад
Уравнение реакции горения метана:
СН4 + 2О2 —> CO2 + 2H2O
Из уравнений видно, что горения 1 м^3 метана потребуется 2 м^3 кислорода.
составляем пропорции:
1 м^3 СН4 —- 2 м^3 О2
448 м^3 СН4 —- х.
х = 448*2 = 896 м^3 О2.
Объемная доля кислорода в воздухе составляет 21%.
896 м^3 —- 21%
х ——— 100%
х = 896*100/21 = 4266,67 м^3 воздух.
Ответ: для сжигания 448 м^3 метана потребуется 4266,67 м^3 воздуха.
автор вопроса выбрал этот ответ лучшим
комментировать
в избранное
ссылка
отблагодарить
От качества процесса горения зависит эффективность работы всевозможного газового оборудования. На что прямо влияет количество воздуха для сжигания природного газа, вычислить которое совсем несложно. Почему бы не позаботиться об эффективности расхода топлива и повышении КПД оборудования, выполнив необходимые расчеты самостоятельно, ведь верно?
Но как это правильно сделать и где взять данные для вычислений? Чтобы разобраться в этой теме, давайте рассмотрим в рамках нашей статьи теорию расхода воздуха на сжигание газа, познакомимся с наиболее простыми формулами для вычисления необходимого объема воздуха. А также поговорим о практической пользе этих вычислений.
Содержание статьи:
- Теория расхода воздуха на сжигание газа
- Формулы и примеры выполнения расчета
- Способ #1 — вычисление с использованием формулы
- Способ #2 — расчет с помощью усредненных данных
- Практическое значение расчета расхода воздуха
- Профилактика поломок и понижения КПД оборудования
- Польза расчетов при обустройстве котельной
- Выводы и полезное видео по теме
Теория расхода воздуха на сжигание газа
Процедура получения тепловой энергии напрямую влияет на длительность эксплуатации, периодичность работ по обслуживанию газоиспользующего оборудования. Следует понимать, что оптимальная газовоздушная смесь является залогом безопасности. Поговорим детальнее о расходе воздуха на сжигание газа.
Для сгорания одной молекулы метана, который является основной составляющей природного газа, требуется ровно 2 молекулы кислорода. Если перевести в понятные объемы, то для того, чтобы окислить кубический метр указанного топлива придется использовать в 2 раза больше кислорода.
Но в реальных условиях все сложней. Так как в качестве окислителя для выполнения химико-физического процесса горения применяется воздух, в составе, которого кислород, необходимый для поддержания горения, составляет всего пятую часть. А, если точно, то 20,93% — именно такое процентное соотношение принято использовать для всевозможных технических расчетов. То есть воздуха понадобится в 9,52 раза больше.
При любом техническом расчете количества газа за основу берут все 100% этого топлива. Хотя его основного вещества — метана (СН4) может быть в составе не более 75%
Узнать указанную цифру получится, выполнив 2 действия:
- Деление 100/21. Эта операция позволяет выяснить, что воздуха в любом объеме в 4,76 раза больше, чем кислорода.
- Умножение 4,76 на 2, что равняется 9,52 — именно во сколько раз больше понадобится израсходовать воздуха для сжигания любого объема природного газа.
Но есть одна важная оговорка: вычисленное количество воздуха необходимое для эффективного горения газа, является теоретическим расходом. А на практике его понадобится. Причина в том, что расчет проводился для идеальных условий, а в реальности почти всегда существует ряд факторов, которые вносят значительные коррективы.
К ним относятся:
- состав и качество реагентов (воздуха, газа);
- вид оборудования, используемого для подвода энергоносителя;
- состояния оборудования;
- способа подачи газа, воздуха, а также ряд других моментов.
Если нужна особая точность, то перечисленные выше особенности иногда возможно учесть. К примеру, точный состав газа получится выяснить в ближайшем представительстве службы газа. Но, когда особая точность не нужна, то полученное значение 9,52 просто умножают на, так называемый, коэффициент избытка воздуха. Значение которого обычно лежит в пределах 1,1 — 1,4.
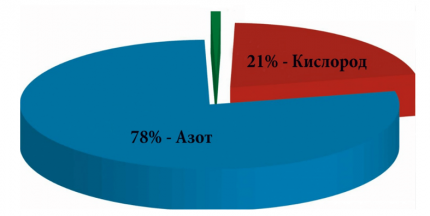
Кислород является окислителем газа. То есть он сам не горит, но активно поддерживает этот процесс с участием указанного топлива. Но поскольку кислорода в составе воздуха не более 20,93%, то считается, что для процедуры сгорания газа его требуется почти в 5 раз больше
Когда расчет должен быть максимально точным, тогда следует количество действительно используемого воздуха разделить на его теоретический расход. Но в большинстве случаев проще использовать усредненное значение коэффициента избытка воздуха. Значение которого следует умножить на 9,52 и в результате получится узнать точное количество расходуемого воздуха, нужного для обеспечения процедуры сгорания газа.
Так если он равен:
- 1,1 — воздушной массы понадобится в 10,472 раза больше;
- 1,4 — воздуха потребуется использовать в 13,328 раз больше.
То есть для сжигания каждого кубического метра энергоносителя понадобится до 13,328 м³ воздуха.
Формулы и примеры выполнения расчета
Необходимое значение в каждом конкретном случае можно получить, воспользовавшись специальной формулой или усредненными показателями. Об этих способах поговорим детальнее.
Способ #1 — вычисление с использованием формулы
Которая гласит, что часовой объем воздуха (Vч ), необходимый для сгорания, будет равен:
Vч = 1,1 х Кизб.в х Vт х Vг/ч х (273 + t)/273,
Где:
- Кизб.в — коэффициент избытка воздуха;
- Vт — теоретически необходимое количество воздуха;
- Vг/ч — часовой расход газа оборудованием;
- t — значения температуры в помещении, где размещено газовое оборудование.
Необходимый для вычислений часовой расход газа указан в паспорте любого газового прибора.
То есть, если такое значение равняется 10, а:
- температура в помещении, к примеру, 18 °С;
- коэффициент избытка воздуха — 1,1.
Тогда выполняем, указанные выше математические действия, а именно:
1,1 х 1,1 х 9,52 х 10 х (273 + 18) / 273 = 122,1
В результате выясняется, что в этом конкретном случае для сжигания газа, каждый час нужно будет 122,1 м³ воздуха.

Расчет количества воздуха необходим для обеспечения эффективной и безопасной работы любого газового оборудования, включая плиты, колонки и котлы отопления, которые используются в быту
Способ #2 — расчет с помощью усредненных данных
Если нет желания выполнять подобный расчет воздуха на горение нужного количества газа, тогда можно прислушаться к рекомендациям многих производителей, специалистов.
Которые гласят, что процесс будет эффективным, если на каждый киловатт мощности ежечасно подводить не меньше 1,6 м³ воздуха.

Если способ расчета с использованием формулы покажется сложным, то можно воспользоваться менее точным и просто усредненным, но зато очень простым, а поэтому доступным. Так как все, что нужно сделать это умножить мощность нужного газового прибора на 1,6, что позволит получить приблизительный объем воздуха, который каждый час придется подводить для полного сгорания газа
То есть выполнить вычисление получится всего за одно действие. Для чего взятое из паспорта значение мощности газового прибора следует умножить на указанные 1,6. В качестве результата получится нужное для эффективного горения количество воздуха.
К примеру, если мощность газового котла составляет 40 кВт, тогда это значение следует умножить на 1,6:
40 х 1,6 = 64
Получится 64 м³ воздуха, которые ежечасно необходимо будет подводить к газовому прибору.
Практическое значение расчета расхода воздуха
Навыки выполнения подобных расчетов могут понадобится для повышения КПД газового оборудования, а также устранения причин его неправильной работы.
Профилактика поломок и понижения КПД оборудования
К примеру, знание оптимального количество окислителя понадобится, когда поверхности дымоходов (внутренние), элементов конструкции оборудования (теплообменники, горелки, прочие) быстро покрываются наслоениями сажи, других продуктов сгорания.
Если устранение загрязнений должного эффекта не дает, как и любые другие меры (настройка, замена частей, узлов агрегатов). Что свидетельствует о наличии так называемого, недогара энергоносителя, который происходит из-за недостаточного количества воздуха.

Процедура горения газа считается сложной реакцией. В результате, если окислителя, то есть воздуха, не будет в достаточном количестве, то это будет сказываться на состоянии, работоспособности и исправности всего газового оборудования. И в ряде случаев неполадки получится устранить только после выявления и корректировки количества воздуха, участвующего в реакции
А также знание необходимого расхода воздуха потребуется в следующих ситуациях:
- Выявлен перерасход газа, который не получается устранить с помощью регулировок, других манипуляций. Так как причиной может быть механический недожег. То есть процесс при котором подводится слишком большое количество воздуха, что тоже приводит к неполному сгоранию газа.
- Замечено частое изменение цвета «голубого» топлива во время горения — к примеру, на оранжевый, белый, красный, желтый. Это более сложные случаи, чем предыдущие, так как причиной может быть, как избыток воздуха, так и его недостаточное количество.
- Неустойчивого процесса горения газа. Например, если задействованы не все рабочие отверстия конфорки, горелки газового котла и т. д. А чистка перечисленных элементов конструкции не привела к улучшению, так как как в таких ситуациях точно придется подводить воздуха на порядок больше.
Несмотря на наличие различных причин расчет выполняется одинаково, согласно методике, изложенной выше.
Польза расчетов при обустройстве котельной
Вычисления количества воздуха, необходимого для эффективного окисления газа, необходимы в случаях обустройства топочной, установки, замены газового оборудования и других подобных.

Всегда следует помнить о том, что теоретические расчеты хороши только, когда их правильность подтверждена практикой. А в случае с количеством воздуха — представителями горгазов с газоанализаторами
И расчеты выполняются, но ситуация в каждом указанном случае усложняется тем, что для получения всех необходимых данных необходимо выполнить еще ряд вычислений.
К которым относятся расчеты:
- суммарного расхода воздуха — в помещение с газовым оборудованием необходимо поставлять воздух не только для процесса горения, но и для его проветривания (в СНиП II-35-76 четко сказано, что в помещениях, используемых в качестве топочных, ежечасно должны сменяться 3 объема воздуха);
- сечения вытяжного канала;
- сечения (-ий) отверстия (-ий) входных каналов;
- естественной тяги в предусмотренном вытяжном канале;
- фактической скорости воздушных масс в сечениях будущих воздуховодов;
- потерь давления на всевозможные местные сопротивления;
- размера окна, положенного в помещении с газовым оборудованием.
Кроме правильного обустройства вентиляции котельной, может понадобиться выполнение еще ряда процедур, к примеру, выполнение аэродинамического расчета.

При выполнении расчета следует помнить о том, что любые действия с газом представляют собой существенную опасность. Поэтому лучше доверить их выполнение специалистам
После чего вся полученная информация должна стать основой проекта замены, установки оборудования, перепланировки, который подается в местную газовую службу на утверждение. Где при выявлении ошибок документ могут отправить обратно составителю.
То есть комплекс процедур по исчислению всех необходимых значений достаточно сложен. Поэтому в случае с установкой, заменой, переносом оборудования с задачей справятся только немногие. Большинству владельцев помещений будет проще обратиться за помощью к специалистам. Которые не только выполнят необходимые математические действия, но и адаптируют расчеты к требованиям законодательства по обустройству топочных, систем вентиляции, дымоудаления, всех прочих. Которые изложены в СНиП II-35-76, а также в СНиП 2.04.08-87 и ряде других менее востребованных профильных документов.
Если в каком-то конкретном случае проект составлять не нужно, то расчеты, выполненные специалистом, исключат угрозу жизни, здоровью самого владельца газового оборудования, его близким и людям, проживающим рядом.
Кроме того, позволят избежать действий, трактующихся законодательством, как самовольное подключение к каким-либо газопроводам. За которые ст. 7.19 КоАП РФ предусматривает санкции в виде штрафа, размер которого 10-15 тыс. рублей. К примеру, так может произойти, если владелец помещения после выполнения расчетов, внесет в конструкцию системы отопления изменения.

Не нужно забывать то, что неудачный расчет количества воздуха или любой другой может сделать человека правонарушителем. За что придется расплачиваться, как минимум финансово. К примеру, если действия или бездействие приведут к нарушению правил, призванных обеспечивать безопасное использование любого газового оборудования, то в качестве штрафа придется расстаться с суммой денег в размере 1-30 тыс. рублей. О чем сказано в ст. 9.23 КоАП
После вычислений не стоит принимать необдуманного решения по замене газового оборудования, особенно с отличающейся мощностью. Если же так произошло, тогда стоит уведомить представителей газовой службы о выполненных действиях. Что поможет избежать штрафов.
А также не нужно воплощать сделанные теоретические расчеты ценой нарушений правил, норм изложенных в СНиП II-35-76, который регулирует сферу обустройства помещений, предназначенных для использования газового оборудования. Так как согласно ст. 9.23 КоАП даже за самые мелкие нарушения придется выложить 1-2 тыс. рублей.
Выводы и полезное видео по теме
Приложенный ниже видеоматериал позволит выявлять недостаток воздуха при горении газа без каких-либо расчетов, то есть визуально.
Рассчитать количество воздуха, необходимого для эффективного горения любого объема газа можно за считанные минуты. И владельцам недвижимости, оборудованной газовым оборудованием, следует об этом помнить. Так как в критический момент, когда котел или любой другой прибор будет работать неправильно, умение вычислять количество воздуха, нужное для эффективного горения, поможет выявить и устранить неполадку. Что, кроме того, повысит безопасность.
Хотите дополнить изложенный выше материал полезными сведениями и рекомендациями? Или у вас остались вопросы по расчету? Задавайте их в блоке комментариев, пишите свои замечания, принимайте участие в обсуждении.
Расчеты по химическим уравнениям с участием газовых смесей
Задача 8.
Определите объем воздуха (н.у.) необходимый для полного сгорания 60 л (н.у.) метана (СН4).
Дано:
объем (н.у.) сгоревшего метана: V(СН4) = 60 л.
Найти:
объем (н.у.) расходовавшегося воздуха: Vвозд. = ?
Решение:
Данных, представленных в условии, явно недостаточно для решения задачи. Нам необходимо дополнительно знать количественный состав воздуха1.
В данном случае в реакции горения метана принимает участие только кислород. Все остальные компоненты представляют собой неактивные примеси. Записываем уравнение реакции:
СН4 + 2О2 = СО2 + 2Н2О
Алгоритм решения можно представить следующим образом:
1. По уравнению горения определим объем кислорода, необходимого для сгорания 60 л метана.
Составим пропорцию:
для сгорания 60 л (СН4) необходимо х л (О2) (по условию)
для сгорания 22,4 л (СН4) необходимо 44,8 л (О2) (по уравнению)
Можно было также найти объем кислорода по закону объемных отношений.
2. Используя дополнительную информацию о содержании кислорода в воздухе, определяем объем воздуха:
Ответ: 571 л воздуха (н.у.) потребуется для полного сгорания 60 л (н.у.) метана.
Задача 9.
Смесь азота и углекислого газа объемом 17,92 л (н.у.) пропустили через избыток раствора гидроксида калия. Определите массу образовавшейся соли, если относительная плотность исходной смеси газов по гелию была 9,5.
Дано:
объем газовой смеси: Vсмеси = 17,92 л;
относительная плотность смеси газов по гелию: D(Не) = 9,5.
Найти:
массу образовавшейся соли: mсоли = ?
Решение:
В данной смеси газов с гидроксидом калия взаимодействует только углекислый газ. Азот же является неактивной примесью. При избытке КОН в результате реакции получается средняя соль К2СО3:
CО2 + 2КОН = К2СО3 + Н2О
Для определения массы образовавшейся соли нам необходимо по относительной плотности смеси газов найти количество СО2 в исходной смеси газов.
Алгоритм решения можно представить следующим образом:
1. Определим среднюю молярную массу смеси газов.
2. Определяем объемную долю СО2 в смеси.
Мсредн. смеси = М(СO2) . (СO2) + M(N2) . (N2)
(N2) = 1 – (СО2) (в долях от 1).
Мсредн. смеси = М(СO2) . (СO2) + M(N2) . (1 – (СО2))
Подставляем все известные значения:
38 = 44 . (СO2+ 28(1 – (СO2))
Решая это уравнение, получим (СO2) = 0,625.
3. Используя значение общего объема смеси газов, определяем объем (СО2).
4. По уравнению реакции определяем массу полученной соли:
Составим пропорцию:
11,2л СО2 дают х г К2СO3 (по данным условия)
22,4 л СО2 дают 138 г К2СО3 (по уравнению)
Ответ: = m(К2СО3) = 69 г.
Комментарии:
1 В условиях большинства задач с использованием воздуха его состав не указывается. Предполагается что решающий должен знать качественный и количественный состав воздуха либо хотя бы содержание в нем активного компонента, чаще всего кислорода.