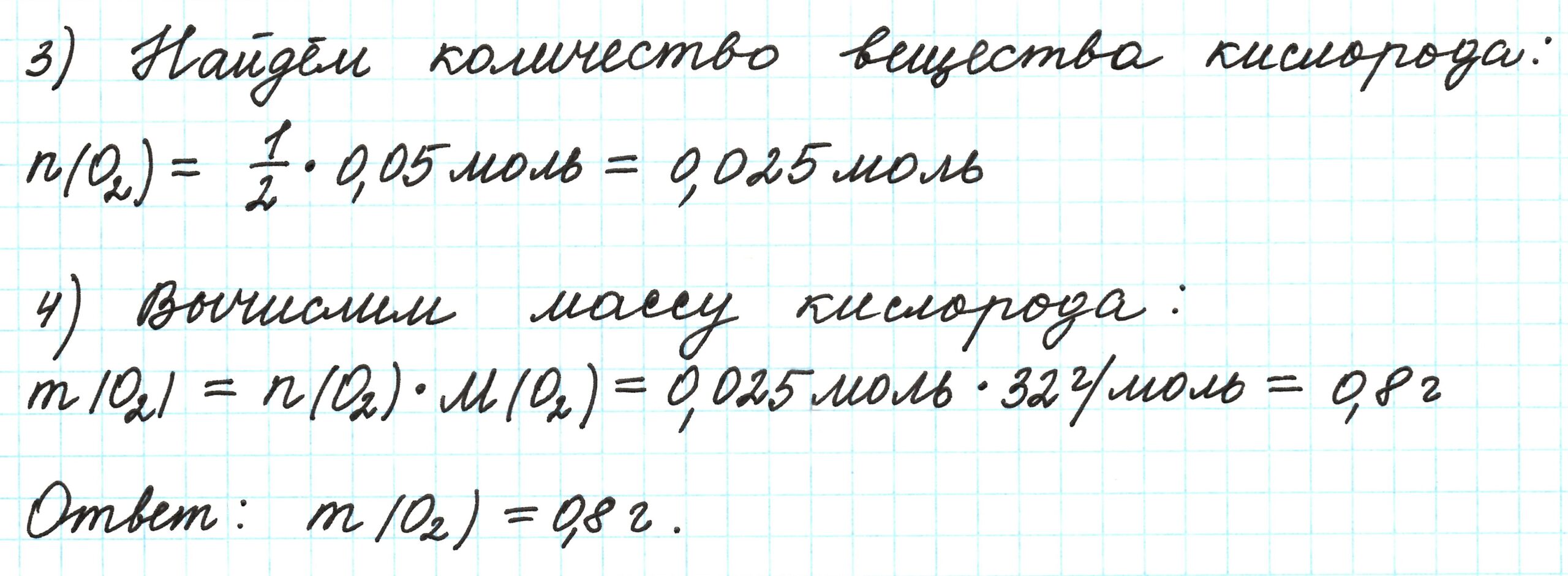4.3.3. Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
На данный момент задачи по этой теме кодификатора идут в КИМе ЕГЭ под номером 29.
Для их решения можно воспользоваться следующим алгоритмом:
1) записать уравнение реакции, о которой идет речь в задаче, и убедиться в правильности расставленных коэффициентов;
2) рассчитать количество молей вещества, масса или объем которого указаны в условии.
Если указана масса некого вещества A, то расчет количества вещества для него следует вести по формуле:
где mA – масса вещества А, а MA – молярная масса вещества А.
Если указан объем газообразного вещества А:
где VA – объем газообразного вещества А, а Vm – молярный объем, одинаковый для всех газов и при н.у. равный 22,4 л/моль.
Иногда вместо массы или объема вещества дается его количество вещества (моль). В таком случае действия по его нахождению не требуются.
3) далее от молей вещества А нужно перейти к молям вещества, массу или объем которого спрашивают в условии.
Допустим спрашивают объем или массу вещества B. Тогда для перехода от количества моль вещества А к количеству моль вещества B следует пользоваться тем правилом, что для любого вещества его количество, деленное на его коэффициент, в уравнении реакции одно и то же. Т.е. количества веществ А и В связаны друг с другом через коэффициенты в уравнении следующим образом:
где n(A) и n(B) – количества вещества А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
Из этого выражения следует, что количество вещества В равно:
4) далее, зная количество вещества B, мы можем найти его массу по формуле:
Если же вещество B является газом и спрашивают его объем, то рассчитать его можно следующим образом:
В общем, последовательность решения таких задач можно изобразить следующей схемой:
1) Зная массу или объем вещества A, рассчитываем его количество вещества.
2) Зная количество вещества A, рассчитываем количество вещества B по формуле:
где n(A) и n(B) – количества веществ А и В соответственно, а k(A) и k(B) – коэффициенты в уравнении перед этими веществами.
3) В зависимости от того, требуется найти массу вещества В или объем газа В, умножаем его количество либо на молярную массу, либо на молярный объем газа:
Пример
Какая масса сульфида алюминия потребуется для того, чтобы в результате его взаимодействия с избытком соляной кислоты образовался газ объемом 33,6 л (н.у.).
Решение:
1) Запишем уравнение реакции:
2) Рассчитываем количество вещества, для которого известна его масса или объем (в случае газа). Нам известен объем сероводорода, рассчитаем его количество вещества:
3) Отношение количества вещества любого фигуранта реакции к его коэффициенту в уравнении этой реакции всегда одно и то же. Т.е. для сульфида алюминия и сероводорода мы можем записать, что:
где k(Al2S3) и k(H2S) – коэффициенты перед Al2S3 и H2S соответственно.
Из этого выражения выразим n(Al2S3):
Подставим известные значения n(H2S) и коэффициентов перед H2S и Al2S3:
Тогда масса сульфида алюминия будет равна:
Задачи с реальных экзаменов ЕГЭ на тему «Расчеты массы вещества или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ» можно порешать здесь.
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ, или Как вычислить массу вещества (или объем газа) по известному количеству вещества одного из вступающих в реакцию или образующихся в результате нее веществ
Расчеты по химическим уравнениям являются одними из самых широко используемых в химии.
Это самый простой тип расчетных задач, в основе которых лежит химическое уравнение.
Содержание
Особенности задач с расчетами по химическим уравнениям
Основной алгоритм расчетов с использованием химических уравнений
Расчеты по химическим уравнениям: примеры
Особенности задач с расчетами по химическим уравнениям
В задачах с расчетами по химическим уравнениям речь идет о каком-либо химическом превращении (например, разложении) одного какого-то вещества или химическом взаимодействии двух или нескольких веществ. Причем:
- Масса или объем одного из них известны. Требуется найти массу или объем продукта реакции – вещества (или одного из веществ), образующегося в результате взаимодействия.
- Либо, наоборот, известны масса или объем образовавшегося вещества, требуется найти массу или объем исходного вещества.
- Либо известны масса или объем одного из реагентов, необходимо вычислить массу или объем второго реагента.
Прежде, чем приступить к вычислениям, важно составить уравнение реакции взаимодействия и правильно расставить коэффициенты.
Необходимо помнить, что коэффициенты, стоящие перед формулами веществ в уравнении реакции, показывают, в каких эквивалентных (достаточных, необходимых, пропорциональных) количествах реагируют вещества. Эти количества называют «количествами вещества по уравнению реакции» и записывают под формулами соответствующих веществ в уравнении.
Те количества вещества, которые находят, используя данные задачи, называют «количествами вещества по условию задачи» и в уравнение не записывают.
В ходе решения сравнивают «количества вещества по уравнению реакции» для того, чтобы узнать, в каком соотношении находятся вещества, о которых идет речь в задаче. Используя данные об этом соотношении, определяют «количества вещества по условию задачи». А затем, применяя основную расчетную формулу, вычисляют искомые массу или объем вещества.
Основной алгоритм расчетов с использованием химических уравнений
Основные шаги, которые необходимо сделать при решении задач с использованием химических уравнений, можно отобразить в виде схемы:
Расчеты по химическим уравнениям: примеры
Приведем несколько примеров с расчетами по химическим уравнениям.
Пример 1. В избытке воды растворили 11,5 г металлического натрия. Какой объем водорода выделился при этом?
- Так как в задаче говорится о химическом процессе: натрий реагирует с водой, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярную массу натрия (смотрим по таблице Менделеева) и молярный объем для водорода (так как требуется найти объем этого газа, а не массу).
- В условии говорится, что натрий реагирует с избытком воды. Это означает только то, что её будет достаточно для взаимодействия с металлом.
Пример 2. Кальций массой 2 г прореагировал с кислородом. Какая масса кислорода вступила в реакцию?
- Так как в задаче говорится о химическом процессе: кальций реагирует с кислородом, — то запишем уравнение реакции.
- Над формулами веществ в уравнении реакции расставим данные условия задачи.
- Под формулами веществ в уравнении реакции расставим количества вещества (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
Пример 3. Смесь, состоящую из 3 г магния и 3,9 г цинка, сплавили с серой, которая находилась в избытке. Рассчитайте массу полученной смеси сульфидов металлов.
- В составе смеси два металла: магний и цинк. Однако каждый из них прореагирует с серой самостоятельно. Поэтому запишем два уравнения реакции и решим фактически две задачи в одной.
- Над формулами веществ в уравнениях реакций расставим данные условия задачи.
- Под формулами веществ в уравнениях реакций расставим количества веществ (они соответствуют коэффициентам, стоящим перед формулами веществ, это эквивалентные количества), молярные массы (смотрим и считаем по таблице Менделеева).
- Поскольку требуется найти массу смеси образовавшихся сульфидов, то рассчитаем массу каждого из них из соответствующего уравнения. Укажем это в уравнениях над формулами сульфидов.
- Избыток серы говорит только о том, что ее будет достаточно для полного реагирования как магния, так и цинка.
Итак, при расчетах по химическим уравнениям важно правильно записать уравнение реакции и расставить коэффициенты.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Как вычислить объем продукта реакции
В задачах по химии школьного курса, как правило, требуется вычислить объем для газообразного продукта реакции. Вы можете это сделать, если известно количество молей любого участника химического взаимодействия. Или найдите это количество из других данных задачи.

Вам понадобится
- — ручка;
- — бумага для записей;
- — калькулятор;
- — таблица Менделеева.
Инструкция
Прежде всего, составьте уравнение реакции. Возьмите для примера реакцию горения аммиака в кислороде с образованием азота и воды. Вам необходимо найти объем выделившегося газа N2.
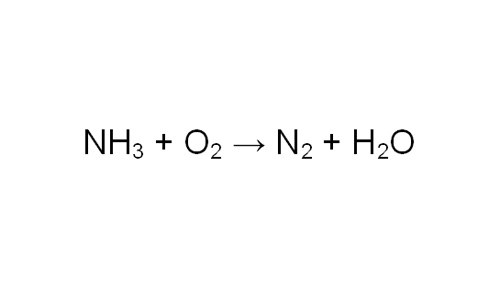
Проставьте коэффициенты в уравнении. Чтобы проверить себя, сосчитайте количество атомов одного элемента в левой и правой части уравнения. Обратите внимание, в каком соотношении химические соединения участвуют в реакции. Теперь, зная количество любого из участников реакции, вы можете определить, сколько молей азота образовалось.
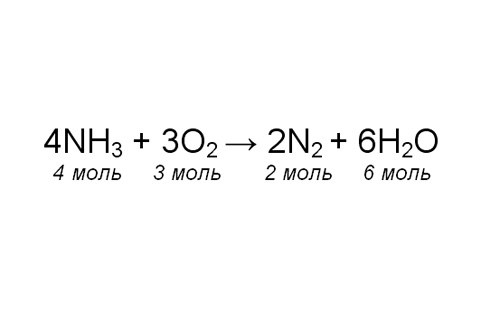
Например, известно, что масса полученной воды, m(H2O), 72 грамма. Рассчитайте молярную массу воды. Для этого найдите в таблице Менделеева значения атомных масс элементов, составляющих молекулу, и сложите их: М(H2O) = 2*1 + 16 = 18 г/моль. Вычислите количество молей образовавшейся воды: v(H2O) = m(H2O)/M(H2O) = 72/18 = 4 моля.
Определите, сколько молей азота получилось, составив пропорцию: 6 моль Н2О — 2 моля N2; 4 моля Н2О – х моль N2. Решите уравнение, найдя х: х = 2*4/6 = 1,33 моль.
Согласно закону Авогадро, один моль любого газа в нормальных условиях, т.е. при температуре 0о и давлении 101325 Па, занимает 22,4 литра. Рассчитайте объем выделившегося 1,33 моля азота: V(N2) = 22,4*1,33 = 29,8 литра.
Если вы знаете, что в реакцию вступило, к примеру, 18 литров кислорода, воспользуйтесь законом объемных отношений Гей-Люссака. Он определяет, что объемы газов, участвующих в реакции, относятся друг к другу, как простые целые числа. То есть из уравнения реакции следует, что из трех литров O2 получается два литра N2. Вы можете сделать вывод, что из 18 литров кислорода образуется 12 литров азота.
Источники:
- вычислите продукт реакции н2 s
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
«Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа».
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
V1: V2: V3 = ν1: ν2: ν3.
Например,
2CO + O2 → 2CO2
При окислении двух объемов оксида углерода (II) одним объемом кислорода образуется 2 объема углекислого газа, т.е. объем исходной реакционной смеси уменьшается на 1 объем.
V(CO): V(О2): V(CO2) = ν(CO): ν(О2): ν(CO2) = 2 : 1 : 2
Например, при синтезе аммиака из элементов:
N2 + 3H2 → 2NH3
Один объем азота реагирует с тремя объемами водорода; образуется при этом 2 объема аммиака — объем исходной газообразной реакционной массы уменьшится в 2 раза.
V(N2):V(H2):V(NH3) = ν(N2):ν(H2):ν(NH3) = 1 : 3 : 2
Решите задачу по образцу:
Вычислите объём кислорода, который потребуется для сжигания 5 м3 метана СН4 н.у.?
Между объёмами газообразных веществ, участвующих в химической реакции, существует прямо пропорциональная зависимость: чем больший объём одного из веществ принимает участие в данном превращении, тем больший объём других газообразных веществ в нём участвует, и наоборот.
В (1808) году известный французский учёный Жозеф Луи Гей-Люссак ((1778)–(1850)) опытным путём установил закон объёмных отношений.
Объёмы газов, вступающих в химические реакции, и объёмы газов, образующихся в результате реакций, относятся между собой как небольшие целые числа.
Жозеф Луи Гей-Люссак
В настоящее время существует понимание того, что объёмы газообразных веществ прямо пропорциональны количеству их вещества, а в свою очередь отношение количества вещества соответствует отношению коэффициентов в уравнении реакции, описывающей происходящее превращение. Поэтому, если в химической реакции участвуют газообразные вещества, отношение их объёмов соответствует отношению коэффициентов, находящихся перед формулами соответствующих веществ в уравнении химической реакции.
Итак, если в химической реакции участвуют газообразные вещества (A) и (B), то уравнение этой реакции можно представить в общем виде (…aA) (+) (…bB), где (a) и (b) — коэффициенты, относящиеся к формулам соответствующих веществ.
Прямо пропорциональную зависимость, существующую между объёмами газообразных веществ (A) и (B), можно выразить так:
.
Отсюда:
V(A)=a⋅V(B)b
или
V(B)=b⋅V(A)a
.
Эта зависимость лежит в основе простейших вычислений по уравнениям химических реакций, протекающих с участием газообразных веществ.