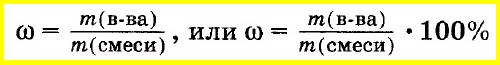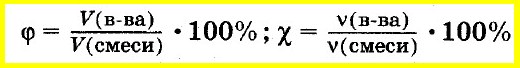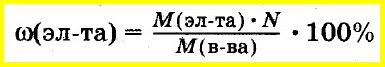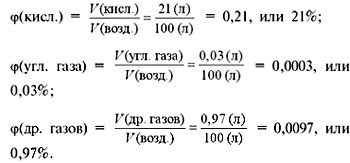поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,666 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,992 -
разное
16,906
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
1.Находим
количество вещества газовой смеси: υ(смеси)= =14/22,4=0,625(моль)
2.Вычисляем среднюю молярную массу смеси: М(смеси) = = 25,5:0,625= 40,8(г/моль)
3.
Находим объемную долю азота в смеси: Пусть x—объемная доля
азота в смеси, φ(N2)=x, тогда
(1-x)—объемная
доля оксида углерода(IV) в
смеси, φ (CO2)= 1-x
по формуле М(смеси)= φ(N2) × М(N2) + φ (CO2) × М(CO2)
40,8= x×28 +
(1-x) ×
44 откуда x=0,2
или x=20%
φ(N2)=20%
φ (CO2)=1-0,2=0,8
или 80%
4.
Определяем мольную долю азота в смеси. По закону Авогадро объемная доля газа
в смеси равна его мольной доле, поэтому φ(N2)= χ(N2)=0,2
или 20%
5.
Вычисляем массовую долю азота в смеси, на основе формулы χ(N2)= υ(N2)/ υ(смеси)
находим
количество вещества азота
υ(N2) = χ(N2) × υ(смеси)=0,2×0,625=0,125
(моль), тогда m(N2)= υ(N2) × M(N2)=
0,125×28=3,5(г)
ω(N2)= = 3,5/25,5=0,137 или 13,7%
Все эти
действия можно объединить одной формулой ω(N2)= = 0,2 × 0,625 × 28/25,5=0,137
или
ω(N2)= = 0,2 × 28/40,8 = 0,137 или 13,7%
Ответ:
φ(N2)=20%
; χ(N2)=20%
ω(N2)=13,7%
УЧЕБНИКИ. ПОСОБИЯ
О.С.ГАБРИЕЛЯН,
И.Г.ОСТРОУМОВ,
А.К.АХЛЕБИНИН
СТАРТ В ХИМИЮ
7 класс
Продолжение. Начало см. в № 1, 2, 3, 4, 5, 6, 7/2006
Глава 2. Математика в химии
(окончание)
§ 13. Объемная доля газов в смеси
В состав воздуха входит несколько различных
газов: кислород, азот, углекислый газ,
благородные газы, водяные пары и некоторые
другие вещества. Содержание каждого из этих
газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в
цифрах, т.е. количественно, используют особую
величину, которую называют объемной долей газов
в смеси.
Объемную долю газа в смеси обозначают
греческой буквой
– «фи».
Объемной долей газа в смеси называют
отношение объема данного газа к общему объему
смеси:
Что же показывает объемная доля газа в смеси
или, как говорят, какой физический смысл этой
величины? Объемная доля газа показывает, какую
часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на
отдельные газообразные компоненты, мы получили
бы около 78 л азота, 21 л кислорода, 30 мл углекислого
газа, в оставшемся объеме содержались бы так
называемые благородные газы (главным образом
аргон) и некоторые другие (рис. 62).
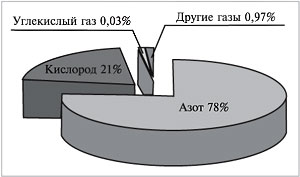 |
Рис. 62.
|
Рассчитаем объемные доли этих газов в
воздухе:
Нетрудно заметить, что сумма объемных долей
всех газов в смеси всегда равна 1, или 100%:
(азота) +
(кисл.) +
(угл. газа) +
(др. газов) = 78% + 21% + 0,03% + 0,97% = 100%.
Тот воздух, который мы выдыхаем, гораздо беднее
кислородом (его объемная доля снижается до 16%),
зато содержание углекислого газа возрастает до
4%. Такой воздух для дыхания уже непригоден. Вот
почему помещение, в котором находится много
людей, надо регулярно проветривать.
В химии на производстве чаще приходится
сталкиваться с обратной задачей: определять
объем газа в смеси по известной объемной доле.
Пример. Вычислите объем кислорода,
содержащегося в 500 л воздуха.
Из определения объемной доли газа в смеси
выразим объем кислорода:
V(кисл.) = V(возд.)•(кисл.).
Подставим в уравнение числа и рассчитаем объем
кислорода:
V(кисл.) = 500 (л)•0,21 = 105 л.
Кстати, для приближенных расчетов объемную
долю кислорода в воздухе можно принять равной 0,2,
или 20%.
При расчете объемных долей газов в смеси можно
воспользоваться маленькой хитростью. Зная, что
сумма объемных долей равна 100%, для «последнего»
газа в смеси эту величину можно рассчитать
по-другому.
Задача. Анализ атмосферы Венеры
показал, что в 50 мл венерианского «воздуха»
содержится 48,5 мл углекислого газа и 1,5 мл азота.
Рассчитайте объемные доли газов в атмосфере
планеты.
Дано:
V(смеси) = 50 мл,
V(угл. газа) = 48,5 мл,
V(азота) = 1,5 мл.
Найти:
(угл. газа),
(азота).
Решение
Рассчитаем объемную долю углекислого газа в
смеси. По определению:
Вычислим объемную долю азота в смеси, зная, что
сумма объемных долей газов в смеси равна 100%:
(угл.
газа) + (азота) = 100%,
(азота) =
100% – (угл. газа) =
100% – 97% = 3%.
Ответ. (угл.
газа) = 97%, (азота) =
3%.
С помощью какой величины измеряют содержание
компонентов в смесях другого типа, например в
растворах? Понятно, что в этом случае
пользоваться объемной долей неудобно. На помощь
приходит новая величина, о которой вы узнаете на
следующем уроке.
1.
Что такое объемная доля компонента в газовой
смеси?2. Объемная доля аргона в воздухе 0,9%. Какой
объем воздуха необходим для получения 5 л аргона?3. При разделении воздуха было получено 224 л
азота. Какие объемы кислорода и углекислого газа
были получены при этом?
4.
Объемная доля метана в природном газе составляет
92%. Какой объем этой газовой смеси будет
содержать 4,6 мл метана?5. Смешали 6 л кислорода и 2 л углекислого
газа. Найдите объемную долю каждого газа в
полученной смеси.
§ 14. Массовая доля вещества в растворе
– Сколько ложечек сахара ты кладешь в чай?
– Дома – две, в гостях – восемь.
Шутка известная, но давайте посмотрим на нее
глазами химика. Вряд ли вам понравится такой «чай
в гостях». Уж очень сладкий он будет из-за
неумеренного содержания сахара! Содержание
растворенного вещества в растворе химики
называют концентрацией.
Концентрацию вещества можно выражать
различными способами. Кстати, число ложечек на
чашку воды – способ вполне приемлемый, но только
для кухни. Трудно представить себе химика,
приготавливающего раствор таким образом.
Один из самых распространенных способов
выражения концентрации раствора – через
массовую долю растворенного вещества.
Массовой долей вещества в растворе называют
отношение массы растворенного вещества к массе
раствора:
Не правда ли, очень похоже на объемную долю? Так
оно и есть, ведь любая доля, как вы уже знаете, –
это отношение какой-то части к целому. Как и
массовая доля элемента в сложном веществе,
массовая доля вещества в растворе обозначается
греческой буквой
(«омега») и может принимать значения от 0 до 1 (или
от 0 до 100%). Она показывает, какая часть массы
раствора приходится на растворенное вещество. И
еще: массовая доля вещества в процентах численно
равна массе растворенного вещества в 100 г
раствора. К примеру, в 100 г 3%-го раствора уксуса
содержится 3 г чистой уксусной кислоты.
Самые простые растворы состоят из двух
компонентов. Один из компонентов раствора –
растворитель. Для нас более привычны жидкие
растворы, значит, растворитель в них – жидкое
вещество. Чаще всего – вода.
Другой компонент раствора – растворенное
вещество. Им может быть и газ, и жидкое, и твердое
вещество.
Масса раствора складывается из массы
растворителя и массы растворенного вещества, т.
е. верно выражение:
m(раствора) = m(растворителя) + m(растворенного
вещества).
Предположим, массовая доля растворенного
вещества равна 0,1, или 10%. Значит, оставшиеся 0,9,
или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко
используется не только в химии, но и в медицине,
биологии, физике, да и в повседневной жизни. В
качестве иллюстрации к сказанному рассмотрим
решение некоторых задач прикладного характера.
Задача 1. Перед посадкой семена
томатов дезинфицируют (протравливают) 1%-м
раствором марганцовки. Какую массу такого
раствора можно приготовить из 0,25 г марганцовки?
Дано:
(марганцовки) =
0,01 г,
m(марганцовки) = 0,25 г.
Найти:
m(раствора).
Решение
Зная массу растворенного вещества и его
массовую долю в растворе, можно вычислить массу
раствора:
Ответ. m(раствора) = 25 г.
Задача 2. В медицине широко применяют
так называемые физиологические растворы, в
частности раствор поваренной соли с массовой
долей соли 0,9%. Рассчитайте массы соли и воды,
необходимые для приготовления 1500 г
физиологического раствора.
Дано:
(соли) = 0,009,
m(раствора) = 1500 г.
Найти:
m(соли),
m(воды).
Решение
Вычислим массу соли, необходимой для
приготовления 1500 г физиологического раствора:
m(соли) = m(раствора)•(соли) = 1500 (г)•0,009 = 13,5 г.
Определим массу воды, необходимой для
приготовления раствора:
m(воды) = m(раствора) – m(соли) =
1500 – 13,5 = 1486,5 г.
Ответ. m(соли) = 13,5 г, m(воды) = 1486,5 г.
Отличаются ли свойства растворов от свойств
компонентов, образующих эти гомогенные смеси?
С помощью домашнего эксперимента (задание 9 к
этому параграфу) вам будет нетрудно убедиться в
том, что раствор замерзает при более низкой
температуре, чем чистый растворитель. Например,
морская вода начинает замерзать при температуре
–1,9 °С, в то время как чистая вода
кристаллизуется при 0 °С.
1.
Что такое массовая доля растворенного вещества?
Сравните понятия «объемная доля» и «массовая
доля» компонентов смеси.2. Массовая доля йода в аптечной йодной
настойке составляет 5%. Какую массу йода и спирта
нужно взять, чтобы приготовить 200 г настойки?3. В 150 г воды растворили 25 г поваренной соли.
Определите массовую долю соли в полученном
растворе.4. В 200 г столового уксуса содержится 6 г
уксусной кислоты. Определите массовую долю
кислоты в столовом уксусе.
5.
Найдите массу воды и лимонной кислоты,
необходимую для приготовления 50 г 5%-го раствора.6. Из 240 г 3%-го раствора питьевой соды
выпарили 80 г воды. Найдите массовую долю соды в
полученном растворе.7. К 150 г 20%-го раствора сахара добавили 30 г
сахара. Найдите массовую долю вещества в
полученном растворе.8. Смешали два раствора серной кислоты: 80 г
40%-го и 160 г 10%-го. Найдите массовую долю кислоты в
полученном растворе.
9.
Пять чайных ложек поваренной соли (с горкой)
растворите в 450 г (450 мл) воды. Учитывая, что масса
соли в каждой ложке примерно 10 г, рассчитайте
массовую долю соли в растворе. В две одинаковые
пластиковые бутылки объемом 0,5 л налейте
полученный раствор и водопроводную воду.
Поместите бутылки в морозильную камеру
холодильника. Загляните в холодильник примерно
через час. Какая жидкость начнет замерзать
раньше? В какой бутылке содержимое раньше
превратится в лед? Сделайте вывод.
ПРАКТИЧЕСКАЯ РАБОТА № 3.
Приготовление раствора с заданной массовой
долей
растворенного вещества
Цель данной работы состоит в приготовлении
раствора с заданной массовой долей путем
растворения рассчитанной массы твердого
вещества в определенном объеме воды.
Рассчитайте массу твердого вещества,
необходимого для приготовления раствора в
соответствии с вашим вариантом задания (табл. 3).
На весах отмерьте рассчитанную массу твердого
вещества и перенесите его в химический стакан.
Таблица 3
Варианты задания к практической
работе № 3
| Вариант | Растворенное вещество |
Масса раствора, г |
Массовая доля растворенного вещества, % |
|---|---|---|---|
| 1 | Поваренная соль | 80 | 10 |
| 2 | Сахар | 150 | 5 |
| 3 | Лимонная кислота | 50 | 2 |
| 4 | Натриевая селитра | 70 | 10 |
Рассчитайте массу воды, необходимой
для приготовления раствора. Поскольку плотность
воды равна 1 г/мл, рассчитанная вами масса
численно равна ее объему. С помощью мерного
цилиндра отмерьте вычисленный объем воды и
прилейте его к веществу в стакане. Перемешивая
содержимое стакана стеклянной палочкой,
добейтесь полного растворения вещества в воде.
Требуемый раствор готов.
§ 15. Массовая доля примесей
На примере замерзания раствора соли вы
убедились, что присутствие посторонних
соединений изменяет свойства вещества. В
некоторых областях техники использование
недостаточно «чистых» материалов недопустимо.
Микросхему компьютера не сделать без особо
чистого кристалла кремния, в атомной энергетике
предъявляются повышенные требования к очистке
ядерного топлива, световой сигнал «погаснет» в
стекловолоконном кабеле, наткнувшись на
посторонние вкрапления.
Если главное (основное) вещество содержит
посторонние загрязнения – это тоже смесь, только
в этом случае все ненужные, а порой и вредные ее
компоненты называют одним словом – примеси. Чем
меньше примесей, тем чище вещество.
Иногда вещество, содержащее примеси, называют
техническим образцом или просто образцом.
Следовательно, любой такой образец включает
основное вещество и примеси.
Степень чистоты вещества принято выражать
массовой долей основного компонента или
массовой долей примесей.
С массовыми долями разного типа вы уже знакомы.
Попробуйте теперь сами сформулировать
определение, что такое массовая доля примесей в
веществе. Получилось? Сравните.
Массовой долей примесей называется отношение
массы примесей к массе образца:
Предположим, вам нужно вычислить массовую долю
основного вещества в образце. Тогда можно
воспользоваться формулой:
Следует не забывать, что сумма массовых долей
основного вещества и примесей всегда равна 1, или
100%:
(осн.
в-ва) + (примесей) =
1, или 100%.
Также справедливо утверждение, что масса
образца складывается из массы основного
вещества и массы примесей:
m(образца) = m(осн. в-ва) + m(примесей).
Разберем несколько задач с использованием
понятия «массовая доля примесей».
Задача 1. Природная самородная
сера содержит 8% примесей. Какая масса чистой серы
содержится в 2 т природного образца?
Дано:
(примесей) = 0,08,
m(образца) = 2 т.
Найти:
m(серы).
Решение
Вычислим массу примесей в 2 т самородной серы:
m(примесей) = m(образца)•(примесей) = 2 (т) •0,08
= 0,16 т.
Рассчитаем массу чистой серы, содержащейся в
природном образце:
m(серы) = m(образца) – m(примесей)
= 2 (т) – 0,16 (т) = 1,84 т.
Ответ. m(серы) = 1,84 т.
Задача 2. В пищевой отрасли
промышленности можно использовать лимонную
кислоту, содержащую не более 1% посторонних
примесей. В аналитической лаборатории
установлено, что в 2,345 г продукта содержится 2,312 г
кислоты. Можно ли использовать продукт в пищевых
целях?
Дано:
m(образца) = 2,345 г,
m(кислоты) = 2,312 г.
Найти:
(примесей).
Решение
Вычислим массовую долю лимонной кислоты в
образце:
Рассчитаем массовую долю примесей в образце:
(примесей)
= 1 – (кислоты) = 1
– 0,986 = 0,014, или 1,4%.
Ответ. Данный образец лимонной кислоты не
может быть использован в пищевой отрасли
промышленности.
1.
Что называется массовой долей примесей? Что
показывает эта величина?2. В промышленности используются вещества с
маркировкой «ч», что означает «чистое вещество».
Содержание примесей в них может составлять,
например, 0,01%. Найдите максимально допустимую
массу примесей в 120 г образца сажи с маркировкой
«ч».3. Массовая доля примесей в известняке
составляет 5%. Рассчитайте массу основного
вещества (карбоната кальция), содержащегося в 300
кг природного известняка.
4.
При очистке медного купороса получилось 150 мг
примесей, что составило 2% от массы образца.
Определите массу технического медного купороса,
который подвергли очистке.
5. Для изготовления полупроводниковых
батарей используется сверхчистый кремний.
Массовая доля примесей в нем не должна превышать
0,000 000 0001%. Годится ли для данных целей
кремний, в 30 кг которого содержится 0,03 мг
примесей?
Для идеальных газов объёмные и мольные доли совпадают. Поэтому рассуждаем так:
Прежде всего пишем суммарное уравнение протекающей реакции: N2 + 3 H2 <——> 2 NH3.
Далее рассмотрим, что будет со смесью 100 молей азота и 100 молей водорода, если 90 молей водорода прореагировало. При этом прореагировало в 3 раза меньшее число моей, т.е. 30 молей азота, и образовалось 60 молей аммиака. Не забываем, что осталось непрореагировавшими 10 молей водорода и 70 молей азота. Общее число молей газов на выходе из контактного аппарата 60+70+10=140 молей. Значит мольная (она же объемная) доля азота 70/140=0,5 или 50 %, мольная доля водорода 10/140=0,071 или 7,1 %.