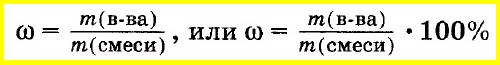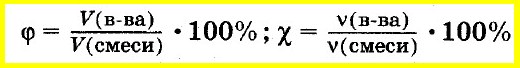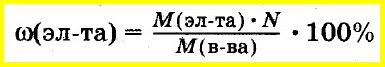При решении химических задач, при расчётах на работе, да и просто в жизни иногда приходится рассчитывать концентрации. Неважно, будет это школьная теоретическая задача, необходимость приготовить электролит для аккумулятора автомобиля, надобность узнать количество сахара для компота — все расчёты концентраций выполняются по известным формулам, которых не так много. Однако, с этим часто возникают трудности.
Прочитав эту статью, Вы научитесь легко рассчитывать концентрации веществ и при надобности играючи переводить одну концентрацию в другую. В статье приводятся примеры задач с решениями, а в конце приведём справочную табличку с формулами, которую можно распечатать и держать под рукой.
Массовая доля
Начнём с простого, но в то же время нужного способа выражения концентрации компонента в смеси — массовой доли.
Массовая доля есть отношение массы данного компонента к сумме масс всех компонентов. Обозначать её принято буквой w или ω (омега).
Рассчитывается массовая доля по формуле:
Large w_{i}=frac{m_{i}}{m}, ;;;;;(1)
где Large w_{i} — массовая доля компонента i в смеси,
Large m_{i} — масса этого компонента,
m — масса всей смеси.
И сразу разберём на примере:
Задача:
Зимой дороги посыпают песком с солью. Известно, что куча имеет массу 50 кг, и в неё всыпали 1 кг соли и перемешали. Найти массовую долю соли.
Решение:
Масса соли есть Large m_{i} по формуле выше. Масса всей смеси нам пока неизвестна, но найти её легко. Просуммируем массу песка и соли:
Large m = m_{п}+m_{с}= 50 кг + 1 кг = 51 кг
А теперь находим и массовую долю:
Large w_{с} = frac{m_{с}}{m} = 1 кг / 51 кг = 0.0196,
или умножаем на 100% и получаем 1.96%.
Ответ: 0.0196, или 1.96%.
Теперь решим что-то посложнее, и ближе к ЕГЭ.
Задача:
Смешали 200 г раствора глюкозы с массовой концентрацией 25% и 300 г раствора глюкозы с массовой концентрацией 10%. Найти массовую концентрацию полученного раствора, ответ округлить до целых.
Решение:
Обозначим первый и второй растворы соответственно Large m_{1} и Large m_{2}. Массу полученного после смешения раствора обозначим Large m и найдём:
Large m = m_{1} + m_{2} = 200 г + 300 г = 500 г
Массу самой глюкозы в первом и втором растворе обозначим Large m_{гл. 1} и Large m_{гл. 2}. По формуле (1) это будут наши массы компонентов. Массы растворов нам известны, их массовые концентрации тоже. Как найти массу компонента? Очень просто, находим неизвестное делимое умножением (и не забываем, что проценты — это сотые части):
Large m_{гл. 1} = w_{1}cdot m_{1} = 0.25 cdot 200 г = 50 г
Large m_{гл. 2} = w_{2}cdot m_{2} = 0.1 cdot 300 г = 30 г
Таким образом, общая масса глюкозы Large m_{гл}:
Large m_{гл} = m_{гл. 1} + m_{гл. 2} = 50 г + 30 г = 80 г.
Ответ: 80 г.
Задачи на смешение раствором с разными концентрациями одного вещества можно решать с помощью «конверта Пирсона».
Объёмная доля
Часто, когда мы имеем дело с жидкостями и газами, удобно оперировать их объёмами, а не массой. Поэтому, чтобы выражать долю какого-либо компонента в таких смесях (но и в твёрдых тоже вполне можно), пользуются понятием объёмной доли.
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах. Обычно обозначается греческой буквой φ (фи).
Рассчитывается объёмная доля по формуле:
Large phi_{B}=frac{V_{B}}{sum{V_{i}}}, ; ;;;; (2)
где Large phi_{B} — объёмная доля компонента B;
Large V_{B} — объём компонента B;
Large sum{V_{i}} — сумма объёмов всех компонентов.
Здесь важно понимать, что в формулу по возможности подставляем именно сумму объёмов всех компонентов, а не объём смеси, так как при смешивании некоторых жидкостей суммарный объём уменьшается. Так, если смешать литр воды и литр спирта, два литра аквавита мы не получим — будет примерно 1800 мл. В школьных задачах, как правило, это не так важно, но в уме держим и помним.
Задача:
Смешали 6 объёмов воды и 1 объём серной кислоты. Найти объёмную долю кислоты в полученном растворе.
Решение:
Так как объёмная доля — безразмерная величина, объёмы компонентов в условии задачи могут даваться в любых единицах — литрах, стаканах, баррелях, штофах, сексталях — главное, чтобы в одинаковых. Если не так — переводим одни в другие, если одинаковые — решаем. В нашем условии описаны просто некоторые «объёмы», их и подставляем.
Large phi_{H_{2}SO_{4}} = frac{V_{ H_{2}SO_{4} }} { V_{ H_{2}SO_{4}} + V_{H_{2}O}} = frac{1 : объём}{1 : объём + 6 : объёмов} = frac{1 : объём}{7 : объёмов} = 0.143, : или : 14.3%
Ответ: 14.3 %.
С газами всё обстоит немного интереснее — при не очень больших давлениях и температурах объёмная доля какого-либо газа в газовой смеси равна его мольной доле. (Ведь мы знаем, что молярный объём газов почти равен 22.4 л/моль).
Задача:
Мольная доля кислорода в сухом воздухе составляет 0.21. Найдите объёмную долю азота, если объёмная доля аргона составляет 1%.
Решение:
Внимательный читатель заметил, что мы написали о том, что объёмная и мольная доля для газов в смеси равны. Поэтому, объёмная доля кислорода равна также 0.21, или 21%. Найдём объёмную долю азота:
Large 100% — 21% — 1% = 78%.
Ответ: 78%.
Мольная доля
В тех случаях, когда нам известны количества веществ в смеси, мы можем выразить содержание того или иного компонента с помощью мольной доли.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы. ИЮПАК рекомендует обозначать мольную долю буквой x (а для газов — y).
Находят мольную долю по формуле:
Large x_{B} = frac{n_{B}}{sum{n_{i}}}, ;;;;;(3)
где Large x_{B} — мольная доля компонента B;
Large n_{B} — количество компонента B, моль;
Large sum{n_{i}} — сумма количеств всех компонентов.
Разберём на примере.
Задача:
При неизвестных условиях смешали 3 кг азота, 1 кг кислорода и 0.5 кг гелия. Найти мольную долю каждого компонента полученной газовой смеси.
Решение:
Сначала находим количество каждого из газов (моль):
Large n_{N_{2}} = frac{ m_{N_{2}}}{M_{N_{2}}} = frac {3000 : г}{28 : ^г/_{моль}} = 107.14 : моль
Large n_{O_{2}} = frac{ m_{O_{2}}}{M_{O_{2}}} = frac {1000 : г}{32 : ^г/_{моль}} = 31.25 : моль
Large n_{He} = frac{ m_{He}}{M_{He}} = frac {500 : г}{4 : ^г/_{моль}} = 125 : моль
Затем считаем сумму количеств:
Large sum {n} = 107.14 : моль + 31.25 : моль + 125 : моль = 263.39 : моль
И находим мольную долю каждого компонента:
Large y_{N_{2}} = frac {107.14 : моль}{263.39 : моль} = 0.4068, : или : 40.68 %;
Large y_{O_{2}} = frac {31.25 : моль}{263.39 : моль} = 0.1186, : или : 11.86 %;
Large y_{He} = frac {125 : моль}{263.39 : моль} = 0.4746, : или : 47.46 %;
Проверяем:
Large 40.68 % + 11.86 % + 47.46 % = 100%.
И радуемся правильному решению.
Ответ: 40.68%, 11.86% , 47.46%.
Молярность (молярная объёмная концентрация)
А сейчас рассмотрим, вероятно, самый часто встречающийся способ выражения концентрации — молярную концентрацию.
Молярная концентрация (молярность, мольность) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Также иногда говорят просто «молярность», и обозначают буквой М. Это значит, что, например, обозначение «0.5 М раствор соляной кислоты» следует понимать как «полумолярный раствор соляной кислоты», или 0.5 моль/л.
Обозначают молярную концентрацию буквой c (латинская «цэ»), или заключают в квадратные скобки вещество, концентрация которого указывается. Например, [Na+] — концентрация катионов натрия в моль/л. Кстати, слово «моль» в обозначениях не склоняют — 5 моль/л, 3 моль/л.
Рассчитывается молярная концентрация по формуле:
Large c_{B} = frac{n_{B}}{V} ; ; ;;; (4)
где Large n_{B} — количество вещества компонента B, моль;
Large V — общий объём смеси, л.
Разберём на примере.
Задача:
В пивную кружку зачем-то насыпали 24 г сахара и до краёв заполнили кипятком. А нам зачем-то нужно найти молярную концентрацию сахарозы в полученном сиропе. И кстати, дело происходило в Британии.
Решение:
Молекулярная масса сахарозы равна 342 (посчитайте, может мы ошиблись — C12H22O11). Найдём количество вещества:
Large n_{сахарозы} = frac{24 : г}{342 : г/моль} = 0.0702 моль
Британская пинта (мера объёма такая) равна 0.568 л. Поэтому молярная концентрация находится так:
Large c_{сахарозы} = frac{0.0702 : моль}{0.568 : л} = 0.1236 моль/л
Ответ: 0.1236 моль/л.
Нормальная концентрация (молярная концентрация эквивалента, «нормальность»)
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов).
Обозначается нормальная концентрация как сн, сN, или даже c(feq B). Рассчитывается нормальная концентрация по формуле:
Large c_{N} = z cdot c_{B} = z cdot frac{n_{B}}{V}= frac{1}{f_{eq}} cdot frac {n_{B}}{V} ; ;;;; (5)
где Large n_{B} — количество вещества компонента В, моль;
V — общий объём смеси, л;
z — число эквивалентности (фактор эквивалентности Large f_{eq} = 1/z ).
Значение нормальной концентрации для растворов записывают как «н» или «N», а говорят «нормальность» или «нормальный». Например, раствор с концентрацией 0.25 н — четвертьнормальный раствор.
Разберём на примере.
Задача:
Рассчитать нормальность раствора объёмом 1 л, если в нём содержится 40 г перманганата калия. Раствор приготовили для последующего проведения реакции в нейтральной среде.
Решение:
В нейтральной среде перманганат калия восстанавливается до оксида марганца (IV). При этом в окислительно-восстановительной реакции 1 атом марганца принимает 3 электрона (проверьте на любой окислительно-восстановительной реакции перманганата калия с образованием оксида, расставив степени окисления), что означает, что число эквивалентности будет равно 3. Для расчёта концентрации по формуле (5) выше нам ещё не хватает количества вещества KMnO4. найдём его:
Large n_{KMnO_{4}}=frac{m _{KMnO_{4}}}{M _{KMnO_{4}} } = frac{40 : г}{158 г/моль}= 0.253 моль
Теперь считаем нормальную концентрацию:
Large c_{N_{KMnO_{4}}}= z cdot frac{n_{KMnO_{4}}}{V} = 3 cdot frac{0.253 : моль}{1 : л} = 0.759 моль-экв/л
Ответ: 0.759 моль-экв/л.
Таким образом, заметим важное на практике свойство — нормальная концентрация больше молярной в z раз.
Мы не будем рассматривать в данной статье особо экзотические способы выражения концентраций, о них вы можете почитать в литературе или интернете. Поэтому расскажем ещё об одном способе, и на нём остановимся — массовая концентрация.
Моляльная концентрация
Моляльная концентрация (моляльность, молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя.
Измеряется моляльная концентрация в молях на кг. Как и с молярной концентрацией, иногда говорят «моляльность», то есть раствор с концентрацией 0.25 моль/кг можно назвать четвертьмоляльным.
Находится моляльная концентрация по формуле:
Large m_{B} = frac{n_{B}}{m_{A}}, ;;;;; (6)
где Large n_{B} — количество вещества компонента B, моль;
Large m_{A} — масса растворителя, кг.
Казалось бы, зачем нужна такая единица измерения для выражения концентрации? Так вот, у моляльной концентрации есть одно важное свойство — она не зависит от температуры, в отличие, например, от молярной. Подумайте, почему?
Массовая концентрация
Массовая концентрация — отношение массы растворённого вещества к объёму раствора. По рекомендации ИЮПАК, обозначается символом γ или ρ.
Находится массовая концентрация по формуле:
Large rho_{B}=frac{m_{B}}{V}, ;;;;; (7)
где Large m_{B} — масса растворенного вещества, г;
Large V — общий объём смеси, л.
В системе СИ выражается в кг/м3.
Разберём на примере.
Задача:
Рассчитать массовую концентрацию перманганата калия по условиям предыдущей задачи.
Решение:
Решение будет совсем простым. Считаем:
Large rho_{ KMnO_{4} }=frac{m_{ KMnO_{4} }}{V} =frac{40 : г}{1 : л} = 40 г/л.
Ответ: 40 г/л.
Также в аналитической химии пользуются понятием титра по растворенному веществу. Титр по растворенному веществу находится так же, как и массовая концентрация, но выражается в г/мл. Легко догадаться, что в задаче выше титр будет равен 0.04 г/мл (для этого надо умножить наш ответ на 0.001 мл/л, проверьте). Кстати, обозначается титр буквой Т.
А теперь, как обещали, табличка с формулами перевода одной концентрации в другую.
Таблица перевода одной концентрации в другую.
В таблице слева — ВО ЧТО переводим, сверху — ЧТО. Если стоит знак «=», то, естественно, эти величины равны.
| Массовая доля, large omega, % | Мольная доля, large x , % | Объёмная доля, large phi, % | Молярная концентрация, large c, моль/л | Нормальная концентрация, large c_{N} , моль-экв/л | Моляльная концентрация, large m, моль/кг | Массовая концентрация, large rho, г/л | |
| Массовая доля, large omega, % | = | large omega_{B}=LARGE frac{x_{B} cdot M(B)}{sum x_{i} cdot M_{i}} | Для газов: omega = LARGE frac{phi_{A} cdot M(A)}{sum (M_{i} cdot phi_{i})} |
large omega_{B}= LARGE frac{c_{B} cdot M(B)}{rho} | large omega_{B}=LARGE frac{c_{N} cdot M(B)}{rho cdot z} | large omega_{B}= LARGE frac{gamma_{B}}{rho} | |
| Мольная доля, large x , % | large x_{B}=LARGE frac{frac{omega_{B}}{M(B)}}{sum frac{omega_{i}}{M_{i}}} | = | large x_{B}=LARGE frac{m_{B}}{m_{B}+frac{1}{M(A)}} | ||||
| Объёмная доля, large phi, % | Для газов: large phi_{A}=LARGE frac{frac{omega_{A}}{M(A)}}{sum frac{omega_{i}}{M_{i}}} |
= | |||||
| Молярная концентрация, large c, моль/л | large c_{B}=LARGE frac{rho cdot omega_{B}}{M(B)} | = | large c_{B}=Large frac{c_{N}}{z} | ||||
| Нормальная концентрация, large c_{N} , моль-экв/л | large c_{N}=LARGE frac{rho cdot omega_{B} cdot z}{M(B)} | large c_{N}=c_{B} cdot z | = | ||||
| Моляльная концентрация, large m, моль/кг | large m_{B}=Large frac{x_{B}}{M(A)(1-x_{B})} | = | |||||
| Массовая концентрация, large gamma, г/л | large gamma_{B}=rho cdot omega_{B} | = |
Таблица будет пополняться.
Как определить объемную долю
Объемная доля — это величина, характеризующая отношение объема какого-либо компонента, входящего в состав смеси, к общему объему. Она измеряется либо в процентах, либо в долях единицы. Как можно определить объемную долю, если речь идет, например, о смеси газов.

Инструкция
Предположим, перед вами стоит такая задача. Дана смесь, состоящая из предельного и непредельного углеводорода, например, из метана и этилена. Объем смеси – 1200 миллилитров. Ее пропустили через бромную воду, масса которой 80 грамм, а содержание брома – 6,4%. Бромная вода обесцветилась. Необходимо определить, какова объемная доля каждого углеводорода.
Прежде всего, вспомните, что предельный углеводород метан просто не может при таких условиях вступить в реакцию с бромом. Следовательно, взаимодействовал с бромом только этилен. Реакция протекала по следующей схеме: С2Н4 + Br2 = C2H4Br2.
Как видно, теоретически с одним молем этилена взаимодействует один моль брома. Вычислите, сколько молей брома приняло участие в реакции.
Посчитайте массовую долю брома. Вам известно, что общая масса бромной воды – 80 грамм. Умножьте ее на процентное содержание галогена: 80 х 0,064 = 5,12 грамм. Именно столько было брома.
Теперь вычислите, сколько молей составляет это количество. По таблице Менделеева определите, что атомная масса брома приблизительно равна 80, а учитывая, что его молекула двухатомная, молярная масса будет ровняться примерно 160 г/моль. Следовательно, 5,12 грамм брома составляют 5,12/160 = 0,032 моля.
После этого решение задачи становится очень простым делом. По условиям реакции во взаимодействие с бромом также вступило 0,032 моля этилена. А вам известно, что при нормальных условиях 1 моль любого газа занимает объем, примерно равный 22,4 литра. Исходя из этого, вы легко найдете объем, занимаемый этиленом: 0,032*22,4 = 0,7168, или округленно — 0,72 литра. Вот такой объем одного из компонентов данной смеси. Следовательно, объем второго компонента, метана равен 1200-720 = 480 миллилитров.
Объемные же доли компонентов:720/1200 = 0,6. Или 60% — для этилена.480/1200 = 0,4. Или 40% — для метана.
Видео по теме
Полезный совет
Разумеется, эти величины лишь приблизительные, округленные. Если бы требовалось сделать вычисление с большей точностью, тогда вам надо воздержаться от округления в большую сторону значения объема этилена, а также учесть, что атомная масса брома составляет не ровно 80, а 79,904.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Объемная доля газов в смеси
1.
Ознакомьтесь, запишите определение и формулу для нахождения объемной доли газа:
В состав воздуха входит несколько различных газов: кислород, азот , углекислый газ, благородные газы, водяные пары и некоторые другие вещества. Содержание каждого из этих газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в цифрах, т. е. количественно, используют особую величину, которую называют объемной долей газов в смеси.
Объемную долю газа в смеси обозначают греческой буквой – «фи».
Объемной долей газа в смеси называют отношение объема данного газа к общему объему смеси:
Что же показывает объемная доля газа в смеси или, как говорят, какой физический смысл этой величины? Объемная доля газа показывает, какую часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на отдельные газообразные компоненты, мы получили бы около 78 л азота, 21 л кислорода, 30 мл углекислого газа, в оставшемся объеме содержались бы так называемые благородные газы (главным образом аргон) и некоторые другие (рис. 62).
|
|
|
Рис. 62. |
Рассчитаем объемные доли этих газов в воздухе:
Нетрудно заметить, что сумма объемных долей всех газов в смеси всегда равна 1, или 100%:
(азота) + (кисл.) + (угл. газа) + (др. газов) = 78% + 21% + 0,03% + 0,97% = 100%.
Тот воздух, который мы выдыхаем, гораздо беднее кислородом (его объемная доля снижается до 16%), зато содержание углекислого газа возрастает до 4%. Такой воздух для дыхания уже непригоден. Вот почему помещение, в котором находится много людей, надо регулярно проветривать.
В химии на производстве чаще приходится сталкиваться с обратной задачей: определять объем газа в смеси по известной объемной доле.
2.
Рассмотрите примеры задач
Пример
. Вычислите объем кислорода, содержащегося в 500 л воздуха.
Из определения объемной доли газа в смеси выразим объем кислорода:
V
(кисл.) = V
(возд.) (кисл.).
Подставим в уравнение числа и рассчитаем объем кислорода:
V
(кисл.) = 500 (л) 0,21 = 105 л.
Кстати, для приближенных расчетов объемную долю кислорода в воздухе можно принять равной 0,2, или 20%.
При расчете объемных долей газов в смеси можно воспользоваться маленькой хитростью. Зная, что сумма объемных долей равна 100%, для «последнего» газа в смеси эту величину можно рассчитать по-другому.
Задача.
Анализ атмосферы Венеры показал, что в 50 мл венерианского «воздуха» содержится 48,5 мл углекислого газа и 1,5 мл азота. Рассчитайте объемные доли газов в атмосфере планеты.
Дано:
V
(смеси) = 50 мл,
V
(угл. газа) = 48,5 мл,
V
(азота) = 1,5 мл.
Найти:
(угл. газа),
Решение
Рассчитаем объемную долю углекислого газа в смеси. По определению:
Вычислим объемную долю азота в смеси, зная, что сумма объемных долей газов в смеси равна 100%:
(угл. газа) + (азота) = 100%,
(азота) = 100% – (угл. газа) = 100% – 97% = 3%.
Ответ.
(угл. газа) = 97%, (азота) = 3%.
С помощью какой величины измеряют содержание компонентов в смесях другого типа, например в растворах? Понятно, что в этом случае пользоваться объемной долей неудобно. На помощь приходит новая величина, о которой вы узнаете на следующем уроке.
3. Выполните домашнее задание:
1.
Что такое объемная доля компонента в газовой смеси?
2.
Объемная доля аргона в воздухе 0,9%. Какой объем воздуха необходим для получения 5 л аргона?
3.
При разделении воздуха было получено 224 л азота. Какие объемы кислорода и углекислого газа были получены при этом?
4.
Объемная доля метана в природном газе составляет 92%. Какой объем этой газовой смеси будет содержать 4,6 мл метана?
5.
Смешали 6 л кислорода и 2 л углекислого газа. Найдите объемную долю каждого газа в полученной смеси.
Концентрация
— величина, характеризующая
количественный составраствора.
Концентрацией
растворённого вещества (не раствора)
называют отношение количества
растворённого вещества или его массыкобъёмураствора (моль/л, г/л), то есть это
соотношение неоднородных величин.
Те
величины, которые являются отношением
однотипных величин (отношение массы
растворённого вещества к массе раствора,
отношение объёма растворённого вещества
к объёму раствора) правильно называть
долями
. Однакона практике
для
обоих видов выражения состава применяют
терминконцентрация
и говорят о
концентрации растворов.
Существует
много способов выражения концентрации
растворов.
Массовая доля (также называют процентной концентрацией)
Массовая
доля — отношение массы растворённого
вещества к массе раствора. Массовая
доля измеряется в долях единицы.
m 1 — масса растворённого
вещества, г (кг);
m — общая масса раствора, г (кг).
Массовую
долю растворённого вещества
w (B) обычно выражают в долях единицы или
в процентах. Например, массовая доля
растворённого вещества – CaCl 2
в воде равна 0,06 или 6%. Это означает,что
в растворе хлорида кальция массой 100 г
содержится хлорид кальция массой 6 г и
вода массой 94 г.
Пример:
Сколько
грамм сульфата натрия и воды нужно для
приготовления 300 г 5% раствора?
Решение:
m
(Na 2 SO 4)
= w (Na 2 SO 4)
/ 100 = (5 · 300) / 100 = 15 (г)
где w
(Na 2 SO 4))
– массовая доля в %,
m — масса раствора
в г
m (H 2 O)
= 300 г — 15 г = 285 г.
Таким
образом, для приготовления 300 г 5% раствора
сульфата натрия надо взять 15 г Na 2 SO 4)
и 285 г воды.
Массовое
процентное содержание компонента, ω %
ω
% =(m i /Σm i)*100
Объёмная доля
Объёмная
доля — отношение объёма растворённого
вещества к объёму раствора. Объёмная
доля измеряется в долях единицы или в
процентах.
V 1 — объём растворённого
вещества, л;
V — общий объём раствора, л.
Cуществуютареометры
,
предназначенные для определения
концентрации растворов определённых
веществ. Такие ареометры проградуированыне в значениях плотности
,
а непосредственно в значениях концентрации
раствора. Для распространённых растворовэтилового
спирта,
концентрация которых
обычно выражается в объёмных процентах,
такие ареометры получили названиеспиртомеров.
Молярность (молярная объёмная концентрация)
Молярная
концентрация — количество растворённого
вещества (число молей) в единице объёма
раствора. Молярная концентрация в
измеряется в моль/л (M) или
ммоль/л (mM). Также
распространено выражение в «молярности».
Так, раствор с концентрацией 0,5 моль/л
называют 0,5-молярным.
ν — количество
растворённого вещества, моль;
V — общий объём раствора, л.
Молярная
концентрация измеряется в моль/л и
обозначается «M». Например, 2 M NaOH —
двухмолярный раствор гидроксида натрия.
Один литр такого раствора содержит 2
моль вещества или 80 г.
Пример:
Какую
массу хромата калия K
2
CrO
4
нужно взять для приготовления 1,2 л 0,1 М
раствора?
Решение:
M(K 2 CrO 4)
= C(K 2 CrO 4)
· V · M(K 2 CrO 4)
= 0,1 моль/л · 1,2 л · 194 г/моль » 23,3 г.
Таким
образом, для приготовления 1,2 л 0,1 М
раствора нужно взять 23,3 г K 2 CrO 4
и растворить в воде, а объём довести до
1,2 литра.
Объёмная доля
(также объёмная часть
, доля по объёму
, объёмная концентрация
) — безразмерная величина, равная отношению объёма какого-то вещества в смеси к объёму всей смеси.
Обозначается греческой буквой φ .
Применяется в основном к газам и жидкостям.
Смысл величины
Объёмная доля вычисляется по формуле:
phi=frac{V_1}{V},
- V 1 — объём растворённого вещества в единицах объёма;
- V — общий объём раствора в тех же единицах.
Объёмная доля в химии
В химии величина используется в основном для газов, потому что объемная доля газовой смеси при н.у. равна его молярной концентрации.
Принято выражать объёмную долю в процентах.
См. также
Напишите отзыв о статье «Объёмная доля»
Ссылки
Отрывок, характеризующий Объёмная доля
Валуев конфиденциально рассказывал, что Уваров был прислан из Петербурга, для того чтобы узнать мнение москвичей об Аустерлице.
В третьем кружке Нарышкин говорил о заседании австрийского военного совета, в котором Суворов закричал петухом в ответ на глупость австрийских генералов. Шиншин, стоявший тут же, хотел пошутить, сказав, что Кутузов, видно, и этому нетрудному искусству – кричать по петушиному – не мог выучиться у Суворова; но старички строго посмотрели на шутника, давая ему тем чувствовать, что здесь и в нынешний день так неприлично было говорить про Кутузова.
Граф Илья Андреич Ростов, озабоченно, торопливо похаживал в своих мягких сапогах из столовой в гостиную, поспешно и совершенно одинаково здороваясь с важными и неважными лицами, которых он всех знал, и изредка отыскивая глазами своего стройного молодца сына, радостно останавливал на нем свой взгляд и подмигивал ему. Молодой Ростов стоял у окна с Долоховым, с которым он недавно познакомился, и знакомством которого он дорожил. Старый граф подошел к ним и пожал руку Долохову.
Часть I
1. Для жидких и твёрдых смесей массовая доля компонента (w) рассчитывается по формуле:
2. Объёмная доля компонента газообразной смеси (φ) рассчитывается по формуле:
3. Используя материал пунктов 1 и 2, выведите формулы для расчётов:
4. Для расчёта m раствора, если известны его плотность и объём, используют формулу, известную из курса физики:
m(р-ра)=V*P
Часть II
1. В 40 г дистиллированной воды растворили 2 г хлорида натрия. Рассчитайте массовую долю соли в полученном растворе.
2. В 2 л раствора серной кислоты содержится 456 г H2SO4. Рассчитайте массовую долю растворённого вещества, учитывая, что плотность раствора равна 1,14 г/мл.
3. Сколько воды и соли нужно взять, чтобы приготовить 250 г 10%-го раствора нитрата натрия?
5. Какова массовая доля сахара в растворе, полученном при упаривании 200 г 20%-го раствора до 70 г? Ответ округлить до десятых.
6. Смешали 120 г 40%-го и 280 г 10%-го раствора азотной кислоты. Определите массовую долю азотной кислоты в полученном растворе.
7. Сколько хлороводорода нужно растворить в 1 м3 воды, чтобы получить 20%-й раствор? Вычислите массу и объём (н. у.) хлороводорода.
8. В воздухе содержится 21% кислорода и 78% азота по объёму. Рассчитайте объём кислорода и азота в 250 м3 воздуха. Определите для каждого газа количество вещества и массу.
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
|
Так, доля кислорода равна 21% Азота — 78% (самая большая) Углекислого газа — 0.03% Прочие газы в сумме — 0.97%
V1 — объём компонента V — общий объём смеси, выраженный в тех же единицах. Знаете ответ? |