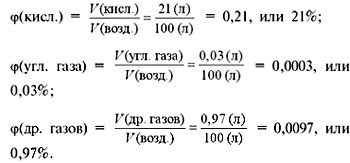ГДЗ (готовое домашние задание из решебника) на § 12 №3, Номера по учебнику Химия. 8 класс. Учебник для общеобразовательных организаций / О.С. Габриелян, И.Г. Остроумов, С.А. Сладков. Просвещение, 2019-2021г.
Условие
3. Каков объёмный состав воздуха? Как изменяется состав воздуха в закрытом кабинете во время проведения урока?
В закрытом помещении с большим количеством людей, за счет дыхания объемная доля кислорода уменьшается, а углекислого газа – возрастает.
?
Решение 1
Подробное решение

Белый фонпереписывать в тетрадь
Цветной фонтеория и пояснения
Популярные решебники
Ваше сообщение отправлено
и скоро будет рассмотрено
Страница 13 из 40
ГЛАВА II. Важнейшие представители неорганических веществ. Количественные отношения в химии
Вопрос в начале параграфа
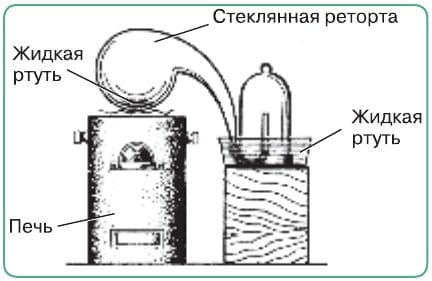
✓ В 1774 г. Лавуазье нагревал ртуть в реторте (рис. 40) в течение 12 суток. Конец реторты был подведён под колокол, поставленный в сосуд с ртутью. В результате уровень ртути в колоколе поднялся примерно на 1/5 его высоты. Оставшийся под колоколом газ был непригоден для дыхания. О чём свидетельствует опыт Лавуазье?
Рис. 40. Установка Лавуазье для изучения состава воздуха.
Ответ:
Этим опытом было доказано, что в воздухе содержится примерно 80% азота и 20% кислорода (по объему).
Проверьте свои знания
1. Почему некорректно выражение «молекула воздуха»?
Ответ:
Выражение «молекула воздуха» некорректно, так как воздух − это смесь веществ: азот, кислород, углекислый газ, инертные газы, водяной пар.
2. Что называют объёмной долей компонента газовой смеси?
Ответ:
Объёмной долей компонента газовой смеси называют отношение объёма данного газа к общему объёму смеси.
3. Каков объёмный состав воздуха? Как изменяется состав воздуха в закрытом кабинете во время проведения урока?
Ответ:
Азот составляет 4/5 от объёма воздуха, или 80%, а кислород — 1/5, или 20%. Детальное изучение состава воздуха позволило прийти к выводу, что он представляет собой многокомпонентную смесь, состоящую из азота, кислорода, углекислого газа, инертных газов, водяного пара.
В закрытом кабинете во время проведения урока объемная доля углекислого газа увеличится, а кислорода уменьшится, так как для дыхания люди используют кислород, а выдыхают углекислый газ.
4. Объёмная доля аргона в воздухе 0,9 %. Какой объём воздуха необходим для получения 125 $м^{3}$ аргона?
Ответ:
Дано:
φ(Ar) = 0,9%
V(Ar) = 125 $м^{3}$
Найти: V(воздуха) − ?
Решение:
Запишем формулу объемной доли аргона в газовой смеси:
φ = V(Ar) : V(смеси)
V(смеси) = V(Ar) : φ
V(смеси) = 125 $м^{3}$ : 0,009 = 13889 $м^{3}$
Ответ: 13889 $м^{3}$.
5. При разделении воздуха было получено 500 $м^{3}$ азота. Сколько литров кислорода и углекислого газа было получено при этом?
Ответ:
Дано:
V($N_{2}$) = 500 $м^{3}$
Найти:
V($O_{2}$) − ?
V($CO_{2}$) − ?
Решение:
Известно, что воздух содержит 78% азота, 21% кислорода и 0,03% углекислого газа. Значит:
500 $м^{3}$ = 78%.
Задачу будем решать методом пропорций.
1) Составим пропорцию:
500 $м^{3}$ − 78%
х $м^{3}$ − 21%
х = 500 * 21 : 78 = 134,62 $м^{3}$
Переведем $м^{3}$ в л, получим, что объем кислорода равен 134620 л
2) Составим вторую пропорцию:
500 $м^{3}$ − 78%
х $м^{3}$ − 0,03%
х = 500 * 0,03 : 78 = 0,19 $м^{3}$
Переведем $м^{3}$ в л, получим, что объем углекислого газа равен 190 л
Ответ: V($O_{2}$) = 134620 л; V($CO_{2}$) = 190 л
6. Объёмная доля метана в природном газе составляет 92 %. В каком объёме этой газовой смеси будет содержаться 300 мл метана?
Ответ:
Дано:
φ($CH_{4}$) = 92%
V($CH_{4}$) = 300 мл
Найти: V(смеси) − ?
Решение:
Запишем формулу объемной доли метана в газовой смеси:
φ = V($CH_{4}$) : V(смеси)
V(смеси) = V($CH_{4}$) : φ
V(смеси) = 300 мл : 0,92 = 326 мл
Ответ: 326 мл
7. Смешали 16 л кислорода и 12 л углекислого газа. Найдите объёмную долю каждого газа в полученной смеси.
Ответ:
Дано:
V($O_{2}$) = 16 л
V($CO_{2}$) = 12 л
Найти:
φ($O_{2}$) − ?
φ($CO_{2}$) − ?
Решение:
Найдем общий объем смеси: V(смеси) = 16 л + 12 л = 28 л
Запишем формулу объемной доли компонента в газовой смеси:
φ = (V(газа) : V(смеси)) * 100%
φ($O_{2}$) = (16л : 28 л) * 100% = 57%
φ($CO_{2}$) = (12л : 28 л) * 100% = 43%
Ответ: φ($O_{2}$) = 57%; φ($CO_{2}$) = 43%
Примените свои знания
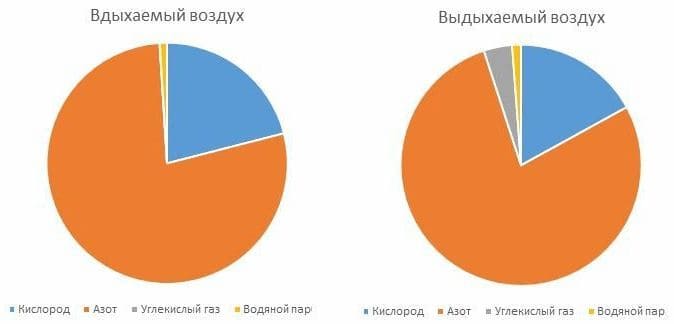
8. Вдыхаемый человеком воздух содержит около 79 % азота, 21 % кислорода, 0,03 % углекислого газа и водяной пар. Воздух, который человек выдыхает, содержит около 16 % кислорода. Количество углекислого газа в выдыхаемом воздухе увеличивается до 4 %, больше становится и водяных паров. Не изменяется лишь количество азота. Постройте круговые диаграммы, показывающие состав вдыхаемого и выдыхаемого воздуха.
Ответ:
Вдыхаемый человеком воздух содержит около 79 % азота, 21 % кислорода, 0,03% углекислого газа и водяной пар. Воздух, который человек выдыхает, содержит около 79% азота, 16 % кислорода, 4% углекислого газа и 1% водяных паров.
Используйте дополнительную информацию
9. Используя ресурсы Интернета, подготовьте сообщение об охране атмосферы. Укажите электронные адреса использованных вами источников.
Ответ:
Меры по охране атмосферного воздуха:
1) Безотходная технология эффективна в том случае, если она строится по аналогии с процессами, происходящими в биосфере: отходы одного звена в экосистеме используются другими звеньями. Цикличное безотходное производство, сопоставимое с циклическими процессами в биосфере, − это будущее промышленности, идеальный путь сохранения чистоты окружающей среды.
2) Один из способов предохранения атмосферы от загрязнения − переход на использование новых экологически безопасных источников энергии. Например, строительство станций, использующих энергию приливов и отливов, использование гелиоустановок и ветряных мельниц.
План урока
- Воздух, состав воздуха и его свойства
- Влияние атмосферного воздуха на живые организмы
- Объёмная доля газа в смеси
Цели урока
- сформировать знания о составе воздуха как природной смеси газов
- углубить знания о воздухе, его составных частях и их свойствах
- научиться находить объёмную долю газа в смеси
Разминка
Через нос проходит в грудь
И обратный держит путь,
Он невидимый, и всё же
Без него мы жить не можем.(Воздух)
Воздух, состав воздуха и его свойства
Земная атмосфера, образовавшаяся в ходе длительной геобиохимической эволюции, — это та часть природной среды, которой человек (и почти все живые аэробные организмы) больше всего пользуется. В сутки человеку необходимо не менее 12 кг воздуха (в 8 раз больше, чем воды, и в 12 раз больше, чем пищи).
Воздух
— это смесь газов, представляющая собой природный коктейль.
Воздух — один из самых нужных компонентов для жизни человека (недаром о чём-то жизненно важном говорят «необходим как воздух»), ведь если без пищи человек может прожить 30 дней, без воды — 10 дней, то без воздуха — лишь считанные минуты.
Вопрос о составе воздуха был объектом исследований в течение многих веков. Лишь в конце XVIII века учёные-естествоиспытатели Дж. Пристли, А. Лавуазье и К. Шееле установили, что воздух — это смесь газов, из которых наиболее важными являются кислород и азот.
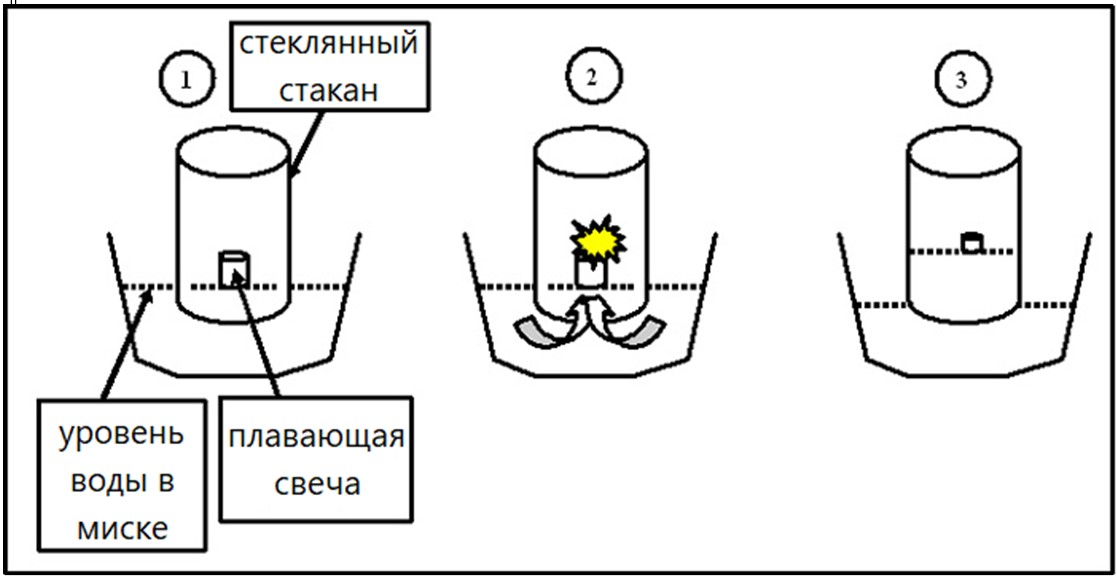
Проведём эксперимент.
В миску наливаем воду и опускаем в неё плавающую свечу. Зажигаем её и накрываем стаканом. Что мы наблюдаем?
Рис. 1. Эксперимент, доказывающий необходимость наличия кислорода для реакций горения
Вода поднялась в стакане на 1/5 объёма: так как при горении свечи расходуется только кислород, он составляет 1/5 часть или 21 % воздуха.
В конце XIX века учёным удалось выяснить состав воздуха. Кроме азота и кислорода, в состав воздуха входят благородные (инертные) газы.
Кроме того, в воздухе содержатся углекислый газ — оксид углерода (IV) и водяные пары, процентное содержание которых зависит от местных условий (например, морской воздух очень влажный).
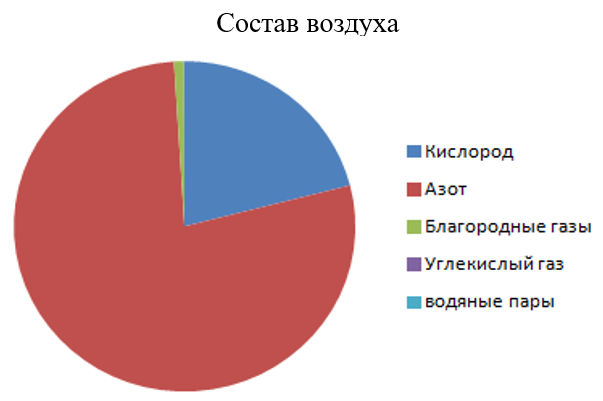
- Кислород — 21 %
- Азот — 78 %
- Благородные газы (Ar
и др.) — 0,94 % - Углекислый газ, оксид углерода (IV) — 0,03 %
- Водяные пары — до 3 %
Такой примерный состав воздуха над незагрязнённой территорией.
В большинстве же городов мира воздух загрязнён. То, чем он засорён, на ладони не ощутить, глазом не увидеть, но ежегодно на головы жителей городов падает до 100 кг загрязняющих веществ.
Виды загрязнения воздуха и меры по его охране
Загрязнение атмосферного воздуха
— изменение состава и свойств атмосферного воздуха вследствие накопления в нём физических, биологических и химических соединений, которые могут неблагоприятно влиять на здоровье людей и состояние окружающей природной среды.
Что же делается для защиты окружающей среды?
- Высокие трубы обезвреживают газы
- Фильтры-поглотители в трубах
- Очистные сооружения
- Автомобили с фильтрами, диагностика которых проводится при прохождении техосмотра на СТО
- Безотходное производство
- Экологически чистое топливо
Объёмная доля газа в смеси
Учёные получили точный состав газа не только экспериментальным путём. Определив состав воздуха, в научных кругах пришли к выводу, что он является многокомпонентной смесью.
Чтобы установить точный количественный состав газовой смеси, необходимо рассчитать объёмную долю каждого компонента, которая обозначается греческой буквой φ («фи»).
Объёмная доля
— это отношение объёма индивидуального газа к общему объёму газовой смеси.
Объёмную долю каждого компонента смеси находят по формуле:
φ %=v газаv газ. смеси·100 %
Где:
φ (газа) — объёмная доля газа в смеси,
v (газа) — объём газа (л, мл, м3),
v (газ. смеси) — объём смеси (л, мл, м3).
Объёмная доля каждого компонента газовой смеси показывает, какую часть общего объёма смеси он занимает. Знание объёмной доли компонента газовой смеси позволяет решать несложные задачи.
Пример 1
Анализ атмосферы Венеры показал, что в 150 мл венерианского «воздуха» содержится 128,5 мл углекислого газа и 21,5 мл азота. Рассчитайте объёмные доли газов в атмосфере планеты.
Дано:
v (смеси) = 150 мл
v (угл. газа) = 128,5 мл
v (азота) = 21,5 мл
Найти:
φ (угл. газа)
φ (азота)
Решение
1. Запишем формулу объёмной доли:
φ %=v (газа) v (газ. смеси)⋅100 %
2. Рассчитаем объемную долю углекислого газа в смеси:
φ угл. газа=128,5 мл150 мл ⋅100 %=85,67 %
3. Рассчитаем объемную долю азота в смеси:
φ азота=21,5 мл150 мл⋅100 %=14,33 %
Ответ: φ (угл. газа)=85,67 %;
φ (азота)=14,33 %
Упражнение 1
Смешали 6 л кислорода и 2 л углекислого газа. Найдите объёмную долю каждого газа в полученной смеси.
Выводы
Воздух для нас с вами — бесценный дар природы, его нужно беречь и знать о нём как можно больше.
В процессе эволюции человек приспособился к существованию в воздушной среде с определёнными свойствами, и поэтому вполне вероятно, что изменение химического состава этой среды или её физических свойств сказывается на состоянии здоровья, самочувствии и работоспособности человека.
Контрольные вопросы
1. Что такое воздух?
2. Назовите компоненты воздуха.
3. Перечислите источники загрязнения воздуха и меры по его охране
Упражнение 1
φ кислорода=75 %
φ угл. газа=25 %
УЧЕБНИКИ. ПОСОБИЯ
О.С.ГАБРИЕЛЯН,
И.Г.ОСТРОУМОВ,
А.К.АХЛЕБИНИН
СТАРТ В ХИМИЮ
7 класс
Продолжение. Начало см. в № 1, 2, 3, 4, 5, 6, 7/2006
Глава 2. Математика в химии
(окончание)
§ 13. Объемная доля газов в смеси
В состав воздуха входит несколько различных
газов: кислород, азот, углекислый газ,
благородные газы, водяные пары и некоторые
другие вещества. Содержание каждого из этих
газов в чистом воздухе строго определенно.
Для того чтобы выразить состав смеси газов в
цифрах, т.е. количественно, используют особую
величину, которую называют объемной долей газов
в смеси.
Объемную долю газа в смеси обозначают
греческой буквой
– «фи».
Объемной долей газа в смеси называют
отношение объема данного газа к общему объему
смеси:
Что же показывает объемная доля газа в смеси
или, как говорят, какой физический смысл этой
величины? Объемная доля газа показывает, какую
часть общего объема смеси занимает данный газ.
Если бы нам удалось разделить 100 л воздуха на
отдельные газообразные компоненты, мы получили
бы около 78 л азота, 21 л кислорода, 30 мл углекислого
газа, в оставшемся объеме содержались бы так
называемые благородные газы (главным образом
аргон) и некоторые другие (рис. 62).
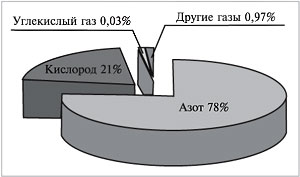 |
Рис. 62.
|
Рассчитаем объемные доли этих газов в
воздухе:
Нетрудно заметить, что сумма объемных долей
всех газов в смеси всегда равна 1, или 100%:
(азота) +
(кисл.) +
(угл. газа) +
(др. газов) = 78% + 21% + 0,03% + 0,97% = 100%.
Тот воздух, который мы выдыхаем, гораздо беднее
кислородом (его объемная доля снижается до 16%),
зато содержание углекислого газа возрастает до
4%. Такой воздух для дыхания уже непригоден. Вот
почему помещение, в котором находится много
людей, надо регулярно проветривать.
В химии на производстве чаще приходится
сталкиваться с обратной задачей: определять
объем газа в смеси по известной объемной доле.
Пример. Вычислите объем кислорода,
содержащегося в 500 л воздуха.
Из определения объемной доли газа в смеси
выразим объем кислорода:
V(кисл.) = V(возд.)•(кисл.).
Подставим в уравнение числа и рассчитаем объем
кислорода:
V(кисл.) = 500 (л)•0,21 = 105 л.
Кстати, для приближенных расчетов объемную
долю кислорода в воздухе можно принять равной 0,2,
или 20%.
При расчете объемных долей газов в смеси можно
воспользоваться маленькой хитростью. Зная, что
сумма объемных долей равна 100%, для «последнего»
газа в смеси эту величину можно рассчитать
по-другому.
Задача. Анализ атмосферы Венеры
показал, что в 50 мл венерианского «воздуха»
содержится 48,5 мл углекислого газа и 1,5 мл азота.
Рассчитайте объемные доли газов в атмосфере
планеты.
Дано:
V(смеси) = 50 мл,
V(угл. газа) = 48,5 мл,
V(азота) = 1,5 мл.
Найти:
(угл. газа),
(азота).
Решение
Рассчитаем объемную долю углекислого газа в
смеси. По определению:
Вычислим объемную долю азота в смеси, зная, что
сумма объемных долей газов в смеси равна 100%:
(угл.
газа) + (азота) = 100%,
(азота) =
100% – (угл. газа) =
100% – 97% = 3%.
Ответ. (угл.
газа) = 97%, (азота) =
3%.
С помощью какой величины измеряют содержание
компонентов в смесях другого типа, например в
растворах? Понятно, что в этом случае
пользоваться объемной долей неудобно. На помощь
приходит новая величина, о которой вы узнаете на
следующем уроке.
1.
Что такое объемная доля компонента в газовой
смеси?2. Объемная доля аргона в воздухе 0,9%. Какой
объем воздуха необходим для получения 5 л аргона?3. При разделении воздуха было получено 224 л
азота. Какие объемы кислорода и углекислого газа
были получены при этом?
4.
Объемная доля метана в природном газе составляет
92%. Какой объем этой газовой смеси будет
содержать 4,6 мл метана?5. Смешали 6 л кислорода и 2 л углекислого
газа. Найдите объемную долю каждого газа в
полученной смеси.
§ 14. Массовая доля вещества в растворе
– Сколько ложечек сахара ты кладешь в чай?
– Дома – две, в гостях – восемь.
Шутка известная, но давайте посмотрим на нее
глазами химика. Вряд ли вам понравится такой «чай
в гостях». Уж очень сладкий он будет из-за
неумеренного содержания сахара! Содержание
растворенного вещества в растворе химики
называют концентрацией.
Концентрацию вещества можно выражать
различными способами. Кстати, число ложечек на
чашку воды – способ вполне приемлемый, но только
для кухни. Трудно представить себе химика,
приготавливающего раствор таким образом.
Один из самых распространенных способов
выражения концентрации раствора – через
массовую долю растворенного вещества.
Массовой долей вещества в растворе называют
отношение массы растворенного вещества к массе
раствора:
Не правда ли, очень похоже на объемную долю? Так
оно и есть, ведь любая доля, как вы уже знаете, –
это отношение какой-то части к целому. Как и
массовая доля элемента в сложном веществе,
массовая доля вещества в растворе обозначается
греческой буквой
(«омега») и может принимать значения от 0 до 1 (или
от 0 до 100%). Она показывает, какая часть массы
раствора приходится на растворенное вещество. И
еще: массовая доля вещества в процентах численно
равна массе растворенного вещества в 100 г
раствора. К примеру, в 100 г 3%-го раствора уксуса
содержится 3 г чистой уксусной кислоты.
Самые простые растворы состоят из двух
компонентов. Один из компонентов раствора –
растворитель. Для нас более привычны жидкие
растворы, значит, растворитель в них – жидкое
вещество. Чаще всего – вода.
Другой компонент раствора – растворенное
вещество. Им может быть и газ, и жидкое, и твердое
вещество.
Масса раствора складывается из массы
растворителя и массы растворенного вещества, т.
е. верно выражение:
m(раствора) = m(растворителя) + m(растворенного
вещества).
Предположим, массовая доля растворенного
вещества равна 0,1, или 10%. Значит, оставшиеся 0,9,
или 90%, – это массовая доля растворителя.
Массовая доля растворенного вещества широко
используется не только в химии, но и в медицине,
биологии, физике, да и в повседневной жизни. В
качестве иллюстрации к сказанному рассмотрим
решение некоторых задач прикладного характера.
Задача 1. Перед посадкой семена
томатов дезинфицируют (протравливают) 1%-м
раствором марганцовки. Какую массу такого
раствора можно приготовить из 0,25 г марганцовки?
Дано:
(марганцовки) =
0,01 г,
m(марганцовки) = 0,25 г.
Найти:
m(раствора).
Решение
Зная массу растворенного вещества и его
массовую долю в растворе, можно вычислить массу
раствора:
Ответ. m(раствора) = 25 г.
Задача 2. В медицине широко применяют
так называемые физиологические растворы, в
частности раствор поваренной соли с массовой
долей соли 0,9%. Рассчитайте массы соли и воды,
необходимые для приготовления 1500 г
физиологического раствора.
Дано:
(соли) = 0,009,
m(раствора) = 1500 г.
Найти:
m(соли),
m(воды).
Решение
Вычислим массу соли, необходимой для
приготовления 1500 г физиологического раствора:
m(соли) = m(раствора)•(соли) = 1500 (г)•0,009 = 13,5 г.
Определим массу воды, необходимой для
приготовления раствора:
m(воды) = m(раствора) – m(соли) =
1500 – 13,5 = 1486,5 г.
Ответ. m(соли) = 13,5 г, m(воды) = 1486,5 г.
Отличаются ли свойства растворов от свойств
компонентов, образующих эти гомогенные смеси?
С помощью домашнего эксперимента (задание 9 к
этому параграфу) вам будет нетрудно убедиться в
том, что раствор замерзает при более низкой
температуре, чем чистый растворитель. Например,
морская вода начинает замерзать при температуре
–1,9 °С, в то время как чистая вода
кристаллизуется при 0 °С.
1.
Что такое массовая доля растворенного вещества?
Сравните понятия «объемная доля» и «массовая
доля» компонентов смеси.2. Массовая доля йода в аптечной йодной
настойке составляет 5%. Какую массу йода и спирта
нужно взять, чтобы приготовить 200 г настойки?3. В 150 г воды растворили 25 г поваренной соли.
Определите массовую долю соли в полученном
растворе.4. В 200 г столового уксуса содержится 6 г
уксусной кислоты. Определите массовую долю
кислоты в столовом уксусе.
5.
Найдите массу воды и лимонной кислоты,
необходимую для приготовления 50 г 5%-го раствора.6. Из 240 г 3%-го раствора питьевой соды
выпарили 80 г воды. Найдите массовую долю соды в
полученном растворе.7. К 150 г 20%-го раствора сахара добавили 30 г
сахара. Найдите массовую долю вещества в
полученном растворе.8. Смешали два раствора серной кислоты: 80 г
40%-го и 160 г 10%-го. Найдите массовую долю кислоты в
полученном растворе.
9.
Пять чайных ложек поваренной соли (с горкой)
растворите в 450 г (450 мл) воды. Учитывая, что масса
соли в каждой ложке примерно 10 г, рассчитайте
массовую долю соли в растворе. В две одинаковые
пластиковые бутылки объемом 0,5 л налейте
полученный раствор и водопроводную воду.
Поместите бутылки в морозильную камеру
холодильника. Загляните в холодильник примерно
через час. Какая жидкость начнет замерзать
раньше? В какой бутылке содержимое раньше
превратится в лед? Сделайте вывод.
ПРАКТИЧЕСКАЯ РАБОТА № 3.
Приготовление раствора с заданной массовой
долей
растворенного вещества
Цель данной работы состоит в приготовлении
раствора с заданной массовой долей путем
растворения рассчитанной массы твердого
вещества в определенном объеме воды.
Рассчитайте массу твердого вещества,
необходимого для приготовления раствора в
соответствии с вашим вариантом задания (табл. 3).
На весах отмерьте рассчитанную массу твердого
вещества и перенесите его в химический стакан.
Таблица 3
Варианты задания к практической
работе № 3
| Вариант | Растворенное вещество |
Масса раствора, г |
Массовая доля растворенного вещества, % |
|---|---|---|---|
| 1 | Поваренная соль | 80 | 10 |
| 2 | Сахар | 150 | 5 |
| 3 | Лимонная кислота | 50 | 2 |
| 4 | Натриевая селитра | 70 | 10 |
Рассчитайте массу воды, необходимой
для приготовления раствора. Поскольку плотность
воды равна 1 г/мл, рассчитанная вами масса
численно равна ее объему. С помощью мерного
цилиндра отмерьте вычисленный объем воды и
прилейте его к веществу в стакане. Перемешивая
содержимое стакана стеклянной палочкой,
добейтесь полного растворения вещества в воде.
Требуемый раствор готов.
§ 15. Массовая доля примесей
На примере замерзания раствора соли вы
убедились, что присутствие посторонних
соединений изменяет свойства вещества. В
некоторых областях техники использование
недостаточно «чистых» материалов недопустимо.
Микросхему компьютера не сделать без особо
чистого кристалла кремния, в атомной энергетике
предъявляются повышенные требования к очистке
ядерного топлива, световой сигнал «погаснет» в
стекловолоконном кабеле, наткнувшись на
посторонние вкрапления.
Если главное (основное) вещество содержит
посторонние загрязнения – это тоже смесь, только
в этом случае все ненужные, а порой и вредные ее
компоненты называют одним словом – примеси. Чем
меньше примесей, тем чище вещество.
Иногда вещество, содержащее примеси, называют
техническим образцом или просто образцом.
Следовательно, любой такой образец включает
основное вещество и примеси.
Степень чистоты вещества принято выражать
массовой долей основного компонента или
массовой долей примесей.
С массовыми долями разного типа вы уже знакомы.
Попробуйте теперь сами сформулировать
определение, что такое массовая доля примесей в
веществе. Получилось? Сравните.
Массовой долей примесей называется отношение
массы примесей к массе образца:
Предположим, вам нужно вычислить массовую долю
основного вещества в образце. Тогда можно
воспользоваться формулой:
Следует не забывать, что сумма массовых долей
основного вещества и примесей всегда равна 1, или
100%:
(осн.
в-ва) + (примесей) =
1, или 100%.
Также справедливо утверждение, что масса
образца складывается из массы основного
вещества и массы примесей:
m(образца) = m(осн. в-ва) + m(примесей).
Разберем несколько задач с использованием
понятия «массовая доля примесей».
Задача 1. Природная самородная
сера содержит 8% примесей. Какая масса чистой серы
содержится в 2 т природного образца?
Дано:
(примесей) = 0,08,
m(образца) = 2 т.
Найти:
m(серы).
Решение
Вычислим массу примесей в 2 т самородной серы:
m(примесей) = m(образца)•(примесей) = 2 (т) •0,08
= 0,16 т.
Рассчитаем массу чистой серы, содержащейся в
природном образце:
m(серы) = m(образца) – m(примесей)
= 2 (т) – 0,16 (т) = 1,84 т.
Ответ. m(серы) = 1,84 т.
Задача 2. В пищевой отрасли
промышленности можно использовать лимонную
кислоту, содержащую не более 1% посторонних
примесей. В аналитической лаборатории
установлено, что в 2,345 г продукта содержится 2,312 г
кислоты. Можно ли использовать продукт в пищевых
целях?
Дано:
m(образца) = 2,345 г,
m(кислоты) = 2,312 г.
Найти:
(примесей).
Решение
Вычислим массовую долю лимонной кислоты в
образце:
Рассчитаем массовую долю примесей в образце:
(примесей)
= 1 – (кислоты) = 1
– 0,986 = 0,014, или 1,4%.
Ответ. Данный образец лимонной кислоты не
может быть использован в пищевой отрасли
промышленности.
1.
Что называется массовой долей примесей? Что
показывает эта величина?2. В промышленности используются вещества с
маркировкой «ч», что означает «чистое вещество».
Содержание примесей в них может составлять,
например, 0,01%. Найдите максимально допустимую
массу примесей в 120 г образца сажи с маркировкой
«ч».3. Массовая доля примесей в известняке
составляет 5%. Рассчитайте массу основного
вещества (карбоната кальция), содержащегося в 300
кг природного известняка.
4.
При очистке медного купороса получилось 150 мг
примесей, что составило 2% от массы образца.
Определите массу технического медного купороса,
который подвергли очистке.
5. Для изготовления полупроводниковых
батарей используется сверхчистый кремний.
Массовая доля примесей в нем не должна превышать
0,000 000 0001%. Годится ли для данных целей
кремний, в 30 кг которого содержится 0,03 мг
примесей?
ГДЗ Химия 7 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2017, § 7 ГАЗЫ И ГАЗОВЫЕ СМЕСИ. ОБЪЁМНАЯ ДОЛЯ КОМПОНЕНТА ГАЗОВОЙ СМЕСИ
Красным цветом приводится решение, а фиолетовым ― объяснение.
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1
Почему неверно выражение «молекула природного газа»? Природный газ представляет собой многокомпонентную смесь: метан, этан и другие газы.
Упражнение 2
Что называют объёмной долей компонента газовой смеси? Объёмной долей компонента газовой смеси называют отношение объёма данного газа к общему объёму смеси.
Упражнение 3
Каков объёмный состав воздуха? Воздух состоит из азота (78%) , кислорода (21%), углекислого газа (0,03%), другие газы (0,97%).
Как изменяется состав воздуха в закрытом кабинете во время проведения урока? Уменьшается объёмная доля кислорода с 21% до 16%, увеличивается объёмная доля углекислого газа с 0,03% до 4%, больше становится и водяных паров.
Упражнение 4
Объёмная доля аргона в воздухе 0,9%. Какой объём воздуха необходим для получения 125 м3 аргона?
Дано: φ(аргона)=0,9%, или 0,009, V(аргона)=125 м3
Найти: V(воздуха)-?
Решение
1-й способ
C формулы нахождения объёмной доли аргона φ(аргона)= V(аргона)/V(воздуха) находим объём воздуха:
V(воздуха)=V(аргона)/φ(аргона)=125 м3 : 0,009=13888,89 м3
2-й способ
То, что объёмная доля аргона составляет 0,9%, значит, что
0,9 м3 аргона содержится в 100 м3 воздуха, а
125 м3 аргона ― в х м3 воздуха.
х=V(воздуха)=125 м3 ● 100 м3 : 0,9 м3=13888,89 м3
Ответ: 13888,89 м3
Упражнение 5
При разделении воздуха было получено 500 м3 азота. Сколько литров кислорода и углекислого газа было получено при этом?
Дано: V(N2)=500 м3
Найти: V(O2)-?, V(CO2)-?
Решение
Объёмные доли составных частей воздуха: φ(N2)=78%, или 0,78, φ(O2)=21%, или 0,21, φ(CO2)=0,03%, или 0,0003.
1. С формулы нахождения объёмной доли азота φ(N2)=V(N2)/V(воздуха) находим объём воздуха:
V(воздуха)=V(N2)/φ(N2)=500 м3 : 0,78=641,03 м3
2. Рассчитываем объём кислорода O2:
V(O2)=V(воздуха)●φ(O2)=641,03 м3 ● 0,21=134,6 м3
3. Рассчитываем объём углекислого газа CO2:
V(CO2)=V(воздуха)●φ(CO2)=641,03 м3●0,0003=0,192 м3
Ответ: V(O2)=134,6 м3, V(CO2)=0,192 м3
Упражнение 6
Объёмная доля метана в природном газе составляет 92%. В каком объёме этой газовой смеси будет содержаться 300 мл метана?
Дано: φ(метана)=92%, или 0,92, V(метана)=300 мл
Найти: V(смеси)-?
Решение
1-й способ
C формулы нахождения объёмной доли метана φ(метана)=V(метана)/V(смеси) находим объём газовой смеси:
V(природного газа)=V(метана)/φ(метана)=300 мл : 0,92=326 мл
2-й способ
То, что объёмная доля метана составляет 92%, значит, что
92 мл метана содержится в 100 мл смеси, а
300 мл метана ― в х мл смеси.
х=V(смеси)=300 мл ● 100 мл : 92 мл=326 мл
Ответ: 326 мл
Упражнение 7
Смешали 16 л кислорода и 12 л углекислого газа. Найдите объёмную долю каждого газа в полученной смеси.
Дано: V(O2)=16 л, V(CO2)=12 л
Найти: φ(O2)-?, φ(CO2)-?
Решение
1-й способ
1. Вычисляем объём смеси:
V(смеси)=V(O2) + V(CO2)=16 л + 12 л=28 л
2. Вычисляем объёмную долю кислорода O2 в смеси:
φ(O2)=V(O2)/V(смеси)=16 л : 28 л=0,5714, или, умножив это значение на 100%, получим 57,14%
3. Вычисляем объёмную долю углекислого газа CO2 в смеси:
φ(CO2)=V(CO2)/V(смеси)=12 л : 28 л=0,4286, или 42,86%
2-й способ
1. Вычисляем объём смеси:
V(смеси)=V(O2) + V(CO2)=6 л + 2 л=8 л
2. Вычисляем объёмную долю кислорода O2 в смеси:
φ(O2)=V(O2)/V(смеси)=16 л : 28 л=0,5714, или, умножив это значение на 100%, получим 57,14%
3. Рассчитываем объёмную долю углекислого газа CO2 в смеси:
φ(CO2)=100% — φ(O2)=100%-57,14%=42,86%
3-й способ
1. Вычисляем объём смеси:
V(смеси)=V(O2) + V(CO2)=6 л + 2 л=8 л
2. Вычисляем объёмную долю углекислого газа CO2 в смеси:
φ(CO2)=V(CO2)/V(смеси)=12 л : 28 л=0,4286, или, умножив это значение на 100%, получим 42,86%
3. Рассчитываем объёмную долю кислорода O2 в смеси:
φ(O2)=100% — φ(CO2)=100%-42,86%=57,14%
Ответ: φ(O2)=57,14%, φ(CO2)=42,86%