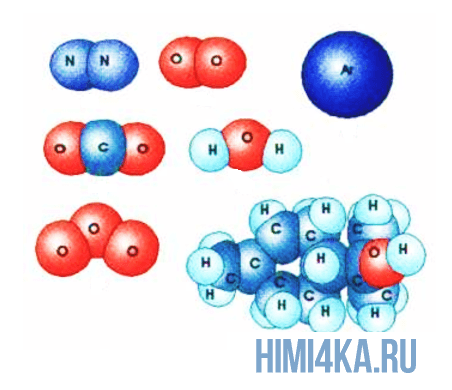
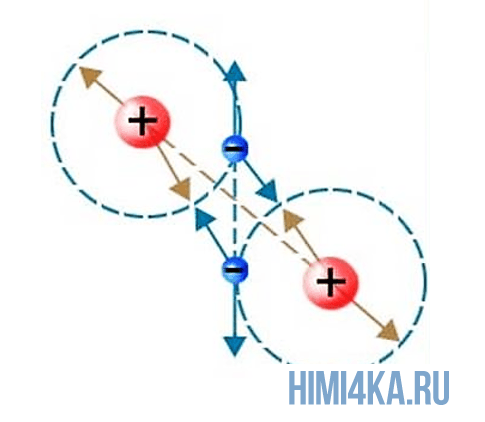
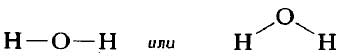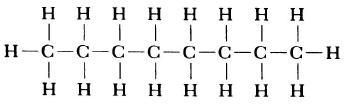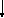В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.
Содержание
- Молекулы состоят из атомов
- Связь атомов в молекулах
- Ковалентная химическая связь
- Молекулярная и структурная формула
- Относительная молекулярная масса вещества
Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла, потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность, и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.
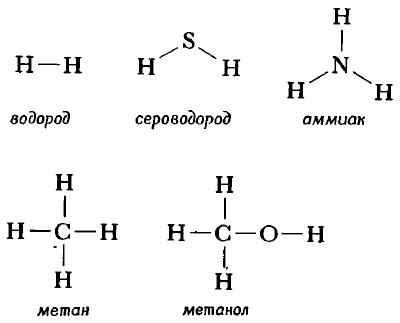
Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
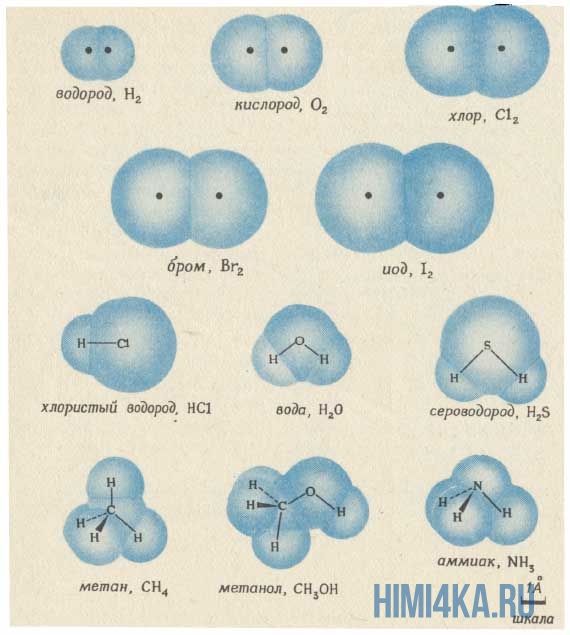
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
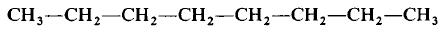
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
- 1×2 + 16 = 18
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
- (8 × 12,011) + (18 × 1,008) = 114,23 а.е.м.
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Cм. в № 13, 18, 23/2007;
6/2008
Глава 4. Понятие о химической связи
В предыдущих главах данного пособия были
обсуждения того, что вещество состоит из молекул,
а молекулы – из атомов. А не возникал ли у
вас вопрос: почему атомы, составляющие молекулу,
не разлетаются в разные стороны?
Что удерживает атомы в молекуле?
Их удерживает химическая связь.
Для того чтобы понять природу химической связи,
достаточно вспомнить простой физический опыт.
Два шарика, висящие рядом на ниточках, никак не
«реагируют» друг на друга. Но если придать
одному шарику положительный заряд, а другому –
отрицательный, они притянутся друг к другу.
Не эта ли сила притягивает атомы друг к
другу? Действительно, исследования показали, что химическая
связь имеет электрическую природу.
Откуда же возникают заряды в нейтральных
атомах?
Статья опубликована при поддержке онлайн курса подготовки к ЕГЭ «Экзамер». На сайте Вы найдёте все необходимые материалы для самостоятельной подготовки к ЕГЭ — составление уникального плана подготовки для каждого пользователя, отслеживание прогресса по каждой теме предмета, теория и задачи. Все задания соответствуют последним изменениям и дополнениям. Есть также возможность отправлять задания из письменной части ЕГЭ на проверку экспертам для получения баллов и разбора работы по критериям оценивания. Задания в виде квестов с накоплением опыта, прохождением уровней, получением бонусов и наград, соревнования с друзьями на ЕГЭ Арене. Чтобы начать подготовку перейдите по ссылке: https://examer.ru.
При описании строения атомов было показано, что
все атомы, за исключением атомов благородных
газов, стремятся присоединить или отдать
электроны. Причина – образование устойчивого
восьмиэлектронного внешнего уровня (как у
благородных газов). При приеме или отдаче
электронов возникают электрические заряды и, как
следствие, электростатическое взаимодействие
частиц. Так возникает ионная связь, т.е.
связь между ионами.
Ионы – это устойчивые заряженные частицы,
которые образуются в результате приема или
отдачи электронов.
Например, в реакции участвует атом активного
металла и активного неметалла:
Na + S ?
В этом процессе атом металла (натрия) отдает
электроны:
а) Устойчива ли такая частица?
б) Сколько всего электронов осталось в атоме
натрия?
в) Будет ли эта частица иметь заряд?
Таким образом, в этом процессе образовалась
устойчивая частица (8 электронов на внешнем
уровне), которая имеет заряд, т.к. у ядра атома
натрия заряд по-прежнему +11, а оставшиеся
электроны имеют суммарный заряд –10. Поэтому
заряд иона натрия +1. Кратко запись этого процесса
выглядит так:
Что происходит с атомом серы? Этот атом
принимает электроны до завершения внешнего
уровня:
Простой подсчет показывает, что эта частица
имеет заряд:
Кратко:
Разноименно заряженные ионы притягиваются, в
результате чего возникает ионная связь и «ионная
молекула»:
Существуют и другие способы образования ионов,
о которых будет сказано в главе 6.
Формально сульфиду натрия приписывают именно
такой состав молекулы, хотя вещество, состоящее
из ионов, имеет приблизительно следующее
строение (рис. 1):
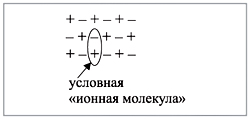 |
Рис. 1.
|
Таким образом, вещества, состоящие из
ионов, не содержат отдельных молекул! В этом
случае можно говорить лишь об условной «ионной
молекуле».
Задание 4.1. Покажите, как происходит переход
электронов при возникновении ионной связи между
атомами:
а) кальция и хлора;
б) алюминия и кислорода.
П о м н и т е! Атом металла отдает внешние
электроны; атом неметалла принимает недостающие
электроны.
Вывод. Ионная связь по описанному выше
механизму образуется между атомами активных
металлов и активных неметаллов.
Исследования, однако, показывают, что полный
переход электронов от одного атома к другому
происходит далеко не всегда. Очень часто
химическая связь образуется не при отдаче-приеме
электронов, а в результате образования общих
электронных пар*. Такая связь
называется ковалентной.
Ковалентная связь возникает за счет
образования общих электронных пар. Этот вид
связи образуется, например, между атомами
неметаллов. Так, известно, что молекула азота
состоит из двух атомов – N2.
Как возникает ковалентная связь между этими
атомами? Чтобы ответить на этот вопрос,
необходимо рассмотреть строение атома азота:
В о п р о с. Сколько электронов не хватает до
завершения внешнего уровня?
О т в е т. Не хватает трех электронов. Поэтому,
обозначив каждый электрон внешнего уровня
точкой, получим:
В о п р о с. Почему три электрона обозначены
одиночными точками?
О т в е т. Дело в том, что мы хотим показать
образование общих пар электронов. А пара – это
два электрона. Такая пара возникает, в частности,
если каждый атом предоставит по одному электрону
для образования пары. Атому азота не хватает трех
электронов до завершения внешнего уровня.
Значит, он должен «приготовить» три одиночных
электрона для образования будущих пар (рис. 2).
 |
Рис. 2.
|
Получена электронная формула
молекулы азота, которая показывает, что у
каждого атома азота имеется теперь восемь
электронов (шесть из них обведены в овал плюс по 2
электрона своих); между атомами возникли три
общие пары электронов (место пересечения
кружков).
Каждая пара электронов соответствует одной
ковалентной связи. Сколько ковалентных связей
возникло? Три. Каждую связь (каждую общую пару
электронов) покажем при помощи черточки
(валентный штрих):
Все эти формулы не дают, однако, ответа на
вопрос: что же связывает атомы при образовании
ковалентной связи? Электронная формула
показывает, что общая пара электронов
располагается между атомами. В этой области
пространства возникает избыточный
отрицательный заряд. А ядра атомов, как
известно, имеют положительный заряд. Таким
образом, ядра обоих атомов притягиваются к
общему отрицательному заряду, который возник
благодаря общим электронным парам (точнее,
пересечению электронных облаков) (рис. 3).
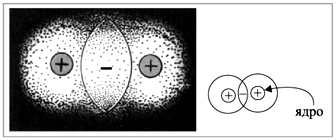 |
Рис. 3.
|
Может ли возникнуть такая связь
между разными атомами? Может. Пусть атом азота
взаимодействует с атомами водорода:
Строение атома водорода показывает, что атом
имеет один электрон. Сколько таких атомов нужно
взять, чтобы атом азота «получил желаемое» – три
электрона? Очевидно, три атома водорода
(рис. 4):
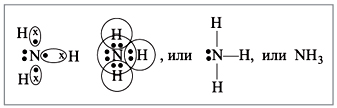 |
Рис. 4.
|
Крестиком на рис. 4 обозначены
электроны атома водорода. Электронная формула
молекулы аммиака показывает, что у атома азота
стало восемь электронов, а у каждого атома
водорода получилось по два электрона (а больше на
первом энергетическом уровне и быть не может).
Графическая формула показывает, что атом азота
имеет валентность три (три черточки, или три
валентных штриха), а каждый атом водорода –
валентность один (по одной черточке).
Хотя в состав обеих молекул N2 и NН3
входит один и тот же атом азота, химические
связи между атомами отличаются друг от друга.
В молекуле азота N2 химические связи
образуют одинаковые атомы, поэтому общие
пары электронов находятся посередине между
атомами. Атомы сохраняют нейтральный характер.
Такая химическая связь называется неполярной.
В молекуле аммиака NH3 химическую связь
образуют разные атомы. Поэтому один из атомов
(в данном случае – атом азота) сильнее
притягивает общую пару электронов. Общие пары
электронов смещаются в сторону атома азота, и на
нем возникает небольшой отрицательный заряд, а
на атоме водорода – положительный, возникли
полюса электричества – связь полярная
(рис. 5).
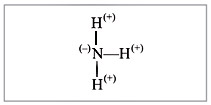 |
Рис. 5.
|
Большинство веществ, построенных при
помощи ковалентной связи, состоят из отдельных
молекул (рис. 6).
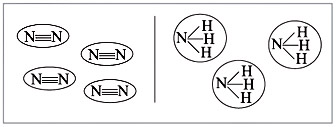 |
Рис. 6.
|
Из рис. 6 видно, что между атомами
химические связи есть, а между молекулами они
отсутствуют или незначительны.
Тип химической связи влияет на свойства
вещества, на его поведение в растворах. Так, чем
больше, значительнее притяжение между частицами,
тем труднее их оторвать друг от друга и сложнее
перевести твердое вещество в газообразное или
жидкое состояние. Попробуйте определить на
схеме, приведенной ниже, между какими частицами
силы взаимодействия больше и какая химическая
связь при этом образуется (рис. 7).
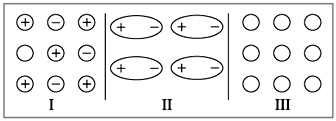 |
Рис. 7.
|
Если вы внимательно прочитали главу,
ответ у вас будет следующим: максимальное
взаимодействие между частицами осуществляется в
случае I (ионная связь). Поэтому все такие
вещества – твердые. Наименьшее взаимодействие
между незаряженными частицами (случай III –
неполярная ковалентная связь). Такие вещества
чаще всего газы.
Задание 4.2. Определите, какая химическая
связь осуществляется между атомами в веществах:
NаСl, НСl, Сl2, АlСl3, Н2О. Дайте
пояснения.
Задание 4.3. Составьте электронные и
графические формулы для тех веществ из задания
4.2, в которых вы определили наличие
ковалентной связи. Для ионной связи составьте
схемы перехода электронов.
Глава 5. Растворы
Нет на Земле человека, который не видел бы
растворов. А что это такое?
Раствор – это однородная смесь из двух или
более компонентов (составных частей или веществ).
Что такое однородная смесь? Однородность смеси
предполагает, что между составляющими ее
веществами отсутствует поверхность раздела.
В этом случае невозможно, по крайней мере
визуально, определить, сколько веществ
образовало данную смесь. Например, глядя на
водопроводную воду в стакане, трудно
предположить, что в ней, кроме молекул воды,
содержится еще добрый десяток ионов и молекул (О2,
СО2, Са2+ и др.). И никакой микроскоп
не поможет увидеть эти частицы.
Но отсутствие поверхности раздела – не
единственный признак однородности.
В однородной смеси состав смеси в любой
точке одинаков. Поэтому для получения раствора
нужно тщательно перемешать образующие его
компоненты (вещества).
Растворы могут иметь разное агрегатное
состояние:
• газообразные растворы (например, воздух –
смесь газов О2, N2, СО2, Аr);• жидкие растворы (например, одеколон, сироп,
рассол);• твердые растворы (например, сплавы).
Одно из веществ, которые образуют раствор,
называется растворителем. Растворитель
имеет то же агрегатное состояние, что и
раствор. Так, для жидких растворов – это
жидкость: вода, масло, бензин и т.д. Чаще всего на
практике применяются водные растворы. О них и
пойдет речь далее (если не будет сделана
соответствующая оговорка).
Что происходит при растворении различных
веществ в воде? Почему одни вещества хорошо
растворяются в воде, а другие – плохо? От чего
зависит растворимость – способность вещества
растворяться в воде?
Представим себе, что в стакан с теплой водой
положили кусочек сахара. Полежал он, уменьшился в
размерах и… исчез. Куда? Неужели нарушается
закон сохранения вещества (его массы, энергии)?
Нет. Сделайте глоток полученного раствора,
и вы убедитесь, что вода сладкая, сахар не
исчез. Но почему его не видно?
Дело в том, что в ходе растворения происходит
дробление (измельчение) вещества. В данном
случае кусочек сахара распался на молекулы, а их
мы видеть не можем. Да, но почему сахар, лежащий на
столе, не распадается на молекулы? Почему кусочек
маргарина, опущенный в воду, тоже никуда не
исчезает? А потому, что дробление
растворяемого вещества происходит под действием
растворителя, например воды. Но растворитель
сможет «растащить» кристалл, твердое вещество на
молекулы, если сумеет «уцепиться» за эти частицы.
Другими словами, при растворении вещества должно
быть взаимодействие между веществом и
растворителем.
Когда возможно такое взаимодействие? Только в
том случае, когда строение веществ (и
растворяемого, и растворителя) похоже, подобно.
Издавна известно правило алхимиков: «подобное
растворяется в подобном». В наших примерах
молекулы сахара полярны и между ними и полярными
молекулами воды существуют определенные силы
взаимодействия. Такие силы отсутствуют между
неполярными молекулами жира и полярными
молекулами воды. Поэтому жиры в воде не
растворяются. Таким образом, растворимость
зависит от природы растворяемого вещества и
растворителя.
В результате взаимодействия между
растворяемым веществом и водой образуются
соединения – гидраты. Это могут быть очень
прочные соединения:
Такие соединения существуют как
индивидуальные вещества: основания,
кислородсодержащие кислоты. Естественно, при
образовании этих соединений возникают прочные
химические связи, выделяется теплота. Так при
растворении СаО (негашеная известь) в воде
выделяется так много теплоты, что смесь закипает.
Но почему при растворении сахара или соли в
воде полученный раствор не нагревается?
Во-первых, далеко не все гидраты так прочны, как
серная кислота или гидроксид кальция. Существуют
гидраты солей (кристаллогидраты), которые
легко разлагаются при нагревании:
Во-вторых, при растворении, как уже упоминалось,
идет процесс дробления. А на это затрачивается
энергия, поглощается теплота.
Поскольку оба процесса происходят
одновременно, раствор может нагреваться или
охлаждаться, в зависимости от того, какой процесс
преобладает.
Задание 5.1. Определите, какой процесс –
дробление или гидратация – преобладает в каждом
случае:
а) при растворении серной кислоты в воде,
если раствор нагрелся;б) при растворении нитрата аммония в воде,
если раствор охладился;в) при растворении поваренной соли в воде,
если температура раствора практически не
изменилась.
Поскольку при растворении изменяется
температура раствора, естественно предположить,
что растворимость зависит от температуры.
Действительно, растворимость большинства
твердых веществ увеличивается при нагревании.
Растворимость газов при нагревании уменьшается.
Поэтому твердые вещества обычно растворяют в
теплой или горячей воде, а газированные напитки
хранят на холоде.
Растворимость (способность растворяться)
веществ не зависит от измельчения вещества или
интенсивности перемешивания. Но, повышая
температуру, измельчая вещество, перемешивая
готовый раствор, можно ускорить процесс
растворения. Изменяя условия получения раствора,
можно получать растворы разных составов.
Естественно, существует предел, достигнув
который, легко обнаружить, что вещество больше не
растворяется в воде. Такой раствор называется насыщенным.
Для хорошо растворимых веществ насыщенный
раствор будет содержать много растворенного
вещества. Так, насыщенный раствор KNO3 при 100
°С содержит 245 г соли на 100 г воды (в 345 г раствора),
это концентрированный раствор. Насыщенные
растворы плохо растворимых веществ содержат
ничтожные массы растворенных соединений. Так,
насыщенный раствор хлорида серебра содержит 0,15
мг AgCl в 100 г воды. Это очень разбавленный
раствор.
Таким образом, если раствор содержит много
растворенного вещества по отношению к
растворителю, он называется концентрированным,
если вещества мало – разбавленным. Очень часто
от состава раствора зависят его свойства, а
значит, и применение.
Так, разбавленный раствор уксусной кислоты
(столовый уксус) используют как вкусовую
приправу, а концентрированный раствор этой
кислоты (уксусная эссенция при приеме внутрь)
может вызвать смертельный ожог.
Для того чтобы отразить количественный состав
растворов, используют величину, называемую массовой
долей растворенного вещества :
где m(в-ва) – масса растворенного вещества в
растворе; m(р-ра) – общая масса раствора,
содержащая растворенное вещество и
растворитель.
Так, если 100 г уксуса содержат 6 г уксусной
кислоты, то речь идет о 6%-м растворе уксусной
кислоты (это столовый уксус). Способы решения
задач с использованием понятия массовой доли
растворенного вещества будут рассмотрены в
главе 8.
Выводы по главе 5. Растворы – это однородные
смеси, состоящие не менее чем из двух веществ,
одно их которых называется растворитель, другое
– растворенное вещество. При растворении
происходит взаимодействие этого вещества с
растворителем, благодаря чему растворяемое
вещество измельчается. Состав раствора выражают
при помощи массовой доли растворенного вещества
в растворе.
* Эти электронные пары
возникают в месте пересечения электронных
облаков.
Продолжение следует
Ковалентная связь образуется при взаимодействии неметаллов. Атомы неметаллов имеют высокую электроотрицательность и стремятся заполнить внешний электронный слой за счёт чужих электронов. Два таких атома могут перейти в устойчивое состояние, если объединят свои электроны.
Ковалентная связь — это связь между атомами неметаллов, образованная за счёт общих электронных пар.
Рассмотрим возникновение ковалентной связи в простых веществах.
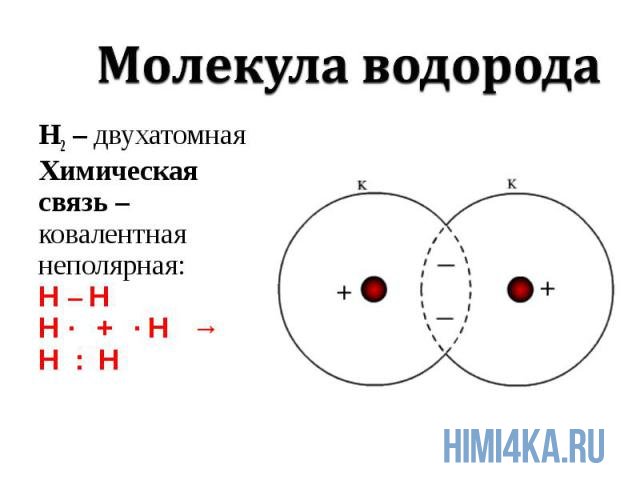
1. Образование молекулы водорода.
Каждый атом водорода имеет один электрон. Для перехода в устойчивое состояние ему необходим ещё один электрон.
При сближении двух атомов электронные облака перекрываются. Образуется общая электронная пара, которая связывает атомы водорода в молекулу.
В пространстве между двумя ядрами общие электроны бывают чаще, чем в других местах. Там формируется область с повышенной электронной плотностью и отрицательным зарядом. Положительно заряженные ядра притягиваются к ней, и образуется молекула.
При этом каждый атом получает завершённый двухэлектронный внешний уровень и переходит в устойчивое состояние.
Рис. (1). Образование молекулы водорода
Ковалентная связь за счёт образования одной общей электронной пары называется одинарной.
Общие электронные пары (ковалентные связи) образуются за счёт неспаренных электронов, расположенных на внешних энергетических уровнях взаимодействующих атомов.
У водорода — один неспаренный электрон. Для других элементов их число равно 8 – № группы.
Неметаллы VIIА группы (галогены) имеют на внешнем слое один неспаренный электрон.
У неметаллов VIА группы (кислород, сера) таких электронов два.
У неметаллов VА группы (азот, фосфор) — три неспаренных электрона.
2. Образование молекулы хлора.
Атом хлора на внешнем уровне имеет семь электронов. Шесть из них образуют пары, а седьмой неспаренный.
При соединении атомов образуется одна общая электронная пара, то есть возникает одна ковалентная связь. Каждый атом получает завершённый восьмиэлектронный внешний слой. Связь в молекуле хлора тоже одинарная. Такие же одинарные связи существуют в молекулах фтора, брома и иода.
Рис. (2). Образование молекулы хлора
Если атомы имеют несколько неспаренных электронов, то образуются две или три общие пары.
3. Образование молекулы кислорода.
У атома кислорода на внешнем уровне — два неспаренных электрона.
При взаимодействии двух атомов кислорода возникают две общие электронные пары. Каждый атом заполняет свой внешний уровень до восьми электронов. Связь в молекуле кислорода двойная.

Рис. (3). Образование молекулы кислорода
4. Образование молекулы азота.
Атом азота имеет три неспаренных электрона на внешнем уровне.
В молекуле образуются три общие электронные пары. Связь в молекуле азота тройная.
Рис. (4). Образование молекулы азота
Образование ковалентных связей показывают структурные (графические) формулы, в которых общая электронная пара обозначается чертой. Одна черта между атомами обозначает одинарную связь, две черты — двойную, три черты — тройную:
Источники:
Рис. 1. Образование молекулы водорода © ЯКласс
Рис. 2. Образование молекулы хлора © ЯКласс
Рис. 3. Образование молекулы кислорода © ЯКласс
Рис. 4. Образование молекулы азота © ЯКласс
4.1. Физические основы образования молекул
Атомы
химических элементов могут образовывать
три типа частиц, способных участвовать
в химических превращениях: молекулы,
ионы и свободные радикалы. Природа
взаимодействий между атомами в этих
частицах долгое время оставалась
неясной. В начале XIX
века Бергман и Бертолле предположили,
что в основе химического взаимодействия
лежат силы гравитации. Однако было
установлено, что химическое сродство
атомов не пропорционально их массам.
В
начале XX
века, с развитием представлений об
электронном строении атома, мерой их
химической активности стали считать
стремление к образованию электронной
оболочки, подобной оболочкам атомов
инертных газов. Наиболее устойчивой и
наименее активной. Это стремление может
осуществляться либо приемом, либо
отдачей электронов и превращением
нейтральных атомов в отрицательные и
положительные ионы. Последующее их
взаимное электростатическое притяжение
обеспечивает устойчивое состояние
веществ. Эти представления были положены
в основу теории ионной связи,
сформулированной Косселем в 1916 году. В
природе веществ с чисто ионной связью
достаточно мало. Преимущественно это
неорганические соединения, образованные
атомами с большой разницей в
электроотрицательностях, например
галогениды щелочных металлов NaCl,
KF.
Примерно в эти же годы Льюис и Лэнгмюр
предложили первую теорию ковалентной
связи. Согласно ей стремление атомов
завершить свои электронные оболочки
до структур атомов инертных газов
удовлетворяется не за счет отдачи или
принятия чужих электронов, а за счет
объединения неспаренных электронов в
общие электронные пары. Количество
таких пар между атомами определяет
кратность или порядок связи (одинарная,
двойная или тройная). В 1927 году Гейтлер
и Лондон, а в 30-х годах Слейтер и Поллинг
предложили спиновую теорию валентности,
или метод электронных пар. В основе
теории лежат квантово-механические
расчеты энергии и длины связи в молекуле
водорода.
Физическая
устойчивость любой молекулы основана
на том, что объединение атомов
сопровождается понижением полной
энергии системы.
Основной
вклад в энергию связи в молекуле вносит
энергия взаимодействия электронов с
ядрами, электронов и ядер между собой.
Если силы притяжения преобладают над
силами отталкивания, то потенциальная
энергия взаимодействующих атомов
понижается, в противном случае —
повышается.
Устойчивому
состоянию молекулы отвечает минимальное
значение энергии и определенное
относительное расположение ядер в
пространстве, называемое равновесной
конфигурацией молекулы.
Равновесная конфигурация молекулы
характеризуется равновесным расстоянием
(r0)
между атомами (длина связи) и энергией
связи (Есв).
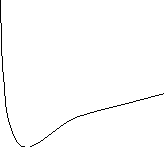
Проиллюстрируем
это на примере образования молекулы
водорода Н2
(рис. 4.1.). Согласно спиновой теории
валентности два атома водорода могут
образовать между собой химическую связь
только в том случае, если имеющиеся у
них валентные электроны имеют
противоположные спины (кр.1)
23
По
мере сближения двух атомов потенциальная
энергия системы понижается, поскольку
электроны одновременно притягиваются
к двум ядрам. Однако при очень малых
межъядерных расстояниях (r
< r0)
потенциальная энергия вновь начинает
повышаться вследствие возрастания
отталкивания между ядрами. Следовательно,
наблюдаемая длина связи устанавливается
в результате того, что притяжение атомов
друг к другу уравновешивается силами
отталкивания между ядрами и между
электронами. В случае, когда спины
электронов параллельны (кр.2), при
сближении атомов энергия всей системы
только нарастает и образование общей
электронной пары не происходит.
Е,эВ
4
1
2
2
0
1,2
1,4 r,
Ǻ
Е0
-2
r0
-4
Рис.
4.1. Изменение энергии в системе атомов
Н-Н при их сближении.
r0= 0,74 Ǻ — межатомное расстояние в молекуле
водорода (длина связи)
Равновесное
расстояние между атомами в молекуле
всегда меньше, чем сумма радиусов
изолированных атомов, что может быть
продемонстрировано на
примере образования молекулы HF.
Радиус атома водорода составляет
0,53 Ǻ, атома фтора – 0,41 Ǻ, а расстояние
между ядрами атомов в молекуле HF равно
0,92 Ǻ.
Таким
образом, длина связи в молекуле – это
расстояние между центрами ядер двух
вступивших в химическую связь атомов.
Спиновая
теория валентности была положена в
основу теории химической связи, получившей
название метод валентных связей.
24
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Основные положения метода молекулярных орбиталей
Электронное строение гомоядерных двухатомных молекул и ионов
Электронное строение гетероядерных молекул и ионов
Задачи для самостоятельного решения
Основные положения метода молекулярных орбиталей (МО ЛКАО)
- В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) – связывающую, энергия которой ниже, чем энергия АО, и разрыхляющую, энергия которой выше энергии АО.
- Электроны в молекуле располагаются на молекулярных орбиталях в соответствии с принципом Паули и правилом Хунда.
- Отрицательный вклад в энергию химической связи электрона, находящегося на разрыхляющей орбитали больше, чем положительный вклад в эту энергию электрона на связывающей МО.
- Кратность связи в молекуле равна деленной на два разности числа электронов, находящихся на связывающих и разрыхляющих МО.
- С повышением кратности связи в однотипных молекулах увеличивается ее энергия связи и уменьшается ее длина.
Если при образовании молекулы из атомов электрон займет связывающую МО, то полная энергия системы понизится, т.е. образуется химическая связь. При переходе электрона на разрыхляющую МО энергия системы повысится, система станет менее устойчивой (рис. 1).
Рис. 1. Энергетическая диаграмма образования молекулярных орбиталей из двух атомных орбиталей.
Молекулярные орбитали, образованные из s-атомных орбиталей, обозначаются ss. Если МО образованы рz-атомными орбиталями – они обозначаются s z. Молекулярные орбитали, образованные рx— и рy-атомными орбиталями, обозначаются π x и π y соответственно.
При заполнении молекулярных орбиталей электронами следует руководствоваться следующими принципами:
- Каждой МО отвечает определенная энергия. Молекулярные орбитали заполняются в порядке увеличения энергии.
- На одной молекулярной орбитали может находиться не более двух электронов с противоположными спинами.
- Заполнение молекулярных квантовых ячеек происходит в соответствии с правилом Хунда.
Экспериментальное исследование (изучение молекулярных спектров) показало, что энергия молекулярных орбиталей возрастает в следующей последовательности:
σ 1s < σ *1s < σ 2s <σ *2s < σ 2pz < π 2рх = π 2ру < π *2рх = π *2ру < σ *2pz.
Звездочкой (*) в этом ряду отмечены разрыхляющие молекулярные орбитали.
У атомов В, С и N энергии 2s- и 2p-электронов близки и переход 2s-электрона на молекулярную орбиталь σ 2pz требует затраты энергии. Следовательно, для молекул В2, С2, N2 энергия орбитали σ 2pz становится выше энергии орбиталей π 2рх и π 2ру:
σ 1s < σ *1s < σ 2s <σ *2s < π 2px = π 2ру < σ 2pz <π *2рх = π *2ру < σ *2pz.
При образовании молекулы электроны располагаются на орбиталях с более низкой энергией. При построении МО обычно ограничиваются использованием валентных АО (орбиталей внешнего слоя), так как именно они вносят основной вклад в образование химической связи.
Электронное строение гомоядерных двухатомных молекул и ионов
Процесс образования частицы H2+ можно представить следующим образом:
Н[1s] + Н+ → H2+[σ 1s].
Таким образом, на связывающей молекулярной σ -орбитали располагается один электрон.
Кратность связи равна полуразности числа электронов на связывающих и разрыхляющих орбиталях. Значит, кратность связи в частице H2+ равна (1 – 0):2 = 0,5. Метод ВС, в отличие от метода МО, не объясняет возможность образования связи одним электроном.
Молекула водорода имеет следующую электронную конфигурацию:
H2 [(σ 1s)2]
В молекуле H2 имеется два связывающих электрона, значит, связь в молекуле одинарная.
Молекулярный ион H2— имеет электронную конфигурацию:
H2— [(σ 1s)2(σ *1s)1]
Кратность связи в H2— составляет (2 – 1):2 = 0,5.
Рассмотрим теперь гомоядерные молекулы и ионы второго периода.
Электронная конфигурация молекулы Li2 следующая:
2Li (K2s) Li2 [KK*(σ 2s)2]
Молекула Li2 содержит два связывающих электрона, что соответствует одинарной связи.
Процесс образования молекулы Ве2 можно представить следующим образом:
2 Ве(K2s2) Ве2 [KK*(σ 2s)2 (σ *2s)2]
Число связывающих и разрыхляющих электронов в молекуле Ве2 одинаково, а поскольку один разрыхляющий электрон уничтожает действие одного связывающего, то молекула Ве2 в основном состоянии не обнаружена.
В молекуле азота на орбиталях располагаются 10 валентных электронов. Электронное строение молекулы N2:
N2 [KK*(σ 2s)2 (π *2s)2 (π2px)2 (π2py)2 (σ 2pz)2]
Поскольку в молекуле N2 восемь связывающих и два разрыхляющих электрона, то в данной молекуле имеется тройная связь. Молекула азота обладает диамагнитными свойствами, поскольку не содержит неспаренных электронов.
На орбиталях молекулы O2 распределены 12 валентных электронов, следовательно, эта молекула имеет конфигурацию:
O2 [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1 (π*2py)1]
Рис. 2. Схема образования молекулярных орбиталей в молекуле О2 (показаны только 2р-электроны атомов кислорода)
В молекуле O2, в соответствии с правилом Хунда, два электрона с параллельными спинами размещаются по одному на двух орбиталях с одинаковой энергией (рис. 2). Молекула кислорода по методу ВС не имеет неспаренных электронов и должна обладать диамагнитными свойствами, что не согласуется с экспериментальными данными. Метод молекулярных орбиталей подтверждает парамагнитные свойства кислорода, которые обусловлены наличием в молекуле кислорода двух неспаренных электронов. Кратность связи в молекуле кислорода равна (8–4):2 = 2.
Рассмотрим электронное строение ионов O2+ и O2— . В ионе O2+ на его орбиталях размещаются 11 электронов, следовательно, конфигурация иона следующая:
O2+ [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1]
или
O2+ [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2py)1]
Кратность связи в ионе О2+ равна (8–3):2 = 2,5. В ионе O2— на его орбиталях распределены 13 электронов. Этот ион имеет следующее строение:
O2— [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)1]
или
O2— [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1 (π*2py)2]
Кратность связи в ионе О2— равна (8 – 5):2 = 1,5. Ионы О2— и О2+ являются парамагнитными, так как содержат неспаренные электроны.
Электронная конфигурация молекулы F2 имеет вид:
F2 [KK(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)2]
Кратность связи в молекуле F2 равна 1, так как имеется избыток двух связывающих электронов. Поскольку в молекуле нет неспаренных электронов, она диамагнитна.
В ряду N2, O2, F2 энергии и длины связей в молекулах составляют:
| Молекула | N2 | O2 | F2 |
| Избыток связывающих электронов | 6 | 4 | 2 |
| Энергия связи, кДж/моль | 941 | 494 | 155 |
| Длина связи, пм | 110 | 121 | 142 |
Увеличение избытка связывающих электронов приводит к росту энергии связи (прочности связи). При переходе от N2 к F2 длина связи возрастает, что обусловлено ослаблением связи.
В ряду О2— , О2, О2+ кратность связи увеличивается, энергия связи также повышается, длина связи уменьшается.
Электронное строение гетероядерных молекул и ионов
Изоэлектронными частицами называют частицы, содержащие одинаковое число электронов. Например, к изоэлектронным частицам относятся N2, CO, BF, NO+, CN- .
Согласно методу МО электронное строение молекулы СО аналогично строению молекулы N2:
CO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ2pz)2]
На орбиталях молекулы СО располагаются 10 электронов (4 валентных электрона атома углерода и 6 валентных электронов атома кислорода). В молекуле СО, как и в молекуле N2, связь тройная. Сходство в электронном строении молекул N2 и СО обуславливает близость физических свойств этих веществ.
В молекуле NO на орбиталях распределены 11 электронов (5 электронов атома азота и 6 электронов атома кислорода), следовательно, электронная конфигурация молекулы такова:
NO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ 2pz)2 (π*2px)1] или
NO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ 2pz)2 (π*2py)1]
Кратность связи в молекуле NO равна (8–3):2 = 2,5.
Конфигурация молекулярных орбиталей в ионе NO— :
NO— [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2 (π*2px)1(π*2py)1]
Кратность связи в этой молекуле равна (8–4):2 = 2.
Ион NO+ имеет следующее электронное строение:
NO+ [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2]
Избыток связывающих электронов в этой частице равен 6, следовательно, кратность связи в ионе NO+ равна трём.
В ряду NO— , NO, NO+ избыток связывающих электронов увеличивается, что приводит к возрастанию прочности связи и уменьшению её длины.
Задачи для самостоятельного решения
1. Используя метод МО, установите порядок уменьшения энергии химической связи в частицах:
NF+; NF —; NF.
2. Используя метод МО, установите порядок увеличения энергии химической связи в частицах:
CO—; CO; CO+.
3. На основе метода МО установите, какие из перечисленных частиц не существуют:
He2; He2+; Be2; Be2+.
4. Распределите электроны на молекулярных орбиталях для молекулы B2. Определите кратность связи.
5. Распределите электроны на молекулярных орбиталях для молекулы N2. Определите кратность связи.
6. Используя метод МО, определите кратность связи в молекуле С2.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
7. На основе метода МО объясните, почему не существует молекулы Ne2.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
8. Объясните уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2—.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
9. Распределите электроны на молекулярных орбиталях для иона CN—. Определите кратность связи в этом ионе.
|
CN— [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2]. |
10. Используя метод МО определите, как изменяется длина связи и энергия связи в ряду CN+, CN, CN—.
|
Электроны располагаются на молекулярных орбиталях следующим образом: CN+ [KK*(σ2s)2 (σ*2s2 (π2px)2 (π2py)2 ]; CN [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)1]; CN— [KK*(σ2s) 2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2 ]. Избыток связывающих электронов в CN+, CN, CN— соответственно составляет 4, 5, 6. |