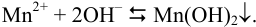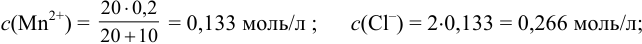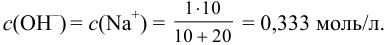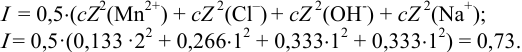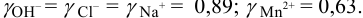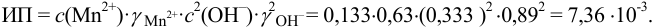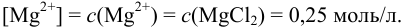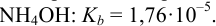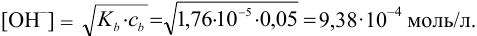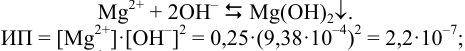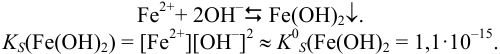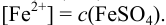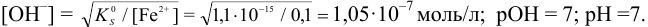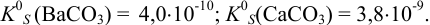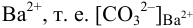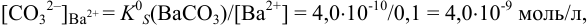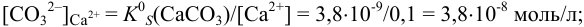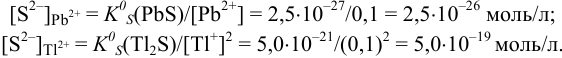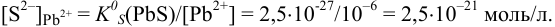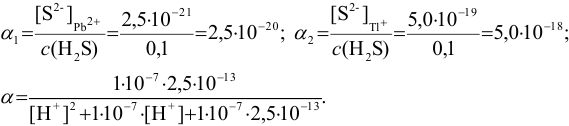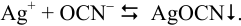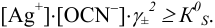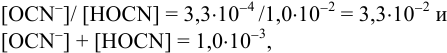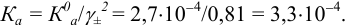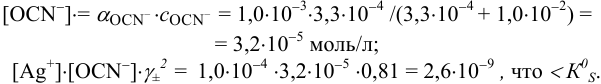Качественные реакции
О чем эта статья:
Что такое качественная реакция
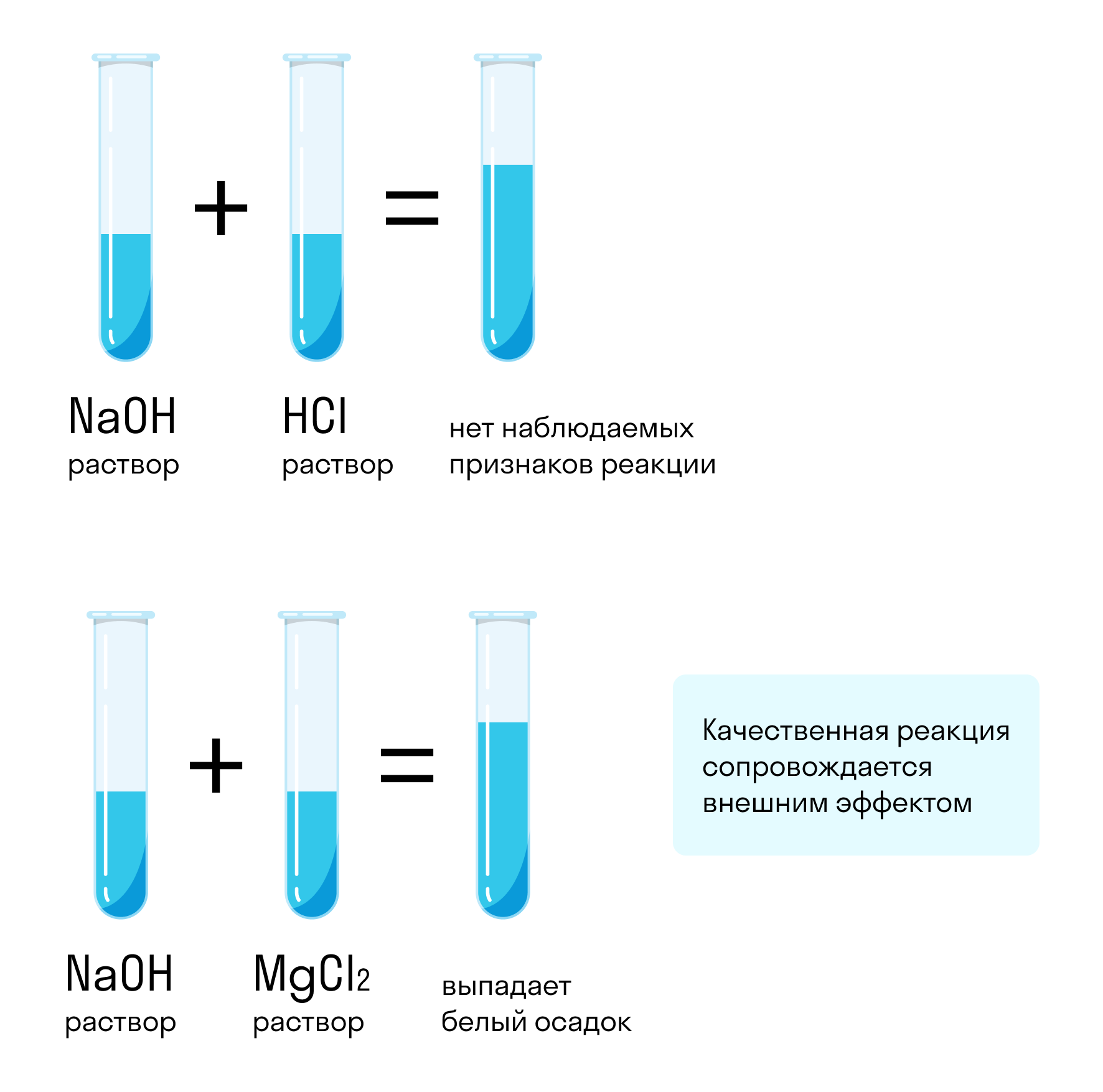
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Правила растворимости химических соединений
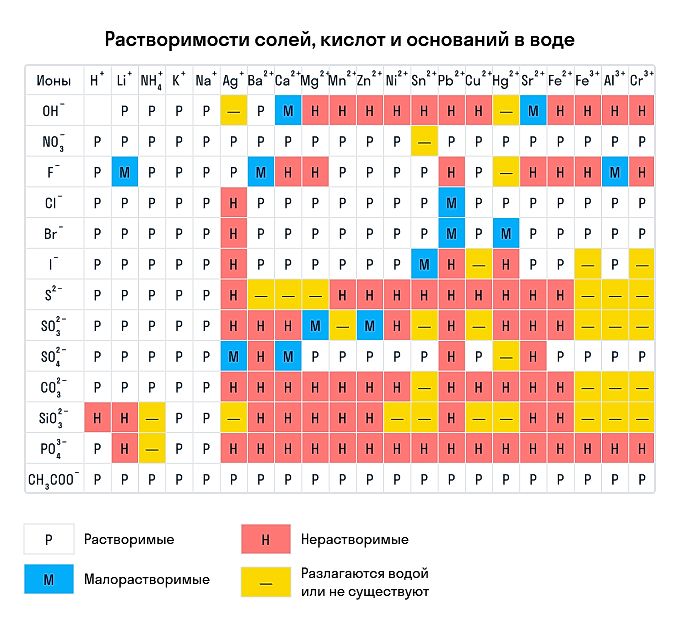
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
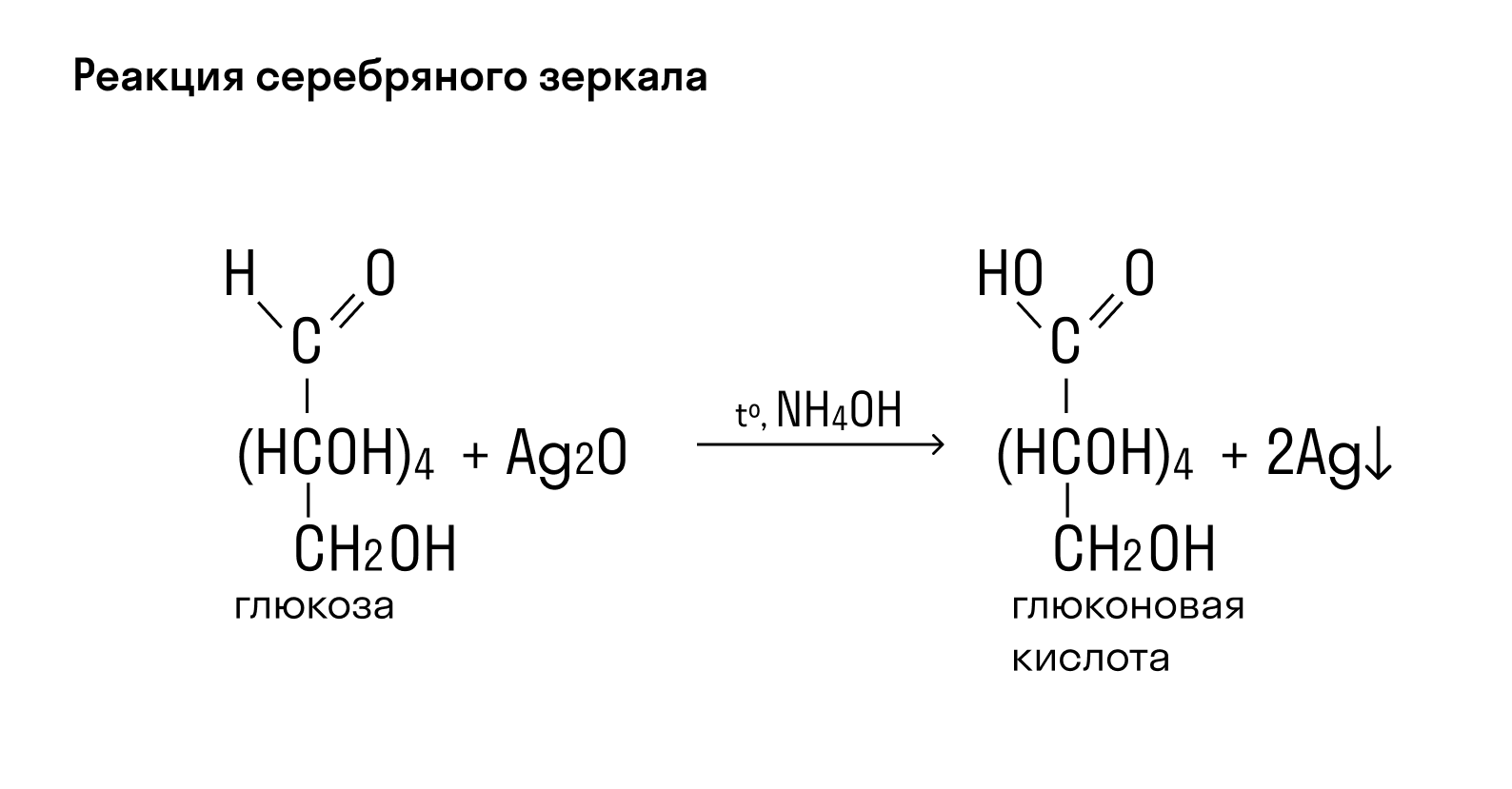
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
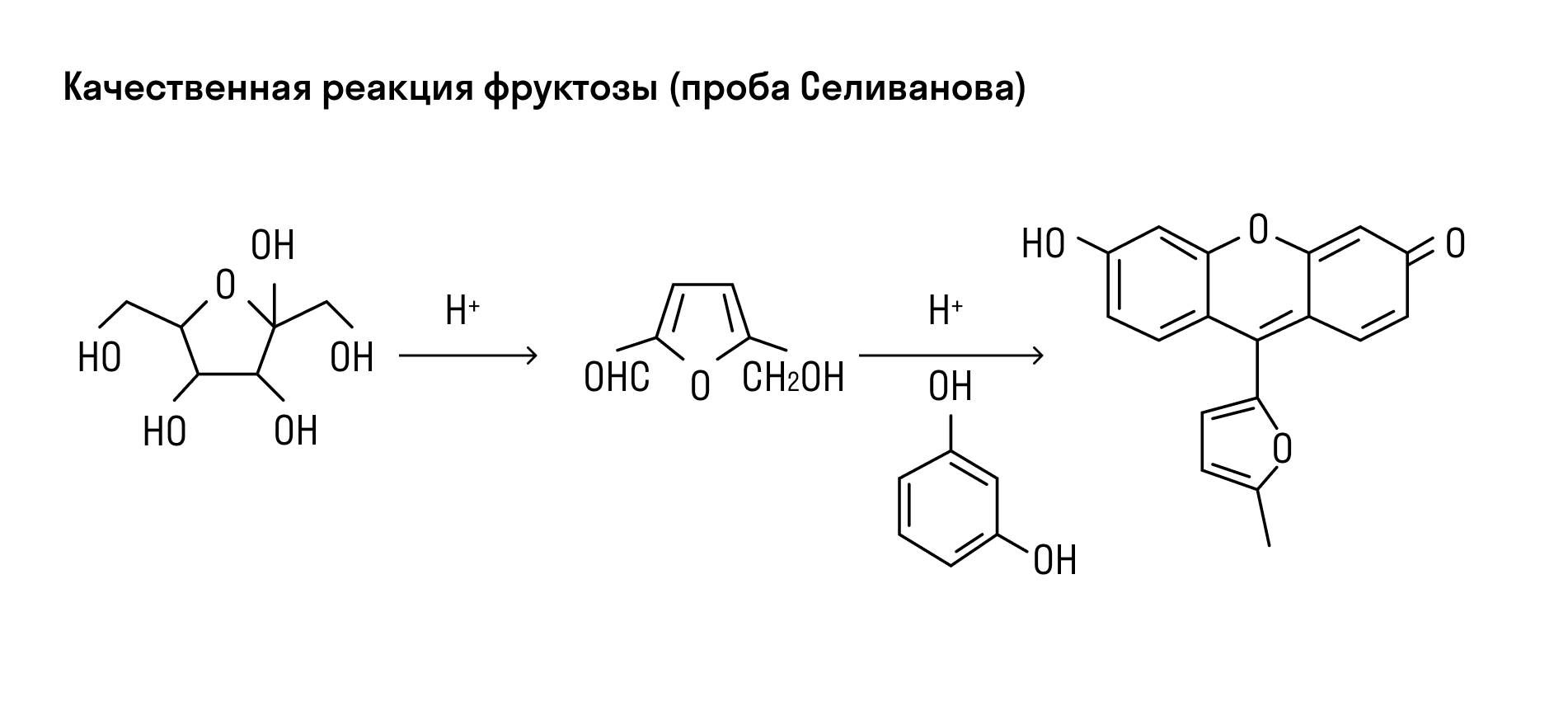
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Цвета осадков и газов в неорганической химии
Для сдачи ОГЭ необходимо знать и предсказывать по формуле цвет осадка или газа, а также характерные запахи, которыми обладают газы. В данном документе собраны необходимые данные по этому вопросу.
Осадки бывают разных цветов и разной консистенции. Все это является частью описания признака реакции.
Задание 13 ОГЭ по химии.

Автор: Фрундина Дарья Андреевна, учитель химии.
4.1.4. Качественные реакции на неорганические вещества и ионы.
Представим себе такую ситуацию:
Вы работаете в лаборатории и решили провести какой-либо эксперимент. Для этого вы открыли шкаф с реактивами и неожиданно увидели на одной из полок следующую картину. У двух баночек с реактивами отклеились этикетки, которые благополучно остались лежать неподалеку. При этом установить точно какой банке соответствует какая этикетка уже невозможно, а внешние признаки веществ, по которым их можно было бы различить, одинаковы.
В таком случае проблема может быть решена с использованием, так называемых, качественных реакций.
Качественными реакциями называют такие реакции, которые позволяют отличить одни вещества от других, а также узнать качественный состав неизвестных веществ.
Например, известно, что катионы некоторых металлов при внесении их солей в пламя горелки окрашивают его в определенный цвет:
Данный метод может сработать только в том случае, если различаемые вещества по разному меняют цвет пламени, или же одно из них не меняет цвет вовсе.
Но, допустим, как назло, вам определяемые вещества цвет пламени не окрашивают, или окрашивают его в один и тот же цвет.
В этих случаях придется отличать вещества с применением других реагентов.
В каком случае мы можем отличить одно вещество от другого с помощью какого-либо реагента?
Возможны два варианта:
- Одно вещество реагирует с добавленным реагентом, а второе нет. При этом обязательно, должно быть ясно видно, что реакция одного из исходных веществ с добавленным реагентом действительно прошла, то есть наблюдается какой-либо ее внешний признак — выпадал осадок, выделился газ, произошло изменение цвета и т.п.
Например, нельзя отличить воду от раствора гидроксида натрия с помощью соляной кислоты, не смотря на то, что щелочи с кислотами прекрасно реагируют:
NaOH + HCl = NaCl + H2O
Связано это с отсутствием каких-либо внешних признаков реакции. Прозрачный бесцветный раствор соляной кислоты при смешении с бесцветным раствором гидроксида образует такой же прозрачный раствор:
Но зато, можно воду от водного раствора щелочи можно различить, например, с помощью раствора хлорида магния – в данной реакции выпадает белый осадок:
2) также вещества можно отличить друг от друга, если они оба реагируют с добавляемым реагентом, но делают это по-разному.
Например, различить раствор карбоната натрия от раствора нитрата серебра можно с помощью раствора соляной кислоты.
с карбонатом натрия соляная кислота реагирует с выделением бесцветного газа без запаха — углекислого газа (СО2):
а с нитратом серебра с образованием белого творожистого осадка AgCl
Ниже в таблицах представлены различные варианты обнаружения конкретных ионов:
Качественные реакции на катионы
Выпадение белого осадка, не растворимого в кислотах:
1) Выпадение осадка голубого цвета:
2) Выпадение осадка черного цвета:
Выпадение осадка черного цвета:
Выпадение белого осадка, не растворимого в HNO3, но растворимого в аммиаке NH3·H2O:
2) Гексацианоферрат (III) калия (красная кровяная соль) K3[Fe(CN)6]
1) Выпадение белого осадка, зеленеющего на воздухе:
2) Выпадение синего осадка (турнбулева синь):
2) Гексацианоферрат (II) калия (желтая кровяная соль) K4[Fe(CN)6]
3) Роданид-ион SCN −
1) Выпадение осадка бурого цвета:
2) Выпадение синего осадка (берлинская лазурь):
3) Появление интенсивно-красного (кроваво-красного) окрашивания:
Fe 3+ + 3SCN − = Fe(SCN)3
Выпадение белого осадка гидроксида алюминия при приливании небольшого количества щелочи:
и его растворение при дальнейшем приливании:
Выделение газа с резким запахом:
Посинение влажной лакмусовой бумажки
| Катион | Реактив | Признак реакции |
| Ba 2+ | SO4 2- | |
| Al 3+ | Щелочь (амфотерные свойства гидроксида) | |
| NH4 + | OH − , нагрев | |
| H + (кислая среда) |
Красное окрашивание |
Качественные реакции на анионы
Выпадение белого осадка, не растворимого в кислотах:
1) Образование раствора синего цвета, содержащего ионы Cu 2+ , выделение газа бурого цвета (NO2)
2) Возникновение окраски сульфата нитрозо-железа (II) [Fe(H2O)5NO] 2+ . Окраска от фиолетовой до коричневой (реакция «бурого кольца»)
Выпадение светло-желтого осадка в нейтральной среде:
Выпадение желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCl:
Выпадение черного осадка:
1) Выпадение белого осадка, растворимого в кислотах:
2) Выделение бесцветного газа («вскипание»), вызывающее помутнение известковой воды:
Выпадение белого осадка и его растворение при дальнейшем пропускании CO2:
Выделение газа SO2 с характерным резким запахом (SO2):
Выпадение белого осадка:
Выпадение белого творожистого осадка, не растворимого в HNO3, но растворимого в NH3·H2O(конц.):
http://4ege.ru/gia-po-himii/60744-cveta-osadkov-i-gazov-v-neorganicheskoj-himii.html
http://scienceforyou.ru/teorija-dlja-podgotovki-k-egje/4-1-4-kachestvennye-reakcii-na-neorganicheskie-veshhestva-i-iony
| Анион | Воздействие или реактив | Признак реакции. Уравнение реакции |
| SO4 2- | Ba 2+ | |
| CrO4 2- | Ba 2+ | |
| CO2 | Известковая вода Ca(OH)2 |
Определение условий выпадения осадка и разделения ионов
Малорастворимое соединение начинает выделяться в виде твердой фазы, когда произведение концентраций (точнее, активностей) ионов данного электролита (так называемое ионное произведение, обозначаемое ИП) достигает величины произведения растворимости. Если 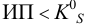
Пример 6.1.
Образуется ли осадок гидроксида марганца, если к 20 мл 0,20 М раствора хлорида марганца прилить 10 мл 1,0 М раствора 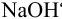
Решение:
Образование осадка происходит по реакции:
Значение 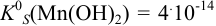
Вычисляем ионную силу раствора по формуле (2.1):
По табл. 1 приложения для полученного значения I находим коэффициенты активности:
Вычисляем ионное произведение с учетом того, что ионы в растворе взаимодействуют по основной реакции в соответствии с равновесными концентрациями, равными общим, побочных реакций нет (не учитываем гидролиз 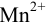
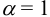
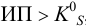
Пример 6.2.
Может ли образоваться осадок 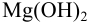
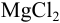
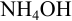
Решение:
При сливании двух равных объемов суммарный объем увеличивается вдвое, а концентрация веществ уменьшается вдвое, т. е. концентрация 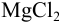
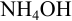
Равновесную концентрацию 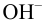
Взаимодействие ионов с образованием осадка протекает по реакции 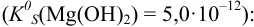
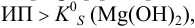
Пример 6.3.
Найдите pH начала выпадения осадка 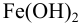
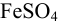
Решение:
Образование осадка можно представить уравнением:
Так как FeSO4-сильный электролит,
Следовательно, при pH = 7 начнется выпадение осадка 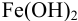
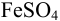
Осаждение (связывание) иона считается практически полным, если его концентрация в растворе становится <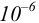
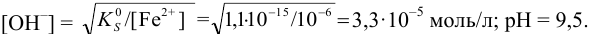
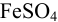
В растворе могут присутствовать несколько ионов, участвующих в реакциях образования осадков с одним и тем же реагентом. Это используется при объединении ионов в одну аналитическую группу аналитических классификаций катионов и анионов. По схеме расчета, подобной приведенной в примере 6.4, можно рассчитать условия начала и конца совместного осаждения группы катионов. Практический интерес представляет также определение возможности разделения двух ионов (при достаточно заметной разнице в As их соединений с одним и тем же реагентом), т. е. возможности их фракционного осаждения.
Пример 6.4.
Какой осадок выпадет первым и какая доля первого иона останется в растворе к началу осаждения второго, если к раствору, содержащему по 0,10 моль/л нитратов кальция и бария, постепенно добавлять 0,10 М карбонат аммония. Возможно ли количественное разделение ионов 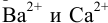
Решение:
Ионную силу учесть в данном случае сложно, поскольку меняется ионный состав раствора в ходе осаждения. Однако её изменения одинаково скажутся на изменении коэффициентов активности ионов, входящих в состав осадков, и не повлияют на общий вывод. Поэтому будем считать 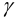
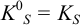
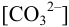
и для начала осаждения ионов 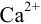
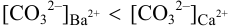
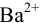
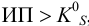
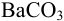
К началу осаждения 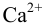
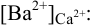
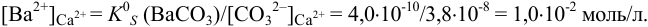
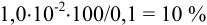
При практически полном осаждении доля иона в растворе составляла бы величину менее 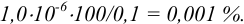
Пример 6.5.*
Найдите условия количественного разделения 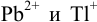
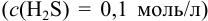
Решение:
Представим равновесия двух главных реакций:
Найдем концентрации 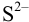
Следовательно, первым будет осаждаться 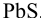
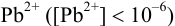
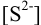
При сравнении полученной величины с концентрацией 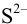
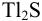
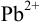
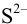
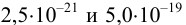
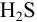
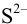
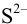
Предварительно вычислим молярные доли для иона S» в этих двух случаях при c(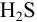
Решая последнее уравнение относительно 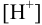
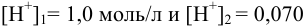
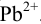
Пример 6.6.*
Установите возможность образования осадка 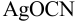
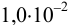
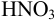
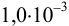
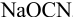
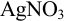
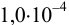
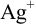
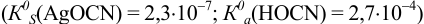
Решение:
Реакция образования осадка:
Условие осаждения:
По величине ионной силы в исходном растворе, равной 0,011, находим 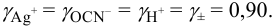
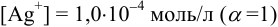
Равновесную концентрацию 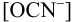
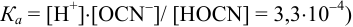
или предварительно вычислив 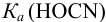
Учитывая, что 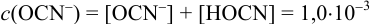
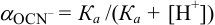
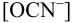
Осадок не выпадет.
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
Определение осадка и пример в химии
На чтение 4 мин. Просмотров 170 Опубликовано 27.05.2021
В химии осаждение означает образование нерастворимого соединения либо путем реакции двух солей, либо путем изменения температуры, чтобы повлиять на растворимость соединения. Кроме того, «осадок» – это название твердого вещества, которое образуется в результате реакции осаждения.
Осаждение может указывать на то, что произошла химическая реакция. , но это также может произойти, если концентрация растворенного вещества превышает его растворимость. Осаждению предшествует событие, называемое зародышеобразованием, когда небольшие нерастворимые частицы объединяются друг с другом или образуют границу раздела с поверхностью, такой как стенка контейнера или затравочный кристалл.
Содержание
- Ключевые выводы: определение осадка в химии
- Precipitate vs Precipitant
- Пример осаждения
- Использование осадков
- Как извлечь осадок
- Преципитатное старение или переваривание
- Источники
Ключевые выводы: определение осадка в химии
- В химии осадок – это и глагол, и существительное .
- Осаждение означает образование нерастворимого соединения либо за счет уменьшения растворимости соединения, либо за счет реакции двух солевых растворов.
- Твердое вещество, которое образуется в результате осаждения. Реакция называется осадком.
- Реакции осаждения выполняют важные функции. Они используются для очистки, удаления или извлечения солей, для изготовления пигментов и для определения веществ при качественном анализе.
Precipitate vs Precipitant
Терминология может показаться немного запутанной. Вот как это работает: образование твердого вещества из раствора называется осаждением . Химическое вещество, которое вызывает образование твердого вещества в жидком растворе, называется осадителем . Образовавшееся твердое вещество называется осадком . Если размер частиц нерастворимого соединения очень мал или сила тяжести недостаточна для притягивания твердого вещества ко дну контейнера, осадок может быть равномерно распределен по жидкости, образуя суспензию . Осаждение относится к любой процедуре, которая отделяет осадок от жидкой части раствора, которая называется супернатантом . Распространенным методом осаждения является центрифугирование. После извлечения осадка полученный порошок можно назвать «цветком».
Пример осаждения
Смешивание серебра нитрат и хлорид натрия в воде вызовут выпадение хлорида серебра из раствора в виде твердого вещества. В этом примере осадок представляет собой хлорид серебра.
При написании химической реакции присутствие осадка может быть указано стрелкой по химической формуле. направленный вниз:
Ag + + Cl – → AgCl ↓
Использование осадков
Осадки могут использоваться для идентификации катиона или аниона в соли в рамках качественного анализа. В частности, известно, что переходные металлы образуют осадки разного цвета в зависимости от их элементной идентичности и степени окисления.. Реакции осаждения используются для удаления солей из воды, выделения продуктов и приготовления пигментов. В контролируемых условиях реакция осаждения дает чистые кристаллы осадка. В металлургии осаждение используется для упрочнения сплавов.
Как извлечь осадок
Есть несколько методов, используемых для восстановления осадок:
Фильтрация : при фильтрации раствор, содержащий осадок, выливается через фильтр. В идеале осадок остается на фильтре, а жидкость проходит через него. Контейнер можно промыть и вылить на фильтр для облегчения восстановления. Всегда наблюдается некоторая потеря осадка, которая может быть вызвана растворением в жидкости, прохождением через фильтр или прилипанием к фильтрующей среде.
Центрифугирование : при центрифугировании раствор быстро вращается. Чтобы техника работала, твердый осадок должен быть плотнее жидкости. Уплотненный осадок, называемый гранулой, может быть получен путем слива жидкости. Обычно при центригации потери меньше, чем при фильтрации. Центрифугирование хорошо работает с небольшими размерами образцов.
Декантация : при декантации слой жидкости сливается или отсасывается от осадок. В некоторых случаях для отделения раствора от осадка добавляют дополнительный растворитель. Декантацию можно использовать для всего раствора или после центрифугирования.
Преципитатное старение или переваривание
Процесс, называемый преципитатным старением или перевариванием происходит, когда в растворе остается свежий осадок. Обычно температура раствора повышается. В результате пищеварения могут образовываться более крупные частицы с более высокой чистотой. Процесс, который приводит к этому результату, известен как созревание Оствальда.
Источники
- Адлер, Алан Д .; Лонго, Фредерик Р .; Кампас, Франк; Ким, Жан (1970). «О препарате металлопорфиринов». Журнал неорганической и ядерной химии . 32 (7): 2443. DOI: 10.1016/0022-1902 (70) 80535-8
- Дхара, С. (2007). «Формирование, динамика и характеристика наноструктур с помощью ионно-лучевого облучения». Критические обзоры по твердому телу и материаловедению . 32 (1): 1-50. DOI: 10.1080/10408430601187624
- Зумдал, Стивен С. (2005). Химические принципы (5-е изд.). Нью-Йорк: Хоутон Миффлин. ISBN 0-618-37206-7.
Рассмотрим первый случай, когда реакции ионного обмена протекают до конца:
ионы связываются и образуют нерастворимое вещество, которое выпадает в осадок.
Смешаем растворы сульфата натрия и хлорида бария (см. рисунок).
Рис. (1). Образование осадка сульфата бария
В результате химической реакции выпадет белый осадок сульфата бария.
- Молекулярное уравнение реакции выглядит так:
.
Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а нерастворимое вещество, уходящее из сферы реакции — в молекулярном виде.
- Получившееся уравнение — полное ионное уравнение реакции:
.
- Если исключить из обеих частей равенства одинаковые ионы, которые не участвуют в реакции, то получится сокращённое ионное уравнение реакции:
Сокращённое ионное уравнение показывает, что сущность реакции сводится к взаимодействию ионов бария
Ba2+
и сульфат-ионов
SO42−
, в результате которого образуется осадок сульфата бария
BaSO4
.
Сокращённое ионное уравнение характеризует сущность реакции, показывает, какие ионы реагируют между собой, и какое вещество они образуют в результате ионной реакции.
При этом неважно, в состав каких веществ-электролитов входили эти ионы до реакции. Это могли быть растворы серной кислоты и нитрата бария, или сульфата аммония и хлорида бария и т. д. Сокращённое ионное уравнение реакций этих пар веществ будет иметь вид:
Таким образом, если в любых водных растворах электролитов содержатся ионы бария и сульфат-ионы, то они всегда взаимодействуют между собой, образуя белый осадок сульфата бария.
Такие реакции для обнаружения ионов (веществ) и называются качественными реакциями.
Источники:
Рис. 1. Образование осадка сульфата бария © ЯКласс
Условия образования и растворения осадка
1. Термодинамика
процесса образования осадка.
При
любом произвольном соотношении
компонентов «твердый осадок
раствор» система будет стремится к
состоянию равновесия:
K
насыщенный
раствор
tnAnm(тв.)
⇄
nKtm+
+ mAnn.
осадок
Этот
процесс можно описать при помощи изотермы
Вант-Гоффа:
В насыщенном
растворе:
и
G
= 0.
В
ненасыщенном или пересыщенном растворе
величина
называетсяпроизведение
концентраций ионов
и обозначается
.
Из
уравнения изотермы Вант-Гоффа видно,
что если
(пересыщенный раствор), тоG > 0
и, следовательно, процесс самопроизвольно
протекает в обратном направлении, т.е.
в сторону образования твердой фазы.
В
другом случае, если
(ненасыщенный раствор), тоG < 0
и процесс самопроизвольно протекает в
прямом направлении, т.е. в сторону
растворения осадка.
Таким
образом, зная концентрации ионов в
растворе, можно прогнозировать направление
смещения гетерогенного равновесия:
1) Условие выпадения
осадка:
Если
произведение концентраций ионов,
возведенных в степени их стехиометрических
коэффициентов, превышает произведение
растворимости, то происходит образование
твердой фазы (осадка):
.
2) Условие растворения
осадка:
Если
произведение концентраций ионов,
возведенных в степени стехиометрических
коэффициентов, не превышает произведение
растворимости, то осадок не образуется,
а
при
наличии в системе твердой фазы (осадка)
происходит ее
растворение:
.
Следует
отметить, что для растворения осадка
достаточно умень-шить концентрацию
одного
из ионов. Этого можно достичь, например,
добавляя реагент, связывающий ион
малорастворимого
электролита
в растворимое малодиссоциирующее
соединение или газообразное вещество.
2. Кинетика
процесса образования осадка.
Процесс
образования твердой фазы (осадка) можно
рассмат-ривать
как
двухстадийный:
1 стадия ‑ химическое
взаимодействие, т. е.
обменная
реакция между ионами;
2 стадия ‑ кристаллизация,
т. е.
образование зародышей кристал-лизации
и их рост.
Первая
стадия протекает с довольно высокой
скоростью, вторая
значительно медленнее.
Это
обстоятельство объясняет тот факт, что
при достижении
условия
выпадения осадка последний не всегда
образуется момен-тально. Он может
появиться через несколько часов, а то
и суток.
В целом, кинетика
процесса образования осадка довольно
сложна и в рамках данного пособия
подробно не рассматривается.
Смещение гетерогенного равновесия
1. Влияние
одноименного иона.
Из
постоянства величины ПР не следует
постоянство концен-траций отдельных
ионов и концентрацию каждого из них
можно варьировать в определенных
пределах. Так, можно увеличить концен-трацию
иона Аnn(или
Ktm+),
добавив, например, вещество с одно-именным
ионом – это немедленно отразится на
состоянии равно-весия: оно сдвинется в
направлении образования осадка, т. к.
избы-точное, по сравнению с равновесным
количеством, содержание ионов Аnn
(или Ktm+)
приведет к увеличению скорости реакции
осаждения (nKtm+ + mАnnKtnAnm).
При
добавлении одноименного иона, например
Аnn,
в системе установится равновесие,
которое будет по-прежнему описываться
уравнением (1) и количественно
характеризоваться той же величиной
,
но другими равновесными концентрациями
ионовKtm+
и Аnn.
Концентрация ионов Ktm+
во вновь установившемся равновесии
уменьшится по сравнению с предыдущим
равновесным состоянием (до добавления
избыточного количества иона Аnn)
за счет того, что часть ионов Ktm+
вступит в реакцию осаждения с избыточным
количеством ионов Аnn.
Концентрация ионов Аnn,
наоборот, будет больше, чем в предыдущем
равновесии.
Пример
4. Сравнить
растворимость
сульфата
бария в воде и в растворе хлорида бария
с С(BaCl2)
= 0,01 моль/л.
Решение.
Растворимость
сульфата бария (ПР = 1,1∙1010)
в воде составляет:
.
Очевидно,
что в насыщенном растворе BaSO4:
P(BaSO4)
= C(Ba2+)
= C(SO42).
Добавление
в раствор растворимой соли бария приводит
к повы-шению концентрации ионов Ba2+.
Согласно принципу Ле Шателье, равновесие:
BaSO4
⇄
Ba2+
+ SO42
осадок
насыщенный
раствор
смещается
в сторону образования осадка и
растворимость сульфата бария снижается.
В
данном случае концентрация катионов
бария складывается из концентрации
ионов Ba2+
в насыщенном растворе BaSO4
(105 моль/л)
и концентрации катионов, образовавшихся
при диссоциации BaCl2 (0,01
моль/л). Ввиду того, что концентрация
ионов Ba2+
в насыщенном растворе BaSO4
на три порядка меньше, чем в растворе
BaCl2,
то ей можно пренебречь, считая, что
С(Ва2+)
= 0,01 моль/л.
Поэтому:
.
Отсюда:
Таким
образом, при осаждении сульфатов в виде
BaSO4
добав-ление BaCl2
понижает растворимость сульфата бария
и способствует более полному выведению
сульфатов из раствора.
2. Влияние
посторонних ионов.
Введение
в насыщенный раствор вещества-электролита,
не содержащего одноименных ионов с
осадком, напротив, повышает растворимость
соединения (солевой
эффект).
Причиной солевого эффекта является
усиление межионных взаимодействий,
способст-вующих переходу ионов вещества
из кристаллической решетки (твердой
фазы) в раствор.
Так,
растворимость сульфата бария в растворе
хлорида натрия
сильного электролита, не образующего
одноименных ионов с осадком
выше, чем в чистой воде.
3. Влияние кислотности
среды.
В
некоторых случаях малорастворимые соли
слабых кислот растворяются в более
сильных кислотах. Добавление сильной
кислоты повышает концентрацию ионов
H+,
которые с анионами соли образуют
малодиссоциированную слабую кислоту.
При этом концен-трация аниона понижается,
и гетерогенное равновесие смещается в
сторону растворения осадка.
Так,
малорастворимый в воде карбонат бария
легко растворяется при добавлении
соляной кислоты, поскольку из-за
протекания реакции:
2H+
+ CO32
⇄
H2CO3
⇄
СО2
+ H2O
в
растворе снижается концентрация ионов
СО32
и равновесие:
BaCO3
⇄
Ba2+
+ CO32
насыщенный
раствор
осадок
смещается
в сторону растворения осадка.
Рассмотрим
процесс растворения малорастворимого
сильного электролита, состоящего из
однозарядного катиона и однозарядного
аниона слабой кислоты KtAn
при добавлении кислоты. Подкисление
раствора приводит к частичному связыванию
аниона в малодиссоци-ированное соединение:
H+ + Аn
HAn,
поэтому
в растворе наряду с ионами Аn
появляются молекулы HАn.
Таким
образом, общая концентрация свободных
и связанных анионов составит:
С(An)
= [An]
+ [HAn].
Поскольку

то:

Отсюда:
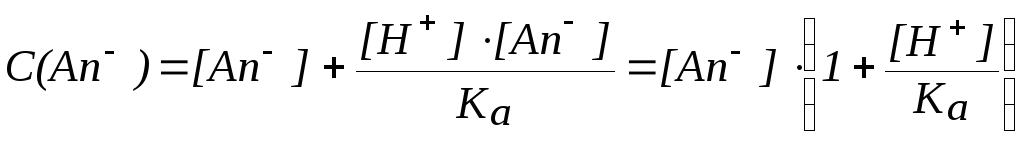
Выражение для ПР
будет иметь вид:
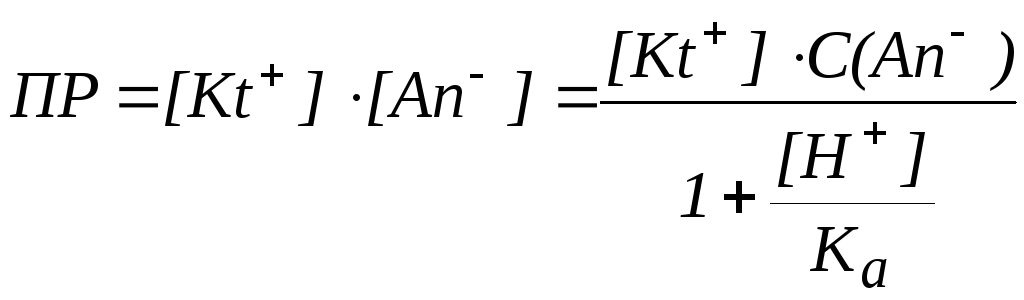
следовательно:
|
|
(4) |
Для малорастворимых
солей, образованных слабыми двух-основными
кислотами, справедливо уравнение:
|
|
(5) |
Из уравнений (4) и
(5) можно сделать следующие выводы:
Чем больше
произведение растворимости соли и чем
меньше константа диссоциации образующейся
слабой кислоты, тем больше растворяющее
действие прибавляемой кислоты на осадок.
Чем
слабее кислота, соответствующая аниону
соли (т.е. чем меньше
),
тем меньшее подкисление раствора
требуется для увеличения растворимости
соли.
Пример
5. Сравнить
растворимость нитрита серебра при pH
= 7 и pH
= 3, если
,
Решение.
Так
как в состав данной соли входит анион
слабой одноосновной кислоты, то согласно
формуле (4) при pH
= 7:
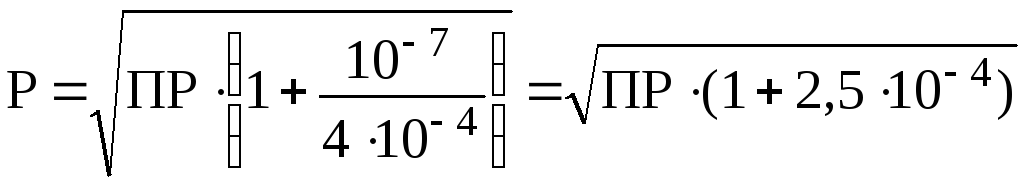
Поскольку
величина 2,5104
<< 1, то:
.
При
pH
= 3:
Таким
образом, при снижении pH
от 7 до 3 растворимость нитрита серебра
увеличивается почти в 2 раза.
Пример
6. Сравнить
растворимость оксалата и тартрата
кальция в кислой среде при одинаковом
pH,
если
,
,
,
Решение.
Оксалат
кальция (СаС2О4)
и тартрат кальция ()
имеют сопоставимые значения ПР, но при
этом:
<
Согласно
формуле (5), осадок тартрата кальция
растворится при более низкой концентрации
ионов Н+
(более высоком значении рН), чем осадок
оксалата кальция. Это означает, что при
одинаковом pH
растворимость тартрата кальция выше,
чем оксалата кальция.
Можно
привести и другие примеры, подтверждающие
справед-ливость уравнений (4) и (5).
Действительно, все карбонаты раство-римы
даже в слабых кислотах, тогда как
большинство фосфатов
только в сильных. Соли,
имеющие низкие значения ПР (например,
сульфиды), не растворимы даже в сильных
кислотах. Не растворимы в сильных
кислотах и соли, образованные анионами
сильных кислот (например, AgCl),
так как при этом не образуются
малодиссоцииро-ванные соединения.
Большинство
веществ, представляющих твердую фазу
в биосис-темах в норме и при патологии,
являются кальциевыми солями слабых
кислот и их растворимость будет
увеличиваться с повы-шением кислотности
среды. При этом легче будут растворяться
соли, образованные более слабыми
кислотами.
3. Влияние
процесса образования комплексного
соединения.
Присутствие
веществ, способных образовывать с
ионами, входя-щими в состав осадка,
прочные комплексные соединения, также
спо-собствует растворению осадка. При
этом в реакцию комплексооб-разования
вступают ионы, входящие в состав осадка,
и понижение их концентрации смещает
гетерогенное равновесие в сторону
раство-рения осадка.
Так,
малорастворимый в воде и сильных кислотах
хлорид серебра AgCl
легко растворяется в водном растворе
аммиака за счет образо-вания
малодиссоциированного комплексного
катиона [Ag(NH3)2]+:
Ag+
+ 2(NH3H2O)
[Ag(NH3)2]+
+ 2H2O.
Понижение
концентрации катионов Ag+
смещает равновесие AgCl
⇄
Ag+
+ Cl
вправо, т.е. в сторону растворения осадка.
Оба
процесса (осаждения и комплексоообразования)
характери-зуются величинами G0.
Так, для процесса осаждения, который
протекает по уравнению:
n
осадок
насыщенный
раствор
Ktm+
+ mAnn
KtnAnm(тв.)
величину
G0
можно рассчитать по уравнению:
|
|
Так
как [KtnAnm(тв.)]
= 1, а [Ktm+]∙[Ann]
= ПР, то можно записать:
|
|
(6) |
Для процесса
комплексообразования:
|
|
(7) |
где
и
константы равновесия процессов
комплексо-образования и диссоциации
комплекса, соответственно (подробнее
см. главу «Комплексные соединения»).
Из
уравнений (6) и (7) видно, что чем меньше
величина ПР или
,
тем больше убыль энергии Гиббса при
образовании, соответ-ственно, осадка
или комплекса.
Если
выполняется соотношение:
|
|
(8) |
то
вследствие выигрыша энергии произойдет
растворение осадка.
Таким
образом:
Чем
прочнее образующееся комплексное
соединение (чем больше
или меньше
),
тем больше смещено равновесие в сторону
образования комплекса, т. е. растворения
осадка.
Пример 7. Объяснить
эффект просветления раствора, содержа-щего
взвесь Zn(OH)2
в воде, при добавлении избытка щелочи.
Решение.
Просветление
раствора происходит за счет протекания
реакции:
Zn(OH)2
+ 2OH
[Zn(OH)4]2,
которая сопровождается
образованием хорошо растворимого
комп-лексного соединения.
4. Влияние
окислительно-восстановительных
процессов.
Если
в состав малорастворимого электролита
входит ион, способ-ный проявлять
окислительные (восстановительные)
свойства, то добавление соответствующего
восстановителя (окислителя) к насы-щенному
раствору этого вещества может
способствовать увеличению его
растворимости.
Так,
практически не растворимый в воде и в
сильных кислотах осадок CuS
растворяется в азотной кислоте HNO3
за счет окисления ионов S2:
NO3
+ 4H+
+ 3ē
NO + 2H2O
S2
+ 4H2O
8ē
SO42
+ 8H+
В
результате ионов S2
становится меньше, и гетерогенное
рав-новесие CuS
⇄
Cu2+
+ S2
смещается в сторону растворения осадка.
Изменение
энергии Гиббса G0
при протекании окислительно-восстановительного
процесса определяется разностью
стандартных потенциалов окислителя и
восстановителя (подробнее см. ч. IV,
глава «Электродные потенциалы на границе
раздела фаз»):
|
|
(9) |
Если
G0
окислительно-восстановительной реакции
превышает G0
процесса осаждения, то происходит
растворение осадка. Процесс растворения
осадка тем более вероятен, чем больше
разность стандартных потенциалов
окислителя и восстановителя (ЭДС), т. е.
чем более сильный окислитель применен
для растворения осадка со свойствами
восстановителя или чем более сильный
восстановитель использован для
растворения осадка со свойствами
окислителя.
Пример 8. Определить,
какой из имеющихся окислителей, КМnО4
или I2,
более эффективен при растворении осадка
СаС2О4.
Решение.
Для
растворения СаС2О4,
содержащего анион С2О42,
который проявляет свойства восстановителя,
следует взять КМnО4,
а не I2,
так как первый является более сильным
окислителем. Действительно:
;
;
,
следовательно,
в первом случае: ЭДС1 = 1,51 (0,50) =
2 В, а во втором: ЭДС2 = 0,5 (0,5)
= 1 В, т. е. в два раза меньше.
5. Влияние
конкурирующих гетерогенных равновесий.
Присутствие
в биожидкостях большого числа ионов
приводит к тому, что одновременно могут
образовываться несколько малораст-воримых
электролитов. Последовательность
выпадения осадков, в большинстве случаев,
определяется уравнением (6) и для
однотипных электролитов справедливо
правило:
Чем
меньше ПР осадка, тем раньше или при
меньшей концен-трации ионов Ktm+
или Аnn,
начнет выпадать осадок.
Пример 9. Определить
минимальные концентрации ионов Ca2+
и Sr2+,
при которых в растворе серной кислоты
с С(H2SO4)
= 0,01 моль/л образуются осадки, если
,
.
Произойдет
ли образование осадка, если концентрации
катионов одинаковы и составляют С(Ca2+)
= С(Sr2+)
= 104 моль/л?
Решение.
Концентрации
ионов кальция и стронция, при которых
из раст-вора с С(SO42) = 0,01 моль/л
начнется выпадение осадка, равны:


Следовательно,
осадок SrSO4
выпадет при меньшей концент-рации
катионов, чем осадок CaSO4.
Если
концентрации катионов одинаковы и равны
104 моль/л,
то при концентрации С(SO42) = 0,01 моль/л
будет образовываться осадок SrSO4,
а не CaSO4,
так как соотношение между
и ПР осадков различное:
;
.
В
случае конкурирующих гетерогенных
равновесий разнотипных электролитов
для установления последовательности
выпадения осадков следует сравнивать
не значения ПР, а величины раство-римостей,
расчет которых проводится по формуле
(2). Очевидно, что в первую очередь будет
выпадать осадок, который имеет наимень-шую
растворимость. Зная величины ПР, можно
выделять из смеси ка-тионов или анионов
отдельный компонент в виде осадка. Такой
под-ход лежит в основе фракционного
разделения катионов или анионов.
Пример 10. Определить,
какой из имеющихся реактивов: йодид
натрия NaI,
карбонат натрия Na2CO3
или сульфид натрия Na2S
может быть использован для отделения
магния от свинца в растворе, содержащем
одинаковые концентрации (по 0,001 моль/л)
нитратов магния и свинца.
Решение.
В
водном растворе ион Рb2+
образует с ионом I
малорастворимый осадок РbI2
(),
тогда какMgI2
хорошо растворим. Поэтому соль NaI
может быть использована для отделения
Рb2+
от Mg2+
путем
перевода свинца в осадок.
Взаимодействуя
с ионом CO32,
ионы Рb2+
и Mg2+
в обоих случаях образуют малорастворимые
соединения РbCO3
и MgCO3.
Концентрация
карбонат-ионов, необходимая для выпадения
осад-ков, составляет:
в
случае MgСО3:

в
случае PbСО3:

Если
добавлять карбонат натрия к раствору
в таких количествах, чтобы концентрация
СО32-
не превышала 0,02 моль/л, то можно оса-дить
свинец в виде PbCO3,
а магний останется в растворе.
С
ионом S2
оба катиона (Mg2+
и Pb2+)
образуют малораство-римые соединения
MgS
()
иPbS
().
Образование
осадка начнется при концентрации сульфид
ионов:
в
случае MgS:

в
случае PbS:

Из
приведенного расчета видно, что
концентрация сульфид-ионов очень мала,
поэтому поддерживать ее величину на
уровне, достаточном для выпадения осадка
одного из компонентов, практи-чески
невозможно.
Таким
образом, использовать Na2S
для отделения Рb2+
от Mg2+
нецелесообразно.