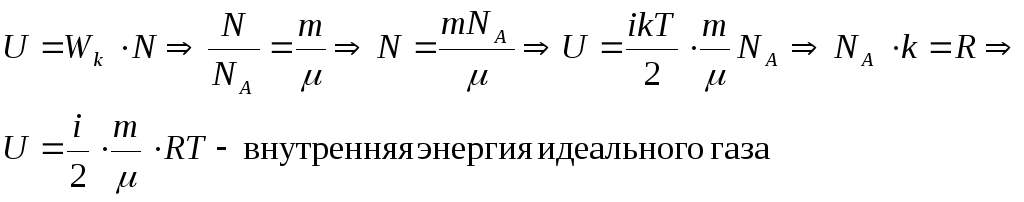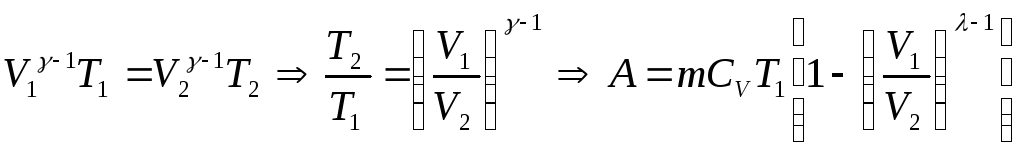Виктор Матвеевич Скоков
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Количество независимых переменных, которыми определяется состояние системы, называют числом степеней свободы. Для полной характеристики энергетического состояния движения материальной точки в момент времени t требуется задать три компоненты скорости для того, чтобы определить кинетическую энергию и три координаты, чтобы определить потенциальную энергию, получается всего необходимо шесть переменных. В случае динамического рассмотрения движения материальной точки эти переменные являются зависимыми. Статистическая система, которая состоит из n точек, имеет 6n степеней свободы. Из них 3n степеней свободы — носители кинетической энергии и 3n — носители потенциальной энергии, если система находится в поле внешних сил или частицы взаимодействуют между собой.
Степени свободы
Степени свободы делят на: поступательные, вращательные и колебательные. Три степени свободы материальной точки — поступательные. Система из n материальных точек, между которыми нет жестких связей имеет 3 n степени свободы. Каждая жесткая связь уменьшает число степеней свободы на единицу. Рассмотрим молекулу, состоящую из двух атомов, если считать, что между атомами существует одна жесткая связь, то такая молекула имеет пять степеней свободы, три поступательные и две вращательные. Если связь квазиупругая, то степеней свободы будет шесть, причем из них три поступательные, две вращательные и одна колебательная. Трехатомной нелинейной молекуле с жесткой связью между атомами нужно приписать шесть степеней свободы — три поступательные, три вращательные. Поступательные степен свободы не имеют преимуществ друг перед другом.
Средняя энергия молекулы
Согласно закону равномерного распределения энергии по степеням свободы на каждую степень свободы в среднем приходится одинаковая кинетическая энергия равная $leftlangle {varepsilon }_irightrangle =frac{1}{2}kT$. В таком случае можно сказать, что средняя энергия молекулы $leftlangle {varepsilon } rightrangle$ равна:
где $i=m_{post}+m_{vr}+2m_{kol}$- сумма числа поступательных, вращательных и удвоенного количества колебательных степеней свободы, $k$ — постоянная Больцмана, T- термодинамическая температура. Возникновение коэффициента 2 при подсчёте энергии колебаний объясняется просто: При колебаниях частица имеет как кинетическую, так и потенциальную энергии. Если колебания гармонические, то эти энергии в среднем равны друг другу. Соответственно, $leftlangle {varepsilon }_{kol}rightrangle =kT$.
Закон равномерного распределения энергии по степеням свободы является приближенным, так как получен на основе классической механики и нарушается, если существенными становятся квантовые эффекты.
«Энергия молекул» 👇
Необходимо отметить, что поступательно могут двигаться только молекулы газов.
Из(1) следует, что одноатомные молекулы имеют среднюю кинетическую энергию:
Полную энергию i частицы можно представить:
[{varepsilon }_i=frac{1}{2}m_i{v_i}^2+frac{1}{2}left(J_{i1}{w_{i1}}^2+J_{i2}{w_{i2}}^2+J_{i3}{w_{i3}}^2right)+sumlimits_j{frac{m_{ij}{{eta }_{ij}}^2}{2}}+sumlimits_j{frac{k_{ij}{{xi }_{ij}}^2}{2}}+U_ileft(x_i,y_i,z_iright) left(3right),]
где $U_ileft(x_i,y_i,z_iright)$- потенциальная энергия сложной частицы во внешних полях, ${xi }_{ij}$- отклонение от положения равновесия частицы при колебаниях, ${eta }_{ij}$- скорость колебательных движений частицы, первый индекс обозначает номер сложной частицы, второй определяет номер частицы внутри сложной, $v_i$ — скорость центра масс сложной частицы, $m_i$- масс частицы, $J_1,J_2,J_3$- моменты инерции вращения частицы, $w_1,w_2,w_3$ — угловые скорости вращения частицы относительно ее главных осей. Индекс j принимает столько значений, сколько необходимо, чтобы исчерпать все степени свободы сложной частицы.
Пример 1
Задание: Сравните средние энергии молекул кислорода и азота при одинаковых температурах.
Решение:
Кислород имеет двухатомную молекулу ($O_2)$, предположим, что связь между атомами жесткая, следовательно, молекула кислорода обладает пятью степенями свободы (тремя поступательными и двумя вращательными). Из закона равномерного распределения энергии по степеням свободы имеем средняя энергия молекулы:
[leftlangle varepsilon rightrangle =frac{i}{2}kTto leftlangle {varepsilon }_{O_2}rightrangle =frac{5}{2}kT left(1.1right)]
Азот имеет двухатомную молекулу ($N_2)$, предположим, что связь между атомами жесткая, следовательно, молекула азота также обладает пятью степенями свободы. Соответственно:
[leftlangle {varepsilon }_{N_2}rightrangle =frac{5}{2}kTleft(1.2right).]
Ответ: Средние энергии молекул кислорода и азота при одинаковых температурах одинаковы.
Пример 2
Задание: Водород находится в сосуде при температуре T=300K. Определите среднюю энергию вращательного движения молекул.
Решение:
Основой для решения задачи является закон равномерного распределения энергии по степеням свободы. Из него известно, что на каждую степень свободы приходится в среднем энергия $leftlangle {varepsilon }_irightrangle $, равная:
[leftlangle {varepsilon }_irightrangle =frac{1}{2}kT left(2.1right).]
Следовательно, чтобы решить задачу, осталось определить, сколько вращательных степеней свободы имеет молекула водорода. Для этого вспомним химическую формулу водорода:
[H_2.]
В молекуле имеется два атома, если молекула жесткая, то общее число степеней свободы такой молекулы будет равно пяти. Из них три приходятся на поступательные степени свободы, на вращательные степени свободы остается две степени. Соответственно:
[leftlangle {varepsilon }_{vr}rightrangle =frac{2}{2}kT=kTleft(2.2right)]
Проведем расчет:
[leftlangle {varepsilon }_{vr}rightrangle =1,38cdot {10}^{-23}cdot 300=4,14cdot {10}^{-21}(Дж)]
Ответ: Средняя энергия вращательного движения молекул водорода при заданных условиях равна $4,14cdot {10}^{-21}Дж$.
Пример 3
Задание: Чему равна суммарная средняя кинетическая энергия молекул двухатомного газа, заключенного в объеме 4 л при давлении 1,47 $cdot {10}^5$Па? Молекулы считать жесткими.
Решение:
Жесткие двухатомные молекулы имеют пять степеней свободы. Средняя энергия движения молекулы определяет формула:
[leftlangle varepsilon rightrangle =frac{i}{2}kTto leftlangle varepsilon rightrangle =frac{5}{2}kTleft(3.1right).]
Следовательно кинетическая энергия всех N молекул газа может быть найдена, как:
[leftlangle Erightrangle =frac{5}{2}NkT left(3.2right).]
Из уравнения состояния идеального газа:
[p=nkT, где n=frac{N}{V}to pV=NkTleft(3.3right).]
Подставим в (3.2) уравнение из (3.3), получим:
[leftlangle Erightrangle =frac{5}{2}pV left(3.4right).]
Переведем данные в СИ: V=4 л=4$cdot {10}^{-3}м^3$
Проведем расчет:
[leftlangle Erightrangle =frac{5}{2}1,47 cdot {10}^5cdot 4cdot {10}^{-3}=1470 (Дж)]
Ответ: Суммарная средняя кинетическая энергия молекул двухатомного газа при заданных условиях равна $1470 Дж.$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Внутренней энергией идеального газа – называется полная энергия всех молекул, из которых состоит идеальный газ.
Полная
энергия всех молекул складывается из
энергиивзаимодействия молекул
(потенциальная энергия) и энергии
движения (кинетическая энергия). НО для
идеального газа взаимодействия молекул
отсутствуют, поэтому, когда рассматривается
полная энергия всех молекул, мы говорим,
что полная энергия равна суммарной
кинетической энергии.
Подсчитаем,
чему равна внутренняя энергия идеального
газа:
средняя
кинетическая энергия одной молекулы.
-
Работа и теплота
Если привести в соприкосновение два
тела, то в процессе взаимодействия они
смогут обмениваться энергией, как в
той так и в другой форме. Этот обмен
различными формами энергии характеризуется
понятиями совершенной работы А и
переданного тепла Q.
Работа
есть мера переданной другому телу или
телам механической энергии. Работа сама
по себе не есть какая-либо особая форма
энергии. Совершая работу над телом, мы
меняем его энергию.
Процесс
передачи энергии от быстрых молекул к
медленным без совершения работы
сокращенно называется теплообменом.
Мера теплообмена – теплота (Q).
Теплота не является особой формой
энергией. Тепло есть мера переданному
телу или отданной им энергии хаотического
молекулярного движения.
4. Первый закон термодинамики
Первый
закон термодинамики называют законом
сохранения энергии.
1-й
закон термодинамики (первое начало).
Формулировка:
Количество тепла, подведенное к системе
равно изменению внутренней энергии
системы и работе системы, совершенной
над внешним телом.
d–полный дифференциал,неполный дифференциал (зависит от того,
как протекает процесс).
Знак
«+» ставится тогда, когда система сама
совершает работу, знак «–» – когда над
системой совершают работу.
-
Применение
первого закона термодинамики к
изопроцессам и изобарическому процессу
Задачи:
1) рассчитать работу, 2) рассчитать
внутренную энергию, 3) как будет выглядеть
1-й закон термодинамики для данного
изопроцесса.
-
Изохорический
теплоемкость
при постоянном объеме..
Сравнивая
эти две формулы можно установить, что:
-
Изобарический
Первый
закон термодинамики:
Определим
работу:
Подставим
в выражение (*) известные значения,
получим:
Это
соотношение можно выразить через
изменение температуры:
Продифференцируем:
,
подставим и получим:
связь
между теплоемкостями при Р-constиV-const–
уравнение Майера.
-
Изотермический
Из
уравнения Клапейрона–Менделеева:
выразим Р и подставим в этот интеграл:
-
Адиабатический
(адиабатный)
Процесс,
протекающий без теплообмена с окружающей
средой, называется адиабатическим.
Выведем
уравнение адиабатического процесса:
Подставим
известные значения:
Разделим
обе части на mиT:
Перенесем
слагаемое и проинтегрируем:
Пусть
,
тогда
уравнение
адиабатического процесса (уравнение
Пуассона).
.
Работа
при адиабатного процессе:
Учебные
наглядные пособия:
Демонстрации:
1.
Работа пара при нагревании воды
в пробирке
П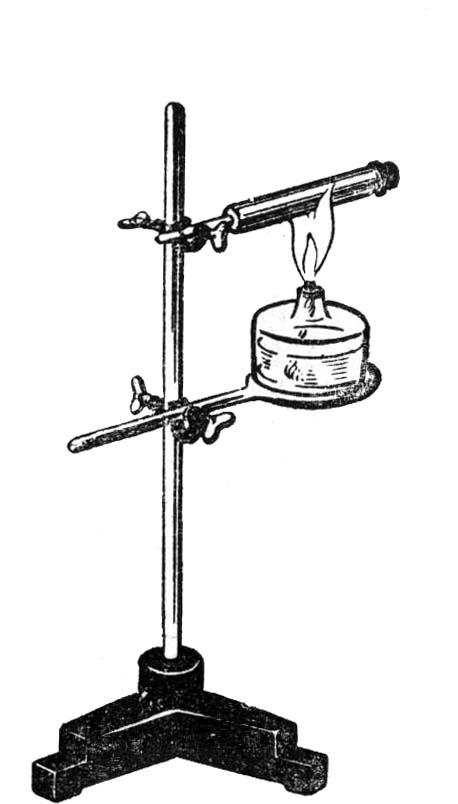
и проведение опыта
Собрать
штатив универсальный. В муфте прямоугольной
(сверху) вертикально укрепить пробирку,
затем слегка наклонить ее. В пробирку
налить 2-3 мл воды. Пробку смочить в воде
и закрыть пробирку. В муфте прямоугольной
(снизу) закрепить трехпалую лапку, в
которой укрепить свечу таким образом,
чтобы нижняя часть пробирки находилась
в пламени свечи. Нагревать пробирку.
При нагревании пробка вылетает — пар
совершает работу.
2.
Адиабатное расширение
П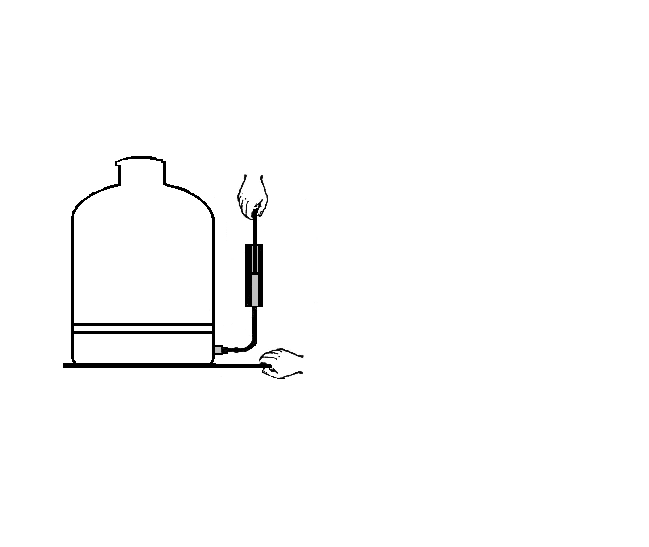
и проведение опыта
В
сосуд добавить воды и спирта. Смочить
пробку водой. Плотно, но не сильно,
закрыть сосуд (верхняя горловина).
Накачать воздух в сосуд (20-30 движений).
При определенном давлении в сосуде –
пробка вылетает из горловины, а в сосуде
образуется “туман”.
Раздел:
Молекулярная физика и термодинамика
Лекция
№ 10
Основы
термодинамики
Основные вопросы, рассматриваемые на
лекции:
-
Обратимый
и необратимый процессы. -
Тепловые
машины. -
Цикл
Карно и его КПД. -
Второй
закон термодинамики.
Краткое содержание
лекционного материала
-
Обратимый
и необратимый процессы
Процесс
– переход системы из одного состояния
в другое. Эти процессы осуществляются
по-разному, поэтому они и разнообразны.
1
2
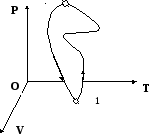
состояние). Кривая называется фазовая
траектория.
Если
процесс можно провести в обратном
порядке, т.е. система возвратиться в
исходное состояние, и в окружающей среде
не происходит никаких изменений, то
процесс называется обратимым, а
когда система не возвращается в исходное
состояние, то процесс называютнеобратимым.
При
обратимом процессе система проходит
те же точки фазовой траектории, что она
проходила и в прямом процессе (иначе
круговом).
Пример:
Рассмотрим работу поршня. Процесс
поднятия поршня бесконечен. Расширение
газа в цилиндре под поршнем будет
обратимым, если этот процесс производить
бесконечно медленно.
При
круговом процессетраектория –
замкнутая кривая. Круговой процесс
может быть обратимым. Круговой процесс
называютциклом.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Кривая потенциальной энергии молекулы. Основные характеристики химической связи. Химические свойства а томов, выражающиеся в способности вступать во взаимодействие друг с другом, объясняются состоянием содержащихся в атомах электронов. Главную роль играют подвижные валентные электроны внешних оболочек. Специфическое взаимодействие валентных электронов разных атомов начинает проявляться лишь при достаточном сближении последних. Результатом взаимодействия может быть притяжение или отталкивание атомов. Естественно, возникновение химической связи возможно только в первом случае, ому случаю соответствует уменьшение потенциальной энергии по мере сближения атомов и минимальное ее значение при образовании устойчивой молекулы. Принцип максимального уменьш е н ия энергии при образовании молекул из атомов лежит в основе количественных теорий химической, связи. Центральная задача теории состоит в вычислении энергии молекулы. [c.16]
В качестве примера рассмотрим вычисление энергии молекулы бутадиена в приближении МОХ. Умножая матрицу А (8.32) на матрицу Р (8.79) и суммируя диагональные элементы, получим [c.293]
Электронная энергия связи составляет около 14% от полной электронной энергии (для большого числа молекул она еще меньше) и для точной ее оценки необходимы очень точные вычисления энергии молекулы и энергии разделенных атомов. [c.93]
ВЫЧИСЛЕНИЕ ЭНЕРГИИ МОЛЕКУЛЫ [c.162]
Для такой молекулы, как НС1, а-связывающая орбиталь образуется как линейная комбинация ls-орбитали водорода и Зр-орбитали хлора. В такую комбинацию Зр-орбиталь хлора должна войти с большим весом, потому что в этом случае вычисленная энергия молекулы оказывается более низкой. Электронную формулу этой молекулы, на основании приведенных соображений, можно записать следующим образом [c.125]
Таким образом, теория валентности представляет собой е основном теорию вычисления энергии молекулы. Следует, од-нако, различать несколько видов энергии. Так, помимо полной электронной энергии молекулы, можно говорить об электронной энергии атомов, составляющих молекулу разность этих величин и дает электронную энергию связи молекулы. Эта последняя величина не совпадает с энергией диссоциации (т. е. с энергией, необходимой для разрыва молекулы на составляющие ее атомы). Для нахождения последней следует учесть три дополнительных эффекта 1) нулевую колебательную энергию, которая для больших многоатомных молекул может достигать величины, сравнимой с энергией отдельной связи, хотя для двухатомных молекул их отношение обычно имеет порядок 0,1—0,05 [c.20]
В ЭТОМ выражении W — вычисленная энергия молекулы Н — оператор Гамильтона (гамильтониан) для данной молекулярной системы т — элементарный объем. Гамильтонианы содержат такие члены, как д 1дх , д 1ду , д 1дг , и обычно представляют собой довольно сложные математические выражения, форма которых зависит от характера рассматриваемой системы. Однако для наших целей нет необходимости определять точную математическую форму гамильтониана достаточно только уяснить, что над функцией, перед которой стоит символ Я, должна быть произведена определенная математическая операция. [c.38]
Если бы можно было определить значения различных интегралов, то это уравнение дало бы квантовомеханический способ вычисления энергии молекулы воды. К сожалению, результаты являются еще недостаточно точными, чтобы иметь количественное значение, но в то же время изучение этого уравнения с качественной стороны может дать ценные сведения о величине валентного угла кислорода. [c.139]
Мы не будем углубляться здесь в дальнейшее рассмотрение энергий связей, так как с их помощью нельзя получить никаких новых сведений. Исключение в этом случае составляют молекулы типа окиси углерода, в которых, по крайней мере, один нз элементов обнаруживает ненормальную валентность. (См. последний абзац 3.3.) Действительно, неяссредственное использование теплот сгорания не только более удобно, поскольку оно не требует ненужной стадии вычисления энергий молекул, но позволяет также избежать некоторых более существенных трудностей, связанных с использованием уравнений 3—6 и 8—15. Дело в том, что точность некоторых величин, приведенных в этих уравнениях, может быть поставлена под сомнение. Так, в теплоте сублимации алмаза возможная ошибка может быть больше 25 ккал/г-атом в ту или иную сторону. Поэтому значения энергий связей иногда недостоверны. Однако эти обстоятельства совсем не сказываются на изложенном способе расчета энергий резонанса, так как значения величин, найденные для энер- [c.118]
Введение в вычисление общей энергии молекул N2 небольшой доли орбиталей 3 дало вклад в ДЯ диссоциации, равный 69 ккал моль. Поправка на участие 4/-состояния для N2 равна 7 ккал моль вместе с тем энергия корреляции электронов отвечает также очень большому вкладу в энергию диссоциации молекул N2, равному 114 ккал моль. Таким образом, без учета корреляции движений электронов оказывается совсем невозможным сколько-нибудь правильное вычисление энергии молекул азота. [c.333]
Теоретическим путем энергия разрыва данной связи, например энергии связи К]—Кг в молекуле К1Кг, может быть вычислена как разность энергий частиц К] и Кг и молекулы К1Кг- Средняя энергия связей определяется из теплоты атомизации, вычисляемой как разность энергии всех входящих в состав данной молекулы атомов и энергии молекулы. Таким образом, теоретическое определение энергий связей 1в конечном итоге сводится к вычислению энергии молекул, т. е. к расчету молекул. [c.20]
Некоторые особенности сумм по состояниям и методы вычисления. Энергия молекул идеального газа, рассмотрением которого мы и ограничимся, слагается из поступательной энергии и внутримолекулярной. К последней относят вращательную, колебательную и электронную энергию, а также нулевую энергию и энергию спинов. Нулевая энергия обусловлена энергией химических связей в молекуле и тем обстоятельством, что при Т = О колебательная энергия не обращается в нуль, а лишь достигает минимума. Энергия спинов соответствует той энергии, которая связана с определенной ориентацией магнитных моментов ядер атомов в дальнейшем мы не будем принимать ее в расчет. [c.181]
Энергаю связи Dg можно определить в теории различными способами. Первый из них основан на вычислении энергии молекулы при различных межьядерных расстояниях R, в том числе и в пределе R .Разность энергий [ (/ — ) — E(R = i e)]n будет представлять энергию связи. Другой способ основан на вычитании из суммы энергий свободных атомов, в данном примере из Ео( л , S) + o(H S) энергии молекулы UH при R =Rg. Для точной волновой функции оба определения должны приводить к одинаковым числовым значениям Dg. Для приближенных волновых функций это не так. [c.227]
Энергия молекулы и энергия диссоциации. Энергия молекулы вычис-, ляется с большой точностью. Однако точность эта не всегда достаточна для расчета энергии диссоциации, которая есть разность двух больших и близких величин — полной энергии молекулы и суммы энергий составляющих ее атомов. Поэтому небольшие ошибки в вычисленных энергиях, молекул и атомов оказываются существенными при расчете энергии диссоциации. Как видно из табл. 13, для молекулы СО расчет аЬ initio с волновой функцией, построенной на расширенном базисе, дал энергию, равную —112,786 ат. ед., вместо экспериментальной —113,377 ат. ед. Ошибка невелика, всего 0,52%, но она приводит к тому, что рассчитанное значение i>o( O) = 7,84 эВ ниже экспериментального Г>о(СО) = 11,108 эВ. Поэтому в настоящее время расчет энергии диссоциации многих простых молекул не достигает точности экспериментальных методов. [c.152]
Вид пробной функции (4.24) определяет возможность применения вариационного метода Ритца для вычисления энергии молекулы и коэффициентов С] и Сг- Система уравнений (1.67) в данном случае [c.101]
Так как энергия диссоциации моля На равна 103/с/сал, то энергия корреляции составляет от этой величины около 13,2%, что весьма заметно. Кроме энергии корреляции, не входящей в решение уравнения Шрёдингера, по Хартри — Фоку при вычислении энергии молекулы Н г вводится еще обменный интеграл (или энергия пре-корреляции), имеющий также прямое отношение к динамическим столкновениям электронов в области перекрывания, и интеграл этот весьма велик (Г7 оказывается, что суммарный эффект корреляции весьма весом в общем балансе определения энергии связи. [c.162]
В. А. Бакаев (Институт физической химии АН СССР, Москва). Вычисление энергии молекулы вблизи полярной поверхности при тех допущениях, которые сделаны в первой части доклада Я. Коутецки в др., т. е. при учете только члена по существу эквивалентно вычислению [c.84]
В. А. Бакаев (Институт физической химии АН СССР, Москва), вычисление энергии молекулы вблизи полярной поверхности при тех допущениях, которые сделаны в первой части доклада Я. Коутецки и др., т. при учете только члена АЕу, по существу эквивалентно вычислению распределения электронной плотности невозмущенной молекулы р (г ) методом квантовой химии, а затем расчету энергии взаимодействия этого цлектронного облака с электростатическим полем адсорбента (обозваче-ния те же, что и в докладе) [c.84]
Согласно принципу Франка — Кондона, в процессе возбуждения происходит изменение только электронной конфигурации растворенной молекулы и окружающих ее молекул растворителя без изменения конфигурации ядер. Конечное возбужденное состояние при этом называют франк-кондоновским возбу/кденным состоянием. В указанном состоянии поле реакции частично обусловлено ядерной конфигурацией молекул растворителя (которая определяется дипольным моментом молекул растворителя в основном состоянии) и частично электронной конфигурацией молекул растворителя (которая определяется дипольным моментом в возбужденном состоянии). Таким образом, для вычисления энергии молекулы во франк-кондоновском возбун<денном состоянии поле [c.182]
В кратных связях между атомами, отличающимися по электроотрицательиости, в значительной степени, имеет ме-сто резонанс с ионными состояниями. Поэтому можно ожи-. дать, что соседние связи будут влиять на кратные связи, в отношении степени ионного характера сильнее, чем на орди-. нарные связи с небольшой степенью ионного характера, В действительности, оказывается, что значения энергии кратных связей, вычисленные из разных соединений, сильно варьируют. Это было до некоторой степени принято во внимание при составлении таблиц для энергий связей, поэтому Для ряда связей приведено несколько значений. Это обстоятельство может привести к ббльшим ошибкам при вычислении энергии молекул, содержащих кратные связи, чем для молекул, содержащих только ординарные связи. [c.135]
Формулы молекулярной физики
Формула концентрации молекул
Здесь n — концентрация 

Формула плотности
Здесь 


Формула относительной молекулярной массы
Здесь 


Формула количества вещества (количества молей)
Здесь v — количество вещества (количество молей) (моль), m — масса вещества (кг), М — молярная масса (кг/моль).
Формулы массы одной молекулы
Здесь 




Формулы количества молекул
Здесь A — количество молекул (безразмерное), п — концентрация молекул 




Формулы средней квадратичной скорости молекул
Здесь 


Основное уравнение кинетической теории идеального газа
Здесь р — давление газа (Па), 



Формула средней кинетической энергии молекул
Здесь 


Связь шкал Цельсия и Кельвина
Здесь Т — абсолютная температура (К), t — температура по шкале Цельсия.
Связь средней кинетической энергии молекул идеального газа с абсолютной температурой
Здесь 
У равнение состояния идеального газа — уравнение Клапейрона — Менделеева
Здесь р — давление газа (Па), V — объем 


Объединенный газовый закон — уравнение Клапейрона
при
Здесь 



Закон Бойля — Мариотта (изотермический процесс)
при
Здесь Т — абсолютная температура газа (К), m — масса газа (кг), 



Закон Гей-Люссака (изобарный процесс)
при
Здесь р — давление газа (Па), m — масса газа (кг), 




Закон Шарля
при
Здесь V — объем газа 


Связь давления идеального газа с концентрацией его молекул и температурой
Здесь р — давление газа (Па), к — постоянная Больцмана (Дж/К), п — концентрация молекул газа 
Формулы относительной влажности
Здесь 



Работа при изобарном изменении объема газа
Здесь А — работа (Дж), р — давление газа (Па), 


Внутренняя энергия идеального одноатомного газа
Здесь U — внутренняя энергия газа (Дж), m — масса газа (кг), М — молярная масса газа (кг/моль), R — молярная газовая постоянная (Дж/(моль • К), Т — абсолютная температура (К), v — количество вещества или число молей (моль), 

Первый закон термодинамики
Здесь Q — количество теплоты, переданное термодинамической системе (Дж), 
Применение первого закона термодинамики к термодинамическим процессам
к изотермическому: при
к изохорному: при V = const
к изобарному: при р = const
к адиабатному: при Q = 0
Здесь Т — абсолютная температура (К), 

Формулы количества теплоты при нагревании или охлаждении тел
Здесь Q — количество теплоты, переданное телу при нагревании или отданное им при охлаждении (Дж), с — удельная теплоемкость вещества (Дж/(кг • К), т — масса тела (кг), 





Формула количества теплоты при плавлении или кристаллизации
Здесь Q — количество теплоты (Дж), т — масса тела (кг), 
Формула количества теплоты при парообразовании или конденсации
Здесь Q — количество теплоты (Дж), m — масса тела (кг), r — удельная теплота парообразования (Дж/кг).
Формула количества теплоты при сгорании топлива
Здесь Q — количество выделившейся теплоты, m — масса топлива (кг), q — удельная теплота сгорания (Дж/кг).
Коэффициент полезного действия теплового двигателя
Здесь 



Коэффициент полезного действия идеального теплового двигателя
Здесь 


Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Задачи по физике с решением
Возможно вам будут полезны эти страницы: