Титр раствора. Формула для его расчета достаточно проста и чем-то напоминает формулу для расчета плотности раствора, так как выражается в тех же единицах.
Титр раствора: формула для расчета
Титр – один из способов выражения количественного состава раствора. Является основной концентрацией в титриметрическом анализе.
Титр (Т) – это масса вещества (в граммах), которая содержится в 1 мл (1 см3) раствора.
Например, титр раствора азотной кислоты равен 0,005672 г/мл. Это означает, что в каждом одном миллилитре раствора содержится 0,005672 г азотной кислоты.
Переход от титра раствора к другим видам концентраций
В титриметрическом анализе применяются и другие концентрации: молярная (См) и нормальная (Сн). Между ними и титром существует взаимосвязь: можно от одной концентрации перейти к другой. Например, взаимосвязь титра и молярной концентрации.
Для См объем измеряется в литрах (л) , для Т – в миллилитрах (мл), то есть в 1000 раз меньше. Учтем это и получим:
Аналогичные преобразования можно провести и с нормальной концентрацией (Сн). В результате получим:
Титр связан и с массовой долей растворенного вещества:
Титр раствора: формула и примеры расчетов
Приведем конкретные примеры вычисления титра раствора и других концентраций, связанных с ним.
Пример 1. Какая масса азотной кислоты содержится в 500 мл раствора, если его титр равен 0,00630 г/мл?
Пример 2. В 1 кг воды растворили 250 г NaOH. Плотность полученного раствора равна 1,219 г/мл. Какова массовая доля NaOH, титр, молярная и нормальная концентрации раствора щелочи.
Пример 3. Титр раствора HCl равен 0,003592 г/мл. Вычислите его нормальную концентрацию.
Пример 4. Нормальная концентрация раствора H2SO4 составляет 0,1205 н. Определите его титр.
Пример 5. Какова нормальная концентрация раствора H2C2O4·2H2O, полученного растворением 1,7334 г ее в мерной колбе вместимостью 250 мл?
Пример 6. Питьевую соду массой 4,2 г растворили в дистиллированной воде. Объем раствора составил 200 мл. Каковы титр и молярная концентрация полученного раствора?
Пример 7. В 100 г раствора (ρ = 1г/мл) хлорида цинка ZnCl2 содержится 5 г соли. Определите титр, массовую долю, молярную и нормальную концентрации раствора.
Таким образом, зная титр раствора, формулу для вычисления его значения, можно перейти к другим видам концентрации раствора, и наоборот.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Как вычислить титр
Очень часто в химическом анализе вместо массовой концентрации используется титр раствора, который показывает содержание любого вещества в одном миллилитре раствора. Для записи титра принято условное обозначение в виде заглавной латинской буквы t. А единицей его измерения является г/мл .

Вам понадобится
- — бумага;
- — ручка;
- — калькулятор.
Инструкция
Для нахождения титра по растворенному веществу (простой титр) воспользуйтесь формулой:T = m/V,где T – титр; m – масса вещества, растворенного в жидкости, V – объем раствора в миллилитрах или кубических сантиметрах.
Кроме этого, титр вы сможете вычислить по определяемому веществу. Эту величину еще называют условным титром. Для этого понадобится формула: T (a/b) = mb/ Va,где Т (a/b) — титр раствора вещества a по веществу b; mb – масса вещества b(в граммах), которое взаимодействует с данным раствором; Va – объем раствора вещества a (в миллилитрах).
Например, нужно найти титр раствора фосфорной кислоты массой 18 г, полученного при растворении Н3РО4 в 282 миллилитрах воды. Плотность раствора равна 1,031 г/мл. Для начала найдите массу, приготовленного раствора, учитывая при этом, что 282 мл воды будут равны 282 г: 28+282 = 300 (г). Затем, посчитайте его объем: 300/ 1,031 = 291 (мл). Теперь подставьте в формулу и найдите титр: 18/291 = 0,0619(г/мл).
Помимо выше описанных методов, вы также можете вычислить титр, зная эквивалентную массу и нормальность (эквивалентную концентрацию).T = Сн*Mэкв/1000,где T – титр, Cн – нормальность, Mэкв – эквивалентная масса.
Нередко вы столкнетесь с задачами, в которых потребуется выразить титр одного вещества через другое. Например, дано условие: на титрование 20 мл раствора соляной кислоты с титром 0,0035 г/мл было потрачено 25 мл раствора гидроксида натрия. Надо вычислить титр NaOH по HCl.
Сначала запишите уравнение реакции: NaOH + HCl = NaCl + H2O. Затем вычислите титр раствора щелочи по формуле: T (NaOH) =T(HCl)*V(HCl)*M(NaOH) / M(HCl)*V(NaOH). Подставив цифровые значения, получите титр гидроксида натрия равный 0,0031 г/мл. Осталось вычислить необходимое для решения задачи значение:T (NaOH/HCl) = T(NaOH)* Мэкв(HCl) / Мэкв(NaOH) =0,0028 г/мл
Полезный совет
Не смотря на одинаковые единицы измерения, никогда не путайте титр раствора с его плотностью. Ведь величина плотности показывает массу одного кубического сантиметра раствора, а не массу растворенного вещества в нем.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Концентрацию
растворов, применяемых в титриметрии,
выражают не только через моль-экв/л
(нормальность), но и через титр раствора
(
)
и титр по определяемому веществу
(
).
Эти концентрации более удобны, так как
непосредственно позволяют вычислять
массу определяемого компонента по
результатам титрования. Формулы,
приведенные в стандартных методиках
титриметрического анализа, предназначенных
для большого числа однотипных измерений,
содержат значение титра по определяемому
веществу
.
Титр вещества
или простой
Титр вещества
показывает содержание компонента
А, выраженное в граммах, в 1
мл его раствора и вычисляется по
формуле:
=
(4.8)
где
– масса вещества А (г) в растворе с
объемом
(мл),
– его титр в г/мл.
Иногда титр для
удобства в расчетах выражают в мг/мл.
Через простой титр легко рассчитать
молярную концентрацию (молярность) или
молярную концентрацию эквивалента
(нормальность) раствора, подставив туда
выражение массы вещества через титр.
и
(4.9)
Пример. Пусть
в растворе соли, объемом 250 см3
содержится 0,5 г
.
Определить титр и нормальность такого
раствора.
Исходя из формул
(4.8) и (4.9), Т(Na2CO3)
= 0,005/250 =
(г/мл),
а нормальность:
=
1000/53
=
(моль-экв/л), где 53 – молярная масса
эквивалента
(г-экв/моль).
Титр по
определяемому веществу
(условный)
Титр по определяемому
веществу
или условный показывает какое
количество вещества А (г)
эквивалентно массе титранта В,
которая содержится в 1 мл раствора
титранта В. Так как масса
титруемого вещества А и объем раствора
В относятся к разным веществам, то
размерность такого титра не указывается.
Титр по определяемому веществу
(условный) позволяет вычислить какое
количество вещества А в
граммах титруется 1-м миллилитром
титранта В.
=
(4.10)
Между титрами Т(В)
и
существует простая связь, вытекающая
из закона эквивалентов. Ее легко получить,
учитывая, что
m(В)
=
и m(А) =
,
где V(B)
в мл – объем раствора В, пошедший
на реакцию (титрование) с веществом А;
m(В) – масса вещества
реагента В (титранта), m(А)
– масса вещества А, эквивалентная
массе реагента В в его растворе
объемом V(B).
или
(4.11)
Тогда молярная
концентрация эквивалента (нормальность)
раствора В через значение
может быть определена как:
(4.12)
Если для рабочего
раствора В известно значение
,
то масса определяемого компонента А
(г) в пробе объемом
легко вычисляется по объему раствора
титранта
,
израсходованному на титрование аликвоты
:
(4.13)
4.4. Классификация растворов, применяемых для титрования и способы их приготовления.
В титриметрии
используют растворы, концентрация
которых установлена каким-либо способом
с высокой степенью точности. Такие
растворы называют стандартными
титрованными или просто
титрованными. Растворы
классифицируют по назначению и по
способу установления их концентрации.
По назначению
их условно делят на рабочие растворы
и растворы стандартов (первичные
и вторичные).
Рабочими
называют растворы, которые используются
непосредственно в анализе при определении
содержания вещества. Если рабочий
раствор не относится к стандартным, то
его необходимо отстандартизировать
непосредственно перед выполнением
анализа, так как концентрация в
процессе хранения могла существенно
измениться. Точную концентрацию рабочего
раствора находят путем титрования
стандартного раствора или установочных
веществ (метод точных навесок). Это
касается, например, таких рабочих
растворов, как: NaOH,
Na2S2O35H2O.
Под стандартным
раствором понимают такой титрованный
раствор, который устойчиво сохраняет
свою концентрацию при длительном
хранении. Основное назначение
стандартных растворов
определение точной концентрации рабочих
и иных растворов, применяемых в титровании.
Процесс установления
точной концентрации раствора путем его
титрования по стандарту называется
стандартизацией.
По способу
определения концентрации различают
первичные стандарты или
растворы с приготовленным титром и
стандартизированные растворы.
Стандартизированные
растворы это
такие растворы, концентрация которых
устанавливается по стандарту и заранее
не может быть точно определена. К ним
относятся растворы кислот, щелочей,
гидролизующихся и гигроскопичных солей,
а также веществ, которые могут реагировать
с атмосферным кислородом и углекислотой.
Известно множество способов
приготовления стандартизированных
растворов. Наиболее часто для этой цели
применяют: приготовление по приближенной
навеске (щелочи, соли), методы разбавления
или смешения растворов (кислоты, соли),
методы ионного обмена (растворы солей).
Стандартные
растворы классифицируют по
способу определения их концентрации.
Различают: первичные стандарты
или растворы с приготовленным титром
и вторичные стандарты
растворы с установленным титром.
Первичные
стандарты это
растворы, которые готовят либо по
точной навеске вещества (рис. 4.10),
либо путем разведения специально
приготовленных стандартизированных
реагентов – фиксаналов (рис. 4.11).
Фиксанал представляет собой стеклянную
запаянную ампулу, выпускаемую
промышленностью и содержащую строго
нормированное количество реагента,
обычно рассчитанного на 1 л 0,1 н. раствора.
Приготовление
раствора по точной навеске
начинают с расчета ее массы по заданной
концентрации (титру или нормальности)
и объему колбы. Навеску стандартного
вещества взвешивают на аналитических
весах с точностью до 1104
г и количественно переносят в мерную
колбу, где ее растворяют при перемешивании
(рис. 4.10).
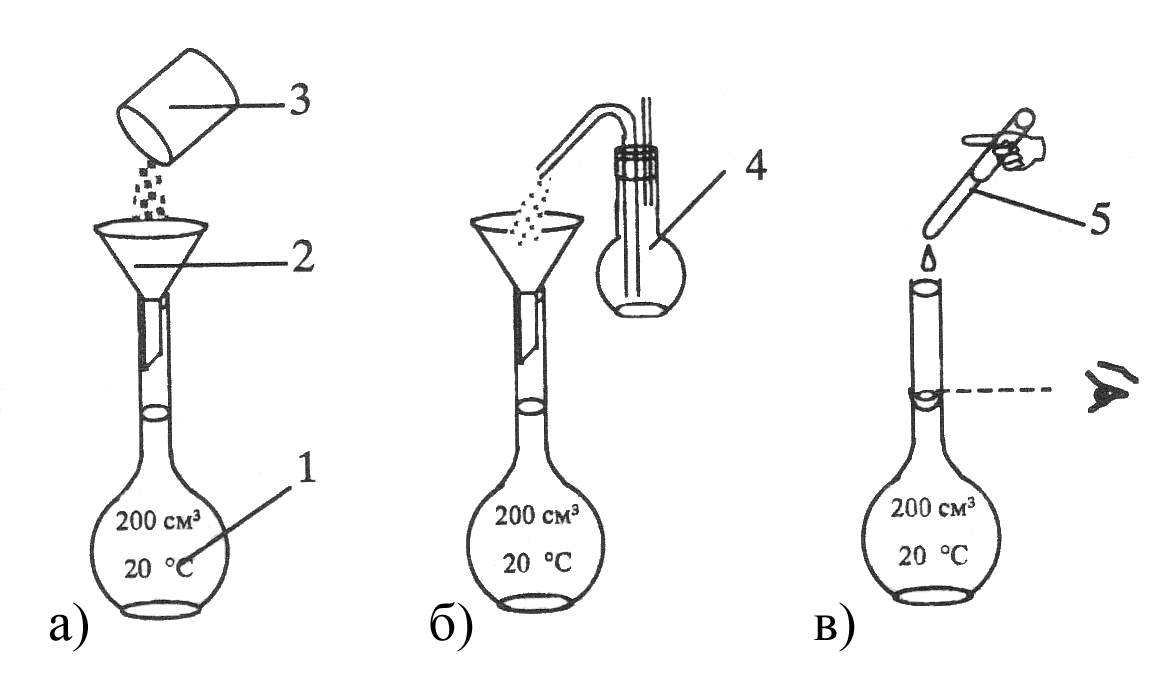
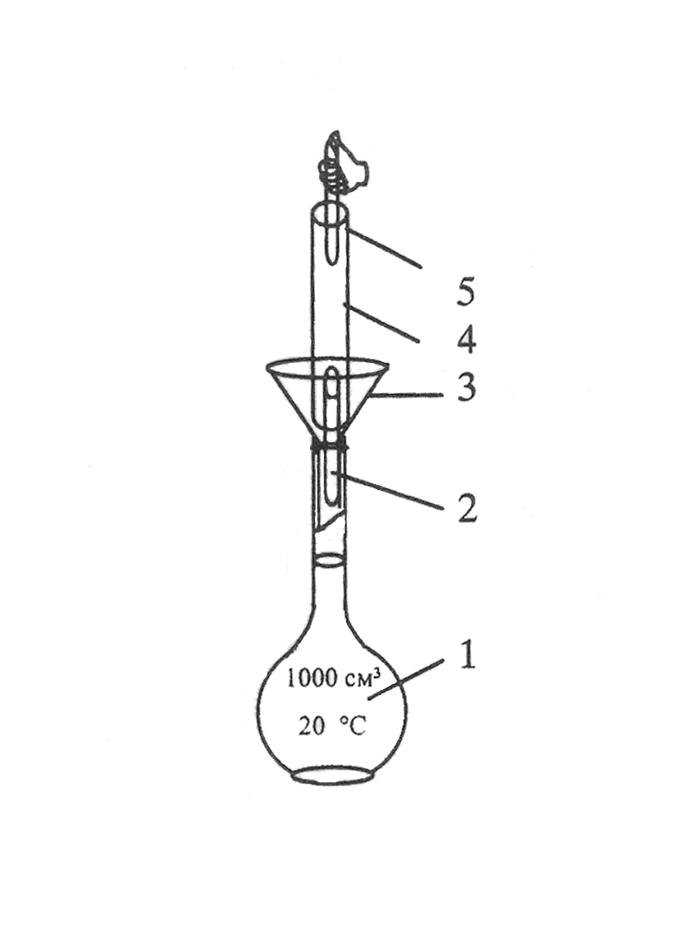
Рисунок 4.10 –
Порядок операций при приготовлении
раствора первичного
стандарта по точной
навеске: 1 – мерная колба Мора; 2 –
воронка;
3 – бюкс с навеской
вещества; 4 – промывалка с дистиллированной
водой;
5 – пипетка или
капельница.
а – перенос навески
вещества в мерную колбу; б – ополаскивание
воронки;
в – доведение
объема раствора стандарта до метки.
Этим методом обычно
готовят растворы солей, таких как бура
(Na2B4O710H2O),
K2Cr2O7.
Количество вещества в растворе находят
или по значению точно взятой массы
навески (при ее переносе необходимо
тщательно промыть бюкс), или рассчитывают
методом разности, определяя точную
массу бюкса сначала с навеской, а затем
– пустого, уже после переноса вещества
в колбу. В случае необходимости
концентрацию раствора заново пересчитывают
с учетом фактически взятой массы навески.
Порядок приготовления
раствора методом разведения из
фиксанала показан на рисунке 4.11. Чтобы
стандарт, полученный этим методом, был
качественным и отвечал всем требованиям,
необходимо исключить потери вещества
при вскрытии ампулы и переносе его в
колбу, а также следить, чтобы осколки
ампулы не попали в раствор. Это во многом
зависит от правильности обращения с
ампулой.
Рисунок 4.11 – Способ
приготовления растворов первичного
стандарта
методом разведения
из фиксанала: 1 – мерная колба Мора на
1л;
2 – нижний боек; 3
– воронка; 4 – ампула фиксанала; 5 –
верхний боек.
Перед использованием,
ампулу следует ополоснуть дистиллированной
водой и только затем ее вскрывать
специальным бойком. Сразу же после
переноса вещества в колбу, нужно тщательно
промыть ампулу дистиллированной водой,
не менее, чем 6-ти кратным ее объемом.
Этот метод приготовления первичного
стандарта проще, чем по точным навескам,
но уступает ему в точности. Его используют
не только для получения растворов солей,
но и различных кислот.
Так как для
приготовления раствора первичного
стандарта пригодны только точная
мерная посуда и аналитические весы,
то и к веществам, применяемым для этой
цели, предъявляют ряд обязательных
требований. В качестве первичного
стандарта можно использовать только
такие реактивы, которые характеризуются:
-
высокой чистотой
(обычно не хуже, чем 99,99 – 99,999%
квалификации ч.д.а. и о.с.ч.); -
точным соответствием
формульному составу и относительно
высокой молекулярной массой; -
устойчивостью
при хранении как в твердом виде,
так и в растворе (отсутствие процессов
гидратации, гидролиза, окисления и
карбонизации); -
простотой в
приготовлении и хорошей растворимостью; -
необратимостью
реакции при стандартизации, селективностью; -
возможностью
точной фиксации Т. Э. каким-либо методом.
Вторичным
стандартом называют такие
стандартизированные растворы,
которые устойчивы при хранении и могут
быть использованы для стандартизации
других растворов.
Вторичные стандарты
готовят как растворы приблизительной
концентрации любым известным методом,
а перед употреблением
определяют их точную концентрацию
путем стандартизации по
первичному стандарту. Поэтому при
приготовлении вторичных стандартов не
требуется высокая точность измерения
массы вещества или объема раствора, как
в случае первичных стандартов. Для этой
цели вполне пригодны технохимические
весы и неточная мерная посуда
(цилиндры, мензурки, градуированные
пробирки).
Примером раствора,
обладающего свойствами вторичного
стандарта, является соляная
кислота. Ее разбавленные растворы
могут храниться длительное время, до
1-го месяца и более, без заметного
изменения концентрации. Бура,
используемая в протолитометрии для
стандартизации HCl, относится
к первичным стандартам и готовится
по точной навеске. Тогда, как рабочий
раствор NaOH –
свойствами стандарта не обладает вообще
и его концентрацию приходится
устанавливать заново при каждом
использовании.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Совет 1: Как вычислить титр
Дюже зачастую в химическом обзоре взамен массовой концентрации применяется титр раствора, тот, что показывает оглавление всякого вещества в одном миллилитре раствора. Для записи титр а принято условное обозначение в виде заглавной латинской буквы t. А единицей его измерения является г/мл .
Вам понадобится
- – бумага;
- – ручка;
- – калькулятор.
Инструкция
1. Для нахождения титр а по растворенному веществу (примитивный титр ) воспользуйтесь формулой:T = m/V,где T – титр ; m – масса вещества, растворенного в жидкости, V – объем раствора в миллилитрах либо кубических сантиметрах.
2. Помимо этого, титр вы сумеете вычислить по определяемому веществу. Эту величину еще называют условным титр ом. Для этого потребуется формула: T (a/b) = mb/ Va,где Т (a/b) – титр раствора вещества a по веществу b; mb – масса вещества b(в граммах), которое взаимодействует с данным раствором; Va – объем раствора вещества a (в миллилитрах).
3. Скажем, необходимо обнаружить титр раствора фосфорной кислоты массой 18 г, полученного при растворении Н3РО4 в 282 миллилитрах воды. Плотность раствора равна 1,031 г/мл. Для начала обнаружьте массу, приготовленного раствора, рассматривая при этом, что 282 мл воды будут равны 282 г: 28+282 = 300 (г). После этого, посчитайте его объем: 300/ 1,031 = 291 (мл). Сейчас подставьте в формулу и обнаружьте титр : 18/291 = 0,0619(г/мл).
4. Помимо выше описанных способов, вы также можете вычислить титр , зная равнозначную массу и нормальность (равнозначную концентрацию).T = Сн*Mэкв/1000,где T – титр , Cн – нормальность, Mэкв – равнозначная масса.
5. Зачастую вы столкнетесь с задачами, в которых понадобится выразить титр одного вещества через другое. Скажем, дано условие: на титр ование 20 мл раствора соляной кислоты с титр ом 0,0035 г/мл было потрачено 25 мл раствора гидроксида натрия. Нужно вычислить титр NaOH по HCl.
6. Вначале запишите уравнение реакции: NaOH + HCl = NaCl + H2O. После этого вычислите титр раствора щелочи по формуле: T (NaOH) =T(HCl)*V(HCl)*M(NaOH) / M(HCl)*V(NaOH). Подставив цифровые значения, получите титр гидроксида натрия равный 0,0031 г/мл. Осталось вычислить нужное для решения задачи значение:T (NaOH/HCl) = T(NaOH)* Мэкв(HCl) / Мэкв(NaOH) =0,0028 г/мл
Совет 2: Как вычислить равнозначную массу
Равнозначная масса – это масса такого числа химического элемента, которое вступает в соединение с одним молем атомов водорода, либо вытесняет такое же число атомов водорода в реакциях замещения. Само наименование «эквивалент» в переводе с греческого обозначает «равноценный», «равный». Каким образом дозволено вычислить данный показатель?
Инструкция
1. Как водится, равнозначную массу определяют, анализируя химические соединения разными способами, либо с подмогой достаточно несложных вычислений. В основе этих вычислений лежит следующее правило: равнозначная масса определяется, исходя из состава соединения какого-нибудь элемента с любым иным, эквивалент которого определен. Водород – лишь частный случай этого всеобщего правила.
2. Продемонстрируем, как это делается на определенном примере. Представим, поставлена такая задача: в ходе реакция одного грамма металлического калия с избытком брома получилось 3,04 грамма бромида калия. Нужно определить равнозначную массу калия и его эквивалент, исхода из того, что равнозначная масса брома вам вестима и равна 79,90 грамм/моль.
3. Для начала, нужно вычесть из всеобщей массы образовавшегося бромида калия начальную массу калия: 3,04 – 1,00 = 2,04
4. Вы видите, что в ходе химической реакции образовался продукт (бромид калия), в котором на один грамм калия доводится 2,04 грамма брома. Зная равнозначную массу брома (79,90), путем решения элементарной пропорции, вы легко обнаружите равнозначную массу калия: 79,90* 1,00 /2,04 = 39,16 То есть равнозначная масса калия, полученная путем расчетов, равна 39,16 грамма /моль.
5. Ну, а каков эквивалент калия? Вы видите, что расчетная равнозначная масса (39,16 грамма/моль) фактически совпадает с его молярной массой (39,09 грамма/моль). Отличие настоль незначительно, что вы с «чистой совестью» посчитаете их безусловно равными. Следственно эквивалент калия равен одному молю.
Видео по теме
Полезный совет
Представление об эквивалентах и равнозначных массах в полной мере применимо и к трудным веществам. Эквивалент трудного вещества – это такое его число, которое без остатка взаимодействует с одним эквивалентом водорода.
Совет 3: Как обнаружить титр раствора
Титр раствора – это один из терминов для обозначения концентрации (наравне с процентной концентрацией, молярной концентрацией и т.д.). Величина титра указывает, какое число граммов вещества содержится в одном миллилитре раствора .
Инструкция
1. Представим, дана такая задача. Имеется 20 миллилитров раствора гидроксида натрия. Для его нейтрализации потребовалось израсходовать 30 миллилитров 1М раствора соляной кислоты. Ни одно из веществ не было взято в избытке. Определить, каков титр щелочи.
2. Раньше каждого, напишите уравнение реакции. Она протекает так:NaOH + HCl = NaCl + H2O.
3. Вы видите, что в ходе этой реакции нейтрализации, согласно уравнению, число молей кислоты всецело совпадает с числом молей связанной ею щелочи. А сколько молей кислоты вступило в реакцию? Раз ее раствор одномолярный, то число молей будет во столько же раз поменьше единицы, во сколько раз 30 миллилитров поменьше 1 литра. То есть, 30/1000 = 0,03 моля.
4. Из этого следует, что щелочи также было 0,03 моля. Посчитайте, сколько это будет в граммах. Молекулярная масса резкого натра приблизительно равна 23 + 16 +1 = 40, следственно, его молярная масса составляет 40 г/моль. Умножив 40 на 0,03, получите: 1,2 грамма.
5. Ну, а дальше все дюже примитивно. 1,2 грамма щелочи содержится в 20 миллилитрах раствора . Поделив 1,2 на 20, получите результат: 0,06 грамм/миллилитр. Вот такой титр у раствора гидроксида натрия.
6. Усложним условие задачи. Представим, у вас имеется то же число раствора гидроксида натрия – 20 миллилитров. Для ее нейтрализации добавили те же 30 миллилитров 1М соляной кислоты. Впрочем, в различие от предыдущей задачи, оказалось, что кислота была взята в избытке, и для ее нейтрализации пришлось израсходовать 5 миллилитров 2М раствора гидроксида калия. Каков титр раствора гидроксида натрия в этом случае?
7. Начните с написания уравнения реакции кислоты с резким кали:HCl + KOH = KCl + H2O.
8. Рассуждая подобно вышеприведенному примеру и произведя расчеты, вы увидите: во-первых, первоначально соляной кислоты было 0,03 моля, а во-вторых, в реакцию с кислотой вступило 2х0,005 = 0,01 моля резкого кали. Эта щелочь, соответственно, связала 0,01 моля соляной кислоты. Следственно, на первую реакцию с иной щелочью – резким натром – ушло 0,03 – 0,01 = 0,02 моля соляной кислоты. Из чего становится ясно, что и резкого натра в растворе содержалось 0,02 моля, то есть, 40х0,02 = 0,8 грамм.
9. А дальше определить титр этого раствора – проще некуда, в одно действие. Поделив 0,8 на 20, получите результат: 0,04 грамма/миллилитр. Решение задачи заняло чуть огромнее времени, но и тут не было ничего трудного.
Совет 4: Как вычислить основность кислоты
Кислота – это химическое вещество трудного состава, которое имеет атомы водорода и кислотные остатки. Кислоты систематизируются по целому ряду знаков, в число которых входит и основность .
Инструкция
1. Если вы имеете дело с неорганическими кислотами, для определения основности посмотрите на их формулу. Вы увидите, сколько атомов водорода в нее входит. Все галогенсодержащие кислоты (фтористая, соляная, бромистая, йодистая) – одноосновные. Сюда дозволено отнести азотную кислоту (формула НNO3), азотистую (НNO2) и другие.
2. Если же в состав молекулы кислоты входит два атома водорода, она является двухосновной. Сюда дозволено включить серную кислоту. Ее формула Н2SO4. Это дюже крепкое химическое вещество. Другие двухосновные кислоты, скажем, сернистая (Н2SO3), кремниевая (Н2SiO3), угольная (Н2СО3), значительно слабее.
3. Трехосновные химические вещества содержат в своем составе три атома водорода. Самая вестимая из кислот – фосфорная (ортофосфорная). Ее формула Н3РО4. Сюда дозволено включить и борную кислоту (Н3ВО3).
4. Четырехосновные кислоты содержат четыре атома водорода в молекуле. Их дюже немного. Скажем, пирофосфорная кислота получается при нагревании ортофосфорной кислоты до температур свыше 200 градусов, реакция проходит дальнейшим образом: 2Н3РО4 = Н4Р2О7 + Н2О.
5. Помимо неорганических кислот, существует много органических. Их функциональная (карбоксильная) группа имеет дальнейший состав: СООН. Дабы определить их основность , посмотрите на формулу, только сейчас обратите внимание не на число атомов водорода, а на число карбоксильных групп.
6. Множество органических кислот являются одноосновными, скажем, муравьиная кислота. Ее формула НСООН. К одноосновным химическим веществам относится также уксусная кислота – СН3СООН. Животрепещуще нужные организму аминокислоты являются одноосновными. К двухосновным органическим кислотам относится, скажем, щавелевая кислота. А к трехосновным – лимонная.
Видео по теме
Полезный совет
Не смотря на идентичные единицы измерения, никогда не путайте титр раствора с его плотностью. Чай величина плотности показывает массу одного кубического сантиметра раствора, а не массу растворенного вещества в нем.
Определение титра, эквивалентной концентрации (нормальности) и титра раствора по определяемому веществу.
Титр раствора – отношение массы растворённого вещества к объёму раствора, T = 
Титр раствора по определяемому веществу – отношение массы определяемого вещества к объёму раствора, пошедшего на титрование данной массы, показывает массу вещества, титруемую 1 мл раствора. Например, титр раствора соляной кислоты по карбонату натрия равен:
T HCl/Na2CO3 = 
Эквивалентная концентрация раствора (Сэ), или нормальность (N) равна:
Сэ = N = 

См = 
(молярная концентрация)
Пример 1. Определить титр раствора перманганата калия по железу и пероксиду водорода, если нормальность (Сэ) этого раствора 0,025 моль/л.
Решение. При окислении железа и пероксида водорода перманганатом калия протекают реакции:
А) Fe2+ — e- ® Fe3+; Мэ(Fe) = М(Fe) = 55,85 г/моль.
Б) H2O2 — 2e — ® 2H+ + O2 ® Мэ(H2O2) = М(H2O2) = 17,01 г/моль.
(В точке эквивалентности nэ(KMnO4) = nэ(Fe));
Сэ(KMnO4) = 0,025 ® 0,025 моль содержится в 1000 мл раствора перманганата калия.
В точке эквивалентности nэ(H2O2) = nэ(KMnO4) = 0,025 моль в 1000 мл раствора перманганата калия.
Пример 2. Образец массой 0,1182 г с массовой долей марганца 0,84% растворили и оттитровали 22,27 мл раствора арсенита натрия. Определить титр раствора арсенита натрия по марганцу, если марганец присутствует в виде марганцовой кислоты (HMnO4).
Решение. Находим массу марганца в образце:
M(Mn) =
® Т NaAsO2/Mn = 
Пример 3. Определить нормальность (Сэ) раствора азотной кислоты с массовой долей азотной кислоты 30,1% и плотностью 1,185 г/мл в реакции:
NO3- + 4H+ + 3e — ® NO + 2H2O.
Решение.
Сэ = 
M(HNO3) = 

Мэ(HNO3) = М(HNO3) =
· 63 г/моль = 21,01 г/моль;
Сэ(HNO3) =