Физические свойства
Оксид бериллия BeO — бинарное неорганическое вещество. Белый, тугоплавкий, термически устойчивый, летучий в токе O2 и водяного пара. Проявляет амфотерные свойства.
Относительная молекулярная масса Mr = 25,01; относительная плотность для тв. и ж. состояния d = 3,015; tпл ≈ 2580º C; tкип = 4260º C.
Способ получения
1. Оксид бериллия получается при разложении карбоната бериллия при температуре выше 180º C. В результате разложения образуется оксид бериллия и углекислый газ:
BeCO3 = BeO + CO2
2. В результате разложения нитрата бериллия при температуре выше 1000º С образуется оксид бериллия, оксид азота (IV) и кислород:
2Be(NO3)2 = 2BeO + 4NO2 + O2
3. Гидроксид бериллия разлагается при 200 — 800º С с образованием оксида бериллия и воды:
Be(OH)2 = BeO + H2O
4. Оксид бериллия можно получить путем разложения сульфата бериллия при температуре 547–600º C, образуется оксид бериллия и оксид серы (VI):
BeSO4 = BeO + SO3
Химические свойства
1. Оксид бериллия реагирует с простыми веществами:
1.1. В результате реакции между оксидом бериллия и фтором при температуре выше 400º С образуется фторид бериллия и кислород:
2BeO + 2F2 = 2BeF2 + O2
1.2. Оксид бериллия реагирует с углеродом и образует карбид углерода и угарный газ:
2BeО + 3C = Be2C + 2CO
1.3. Магний реагирует с оксидом бериллия при 700 — 800º С. На выходе образуется оксид магния и бериллий:
BeO + Mg = MgO + Be
2. Оксид бериллия взаимодействует со сложными веществами:
2.2. Оксид бериллия взаимодействует с кислотами. При этом образуются соль и вода.
2.2.1. Оксид бериллия с концентрированной соляной кислотой образует хлорид бериллия и воду:
BeO + 2HCl = BeCl2 + H2O
2.2.2. В результате реакции между оксидом бериллия и концентрированной серной кислотой образуется сульфат бериллия и вода:
BeO + H2SO4 = BeSO4↓ + H2O
2.2.3. Если смешать горячую плавиковую кислоту с оксидом бериллия при 220 º С на выходе образуется фторид бериллия и вода
BeO + 2HF = BeF2 + H2O
2.2.4. Оксид бериллия вступает в реакцию с концентрированной плавиковой кислотой образуя тетрафторобериллат водорода и воду:
BeO + 4HF = H2[BeF4] + H2O
2.3. При взаимодействии бериллия с оксидами образуются соли:
2.3.1. Реагируя с оксидом кремния при температуре 1500 — 1600º С оксид бериллия образует силикат бериллия:
BeO + SiO2 = BeSiO3
2.3.2. Оксид бериллия реагирует с оксидом алюминия и образует алюминат бериллия:
BeO + Al2O3 = Be(AlO2)2
2.3.3. В результате взаимодействия оксида бериллия и оксида натрия при 500º С образуется бериллат натрия:
BeO + Na2O = Na2BeO2
2.4. Оксид бериллия вступает в реакции с основаниями:
Оксид бериллия взаимодействует с гидроксидом натрия при 250 — 300º С в расплаве. При это образуется бериллат натрия и вода:
BeO + 2NaOH = Na2BeO2 + H2O
Оксид бериллия взаимодействует с гидроксидом натрия в растворе. При это образуется комплексная соль и вода:
BeO + 2NaOH + H2O = Na2[Be(OH)4]
2.5. Оксид бериллия реагирует с солями:
Оксид бериллия взаимодействует с карбонатами при сплавлении и образует бериллат и воду:
BeO + K2CO3 = K2BeO2 + CO2
From Wikipedia, the free encyclopedia
|
|

|
|
| Names | |
|---|---|
| Preferred IUPAC name
Beryllium(II) monoxide |
|
| Systematic IUPAC name
Oxoberyllium |
|
| Other names
Beryllia, Thermalox, Bromellite, Thermalox 995.[1] |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
3902801 |
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.013.758 |
| EC Number |
|
| MeSH | beryllium+oxide |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
| UN number | 1566 |
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
BeO |
| Molar mass | 25.011 g·mol−1 |
| Appearance | Colourless, vitreous crystals |
| Odor | Odourless |
| Density | 3.01 g/cm3 |
| Melting point | 2,507 °C (4,545 °F; 2,780 K) |
| Boiling point | 3,900 °C (7,050 °F; 4,170 K) |
|
Solubility in water |
0.00002 g/100 mL |
| Solubility | soluble in acid[2] |
| Band gap | 10.6 eV |
| Thermal conductivity | 330 W/(K·m) |
|
Refractive index (nD) |
1.719 |
| Structure | |
|
Crystal structure |
Hexagonal |
|
Space group |
P63mc |
|
Point group |
C6v |
|
Coordination geometry |
Tetragonal |
|
Molecular shape |
Linear |
| Thermochemistry | |
|
Heat capacity (C) |
25.5 J/(K·mol) |
|
Std molar |
13.73–13.81 J/(K·mol) |
|
Std enthalpy of |
−599 kJ/mol[3] |
|
Gibbs free energy (ΔfG⦵) |
−582 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Very toxic, carcinogen.[4] |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H301, H315, H317, H319, H330, H335, H350, H372 |
|
Precautionary statements |
P201, P260, P280, P284, P301+P310, P305+P351+P338 |
| NFPA 704 (fire diamond) |
4 0 0 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
15 mg/kg (mouse, oral)[6] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 0.002 mg/m3 C 0.005 mg/m3 (30 minutes), with a maximum peak of 0.025 mg/m3 (as Be)[5] |
|
REL (Recommended) |
Ca C 0.0005 mg/m3 (as Be)[5] |
|
IDLH (Immediate danger) |
Ca [4 mg/m3 (as Be)][5] |
| Related compounds | |
|
Other anions |
Beryllium telluride |
|
Other cations |
|
| Supplementary data page | |
| Beryllium oxide (data page) | |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Beryllium oxide (BeO), also known as beryllia, is an inorganic compound with the formula BeO. This colourless solid is a notable electrical insulator with a higher thermal conductivity than any other non-metal except diamond, and exceeds that of most metals.[7] As an amorphous solid, beryllium oxide is white. Its high melting point leads to its use as a refractory material.[8] It occurs in nature as the mineral bromellite. Historically and in materials science, beryllium oxide was called glucina or glucinium oxide, owing to its sweet taste.
Preparation and chemical properties[edit]
Beryllium oxide can be prepared by calcining (roasting) beryllium carbonate, dehydrating beryllium hydroxide, or igniting metallic beryllium:
- BeCO3 → BeO + CO2
- Be(OH)2 → BeO + H2O
- 2 Be + O2 → 2 BeO
Igniting beryllium in air gives a mixture of BeO and the nitride Be3N2.[7] Unlike the oxides formed by the other Group 2 elements (alkaline earth metals), beryllium oxide is amphoteric rather than basic.
Beryllium oxide formed at high temperatures (>800 °C) is inert, but dissolves easily in hot aqueous ammonium bifluoride (NH4HF2) or a solution of hot concentrated sulfuric acid (H2SO4) and ammonium sulfate ((NH4)2SO4).
Structure[edit]
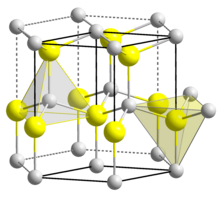
BeO crystallizes in the hexagonal wurtzite structure, featuring tetrahedral Be2+ and O2− centres, like lonsdaleite and w-BN (with both of which it is isoelectronic). In contrast, the oxides of the larger group-2 metals, i.e., MgO, CaO, SrO, BaO, crystallize in the cubic rock salt motif with octahedral geometry about the dications and dianions.[7] At high temperature the structure transforms to a tetragonal form.[9]
In the vapour phase, beryllium oxide is present as discrete diatomic molecules. In the language of valence bond theory, these molecules can be described as adopting sp orbital hybridisation on both atoms, featuring one σ (between one sp orbital on each atom) and one π bond (between aligned p orbitals on each atom oriented perpendicular to the molecular axis). Molecular orbital theory provides a slightly different picture with no net sigma bonding (because the 2s orbitals of the two atoms combine to form a filled sigma bonding orbital and a filled sigma* anti-bonding orbital) and two pi bonds formed between both pairs of p orbitals oriented perpendicular to the molecular axis. The sigma orbital formed by the p orbitals aligned along the molecular axis is unfilled. The corresponding ground state is …(2sσ)2(2sσ*)2(2pπ)4 (as in the isoelectronic C2 molecule), where both bonds can be considered as dative bonds from oxygen towards beryllium.[10]
Applications[edit]
High-quality crystals may be grown hydrothermally, or otherwise by the Verneuil method. For the most part, beryllium oxide is produced as a white amorphous powder, sintered into larger shapes. Impurities, like carbon, can give a variety of colours to the otherwise colourless host crystals.
Sintered beryllium oxide is a very stable ceramic.[11] Beryllium oxide is used in rocket engines[12] and as a transparent protective over-coating on aluminised telescope mirrors.
Beryllium oxide is used in many high-performance semiconductor parts for applications such as radio equipment because it has good thermal conductivity while also being a good electrical insulator. It is used as a filler in some thermal interface materials such as thermal grease.[13] Some power semiconductor devices have used beryllium oxide ceramic between the silicon chip and the metal mounting base of the package to achieve a lower value of thermal resistance than a similar construction of aluminium oxide. It is also used as a structural ceramic for high-performance microwave devices, vacuum tubes, magnetrons, and gas lasers. BeO has been proposed as a neutron moderator for naval marine high-temperature gas-cooled reactors (MGCR), as well as NASA’s Kilopower nuclear reactor for space applications.[14]
Safety[edit]
BeO is carcinogenic in powdered form[15] and may cause a chronic allergic-type lung disease berylliosis. Once fired into solid form, it is safe to handle if not subjected to machining that generates dust. Clean breakage releases little dust, but crushing or grinding actions can pose a risk.[16]
References[edit]
- ^ «beryllium oxide – Compound Summary». PubChem Compound. USA: National Center for Biotechnology Information. 27 March 2005. Identification and Related records. Retrieved 8 November 2011.
- ^ John Rumble (June 18, 2018). CRC Handbook of Chemistry and Physics (99th ed.). CRC Press. pp. 4–41. ISBN 978-1138561632.
- ^ Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ^ Group 1B Carcinogens
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. «#0054». National Institute for Occupational Safety and Health (NIOSH).
- ^ Beryllium oxide toxicity
- ^ a b c Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Raymond Aurelius Higgins (2006). Materials for Engineers and Technicians. Newnes. p. 301. ISBN 0-7506-6850-4.
- ^ A. F. Wells (1984). Structural Inorganic Chemistry (5 ed.). Oxford Science Publications. ISBN 0-19-855370-6.
- ^ Fundamentals of Spectroscopy. Allied Publishers. p. 234. ISBN 978-81-7023-911-6. Retrieved 29 November 2011.
- ^ Günter Petzow, Fritz Aldinger, Sigurd Jönsson, Peter Welge, Vera van Kampen, Thomas Mensing, Thomas Brüning «Beryllium and Beryllium Compounds» in Ullmann’s Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a04_011.pub2
- ^ Ropp, Richard C. (2012-12-31). Encyclopedia of the Alkaline Earth Compounds. Newnes. ISBN 9780444595539.
- ^ Greg Becker; Chris Lee; Zuchen Lin (2005). «Thermal conductivity in advanced chips — Emerging generation of thermal greases offers advantages». Advanced Packaging: 2–4. Archived from the original on June 21, 2000. Retrieved 2008-03-04.
- ^ McClure, Patrick; Poston, David; Gibson, Marc; Bowman, Cheryl; Creasy, John (14 May 2014). «KiloPower Space Reactor Concept – Reactor Materials Study». Retrieved 21 November 2017.
- ^ «Hazardous Substance Fact Sheet» (PDF). New Jersey Department of Health and Senior Services. Retrieved August 17, 2018.
- ^ «Beryllium Oxide Safety». American Beryllia. Retrieved 2018-03-29.
External links[edit]
- Beryllium Oxide MSDS from American Beryllia
- IARC Monograph «Beryllium and Beryllium Compounds»
- International Chemical Safety Card 1325
- National Pollutant Inventory – Beryllium and compounds
- NIOSH Pocket guide to Chemical Hazards
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Оксид бериллия
Окси́д бери́ллия — амфотерный оксид, имеющий химическую формулу BeO.
В зависимости от способа получения, при стандартных условиях, оксид бериллия представляет собой белое кристаллическое или аморфное вещество без вкуса и запаха, очень малорастворимое в воде. Растворяется в концентрированных минеральных кислотах и щелочах, хорошо растворим в щелочных расплавах[2][3].
Как и все соединения бериллия, очень ядовит.
Оксид бериллия является единственным бинарным соединением бериллия с кислородом, хотя в паровой фазе над ВеО при температуре около 2000°С было отмечено присутствие полимеров типа (ВеО)3 и (ВеО)4[2].
Получение и свойства[ | ]
В природе оксид бериллия встречается в виде минерала [3].
Получают оксид бериллия термическим разложение гидроксида бериллия и некоторых его солей (например, нитрата, основного ацетата, карбоната и др.) при температуре от 500 до 1000°С.
Полученный таким образом оксид представляет собой белый аморфный порошок.
В виде кристаллов оксид бериллия может быть получен нагреванием до высокой температуры (плавлением) аморфной формы или, например, при кристаллизации из расплавленных карбонатов щелочных металлов[2].
Упругость пара ВеО незначительна, поэтому в отсутствие паров воды это наименее летучий из всех тугоплавких оксидов. Примесь таких оксидов, как MgO, CaO, Al2O3, SiO2, ещё больше понижает летучесть ВеО из-за химического взаимодействия между ними. В присутствии паров воды при 1000—1800°С летучесть оксида бериллия сильно возрастает в связи с образованием газообразного гидроксида бериллия[2].
Оксид бериллия обладает очень высокой теплопроводностью.
При 100° С она составляет 209,3 Вт·м−1·К−1, что больше, чем теплопроводность любых неметаллов (кроме алмаза и карбида кремния) и большинства металлов (кроме меди, серебра, золота, алюминия и ряда их сплавов)[4][5].
При понижении температуры теплопроводность оксида бериллия сперва растёт (370 Вт·м−1·К−1 при 300 К), достигая максимума (13 500 Вт·м−1·К−1) при 40 К, затем понижается (47 Вт·м−1·К−1 при 4 К)[5].
Химические свойства[ | ]
Реакционная способность оксида бериллия зависит от способа его получения и от степени . Повышение температуры при прокаливании ведет к увеличению размера зерен (то есть к уменьшению удельной поверхности), а, следовательно, и к уменьшению химической активности соединения.[2]
Прокаленный при температуре не выше 500 °С, оксид бериллия растворяется в водных растворах кислот и щелочей (даже разбавленных), образуя соответствующие соли и . Например:
B e O + 2 N a O H + H 2 O ⟶ N a 2 [ B e ( O H ) 4 ] {displaystyle {mathsf {BeO+2NaOH+H_{2}Olongrightarrow Na_{2}[Be(OH)_{4}]}}} B e O + 2 H C l ⟶ B e C l 2 + H 2 O {displaystyle {mathsf {BeO+2HCllongrightarrow BeCl_{2}+H_{2}O}}}
Оксид бериллия, прокаленный при температуре от 1200 до 1300 °С, растворим в растворах концентрированных кислот. Например, прокаленный таким образом ВеО реагирует с горячей концентрированной серной кислотой:
B e O + H 2 S O 4 ⟶ B e S O 4 + H 2 O {displaystyle {mathsf {BeO+H_{2}SO_{4}longrightarrow BeSO_{4}+H_{2}O}}}
Прокаливание оксида бериллия при температурах выше 1800 °С приводит к практически полной утрате им реакционной способности. После такого прокаливания ВеО растворяется только в концентрированной плавиковой кислоте (с образованием фторида) и в расплавленных щелочах, карбонатах и пиросульфатах щелочных металлов (с образованием бериллатов):[2][3]
B e O + 2 H F ⟶ B e F 2 + H 2 O {displaystyle {mathsf {BeO+2HFlongrightarrow BeF_{2}+H_{2}O}}} B e O + 2 N a O H ⟶ N a 2 B e O 2 + H 2 O {displaystyle {mathsf {BeO+2NaOHlongrightarrow Na_{2}BeO_{2}+H_{2}O}}} B e O + N a 2 C O 3 ⟶ N a 2 B e O 2 + C O 2 {displaystyle {mathsf {BeO+Na_{2}CO_{3}longrightarrow Na_{2}BeO_{2}+CO_{2}}}}
Выше 1000 °С оксид бериллия реагирует с хлором, при этом в присутствии угля данная реакция идет легче и при гораздо меньших температурах (600—800°С):[2]
2 B e O + 2 C l 2 ⟶ 2 B e C l 2 + O 2 {displaystyle {mathsf {2BeO+2Cl_{2}longrightarrow 2BeCl_{2}+O_{2}}}} B e O + C l 2 + C ⟶ B e C l 2 + C O {displaystyle {mathsf {BeO+Cl_{2}+Clongrightarrow BeCl_{2}+CO}}}
При температуре выше 1000 °С оксид бериллия вступает в обратимую реакцию гидрохлорирования (понижение температуры системы вызывает обратный процесс разложения образовавшегося хлорида бериллия):[2]
B e O + 2 H C l ⟶ B e C l 2 + H 2 O {displaystyle {mathsf {BeO+2HCllongrightarrow BeCl_{2}+H_{2}O}}}
При нагревании оксид бериллия способен реагировать со многими хлорсодержащими соединениями. В частности, уже при 500 °С начинается реакция с фосгеном:[2]
B e O + C O C l 2 ⟶ B e C l 2 + C O 2 {displaystyle {mathsf {BeO+COCl_{2}longrightarrow BeCl_{2}+CO_{2}}}} Хлорирование тетрахлорметаном протекает при температуре 450—700 °С:[2]
2 B e O + C C l 4 ⟶ 2 B e C l 2 + C O 2 {displaystyle {mathsf {2BeO+CCl_{4}longrightarrow 2BeCl_{2}+CO_{2}}}}
Гораздо труднее оксид бериллия взаимодействует с бромом, сведений же о взаимодействии ВеО с иодом нет.
Оксид бериллия реагирует далеко не всеми обычно применяемыми восстановителями. В частности, для восстановления бериллия из оксида применимы лишь кальций, магний, титан и уголь (при высокой температуре). Кальций и магний могут быть использованы в качестве восстановителя при температуре ниже 1700 °С и атмосферном давлении, титан применим при давлении ниже 0,001 мм рт. ст. и 1400 °С:[2]
B e O + C a ⟶ B e + C a O {displaystyle {mathsf {BeO+Calongrightarrow Be+CaO}}} 4 B e O + T i ⟶ 2 B e + T i O 2 {displaystyle {mathsf {4BeO+Tilongrightarrow 2Be+TiO_{2}}}}
В обоих случаях бериллий получается загрязненным, так как технически очень трудно разделить продукты реакции.
Использование угля более предпочтительно, но реакция с ним идет лишь при температурах выше 2000 °С:
B e O + C ⟶ B e + C O {displaystyle {mathsf {BeO+Clongrightarrow Be+CO}}}
Оксид бериллия при температурах ниже 800 °С устойчив по отношению к расплавленным щелочным металлам (литию, натрию и калию) и почти совсем не реагирует с церием, платиной, молибденом, торием и железом; только при 1800 °C взаимодействует с никелем, кремнием, титаном и цирконием[2][6].
Применение[ | ]
Сочетание высокой теплопроводности и небольшого коэффициента термического расширения позволяет использовать оксид бериллия в качестве термостойкого материала, обладающего значительной химической инертностью.
Токсичность[ | ]
Оксид бериллия очень ядовит и канцерогенен, по токсикологии NFPA 704 ему присвоена высшая токсичность.
Примечания[ | ]
- ↑ Бериллий
- ↑ 123456789101112 Химия и технология редких и рассеянных элементов: Учеб.
пособие для вузов: Ч. I / Под ред. К. А. Большакова. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1976. — С. 176.
- ↑ 123 Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977. — С.56
- ↑ Бериллий.
Соединения бериллия. Оксид бериллия
- ↑ 12 Инюшкин А. В. Теплопроводность / В кн.: Физические величины: Справочник. — М.: Энергоатомиздат. — 1991. — С.337—363.
- ↑ Egon Wiberg, Arnold Frederick Holleman Inorganic Chemistry. — Elsevier, 2001.
№4 Бериллий
Бериллий был открыт в 1798 году Л. Вокленом в виде берилловой земли (оксида ВеО), когда этот французский химик выяснял общие особенности химического состава драгоценных камней берилла и изумруда. Металлический бериллий был получен в 1828 г. Ф. Велером в Германии и независимо от него А.
Бюсси во Франции. Однако из-за примесей его не удавалось сплавить. Лишь в 1898 г. французский химик П. Лебо, подвергнув электролизу двойной фторид калия и бериллия, получил достаточно чистые металлические кристаллы бериллия.
Интересно, что из-за сладкого вкуса растворимых в воде соединений бериллия элемент вначале называли «глюциний» (от греческого glykys — сладкий). Из-за сходства свойств бериллия и алюминия считалось, что это трехвалентный металл с атомной массой 13,5. Эту ошибку исправил Д.И.
Менделеев, который, исходя из закономерности изменения свойств элементов в периоде, определил бериллию место во второй группе.
Нахождение в природе, получение:
Бериллий относится к редким элементам, его содержание в земной коре 2,6·10-4% по массе. В морской воде содержится до 6·10-7 мг/л бериллия.Основные природные минералы, содержащие бериллий: берилл Be3Al2(SiO3)6, фенакит Be2SiO4, бертрандит Be4Si2O8·H2O и гельвин (Mn,Fe,Zn)4[BeSiO4]3S.
Окрашенные примесями катионов других металлов прозрачные разновидности берилла — драгоценные камни, например, зеленый изумруд, голубой аквамарин, гелиодер, воробьевит и другие. В настоящее время их научились синтезировать искусственно.
В виде простого вещества в XIX веке бериллий получали действием калия на безводный хлорид бериллия:
BeCl2+2K=Be+2KCl.
В настоящее время бериллий получают,восстанавливая его фторид магнием:
BeF2+Mg=Be+MgF2
либо электролизом расплава смеси хлоридов бериллия и натрия. Исходные соли бериллия выделяют при переработке бериллиевой руды.
Физические свойства:
Металлический бериллий — твердый, хрупкий металл серого цвета. На воздухе бериллий, как и алюминий, покрыт оксидной пленкой, придающей ему матовый цвет.
Температура плавления 1278°C, температура кипения около 2470°C, плотность 1,816 кг/м3.
До температуры 1277°C устойчив a-Ве (гексагональная решетка типа магния (Mg), параметры а = 0,22855 нм, с = 0,35833 нм), при температурах, предшествующих плавлению металла (1277-1288°C) — b-Ве с кубической решеткой.
Химические свойства:
Наличие оксидной пленки предохраняет металл от дальнейшего разрушения и обусловливает его невысокую химическую активность при комнатной температуре. При нагревании бериллий сгорает на воздухе с образованием оксида BeO, реагирует с серой и азотом. С галогенами бериллий реагирует при обычной температуре или при слабом нагревании.
Все эти реакции сопровождаются выделением большого количества теплоты, так как прочность кристаллических решеток возникающих соединений (BeO, BeS, Be3N2, ВеCl2 и др.) довольно велика. Благодаря образованию на поверхности прочной пленки бериллий не реагирует с водой, хотя находится в ряду стандартных потенциалов значительно левее водорода.
Как и алюминий, бериллий реагирует с кислотами и растворами щелочей:
Be + 2HCl = BeCl2 + H2,
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2. Интересно, что бериллий хорошо растворяется в концентрированных растворах фторидов:
Be + 4NH4F + 2H2O = (NH4)2[BeF4] + 2NH3*H2O + H2↑
Причина — образование прочных фторидных комплексов.
Важнейшие соединения:
Оксид бериллия, BeO встречается в природе в виде редкого минерала бромеллита. Получают термическим разложением сульфата или гидроксида бериллия выше 800° С. Продукт высокой чистоты образуется при разложении основного ацетата [Be4O(OOCH3)6] выше 600°С.
Непрокаленный оксид бериллия гигроскопичен, адсорбирует до 34% воды, а прокаленный при 1500° С — лишь 0,18%. Оксид бериллия, прокаленный не выше 500°С, легко взаимодействует с кислотами, труднее — с растворами щелочей, а прокаленный выше 727° С — лишь со фтороводородной кислотой, горячей концентрированной серной кислотой и расплавами щелочей.
Устойчив к воздействию расплавленных лития, натрия, калия, никеля и железа. Оксид бериллия обладает очень высокой теплопроводностью. Считается одним из лучших огнеупорных материалов, используется для изготовления тиглей и других изделий
Гидроксид бериллия, Be(OH)2 — полимерное соединение, нерастворимое в воде.
Оно проявляет амфотерные свойства: Be(OH)2 + 2КOH = К2[Be(OH)4], Be(OH)2 + 2HCl = BeCl2 + 2H2O.
Действием на гидроксид бериллия Be(OH)2 растворами карбоновых кислот или при упаривании растворов их бериллиевых солей получают оксисоли бериллия, например, оксиацетат Be4O(CH3COO)6.
Галогениды бериллия, бесцв. крист. вещества, расплываются на воздухе, поглощая влагу. Для получения безводного хлорида используется реакция 2BeO + CCl4 = 2BeCl2 + CO2
Подобно хлориду алюминия BeCl2 является катализатором в реакции Фриделя – Крафтса. В растворах подвергается гидролизу…Бериллаты, в концентрированных растворах и расплавах щелочей присутствуют бериллаты состава M2BeO2, M3BeO4, в разбавленных растворах гидроксобериллаты M2[Be(OH)4]. Легко гидролизуются до гидроксида бериллия.
…
Гидрид бериллия, BeH2 — полимерное вещество, его получают реакцией:BeCl2 + 2LiH = BeH2 + 2LiCl
Карбид бериллия, Be2С — образуется при взаимодействии бериллия с углеродом. Подобно карбиду алюминия гидролизуется водой с образованием метана.
Применение:
Бериллий в основном используют как легирующую добавку к различным сплавам. Добавка бериллия значительно повышает твердость и прочность сплавов, коррозионную устойчивость поверхностей изготовленных из этих сплавов изделий.
Бериллиевые бронзы (Cu и 3-6% Be) – материал для пружин c большой устойчивостью к механической усталости и совершенно не дающих искр при механических ударах.
Бериллий слабо поглощает рентгеновское излучение, поэтому из него изготавливают окошки рентгеновских трубок (через которые излучение выходит наружу). В атомных реакторах из бериллия изготовляют отражатели нейтронов, его используют как замедлитель нейтронов.
В смесях с некоторыми a-радиоактивными нуклидами бериллий используют в ампульных нейтронных источниках, так как при взаимодействии ядер бериллия-9 и a-частиц возникают нейтроны: 9Ве(a,n)12C.
Физиологическое действие: в живых организмах бериллий, по-видимому, не несет никакой биологической функции, однако бериллий может замещать магний в некоторых ферментах, что приводит к нарушению их работы. Летучие и растворимые соединения бериллия, а также пыль, содержащая бериллий и его соединения, очень токсичны, канцерогенны (ПДК 0,001 мг/м3).
Рудакова Анна Валерьевна
ХФ ТюмГУ, 561 группа.
Содержание
- Получение и свойства
- Химические свойства
- Применение
- Токсичность
Оксид бериллия — амфотерный оксид, имеющий химическую формулу BeO.
| Оксид бериллия | |
|---|---|
| Общие | |
| Систематическое наименование |
Оксид бериллия |
| Хим. формула | BeO |
| Рац. формула | BeO |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 25,01158 г/моль |
| Плотность | 3,01 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 2530 °C |
| • кипения | 4120 °C |
| Мол. теплоёмк. | 25,5 Дж/(моль·К) |
| Теплопроводность | при 100°С 209,3 Вт/(м·K) |
| Энтальпия | |
| • образования | 589,2 кДж/моль |
| Давление пара | при 2000°С 0,003 атм |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,00005 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,719 |
| Структура | |
| Кристаллическая структура | гексагональная |
| Классификация | |
| Рег. номер CAS | 1304-56-9 |
| PubChem | 14775 |
| Рег. номер EINECS | 215-133-1 |
| SMILES |
[Be]=O |
| InChI |
1S/Be.O LTPBRCUWZOMYOC-UHFFFAOYSA-N |
| RTECS | DS4025000 |
| ChEBI | 62842 |
| Номер ООН | 1566 |
| ChemSpider | 14092 |
| Безопасность | |
| Токсичность | высокотоксичен, канцерогенен, ирритант |
| Пиктограммы ECB |    |
| NFPA 704 |
В зависимости от способа получения, при стандартных условиях, оксид бериллия представляет собой белое кристаллическое или аморфное вещество без вкуса и запаха, очень малорастворимое в воде. Растворяется в концентрированных минеральных кислотах и щелочах, хорошо растворим в щелочных расплавах.
Как и все соединения бериллия, очень ядовит.
Оксид бериллия является одним из 2 (так же существует оксид бериллия 1), бинарным соединением бериллия с кислородом, хотя в паровой фазе над ВеО при температуре около 2000°С было отмечено присутствие полимеров типа (ВеО)3 и (ВеО)4.
Получение и свойства
В природе оксид бериллия встречается в виде минерала бромеллита.
Получают оксид бериллия термическим разложением гидроксида бериллия и некоторых его солей (например, нитрата, основного ацетата, карбоната и др.) при температуре от 500 до 1000°С. Полученный таким образом оксид представляет собой белый аморфный порошок. В виде кристаллов оксид бериллия может быть получен нагреванием до высокой температуры (плавлением) аморфной формы или, например, при кристаллизации из расплавленных карбонатов щелочных металлов.
Упругость пара ВеО незначительна, поэтому в отсутствие паров воды это наименее летучий из всех тугоплавких оксидов. Примесь таких оксидов, как MgO, CaO, Al2O3, SiO2, ещё больше понижает летучесть ВеО из-за химического взаимодействия между ними. В присутствии паров воды при 1000—1800°С летучесть оксида бериллия сильно возрастает в связи с образованием газообразного гидроксида бериллия.
Оксид бериллия обладает очень высокой теплопроводностью. При 100° С она составляет 209,3 Вт·м−1·К−1, что больше, чем теплопроводность любых неметаллов (кроме алмаза и карбида кремния) и большинства металлов (кроме меди, серебра, золота, алюминия и ряда их сплавов). При понижении температуры теплопроводность оксида бериллия сперва растёт (370 Вт·м−1·К−1 при 300 К), достигая максимума (13 500 Вт·м−1·К−1) при 40 К, затем понижается (47 Вт·м−1·К−1 при 4 К).
Химические свойства
Реакционная способность оксида бериллия зависит от способа его получения и от степени прокаливания. Повышение температуры при прокаливании ведет к увеличению размера зерен (то есть к уменьшению удельной поверхности), а, следовательно, и к уменьшению химической активности соединения.
Прокаленный при температуре не выше 500 °С, оксид бериллия растворяется в водных растворах кислот и щелочей (даже разбавленных), образуя соответствующие соли и гидроксобериллаты. Например:
Выше 1000 °С оксид бериллия реагирует с хлором, при этом в присутствии угля данная реакция идет легче и при гораздо меньших температурах (600—800°С):
Хлорирование тетрахлорметаном протекает при температуре 450—700 °С:
Гораздо труднее оксид бериллия взаимодействует с бромом, сведений же о взаимодействии ВеО с иодом нет.
Оксид бериллия реагирует далеко не всеми обычно применяемыми восстановителями. В частности, для восстановления бериллия из оксида применимы лишь кальций, магний, титан и уголь (при высокой температуре). Кальций и магний могут быть использованы в качестве восстановителя при температуре ниже 1700 °С и атмосферном давлении, титан применим при давлении ниже 0,001 мм рт. ст. и 1400 °С:
В обоих случаях бериллий получается загрязненным, так как технически очень трудно разделить продукты реакции.
Использование угля более предпочтительно, но реакция с ним идет лишь при температурах выше 2000 °С:
Оксид бериллия при температурах ниже 800 °С устойчив по отношению к расплавленным щелочным металлам (литию, натрию и калию) и почти совсем не реагирует с церием, платиной, молибденом, торием и железом; только при 1800 °C взаимодействует с никелем, кремнием, титаном и цирконием.
Применение
Сочетание высокой теплопроводности и небольшого коэффициента термического расширения позволяет использовать оксид бериллия в качестве термостойкого материала, обладающего значительной химической инертностью.
Токсичность
Оксид бериллия очень ядовит и канцерогенен, по токсикологии NFPA 704 ему присвоена высшая токсичность.



